修回日期: 2020-12-12
接受日期: 2020-12-25
在线出版日期: 2021-02-08
急性A型主动脉夹层并发肠系膜灌注不良综合征(mesenteric malperfusion syndrome, mesMPS)死亡率高, 早期没有特异的临床表现, 容易漏诊. 一旦出现非特异可疑症状, 需及时复查主动脉CTA或腹部CT, 尽早诊治.
本例病人以"突发胸背部撕裂样疼痛15小时"为主诉急诊转入我院. 急诊行"升主动脉置换+全弓置换(岛状吻合)+降主动脉支架植入术+冠状动脉旁路移植术+自体血管取用术". 术后大便隐血阳性; 术后第11天, 可见肉眼血便; 术后第12天有腹部压痛; 术后第13天, 有腹痛, 并检查CT为肠梗阻. 遂当日剖腹探查行: 右半结肠切除术+小肠占位切除术+胆囊切除术+回肠造口术. 出院诊断为: (1)主动脉夹层(A型); (2)冠脉夹层; (3)急性弥漫性腹膜炎; (4)结肠多发穿孔; (5)小肠先天性腺体异位(可能性大); (6)慢性胆囊炎急性发作. 术后一年余行"肠粘连松解术+回肠造口闭合术+切口疝修补术", 之后一年随访恢复佳.
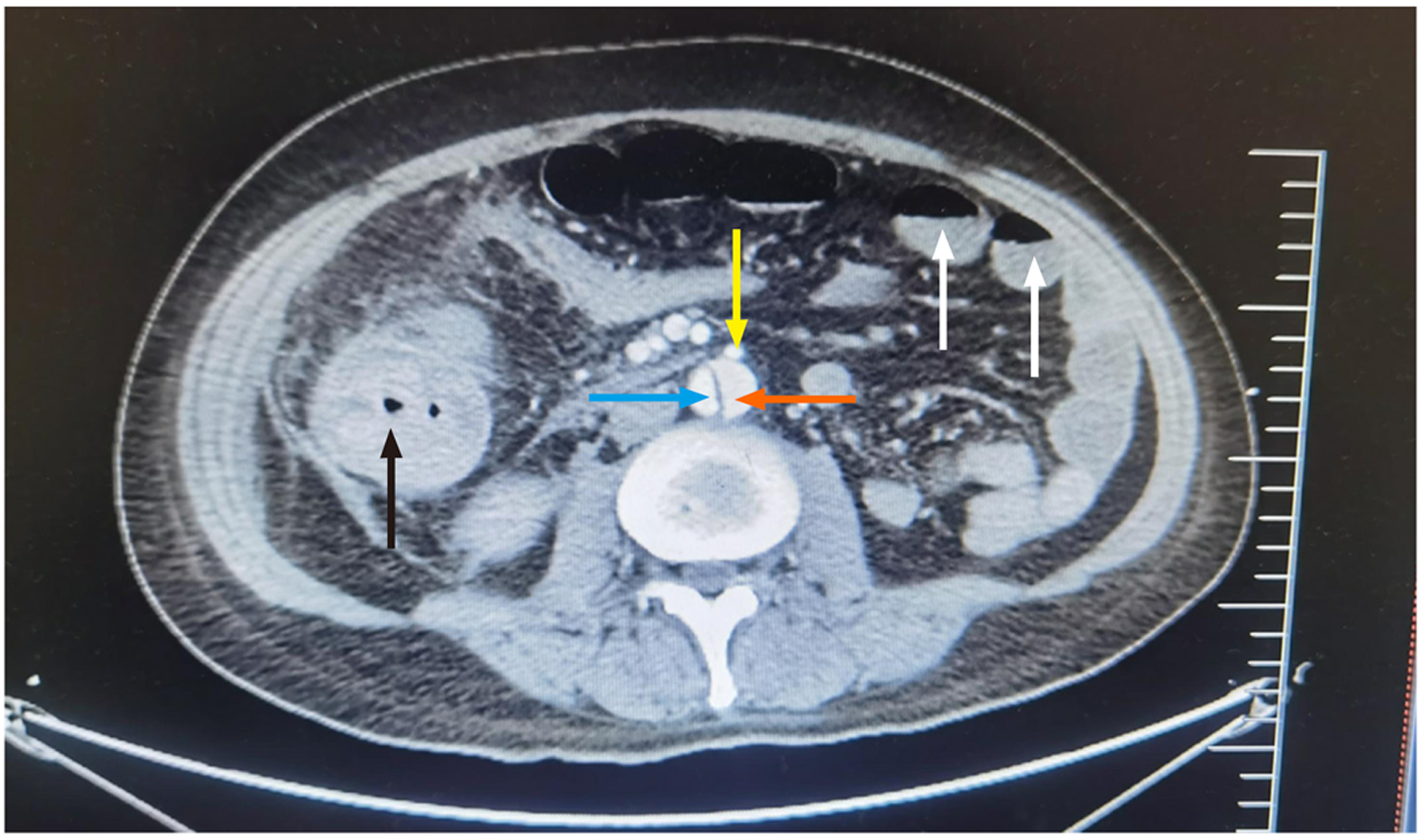
本例病人高度提示并发肠系膜灌注不良综合征的表现包含: 2支以上的肠道供血血管夹层累及(图1, 图2是术前的; 图3是术后的); 乳酸高; 并发急性肾衰; 大便隐血阳性; 术后11 d大便红色稀糊状; 术后12 d腹部压痛; 术后13 d诉腹痛, 急查腹部平扫CT示肠梗阻. 本例病人肠系膜灌注不良综合征的早期临床表现缺乏特异性, 直至后期出现透壁性肠坏死引起腹膜炎, 动力性肠梗阻. CTA是肠系膜灌注不良一线的检查手段, A型主动脉夹层的诊治中所行全主动脉CTA包含肠道供血血管的影像. 对于肠道供血血管中2条或2条以上夹层受累的情况下, 应高度怀疑并发肠系膜灌注不良综合征, 有非特异临床表现时, 就要提高警惕尽早复查CTA看肠道供血血管闭塞情况或复查腹部CT看是否存在透壁性肠坏死的迹象, 及时干预以改善病人预后.
核心提要: 肠系膜灌注不良综合征(mesenteric malperfusion syndrome, mesMPS)早期缺乏特异的实验室检查指标和临床表现. 夹层并发mesMPS死亡率高. 应提高警惕尽早诊断夹层并发mesMPS, 及时干预, 改善预后.
引文著录: 柴琳, 王玥, 范阜东, 王东进. 急性A型主动脉夹层并发肠系膜灌注不良综合征1例. 世界华人消化杂志 2021; 29(3): 152-158
Revised: December 12, 2020
Accepted: December 25, 2020
Published online: February 8, 2021
Patients with acute type A aortic dissection and mesenteric malperfusion syndrome (mesMPS) have a high mortality rate. Therefore, the analysis of the timing of open aortic repair and intestinal operation is of great significance for the timely selection of clinical treatment.
The chief complaints of the patient were sudden chest and back bursting pain for 15 h. Emergency "ascending aorta replacement + total arch replacement (island flap anastomosis) + descending aorta stent implantation + coronary artery bypass grafting + autologous vascular access" was performed. The patient's postoperative occult blood test was positive. His blood stool was visible to the naked eye on the 11th day after the open aortic repair. He had abdomen tenderness on the 12th postoperative day. He had abdominal pain and was diagnosed by CT with intestinal obstruction on the 13th postoperative day. Then, he underwent an emergency laparotomy for right hemicolectomy + partial resection of small intestine + cholecystectomy + ileostomy. He was discharged with diagnoses of aortic dissection (type A), coronary dissection, multiple perforations of the colon, congenital ectopic small bowel glands, and acute attack of chronic cholecystitis. More than a year later, he underwent "intestinal adhesion lysis + ileostomy closure + incisional hernia repair". The patient recovered well at the 1-year follow-up.
We have reported a case of acute type A aortic dissection with mesenteric malperfusion syndrome. In the early stage of mesenteric hypoperfusion syndrome, specific laboratory examination indexes and clinical manifestations are lacking, and mesenteric multidetector CT angiography is a first-line examination method for mesenteric malperfusion. Through the detailed analysis of the patient's condition and the review of the relevant literature, we hope to have a deeper understanding of this condition and provide evidence supporting the formulation of clinical treatment plan.
- Citation: Chai L, Wang Y, Fan FD, Wang DJ. Acute type A aortic dissection with mesenteric malperfusion syndrome: a case report. Shijie Huaren Xiaohua Zazhi 2021; 29(3): 152-158
- URL: https://www.wjgnet.com/1009-3079/full/v29/i3/152.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i3.152
急性A型主动脉夹层并发肠系膜灌注不良综合征(mesenteric malperfusion syndrome, mesMPS)在所有灌注异常综合征中死亡率最高, 而早期不易诊断, 因此对它的诊断需仔细基于病史和临床表现, 始于高度怀疑.
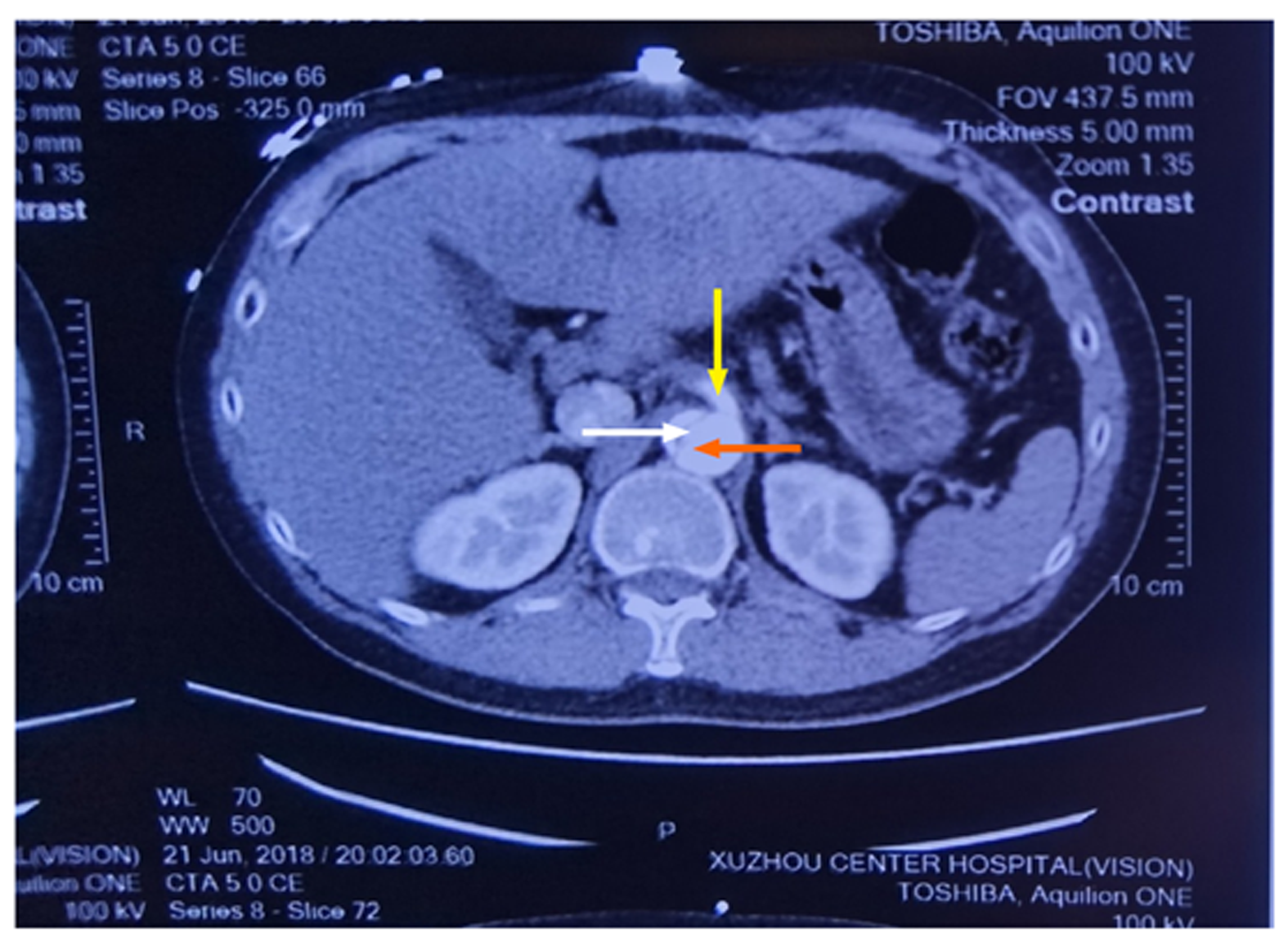
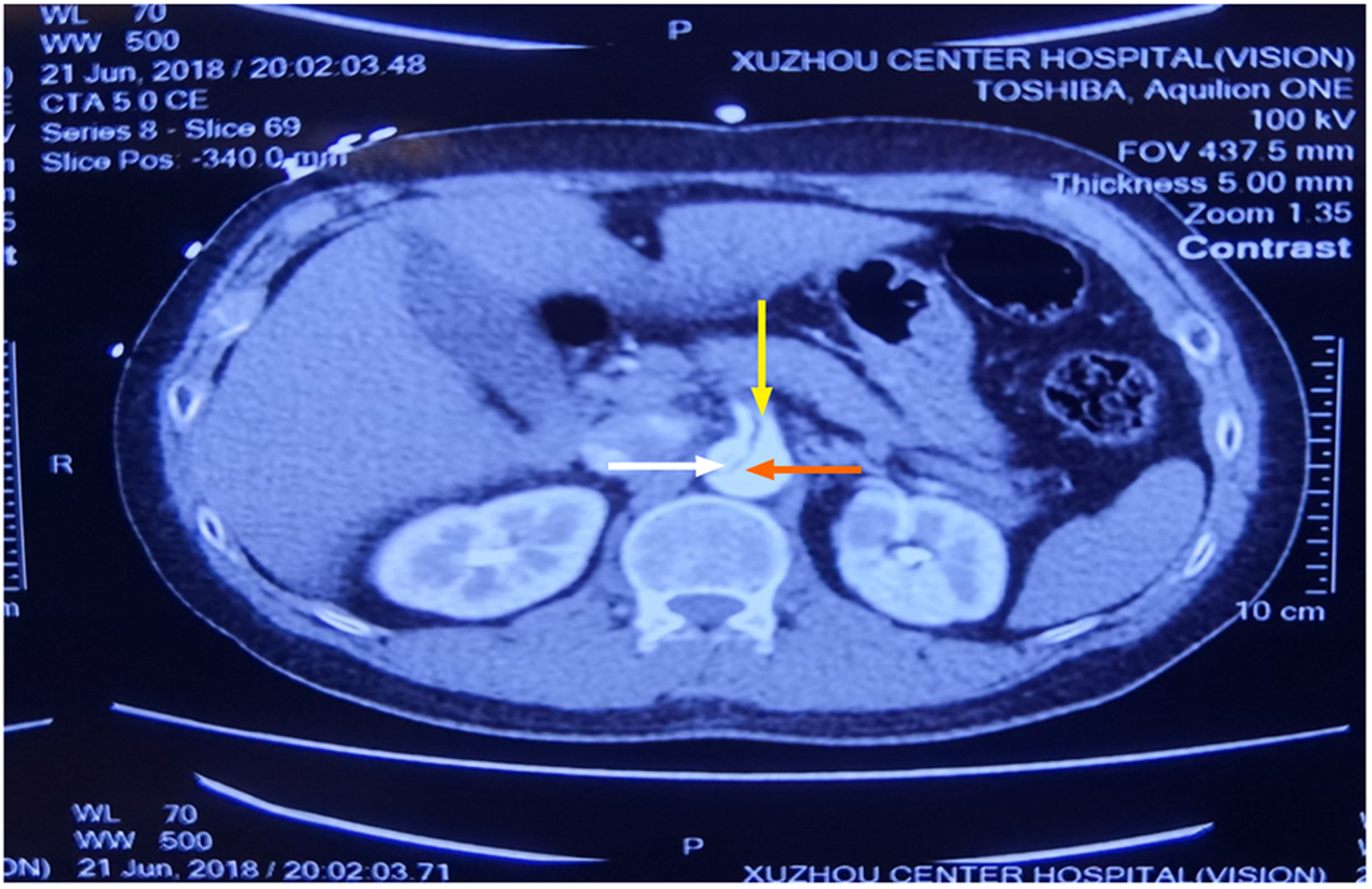
入院情况: 患者男性, 36岁, 体重85 kg, 因突发胸背部撕裂样疼痛15 h, 于2018-06-22, 05: 34入我院. 现病史: 患者15 h前在活动中突发胸背部撕裂样疼痛, 休息后缓解不明显, 伴面部大汗, 神志清, 嗜睡, 无晕厥. 查CTA示"A型主动脉夹层", 发病到入院无发热, 无腹痛, 无双下肢疼痛, 食欲欠佳, 小便正常, 大便未解. 既往无特殊病史. 体格检查: 体温36.0 ℃, 脉搏76次/分, 呼吸18次/分, 血压148/66 mmHg, 体重指数26.23 Kg/m2. 神清, 嗜睡. 入院时心肺查体未有明显异常. 腹软, 全腹无压痛及反跳痛, 肝脾肋下未触及, 双侧桡动脉、股动脉, 足背动脉搏动可及. 辅助检查(入院后半小时): cTnT 0.717 μg/L, CKMB 197 U/L, 肌酸激酶1298 U/L, BNP202 pg/mL, 尿素5.15 mmol/L, 肌酐75.3 μmol/L. 主动脉CTA(外院): 主动脉夹层, 自升主动脉至两侧髂总动脉呈双腔改变, 假腔内密度欠均匀, 腹腔干发自假腔(图1示), 近段未见显影, 右侧头臂干、左侧颈总、锁骨下动脉、肠系膜上动脉发自真假腔(图2示), 肠系膜上动脉部分未见显影, 肠系膜下动脉发自假腔(参考术后图3, 术前外院主动脉CTA胶片, 未打印肠系膜下动脉开口处断层图像, 参考夹层术后主动脉CTA图片可知肠系膜下动脉开口于假腔), 两侧肾动脉均发自真腔. 术前诊断: 急性A型主动脉夹层. 本病例报告研究得到病人的知情同意, 并签署了知情同意书.
(1)主动脉夹层(A型); (2)冠脉夹层; (3)急性弥漫性腹膜炎; (4)结肠多发穿孔; (5)小肠先天性腺体异位(可能性大); (6)慢性胆囊炎急性发作.
入院三个半小时后急诊行"主动脉根部加固成形+升主动脉置换+全弓置换(岛状吻合)+降主动脉支架植入术+冠状动脉搭桥术+自体血管取用术". 体外循环前尿量200 mL. 体外循环开始后10 min血气乳酸5.9 mmol/L. 术中探查见: 破口位于主动脉弓部小弯侧, 夹层累及右冠状动脉. 术中搭桥1根: 升主动脉→大隐静脉→右冠. 距窦管交界2 cm处横行切断升主动脉, 取合适大小形状涤纶补片衬入主动脉窦部撕开的外膜与内膜之间, 相应管腔内垫入环形涤纶补片, 4-0滑线连续缝合行三明治样主动脉根部加固成形, 鼻咽温降至20 ℃时选择性脑灌, 流量8 mL/kg/min, 降主动脉植入28#微创支架, 取直径28 mm Gelweave人工血管, 主动脉弓行岛状吻合, 保留主动脉弓三分支血管. 心脏自动复跳. 转机时间226 min, 深停时间35 min, 阻断时间185 min. 停机前乳酸15.8 mmol/L. 术中输血3695 mL. 体外循环过程中尿量400 mL. 术后第一天未醒, 躁动; 大便黄色, 隐血阳性(+). 术后第二天未醒, 躁动; 大便850 mL, 色黄, 腹软, 未及包块. 术后第2天应用CRRT至术后第66天. 术后第三天未醒, 躁动, 行腰椎穿刺置管术; 大便650 mL. 术后第四天, 未醒, 仍有躁动, 下肢仍未见明显活动; 大便450 mL. 术后第五天, 醒, 有应答, 双上肢肌力可; 大便约500 mL. 术后第六天, 神清, 双下肢肌力较前恢复. 术后第七天神清, 拔除气管插管; 大便黄色, 量: 1400 mL, 大便隐血阳性(+). 术后第八天双下肢肌力较前稍恢复; 大便1150 mL. 术后第九天, 右下肢肌力0级, 左下肢肌力Ⅰ级; 大便350 mL. 术后第十天, 双下肢肌力Ⅰ级, 大便100 mL. 术后第十一天, 双下肢肌力Ⅰ级; 大便200 mL, 色红, 稀糊样. 术后第十二天, 双下肢肌力Ⅰ级; 大便200 mL, 色红, 稀糊样, 腹部有压痛, 有反跳痛. 术后第十三天, 双下肢肌力Ⅰ级; 大便50 mL, 色红, 稀糊样, 诉右侧腹痛, 有压痛有反跳痛. 当日查全腹部平扫示: "主动脉夹层术后"观, 降主动脉支架外至胸腹主动脉L3椎体上缘水平附壁血肿形成, 心影增大. 结肠肝曲即升结肠壁增厚并腔内密度不均匀增高, 其上方小肠梗阻; 直肠即乙状结肠腔内密度增高. 胆囊内密度不均匀, 胆汁淤积可能. 当天行剖腹探查术, 术中探查见: 腹盆腔多量粪渣样积液, 大网膜包裹回盲部及升结肠, 胆囊与周围网膜组织严重粘连, 分离粘连见胆囊肿胀, 胆囊壁内见大量散在坏疽样坏死, 吸尽积液, 升结肠可及多发穿孔, 最大穿孔直径约3 cm×2 cm, 穿孔附近肠壁呈坏死样改变, 遂决定行"右半结肠切除术+小肠部分切除术+胆囊切除术+回肠造口术". 术后即留取血、痰, 导管头细菌和真菌培养和药敏检测. 术后经验性应用万古霉素+头孢地嗪. 术后五天血、痰, 导管头细菌和真菌培养回示为阴沟肠杆菌溶解亚种. 升级抗生素为万古霉素+泰能抗感染. 术后2 d留取腹水培养, 术后1 wk腹水分泌物细菌和真菌培养结果为摩氏摩根菌塞氏亚种. 术后10 d腹水细菌和真菌培养结果为摩氏摩根菌塞氏亚种+肺炎克雷伯菌. 改替加环素+舒普深. 术后26 d复查痰培养结果为鲍曼不动杆菌、肺炎克雷伯(泛耐药)及酵母样真菌. 从术后26 d至术后76 d出院予伏立康唑抗真菌感染治疗, 这期间血侵袭性G试验波动在180 pg/mL至722 pg/mL. 术后一年余行"肠粘连松解术+回肠造口闭合术+切口疝修补术"术后应用奥硝唑5 d, 头孢米诺钠2 wk治愈出院.
患者夹层术后一年电话随访下地活动自如, 并来我院行造口回纳术. 患者造口回纳术后1年电话随访, 患者情况良好.
急性A型主动脉夹层是14 d内出现症状的累及升主动脉和/或主动脉弓的主动脉夹层. 国际主动脉夹层登记报道急性A型主动脉夹层并发mesMPS的发病率为3.8%(68/1809), 死亡率为63.2%(43/68), 甚至更高[1]. 肠系膜灌注不良是肠道血供不足, 脏器是缺血的但没有坏死. mesMPS不同于肠系膜灌注不良. mesMPS是肠道已经因缺血而发生坏死及功能障碍, 早期的肠系膜灌注不良的缺血性损伤可以逆转, 而mesMPS可认为是肠系膜灌注不良的晚期并发症. 肠系膜灌注不良和mesMPS都属于急性肠系膜缺血性肠病(acute mesenteric ischemia, AMI), 肠缺血有急, 慢性之分. 本文着重探讨急性A型主动脉夹层引起的急性肠缺血. 病人诊断有急性A型主动脉夹层并发肠系膜灌注不良依靠影像学证据, 表现为腹腔干、肠系膜上动脉, 肠系膜下动脉的血流灌注减少, 伴或不伴乳酸酸中毒、疼痛, 腹部膨胀. 而mesMPS早期缺乏特异的实验室检查指标和临床表现. 对于急性A型主动脉夹层并发mesMPS, 40%的病人没有出现腹痛[1]. 临床工作中一般出现严重的感染性休克的表现如心动过速、呼吸急促、低血压和体温升高或腹腔穿刺发现血性腹水以及出现腹膜炎及全身情况恶化后才意识到已进展成为肠坏死, 此时积极手术, 在术中得到证实发生肠坏死, 患者预后也较差[2]. 随着辅助检查水平不断提高, 腹部CTA, 磁共振成像(MRI)和多普勒血流仪等检查, 使得肠系膜灌注不良和mesMPS的早期诊断变得可行. 腹部计算机断层扫描血管造影(CTA)是肠系膜灌注不良和mesMPS的一线检查手段.
由于所有的肠系膜动脉通过侧枝相通, 肠道的缺血通常发生于三个主要的肠系膜供血动脉中有两个(通常是肠系膜上动脉和腹腔干)存在严重的狭窄和闭塞. 肠道血管没有完全闭塞而有严重狭窄在有低血压和低心排的情况下也可发生肠缺血[3]. 热缺血时肠管可耐受12 h内的75%的血流量减少[4], 但肠道血供完全闭塞6 h即导致不可逆的肠粘膜缺血, 细胞能量损失和白细胞浸润, 并伴有氧自由基的形成[5]. 肠道肌肉和神经的梗死导致动力型肠梗阻和肠管扩张, 最终导致透壁肠梗死继而肠穿孔, 腹膜炎和死亡, 然而感染性休克和多器官功能障碍可能在穿孔前导致病人死亡[3]. 主动脉置换会通过真腔的开放获得脏器的再灌注, 从而解决例如肠系膜上动脉主干动力型闭塞的问题, 却不能解决肠系膜上动脉分支真/假腔血栓形成引起的静力型闭塞问题[6]. 对于急性A型主动脉夹层引起的血流动力学改变导致肠系膜动脉分支血供不良, CTA可能低估其严重性, 尤其在夹层片延申累及肠系膜动脉分支的情况下肠系膜主干动脉通过修复或开窗恢复真腔供血数天后肠系膜分支的灌注可能会更差[7].
病人以急性A型主动脉夹层急诊入院, 存在的情况有: (1)CTA示: 腹腔干发自假腔, 肠系膜上动脉发自真假腔, 肠系膜下动脉发自假腔, 供应肠道血供的三大血管均被夹层累及, 一方面可存在动力型供血受损, 另一方面夹层撕到肠道血供的三大血管的分支开口, 有可能加剧导致分支中形成血栓而引起静力型供血受损; (2)体外循环转机时乳酸5.9 mmol/L, 停机时乳酸升高到15.8 mmol/L提示机体仍可能有氧供不足的地方; (3)并发急性肾衰; (4)从术后第一天大便隐血呈阳性. 通过以上情况可高度怀疑本例病人夹层术前和夹层术后早期就存在肠系膜灌注不良, 由于入院时尚缺乏诊断mesMPS的依据, 所以不支持入院后早于急诊夹层手术而介入优先解决mesMPS的问题, 主动脉夹层破裂的风险是首要致命的, 故急诊行夹层手术. 夹层手术可以恢复大动脉主干真腔供血.如果病人夹层所累及的腹腔干、肠系膜上动脉, 肠系膜下动脉的分支中形成了血栓而引起静力型供血受损(static ischemia), 那么肠系膜的血供并不能在主动脉修复手术后得到解决. 对于分支型的夹层并且有静力型闭塞, 也许需要初期就通过分支支架或建立旁路使得血流再通. 对于本例病人, 供应肠道血供的三大血管均被夹层累及, 其最终并发mesMPS的可能性大. 病人夹层手术后第一天大便隐血阳性, 术后第十一天出现大便红色稀糊状, 术后第十二天腹部有压痛, 术后第十三天才诉腹痛. 病人mesMPS特异的临床表现出现较晚. 然而病人三大肠道供血血管夹层受累, 其一旦出现可疑肠缺血症状, 应当尤为重视. 而急性A型夹层手术后病人有呼吸机人工通气的状态, 不方便转运行CTA检查. 病人可能有术后苏醒延迟, 谵妄的情况, 不利于及时表述腹部不适的症状, 所以夹层术后更难以早期诊断并发mesMPS. 故急性A型主动脉夹层累及肠道血供需更加始终警惕mesMPS的发生.
对于急性A型主动脉夹层术前并发mesMPS(除外主动脉破裂、心包填塞, 严重的主动脉瓣反流等急诊先行主动脉置换)的病人, Bo Yong MD和Ms Norton等[6]认为可介入手术优先通过开窗/释放支架处理肠系膜血供的问题, 介入手术观察病人腹部情况的变化和全身状态(如血清乳酸值等)以判断肠道的缺血损伤是否可逆以决定是否行坏死肠道切除术, 其后再延迟主动脉的开放置换手术, 这种介入先行解决mesMPS的治疗方式对挽救病人生命可改善结局. 每个未经治疗的mesMPS的病人都会死亡. 因此及时治疗mesMPS至关重要.
大鼠实验中肠缺血早期标志物有血清D-二聚体升高[8]. D-二聚体升高作为患者早期肠缺血的标志物敏感性较高, 但特异性较低[9]. 故D-二聚体成为患者肠缺血早期标志物备受怀疑. 白细胞计数增高有利于提示肠缺血的诊断, 然而发生夹层以及手术本身也会使白细胞计数增高, 故白细胞计数增高没有特异性. 腹胀和胃肠道出血大约是25%肠缺血病人的主要症状, 初期腹泻进展为后期便秘也是肠缺血病人的常见临床特征[10]. 在过去的几十年中, 有几种最有前途的生物标记物: 肠型脂肪酸结合蛋白(I-FABP)、α-谷胱甘肽-S转移酶(α-GST)、L、D-乳酸、瓜氨酸、缺血修饰白蛋白、降钙素原(PCT), 它们可能是早期诊断肠缺血的最佳候选标记物[11], 可用于急性肠系膜缺血性疾病肠管生机活性的判断[12,13]. 然而I-FABP尚且也不能区分可逆性肠粘膜缺血和不可逆性肠透壁性坏死. α-GST具有诊断早期急性肠缺血的潜在价值. 但是在伴有多器官功能衰竭的非特异性低血压患者中, α-GST也升高. D-乳酸具有良好的灵敏性, 但特异性较低. 因此D-乳酸不能作为一个标记[14]. 对于L-乳酸, 如果肝功能良好, 有能力清除大量的L-乳酸, 那么肠缺血早期并不表现出血浆L-乳酸的升高, 因此L-乳酸也不能作为早期肠缺血的标志[15]. 总之, 临床评估和实验室检查往往没有帮助, 影像学在急性肠缺血的诊断中起着重要的作用[3]. 如今, 对于检查肠系膜的血供, CTA已取代血管造影术成为诊断肠系膜缺血的金标准, 其敏感性和特异性分别为0.96和0.94[14]. 腹部CTA和腹部平扫CT常联合使用于临床. 肠损伤的诊断性CT描述特征包括腹腔游离腹水, 肠壁增厚, 肠系膜静脉中存在空气, 肠系膜静脉血栓形成等[2].
在mesMPS发生前或发生早期做出诊断, 及时外科干预可减少肠道的损伤, 改善预后. 并发mesMPS的急性A型主动脉夹层与没有并发mesMPS的急性A型主动脉夹层相比, 特点为: 年龄更大, 原发破口更多起始于根部, 更有可能有腹痛、腿疼、昏迷、缺血性脊髓损伤、急性肾衰、肢体缺血, 以及任何的脉搏短缺[1]. 急性A型主动脉夹层累及肠道血供并发mesMPS的预测研究较少. 而针对肠缺血发生透壁性肠坏死, 有研究发现其独立危险因素有: 肠系膜动脉闭塞, 白细胞>18.4×109/L, pH<7.29, 腹腔内游离积液[2]. 另一项研究得出结论, 包括休克, 血液浓缩, 血清淀粉酶水平升高和代谢性酸中毒被认为是肠缺血肠道透壁坏死的独立预测因素[16]. 还有研究发现其独立危险因素: 肠系膜动脉闭塞、白细胞增多、酸中毒、游离腹腔积液、并且有门静脉和肠系膜静脉血栓[17]. mesMPS发生后, 不仅需要恢复肠道的血供, 还需要剖腹探查切除坏死的肠道. 术中评估肠道活力除了观察肠管的颜色, 蠕动情况, 肠管供血血管的搏动情况以外, 荧光素法, 多普勒超声或激光多普勒也可以在术中评估肠道活力[18,19].
急性A型主动脉夹层第一位死亡原因是血管破裂, 若尚未出现mesMPS, 急诊需先行主动脉置换手术解除破裂的危险. 急性肠系膜缺血坏死的预后取决于诊断时间. 在立即治疗的情况下, 死亡率从0%到10%不等, 如果治疗延误6-12 h, 死亡率会增加到50%-60%, 如果治疗延误超过24 h, 死亡率会进一步增加到80%-100%[20]. 因此, 对急性A型主动脉夹层并发mesMPS的高危病人, 尤其是对于夹层累及2支及以上的肠道供血血管的病人, 始于"高度怀疑", 及时进行腹部CTA或肠系膜血管造影以及腹部平扫CT, 从而早期诊断, 进而早期干预是改善预后的关键.
夹层并发肠系膜灌注不良综合征死亡风险高, 早期缺乏特异的实验室检查指标和临床表现, 依靠CTA密切结合临床表现, 无论术前术后都应警惕肠系膜灌注不良综合征的发生, 以尽早诊断, 尽早干预, 改善预后.
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Di Eusanio M, Trimarchi S, Patel HJ, Hutchison S, Suzuki T, Peterson MD, Di Bartolomeo R, Folesani G, Pyeritz RE, Braverman AC, Montgomery DG, Isselbacher EM, Nienaber CA, Eagle KA, Fattori R. Clinical presentation, management, and short-term outcome of patients with type A acute dissection complicated by mesenteric malperfusion: observations from the International Registry of Acute Aortic Dissection. J Thorac Cardiovasc Surg. 2013;145:385-390. [PubMed] [DOI] |
| 3. | Hawthorn BR, Ratnam LA. Acute mesenteric ischaemia: imaging and intervention. Clin Radiol. 2020;75:19-28. [PubMed] [DOI] |
| 4. | Ha C, Magowan S, Accortt NA, Chen J, Stone CD. Risk of arterial thrombotic events in inflammatory bowel disease. Am J Gastroenterol. 2009;104:1445-1451. [PubMed] [DOI] |
| 5. | Klar E, Rahmanian PB, Bücker A, Hauenstein K, Jauch KW, Luther B. Acute mesenteric ischemia: a vascular emergency. Dtsch Arztebl Int. 2012;109:249-256. [PubMed] [DOI] |
| 6. | Yang B, Norton EL, Rosati CM, Wu X, Kim KM, Khaja MS, Deeb GM, Williams DM, Patel HJ. Managing patients with acute type A aortic dissection and mesenteric malperfusion syndrome: A 20-year experience. J Thorac Cardiovasc Surg. 2019;158:675-687.e4. [PubMed] [DOI] |
| 7. | Tanaka A, Estrera AL. Mesenteric Malperfusion: The Insidious, Dreadful Enemy. Semin Thorac Cardiovasc Surg. 2017;29:179-180. [PubMed] [DOI] |
| 8. | Altinyollar H, Boyabatli M, Berberoğlu U. D-dimer as a marker for early diagnosis of acute mesenteric ischemia. Thromb Res. 2006;117:463-467. [PubMed] [DOI] |
| 9. | Cudnik MT, Darbha S, Jones J, Macedo J, Stockton SW, Hiestand BC. The diagnosis of acute mesenteric ischemia: A systematic review and meta-analysis. Acad Emerg Med. 2013;20:1087-1100. [PubMed] [DOI] |
| 10. | Inderbitzi R, Wagner HE, Seiler C, Stirnemann P, Gertsch P. Acute mesenteric ischaemia. Eur J Surg. 1992;158:123-126. [PubMed] |
| 11. | Memet O, Zhang L, Shen J. Serological biomarkers for acute mesenteric ischemia. Ann Transl Med. 2019;7:394. [PubMed] [DOI] |
| 12. | Wiesner W, Khurana B, Ji H, Ros PR. CT of acute bowel ischemia. Radiology. 2003;226:635-650. [PubMed] [DOI] |
| 14. | van den Heijkant TC, Aerts BA, Teijink JA, Buurman WA, Luyer MD. Challenges in diagnosing mesenteric ischemia. World J Gastroenterol. 2013;19:1338-1341. [PubMed] [DOI] |
| 15. | Jakob SM, Merasto-Minkkinen M, Tenhunen JJ, Heino A, Alhava E, Takala J. Prevention of systemic hyperlactatemia during splanchnic ischemia. Shock. 2000;14:123-127. [PubMed] [DOI] |
| 16. | Acosta-Mérida MA, Marchena-Gómez J, Cruz-Benavides F, Hernández-Navarro J, Roque-Castellano C, Rodríguez-Méndez A, Alonso-Alvarado A, Hernández-Romero J. [Predictive factors of massive intestinal necrosis in acute mesenteric ischemia]. Cir Esp. 2007;81:144-149. [PubMed] [DOI] |
| 17. | Emile SH. Predictive Factors for Intestinal Transmural Necrosis in Patients with Acute Mesenteric Ischemia. World J Surg. 2018;42:2364-2372. [PubMed] [DOI] |
| 18. | Bulkley GB, Zuidema GD, Hamilton SR, O'Mara CS, Klacsmann PG, Horn SD. Intraoperative determination of small intestinal viability following ischemic injury: a prospective, controlled trial of two adjuvant methods (Doppler and fluorescein) compared with standard clinical judgment. Ann Surg. 1981;193:628-637. [PubMed] [DOI] |
| 19. | Wright CB, Hobson RW 2nd. Prediction of intestinal viability using Doppler ultrasound technics. Am J Surg. 1975;129:642-645. [PubMed] [DOI] |
| 20. | Kanasaki S, Furukawa A, Fumoto K, Hamanaka Y, Ota S, Hirose T, Inoue A, Shirakawa T, Hung Nguyen LD, Tulyeubai S. Acute Mesenteric Ischemia: Multidetector CT Findings and Endovascular Management. Radiographics. 2018;38:945-961. [PubMed] [DOI] |