修回日期: 2021-07-08
接受日期: 2021-09-13
在线出版日期: 2021-10-28
肌肉减少症是终末期肝病患者死亡的独立危险因素, 与患者的预后密切相关, 因此受到广泛关注. 但对于肌少症来说, 目前还缺乏统一的检测方法和诊断标准, 临床应用受限.
评估乙肝肝硬化相关慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)患者的第三腰椎腰大肌指数(the third lumbar level psoas muscle index, L3-PMI)与临床指标的关系及其在预后评估中的作用.
采用回顾性研究的方法, 选取2014-01/2017-12在天津市第三中心医院肝内科住院的符合乙肝肝硬化相关ACLF诊断标准且有腹部CT扫描资料的140例患者为研究对象. 由同一名研究者在患者腹部CT图像上手动追踪第三腰椎下缘水平面, 测量双侧腰大肌最大前后径和横径, 计算腰大肌指数. 分析患者的L3-PMI和临床特点及预后.
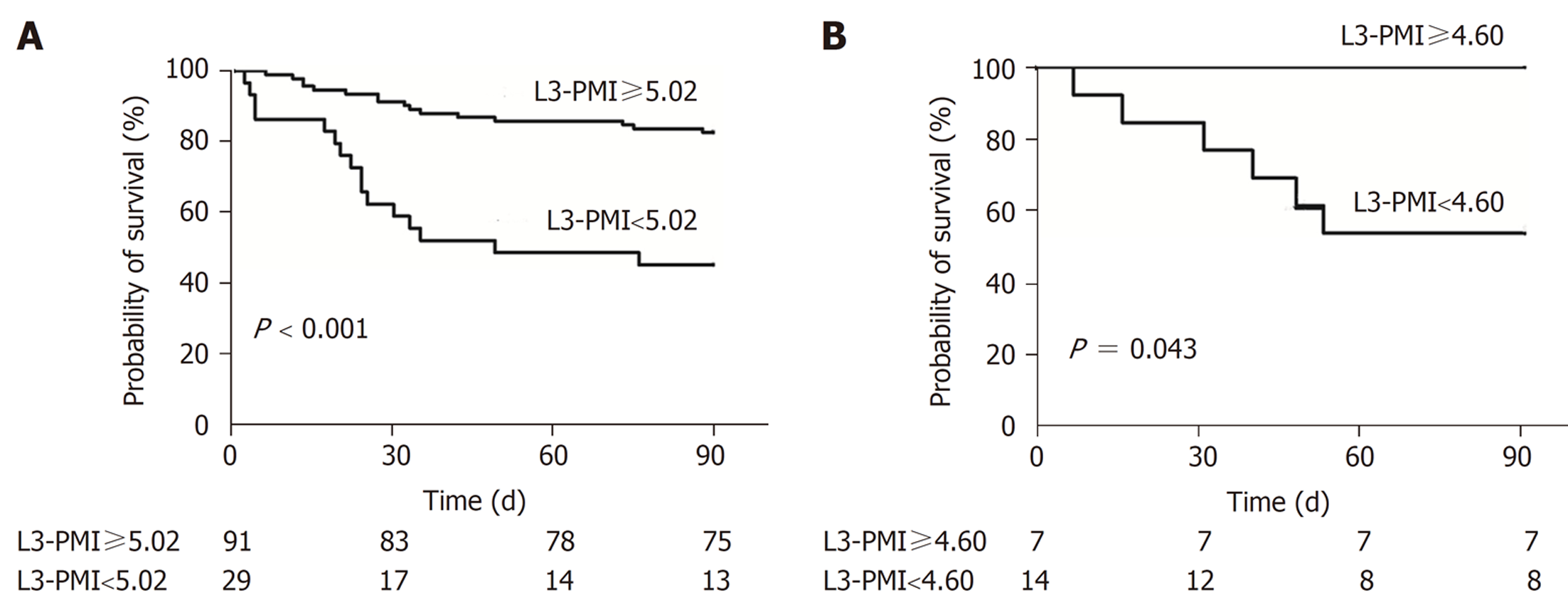
将140例患者按90天生存情况分为生存组102例, 死亡组38例. 死亡组患者L3-PMI值4.89 cm2/m2±1.42 cm2/m2较生存组患者5.94 cm2/m2±1.24 cm2/m2显著降低(P<0.001); 血小板(platelet, PLT)、白蛋白(albumin, ALB)、丙氨酸转移酶(alanine aminotransferase, ALT)、天门冬氨酸转移酶(aspartate transaminase, AST)、血肌酐(serum creatinine, SCr)、估算肾小球滤过率(estimated glomerular filtration rate, eGFR)在两组之间无统计学差异, P值均>0.05; 死亡组患者白细胞(white blood cell, WBC)、国际标准化比值(international normalized ratio, INR)水平、终末期肝病模型(model for end-stage liver disease, MELD)评分显著高于生存组, 而血清钠显著低于生存组(P值均<0.05). 此外, ACLF患者中33例合并肝性脑病(hepatic encephalopathy, HE)的患者L3-PMI值5.17 cm2/m2±1.49 cm2/m2显著低于107例未合并HE的患者5.80 cm2/m2±1.29 cm2/m2, (P = 0.02). 所有ACLF患者中男性 120例, 女性20例, 其中男性组L3-PMI值5.92 cm2/m2±1.23 cm2/m2显著高于女性组4.03 cm2/m2±0.92 cm2/m2, (P<0.05). 按性别分别绘制L3-PMI预测死亡的ROC曲线图, 其中男性ROC曲线下面积0.726, 截断值为5.02, 敏感度为85%, 特异度50%; 女性ROC曲线下面积0.774, 截断值为4.60, 敏感度为50%, 特异度100%.
L3-PMI对于评估乙肝肝硬化相关ACLF患者的预后有重要临床应用价值.
核心提要: 肌肉减少症与终末期肝病患者的预后密切相关, 但目前还缺乏统一的检测方法和诊断标准. 第三腰椎腰大肌指数(the third lumbar level psoas muscle index, L3-PMI)测量简便客观, 在慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)患者中观察到有很好的指示作用, 临床应用前景广阔.
引文著录: 叶青, 蔡均均, 闫俊卿, 吕蓉. L3-PMI在乙肝肝硬化相关慢加急性肝衰竭患者预后评估中的作用. 世界华人消化杂志 2021; 29(20): 1167-1173
Revised: July 8, 2021
Accepted: September 13, 2021
Published online: October 28, 2021
Sarcopenia has received widespread attention in patients with end-stage liver disease since it is an independent risk factor for death and is closely related to the prognosis of the patients. However, there is still a lack of unified detection methods and diagnostic criteria for sarcopenia.
To evaluate the relationship between the third lumbar psoas muscle index (L3-PMI) and clinical indicators in patients with acute-on-chronic liver failure (ACLF) associated with hepatitis B cirrhosis and its role in prognostic evaluation.
A retrospective study was performed on 140 patients who were hospitalized at the Department of Hepatology, Tianjin Third Central Hospital from January 2014 to December 2017, met the ACLF diagnostic criteria for hepatitis B cirrhosis, and had abdominal CT data. The same researcher manually tracked the level of the lower edge of the third lumbar vertebra on the CT images of the patient's abdomen, measured the maximum anteroposterior and transverse diameters of the psoas major on both sides, and calculated the psoas major index. The relationship of L3-PMI with clinical characteristics and prognosis was then analyzed.
The 140 patients were divided into a survival group with 102 cases and a death group with 38 cases according to their 90-d survival status. The L3-PMI value of patients in the death group was 4.89 cm2/m2 ± 1.42 cm2/m2, significantly lower than that of patients in the survival group (5.94 cm2/m2 ± 1.24 cm2/m2; P < 0.001). There was no statistical difference between the two groups in PLT, ALB, ALT, AST, SCr, or eGFR (P > 0.05). The WBC, INR, and MELD scores of the death group were significantly higher than those of the survival group, while the serum sodium was significantly lower than that of the survival group (P < 0.05). In addition, 33 ACLF patients with hepatic encephalopathy (HE) had an L3-PMI value of 5.17 cm2/m2 ± 1.49 cm2/m2, which was significantly lower than that of 107 patients without HE (P = 0.020). Among all ACLF patients, there were 120 males and 20 females. The L3-PMI value of the male group (5.92 cm2/m2 ± 1.23 cm2/m2) was significantly higher than that of the female group (4.03 cm2/m2 ± 0.92 cm2/m2; P < 0.05). The ROC curve of L3-PMI for predicting death by gender was plotted. The area under the ROC curve for males was 0.726, the cut-off value was 5.02, and the sensitivity and specificity were 85% and 50%, respectively. The area under the ROC curve for females was 0.774, the cut-off value was 4.60, and the sensitivity and specificity were 50% and 100%, respectively.
L3-PMI has important clinical application value for evaluating the prognosis of ACLF patients related to hepatitis B liver cirrhosis.
- Citation: Ye Q, Cai JJ, Yan JQ, Lv R. Role of L3-PMI in prognostic evaluation of patients with acute-on-chronic liver failure related to hepatitis B cirrhosis. Shijie Huaren Xiaohua Zazhi 2021; 29(20): 1167-1173
- URL: https://www.wjgnet.com/1009-3079/full/v29/i20/1167.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i20.1167
慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)是在慢性肝病基础上发生的急性肝功能失代偿的临床综合征, 伴随多器官功能衰竭, 在短期内病死率高[1-3]. 肌肉减少症被定义为慢性病患者的病理性肌肉丢失, 其在终末期肝病患者预后中的作用已被广泛接受[4-6]. 目前已经提出了使用横断面成像诊断肌肉减少症的不同方法[7-10], 大多数方法需要特殊软件, 相对耗时且难以在临床应用中实施[9]. 近年来国际上用腰大肌指数(psoas muscle index, PMI)来评估肌肉减少症, 测量简便客观[9]. 第三腰椎下缘水平测量腰大肌横截面积, 除以身高的平方, 即为第三腰椎腰大肌指数(the third lumbar level psoas muscle index, L3-PMI). 但目前我国还缺乏慢加急性肝衰竭患者L3-PMI的相关数据. 本研究调查了我院住院的乙肝肝硬化相关ACLF患者140例的L3-PMI, 以期评价L3-PMI对乙肝肝硬化相关ACLF患者预后的影响及临床应用价值.
选择2014-01/2017-12在天津市第三中心医院肝内科住院的符合ACLF诊断标准的乙肝肝硬化且有腹部计算机断层扫描(computed tomography, CT)资料的140例患者为研究对象. 其中男120例, 女20例, 平均年龄52.4岁. 将140例患者按90天生存情况分为生存组102例, 死亡组38例. 两组男女比例分别为88/14和32/6, 年龄分别为52.88±11.21和54.76±9.44.
慢加急性肝衰竭诊断标准符合2018年《肝衰竭诊治指南》[3]中的诊断标准. 排除标准: (1)合并恶性肿瘤患者; (2)合并其他原因肝衰竭, 如酒精性肝病、自身免疫性肝病等; (3)年龄小于35岁或大于70岁; (4)没有腹部CT扫描资料的患者; (5)腰椎畸形、腰大肌外伤等无法测量腰大肌面积的患者.
本研究获得天津市第三中心医院伦理委员会审查通过, 所有纳入人员(本人或家属)均签署知情同意书.
所有患者于入院当日清晨, 空腹状态下取静脉血送检肝、肾功能、电解质、凝血功能、血常规等血液学检测.
由同一名研究者在患者腹部CT图像上手动追踪第三腰椎下缘水平面, 测量双侧腰大肌最大前后径和横径, 相乘即得到双侧腰大肌横截面面积, 再除以患者身高的平方,计算腰大肌指数L3-PMI(cm2/m2).
统计学处理 所有数据均采用SPSS 17.0软件(SPSS Inc., Chicago, IL, USA)进行统计学分析. 先将各组数据进行正态分布检验, 正态分布计量资料以均数±标准差mean±SD表示, 两组间比较采用t检验; 非正态分布计量资料以中位数和四分位数间距Median(IQR)表示, 两组间比较采用Mann-whitney U检验. 计数资料采用数量及百分数表示. 计数资料的比较选用χ2检验和Fisher's精确检验. 使用Kaplan-Meier法进行生存分析, 生存率比较采用log-rank检验. 应用ROC曲线评估L3-PMI预测患者90天病死率的能力. 双侧检验, P<0.05认为差异有统计学意义.
| 变量 | 生存组(n = 102) | 死亡组(n = 38) | P值 |
| 年龄(岁) | 52.88±11.21 | 54.76±9.44 | 0.068 |
| 性别(男/女) | 88/14 | 32/6 | 0.788 |
| WBC(×109/L) | 7.10±4.04 | 9.80±6.64 | 0.004 |
| PLT(×109/L) | 83.50(53.75-124.0) | 81.50(34.75-135.75) | 0.708 |
| ALB(g/L) | 29.19±5.08 | 27.38±29.70 | 0.052 |
| ALT(U/L) | 111.50(34.00-384.00) | 57.00(34.50-316.50) | 0.346 |
| AST(U/L) | 132.00(70.25-346.00) | 124.00(65.25-373.43) | 0.554 |
| TBIL(μmol/L) | 232.07±130.14 | 220.83±112.51 | 0.639 |
| BUN(mmol/L) | 4.95(4.03-7.40) | 6.00(4.84-9.81) | 0.061 |
| SCr(μmol/L) | 64.50(52.75-85.00) | 62.00(53.75-88.75) | 0.39 |
| Na+(mmol/L) | 134.41±4.98 | 130.89±5.74 | <0.001 |
| K+(mmol/L) | 3.82±0.56 | 3.89±0.75 | 0.578 |
| PTA(%) | 42.03±12.15 | 35.45±13.91 | 0.007 |
| INR | 1.89(1.67-2.33) | 2.32(1.88-3.10) | 0.004 |
| eGFR(mL/min/1.73m2) | 113.42±46.14 | 104.44±42.35 | 0.297 |
| MELD评分 | 20.72±5.63 | 23.23±7.32 | 0.033 |
| L3-PMI(cm2/m2) | 5.94±1.24 | 4.89±1.42 | <0.001 |
乙肝肝硬化相关ACLF患者140例按90天生存情况分为生存组102例, 死亡组38例, 两组年龄分别为52.88±11.21, 54.76±9.44, P = 0.068; 两组性别无差异, P = 0.788. 生存组患者的白细胞(white blood cell, WBC)、国际标准化比值(international normalized ratio, INR)水平、终末期肝病模型(model for end-stage liver disease, MELD)评分明显低于死亡组, 分别P = 0.004, P = 0.004和P = 0.033; 而凝血酶原活动度(prothrombin time activity, PTA)、血清钠(Na+)和L3-PMI均高于死亡组, 分别P = 0.007、P<0.001和P<0.001. 生存组和死亡组两组间白蛋白(albumin, ALB)、丙氨酸转移酶(alanine aminotransferase, ALT)、天门冬氨酸转移酶(aspartate transaminase, AST)、血小板(platelet, PLT)、总胆红素(total bilirubin, TBIL)、尿素氮(blood urea nitrogen, BUN)、血肌酐(serum creatinine, SCr)、估算肾小球滤过率(estimated glomerular filtration rate, eGFR)均无统计学差异.
乙肝肝硬化相关ACLF患者按照性别分组, 分别绘制L3-PMI预测死亡ROC曲线图. 其中男性120例, ROC曲线下面积0.726, 截断值为5.02 cm2/m2, 敏感度为85%, 特异度为50%; 女性20例, ROC曲线下面积0.774, 截断值为4.60 cm2/m2, 敏感度为50%, 特异度为100%. 根据男女L3-PMI的截断值, 绘制出男性及女性生存曲线图(图1). 根据不同性别的截断值分组所得出的临床指标差异见表2. 依据男性L3-PMI的截断值5.02 cm2/m2分组, 发现男性中L3-PMI小于5.02cm2/m2的患者29例, 其死亡率达到55.17%, 其WBC、ALB、ALT、BUN、Na、PTA、INR、MELD评分与L3-PMI大于5.02 cm2/m2的患者有明显统计学差异, P值均小于0.05; 依据女性L3-PMI的截断值4.60 cm2/m2分组, 发现女性中L3-PMI小于4.60 cm2/m2的患者13例, 其死亡率达到46.15%.
| 变量 | 男性组(n = 120) | 女性组(n = 20) | ||||
| L3-PMI<5.02 cm2/m2 (n = 29) | L3-PMI≥5.02 cm2/m2 (n = 91) | P值 | L3-PMI<4.60 cm2/m2 (n = 13) | L3-PMI≥4.60 cm2/m2 (n = 7) | P值 | |
| 年龄 | 53.17±8.68 | 51.25±10.70 | 0.382 | 57.62±12.27 | 46.86±15.36 | 0.057 |
| WBC(×109/L) | 10.03±6.73 | 7.46±4.20 | 0.016 | 6.84±5.56 | 5.42±3.00 | 0.542 |
| PLT(×109/L) | 71.00(53.00-173.50) | 85.00(53.00-124.00) | 0.465 | 81.00(37.50-125.50) | 98.00(23.00-131.00) | 0.837 |
| ALB(g/L) | 26.68±4.49 | 29.47±4.22 | 0.003 | 28.23±7.02 | 27.94±8.34 | 0.936 |
| ALT(U/L) | 46.50(29.25-121.00) | 154.00(37.50-394.00) | 0.001 | 208.00(34.00-376.25) | 210.00(68.00-934.00) | 0.288 |
| AST(U/L) | 93.00(43.00-164.00) | 140.00(76.00-375.00) | 0.279 | 173.00(75.50-434.00) | 260.00(65.00-630.00) | 0.500 |
| TBIL(μmol/L) | 218.84±102.63 | 243.17±131.35 | 0.364 | 190.21±124.60 | 159.34±110.67 | 0.590 |
| BUN(mmol/L) | 6.38(5.24-13.79) | 5.03(4.05-7.09) | 0.014 | 4.68±6.83 | 3.44(3.03-7.29) | 0.452 |
| SCr(μmol/L) | 64.00(50.50-117.00) | 65.00(55.00-85.00) | 0.169 | 55.00(46.00-83.50) | 45.00(42.00-78.00) | 0.533 |
| Na(mmol/L) | 130.48±6.29 | 134.43±4.35 | <0.001 | 131.33±7.55 | 137.16±3.38 | 0.071 |
| K(mmol/L) | 3.94±0.77 | 3.77±0.58 | 0.205 | 3.96±0.53 | 4.11±0.39 | 0.516 |
| PTA(%) | 35.52±11.62 | 42.18±12.10 | 0.010 | 40.38±15.74 | 34.57±18.81 | 0.471 |
| INR | 2.25(1.91-2.99) | 1.86(1.67-2.33) | 0.018 | 1.99(1.65-2.72) | 3.09(1.89-3.63) | 0.290 |
| MELD评分 | 23.56±6.98 | 21.20±5.02 | 0.048 | 18.87±8.93 | 19.85±9.43 | 0.820 |
| eGFR(mL/min/1.73 m2) | 109.59±53.15 | 112.53±42.30 | 0.760 | 103.66±51.78 | 110.29±41.43 | 0.774 |
| L3-PMI(cm2/m2) | 4.29±0.62 | 6.45±0.87 | <0.001 | 3.60±0.86 | 4.83±0.29 | 0.002 |
| 死亡 | 16(55.17%) | 16(17.58%) | 6(46.15%) | 0 | ||
近年来, 越来越多的研究证实肌肉减少症与慢性肝病患者的预后密切相关, 是慢性肝病患者死亡的独立危险因素[11]. 由于肝脏是营养物质的代谢中枢, 尤其终末期肝病患者, 其蛋白质摄入及代谢障碍, 肌肉减少是最常见的并发症, 也是最容易被忽视的并发症[12,13]. 鉴于此, 2016年, 国际上已把肌肉减少症明确为一种疾病, 并且授予了特定ICD-10编码[14], 这为推动肌肉减少症的诊断和治疗奠定了基础.
对于慢加急性肝衰竭患者来说, 在慢性肝病的基础上, 由于各种诱因出现了急性肝功能的失代偿[2,15], 这种诱因可能是上消化道出血、腹腔感染等. 而随之继发而来的全身炎症反应会引起骨骼肌的分解代谢反应, 导致过度的能量消耗并最终加重肌肉减少症[16]. 在我们的队列中, 白细胞计数(全身炎症的替代指标)在肌肉减少症患者中显着升高, 进一步强调了全身炎症与肌肉减少症和ACLF的进展密切关联. ACLF发展的发病机制中也包括全身炎症[17]. 据此可见, 肌肉减少症可能是潜在慢性全身炎症的临床表现, 这可能是促进ACLF的进展因素.
此外, 合并肝性脑病(hepatic encephalopathy, HE)的33例患者的L3-PMI值显著低于未合并HE的患者107例(P = 0.020). 最近的研究报道了肝硬化中肌肉减少症和HE之间的关联[18,19], 实际上这两种并发症通常会影响终末期肝病患者的预后, 并且可能发挥协同作用. 高氨血症本身会通过上调肌肉生长抑制素的产生而减少肌肉蛋白合成[20]. 但本研究中合并HE和未合并HE两组中男女比例存在差异(P = 0.008), 对于L3-PMI可能会照成潜在的性别差异影响, 需要进一步扩大样本量来平衡性别差异.
尽管对肌肉减少症的研究越来越多, 但对于肌少症目前还缺乏统一的检测方法和诊断标准. 几种成像方式, 例如双能X射线吸收测定法(dual-energy X-ray absorptiometry, DXA), 超声检查(ultrasonography, US)、计算机断层扫描(CT)和磁共振成像(magnetic resonance imaging, MRI)等使对慢性肝病患者进行肌肉评估成为可能[9]. 其中计算机断层扫描(CT)被认为可以作为检测骨骼肌肌肉质量的"金标准", 具有准确、客观、可重复测定等优点[9]. 有报道, 第三腰椎水平骨骼肌质量指数(L3-SMI)可评估肌肉减少症[21], 但是其测量方法比较复杂, 需要测量L3层面所有骨骼肌(包括腰大肌、竖脊肌、腰方肌、腹横肌、腹外斜肌和腹内斜肌)横截面积之和, 再除以身高的平方(cm2/m2), 而得到L3-SMI. 需要用特殊软件进行测算, 同时SMI用于诊断肌肉量减少的界值尚未统一[9] . 而腰大肌指数(L3-PMI)因测量方法简便易行, 在评估肌肉含量中日益受到关注, 日本肝病学会发布了对于肝病患者肌肉减少症的诊疗指南[12], 该指南推荐50岁以下男性L3-PMI截断值为6.36 cm2/m2, 女性L3-PMI截断值为3.92 cm2/m2. 本研究依据ROC曲线估算出的男女L3-PMI的截断值分别为5.02 cm2/m2和4.60 cm2/m2. 目前对于ACLF患者的截断值亦没有统一的界值, 需要更多研究数据来提供依据.
本研究发现, 对于经典的MELD 评分来说, 该评分为终末期肝病模型, 旨在对终末期肝病短期、中期死亡率进行有效的预测[22]. 死亡组的MELD评分明显低于生存组(P = 0.033), 同时其L3-PMI值(4.89 cm2/m2±1.42 cm2/m2)亦明显低于生存组(5.94 cm2/m2±1.24 cm2/m2)(P<0.001); 因此, 在评估终末期肝病患者死亡风险时, L3-PMI可能是一个新的可供选择的指标.
越来越多的证据表明, 认识到肌肉减少症患者的年龄、性别差异非常重要[4,9,23]. 健康人群的老年人中, 肌肉含量快速逐年下降[4,12]. 本研究排除了70岁以上老年人, 入组标准控制在35-70岁之间. 但由于样本量不足, 未能进行对年龄的进一步分层细化分析, 还需要在今后的研究中进一步探讨年龄和肌肉减少症的关系. 相对于性别, 虽然L3-PMI用身高的平方对男女不同性别肌肉量可能存在的差异做了调整, 本研究发现女性的L3-PMI明显偏低, 这与既往研究的结果一致[4]. 我们的队列中的男女不同性别的截断值分别为5.02和4.60, 该结果将特定性别的肌肉减少症分类确定为死亡率的独立预测因子.
传统的应用人体测量学评估肌肉减少症的指标例如前臂肌围(mid-arm muscle circumference, MAMC)、握力等在临床中应用中会受到测量人员主观判断差异性、患者意识状态等诸多因素影响[19]. 而CT检查通常成为慢性肝病患者的常规检查手段, 评估肌肉减少无需额外费用, 且测量快速、客观且可重复, 因此应用L3-PMI评估肌肉减少症的方法具有简单性和便捷性, 临床应用前景广阔.
综上所述, 本研究对于L3-PMI在乙肝相关慢加急性肝衰竭患者死亡风险方面的价值进行了探讨. 提示对于慢加急性肝衰竭患者来说, 早期识别肌肉减少症具有临床意义, 可以尽早进行营养干预, 以期改善预后, 延长生存期. 但本研究尚存在一定不足, 首先, 本研究为单中心的数据, 样本量相对不足, 需要对大型患者队列进行进一步的多中心研究; 其次, 本研究是回顾性研究, 缺少对于肌肉减少症的机制研究. 我们将在未来的研究中加以完善和加强.
终末期肝病患者的营养问题日益受到关注, 肌肉减少症是其最突出的表现, 但目前国际国内还缺乏相应的诊断标准和检测方法.
评估肌肉减少症与终末期肝病患者预后的关系, 寻求一种临床中简便易行的评估肌肉减少症的方法, 以期达到尽早诊断并干预, 延长患者生存期的目的.
评估第三腰椎腰大肌指数(the third lumbar level psoas muscle index, L3-PMI)与乙肝肝硬化相关慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)患者预后的关系, 探讨L3-PMI在临床中应用的价值.
本研究回顾性地分析了乙肝肝硬化相关ACLF患者的L3-PMI值及其与临床指标和预后的关系.
ACLF患者死亡组的L3-PMI值(4.89 cm2/m2±1.42 cm2/m2)较生存组(5.94 cm2/m2±1.24 cm2/m2)显著降低, P<0.001; ACLF患者中33例合并肝性脑病(hepatic encephalopathy, HE)的患者L3-PMI值5.17 cm2/m2±1.49 cm2/m2显著低于未合并HE的患者5.80 cm2/m2±1.29 cm2/m2, (P = 0.020). 按性别分别绘制L3-PMI预测死亡的ROC曲线图, 其中男性ROC曲线下面积0.726, 截断值为5.02, 敏感度为85%, 特异度50%; 女性ROC曲线下面积0.774, 截断值为4.60, 敏感度为50%, 特异度100%.
L3-PMI用于识别肌肉减少症简便易行, 在评估乙肝肝硬化相关ACLF患者的预后中有重要临床应用价值.
本研究为回顾性观察研究, 且为单中心临床数据, 尚需进一步开展多中心、大样本和前瞻性研究, 并深入探讨ACLF患者合并肌肉减少症的机制.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Zaccherini G, Weiss E, Moreau R. Acute-on-chronic liver failure: Definitions, pathophysiology and principles of treatment. JHEP Rep. 2021;3:100176. [PubMed] [DOI] |
| 2. | Sarin SK, Choudhury A, Sharma MK, Maiwall R, Al Mahtab M, Rahman S, Saigal S, Saraf N, Soin AS, Devarbhavi H, Kim DJ, Dhiman RK, Duseja A, Taneja S, Eapen CE, Goel A, Ning Q, Chen T, Ma K, Duan Z, Yu C, Treeprasertsuk S, Hamid SS, Butt AS, Jafri W, Shukla A, Saraswat V, Tan SS, Sood A, Midha V, Goyal O, Ghazinyan H, Arora A, Hu J, Sahu M, Rao PN, Lee GH, Lim SG, Lesmana LA, Lesmana CR, Shah S, Prasad VGM, Payawal DA, Abbas Z, Dokmeci AK, Sollano JD, Carpio G, Shresta A, Lau GK, Fazal Karim M, Shiha G, Gani R, Kalista KF, Yuen MF, Alam S, Khanna R, Sood V, Lal BB, Pamecha V, Jindal A, Rajan V, Arora V, Yokosuka O, Niriella MA, Li H, Qi X, Tanaka A, Mochida S, Chaudhuri DR, Gane E, Win KM, Chen WT, Rela M, Kapoor D, Rastogi A, Kale P, Rastogi A, Sharma CB, Bajpai M, Singh V, Premkumar M, Maharashi S, Olithselvan A, Philips CA, Srivastava A, Yachha SK, Wani ZA, Thapa BR, Saraya A, Shalimar, Kumar A, Wadhawan M, Gupta S, Madan K, Sakhuja P, Vij V, Sharma BC, Garg H, Garg V, Kalal C, Anand L, Vyas T, Mathur RP, Kumar G, Jain P, Pasupuleti SSR, Chawla YK, Chowdhury A, Alam S, Song DS, Yang JM, Yoon EL; APASL ACLF Research Consortium (AARC) for APASL ACLF working Party. Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific association for the study of the liver (APASL): an update. Hepatol Int. 2019;13:353-390. [PubMed] [DOI] |
| 4. | Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyère O, Cederholm T, Cooper C, Landi F, Rolland Y, Sayer AA, Schneider SM, Sieber CC, Topinkova E, Vandewoude M, Visser M, Zamboni M; Writing Group for the European Working Group on Sarcopenia in Older People 2 (EWGSOP2), and the Extended Group for EWGSOP2. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48:16-31. [PubMed] [DOI] |
| 5. | Ooi PH, Hager A, Mazurak VC, Dajani K, Bhargava R, Gilmour SM, Mager DR. Sarcopenia in Chronic Liver Disease: Impact on Outcomes. Liver Transpl. 2019;25:1422-1438. [PubMed] [DOI] |
| 6. | Ebadi M, Bhanji RA, Mazurak VC, Montano-Loza AJ. Sarcopenia in cirrhosis: from pathogenesis to interventions. J Gastroenterol. 2019;54:845-859. [PubMed] [DOI] |
| 7. | Praktiknjo M, Book M, Luetkens J, Pohlmann A, Meyer C, Thomas D, Jansen C, Feist A, Chang J, Grimm J, Lehmann J, Strassburg CP, Abraldes JG, Kukuk G, Trebicka J. Fat-free muscle mass in magnetic resonance imaging predicts acute-on-chronic liver failure and survival in decompensated cirrhosis. Hepatology. 2018;67:1014-1026. [PubMed] [DOI] |
| 8. | Giusto M, Lattanzi B, Albanese C, Galtieri A, Farcomeni A, Giannelli V, Lucidi C, Di Martino M, Catalano C, Merli M. Sarcopenia in liver cirrhosis: the role of computed tomography scan for the assessment of muscle mass compared with dual-energy X-ray absorptiometry and anthropometry. Eur J Gastroenterol Hepatol. 2015;27:328-334. [PubMed] [DOI] |
| 9. | Lee CM, Kang BK, Kim M. Radiologic Definition of Sarcopenia in Chronic Liver Disease. Life (Basel). 2021;11. [PubMed] [DOI] |
| 10. | Park J, Gil JR, Shin Y, Won SE, Huh J, You MW, Park HJ, Sung YS, Kim KW. Reliable and robust method for abdominal muscle mass quantification using CT/MRI: An explorative study in healthy subjects. PLoS One. 2019;14:e0222042. [PubMed] [DOI] |
| 11. | Hou L, Deng Y, Wu H, Xu X, Lin L, Cui B, Zhao T, Fan X, Mao L, Hou J, Sun H, Wang B, Sun C. Low psoas muscle index associates with long-term mortality in cirrhosis: construction of a nomogram. Ann Transl Med. 2020;8:358. [PubMed] [DOI] |
| 12. | Nishikawa H, Shiraki M, Hiramatsu A, Moriya K, Hino K, Nishiguchi S. Japan Society of Hepatology guidelines for sarcopenia in liver disease (1st edition): Recommendation from the working group for creation of sarcopenia assessment criteria. Hepatol Res. 2016;46:951-963. [PubMed] [DOI] |
| 13. | Plauth M, Bernal W, Dasarathy S, Merli M, Plank LD, Schütz T, Bischoff SC. ESPEN guideline on clinical nutrition in liver disease. Clin Nutr. 2019;38:485-521. [PubMed] [DOI] |
| 14. | Anker SD, Morley JE, von Haehling S. Welcome to the ICD-10 code for sarcopenia. J Cachexia Sarcopenia Muscle. 2016;7:512-514. [PubMed] [DOI] |
| 15. | Arroyo V, Moreau R, Jalan R. Acute-on-Chronic Liver Failure. N Engl J Med. 2020;382:2137-2145. [PubMed] [DOI] |
| 16. | Pérez-Baos S, Prieto-Potin I, Román-Blas JA, Sánchez-Pernaute O, Largo R, Herrero-Beaumont G. Mediators and Patterns of Muscle Loss in Chronic Systemic Inflammation. Front Physiol. 2018;9:409. [PubMed] [DOI] |
| 17. | Laleman W, Claria J, Van der Merwe S, Moreau R, Trebicka J. Systemic Inflammation and Acute-on-Chronic Liver Failure: Too Much, Not Enough. Can J Gastroenterol Hepatol. 2018;2018:1027152. [PubMed] [DOI] |
| 18. | Lattanzi B, D'Ambrosio D, Merli M. Hepatic Encephalopathy and Sarcopenia: Two Faces of the Same Metabolic Alteration. J Clin Exp Hepatol. 2019;9:125-130. [PubMed] [DOI] |
| 19. | Anand AC. Nutrition and Muscle in Cirrhosis. J Clin Exp Hepatol. 2017;7:340-357. [PubMed] [DOI] |
| 20. | Qiu J, Tsien C, Thapalaya S, Narayanan A, Weihl CC, Ching JK, Eghtesad B, Singh K, Fu X, Dubyak G, McDonald C, Almasan A, Hazen SL, Naga Prasad SV, Dasarathy S. Hyperammonemia-mediated autophagy in skeletal muscle contributes to sarcopenia of cirrhosis. Am J Physiol Endocrinol Metab. 2012;303:E983-E993. [PubMed] [DOI] |
| 21. | Ebadi M, Wang CW, Lai JC, Dasarathy S, Kappus MR, Dunn MA, Carey EJ, Montano-Loza AJ; From the Fitness, Life Enhancement, and Exercise in Liver Transplantation (FLEXIT) Consortium. Poor performance of psoas muscle index for identification of patients with higher waitlist mortality risk in cirrhosis. J Cachexia Sarcopenia Muscle. 2018;9:1053-1062. [PubMed] [DOI] |
| 22. | Kamath PS, Kim WR; Advanced Liver Disease Study Group. The model for end-stage liver disease (MELD). Hepatology. 2007;45:797-805. [PubMed] [DOI] |
| 23. | Anderson LJ, Liu H, Garcia JM. Sex Differences in Muscle Wasting. Adv Exp Med Biol. 2017;1043:153-197. [PubMed] [DOI] |