修回日期: 2021-06-03
接受日期: 2021-09-29
在线出版日期: 2021-10-28
肝癌干细胞样细胞(hepatocarcinoma stem cell-like cells, CSCs)具有较强的自我更新和肿瘤发生能力, 在肝硬化进展至肝癌的进程发挥关键作用. 我们将肝脏Axin2+CD90+细胞鉴定为肝硬化的CSCs, 并观察了HGF/Met/JN信号通路介导的细胞自噬在肝硬化进展至肝癌期间的作用.
明确肝细胞生长因子(hepatocyte growth factor, HGF)/Met/JNK信号通路介导的细胞自噬在肝硬化癌变进程中的作用.
从肝血管瘤患者中共收集8例非肝硬化手术标本; 2007-09, 在本院收集了18例酒精相关, 30例慢性乙型肝炎相关肝硬化活检样本. 这些患者随访至2015-12. 来自患者的3例外科肝癌样本与酒精相关的肝硬化, 通过手术收集来自乙型肝炎相关肝硬化患者的8个肝癌样本. 8 wk龄雄性SD大鼠每周两次腹膜内注射50 mg/kg二乙基亚硝胺持续8 wk建立肝硬化模型. Western-blotting检测人和大鼠进行的组织自噬状态、HGF的水平及HGF/Met/JNK信号途径分子的变化. 采用c-Met抑制剂EMD1214063治疗肝硬化大鼠并评估细胞增殖和凋亡, 同时评估HGF/Met/JNK信号途径分子的变化.
相较于正常肝组织对照, 肝硬化患者的自噬水平显著升高(全部P<0.05), 而自噬水平的下降与肝硬化进展为肝癌有关; 同时, 这些肝硬化异常自噬样本中HGF的产生显著增加. 肝硬化肝脏根据自噬状态和HGF表达首先分层后发现p-Met、t-Met及p-JNK水平在自噬增强的Axin2阳性细胞中显著升高(全部P<0.05). 治疗8 wk和11 wk后细胞增殖显著减少(全部P<0.05), 而TUNEL染色的结果显示细胞的c-Met抑制剂EMD1214063对肝细胞的凋亡并无明显影响. 在第8周和第11周使用来自对照和EMD1214063处理组的全肝裂解物的Western印迹分析显示p-Met、p-JNK及HGF在11 wk的大鼠中显著降低, 而t-Met、p-JNK及HGF在8 wk的大鼠中显著降低.
HGF/Met/JNK信号通路介导的细胞自噬参与到肝硬化癌变进程中, 并且c-Met抑制剂能够在肝硬化进程中发挥治疗作用.
核心提要: 肝细胞生长因子(hepatocyte growth factor, HGF)/Met/JNK信号通路介导的细胞自噬参与到肝硬化癌变进程中, 并且c-Met抑制剂能够在肝硬化进程中发挥治疗作用.
引文著录: 彭全斌, 朱书渊, 汪望月. HGF/Met/JNK信号通路介导的细胞自噬在肝硬化癌变进程中的作用. 世界华人消化杂志 2021; 29(20): 1158-1166
Revised: June 3, 2021
Accepted: September 29, 2021
Published online: October 28, 2021
Liver cancer stem cell-like cells (CSCs) have strong self-renewal and tumorigenic capabilities, and play a key role in the progression of liver cirrhosis to liver cancer. We identified liver Axin2+CD90+ cells as CSCs in liver cirrhosis, and observed the effect of autophagy mediated by the HGF/Met/JN signaling pathway during the progression of liver cirrhosis to liver cancer.
To determine the role of HGF/Met/JNK signaling pathway-mediated autophagy in the carcinogenesis of liver cirrhosis and the effect of c-Met inhibitor on this process.
Eight non-cirrhotic surgical specimens were collected from patients with hepatic hemangioma. In September 2007, 18 alcohol-related and 30 chronic hepatitis B-related cirrhosis biopsy samples were collected in our hospital. These patients were followed until December 2015. Three surgical liver cancer samples from patients with alcohol-related cirrhosis, and eight liver cancer samples from patients with hepatitis B-related cirrhosis were collected by surgery. Eight-week-old male SD rats were injected intraperitoneally with 50 mg/kg diethylnitrosamine twice a week for 8 wk to establish a liver cirrhosis model. Western blot was used to detect tissue autophagy status, HGF levels, and changes in HGF/Met/JNK signaling pathway molecules in humans and rats. The c-Met inhibitor EMD1214063 was used to treat cirrhotic rats, evaluate cell proliferation and apoptosis, and assess changes in HGF/Met/JNK signaling pathway molecules.
Compared with normal liver tissue, the level of autophagy in cirrhosis was significantly increased (P < 0.05), while the decrease in autophagy was associated with the progression of cirrhosis to liver cancer. At the same time, the production of HGF in these abnormal samples was significantly increased. The liver cirrhosis tissue was first stratified according to autophagy status and HGF expression, and the levels of p-Met, t-Met, and p-JNK were found to be significantly elevated in autophagy-enhanced Axin2-positive cells (P < 0.05). Cell proliferation was significantly reduced after 8 and 11 wk of treatment (P < 0.05), and TUNEL staining showed that the c-Met inhibitor EMD1214063 had no significant effect on hepatocyte apoptosis. Western blot analysis using whole liver lysates from control and EMD1214063 treated groups at weeks 8 and 11 showed that the levels of p-Met, p-JNK, and HGF were significantly reduced at both time points.
HGF/Met/JNK signaling pathway-mediated autophagy is involved in the carcinogenesis of cirrhosis, and c-Met inhibitors can play a therapeutic role in this process.
- Citation: Peng QB, Zhu SY, Wang WY. Autophagy mediated by the HGF/Met/JNK signaling pathway is involved in carcinogenesis of liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2021; 29(20): 1158-1166
- URL: https://www.wjgnet.com/1009-3079/full/v29/i20/1158.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i20.1158
肝硬化是由酒精性肝病和慢性肝炎等肝病引起的弥漫性的慢性肝损伤, 若不及时治疗, 可进一步发展为肝癌, 这是慢性肝病的自然过程. 目前对于肝硬化进展为肝癌的细胞和分子机制知之甚少. 近年研究发现, 肝癌干细胞样细胞(hepatocarcinoma stem cell-like cells, CSCs)具有较强的自我更新和肿瘤发生能力, 在肝硬化进展至肝癌的进程发挥关键作用[1]. 研究显示[2,3], Wnt/β-catenin信号转导通路可能参与维持了正常干细胞的自我更新和祖细胞的增殖或分化, 而Axin2作为靶基因, 在信号级联反应中起负调节因子的作用. 学者研究发现[4], Wnt信号维持的肝Axin2+细胞具有自我更新的能力并发挥肝干细胞的作用, 而若Axin2基因敲除或发生突变将促进或维持肺癌[5]、卵巢癌[6]、骨肉瘤[7]和肝癌[8]中的癌症干细胞样特征. 因此, 我们推测肝脏Axin2+细胞可能作为肝硬化进展为肝癌过程中的肝脏CSCs的重要标志物.
自噬是细胞生长、发育、成熟和分化的重要生理过程, 在细胞处于应激状态时, 可产生细胞内营养、生长因子和能量, 以支持细胞存活, 若营养缺乏, 缺氧或缺血[9]等应激状态持续存在, 可导致细胞的死亡. 研究发现[10], 细胞自噬过程中所产生的细胞因子或生长因子可独立激活内源性信号刺激细胞繁殖和增殖, 甚至促进细胞干性. 由于肝硬化、肝细胞纤维化等病理变化不断损伤肝细胞[11], 可导致细胞的异常自噬. 因此, 自噬可能在肝硬化进展为肝癌过程中发挥重要作用.
研究表明[12,13], 分化簇90(cluster of differentiation 90, CD90)被证实是肝脏CSCs更稳定的标志物. 因此, 在本研究中, 我们将肝脏Axin2+CD90+细胞鉴定为肝硬化的CSCs, 并观察了肝细胞生长因子(hepatocyte growth factor, HGF)/Met/JNK信号通路介导的细胞自噬在肝硬化进展至肝癌期间的作用.
从肝血管瘤患者中共收集8例非肝硬化手术标本和血样; 2007-09, 在本院收集了18例酒精相关, 30例慢性乙型肝炎相关肝硬化活检样本. 这些患者随访至2015-12. 来自患者的3例外科肝癌样本与酒精相关的肝硬化, 通过手术收集来自乙型肝炎相关肝硬化患者的8个肝癌样本. 这些组织样品立即用于随后的实验, 或者在活组织检查或手术切除后固定在多聚甲醛和石蜡包埋中. 根据世界卫生组织标准进行肝癌的组织病理学诊断. 排除纤维板层肝癌, 胆管癌和合并肝胆管癌. 本研究经医院伦理委员会批准. 从每位患者获得书面知情同意书.
1.2.1 动物模型: 为了建立肝硬化至肝癌进展的模型, 8 wk龄雄性Sprague Dawley大鼠每周两次腹膜内注射50 mg/kg二乙基亚硝胺(N0258-1G; 美国Sigma-Aldrich公司), 持续8 wk. 给大鼠喂食常规饮食4 wk. 对大鼠进行活组织检查以评估肝硬化和自噬状态的存在. 大鼠也接受c-Met抑制剂Tepotinib(EMD1214063, 15 mg/kg; Selleck), 每周两次通过腹膜内注射给药4 wk. 在适当的情况下, 将一组正常大鼠或具有媒介物注射的大鼠作为对照. 在最终处理后, 在另外8 wk和11 wk时间点的观察后杀死大鼠. 整个实验期为20 wk.
1.2.2 流式细胞术: 取小块肝组织(1 mm3)在超净台中采用2 mL无菌注射器的推动杆于10 cm培养皿中进行研磨后, 经过40 µm的滤网过滤后, PBS洗涤两遍后用于流式上机. 使用BD Accuri C6(美国BD Biosciences公司)通过流式细胞术测定人Axin2+CD90+, Axin2+CD133+和Axin2+Epcam+细胞. 来自每种类型的人肝硬化肝脏的Axin2+和Axin2-细胞被分类并在体外进一步分析.
1.2.3 球囊细胞形成测定: 分选的人Axin2+CD90+, Axin2+CD90-和Axin2-CD90-细胞以1000个细胞/孔的密度在Dulbecco改良的Eagle培养基中培养/F12培养基(美国HyClone公司)补充2%B27(美国Invitrogen公司), 100 U/mL青霉素和100 μg/mL链霉素, 20 ng/mL表皮生长因子和20 ng/mL碱性成纤维细胞生长因子(美国PeproTech公司)使用超低附着六孔板(美国Corning公司)2 wk. 每3 d将细胞暴露于新鲜培养基中. 计算形成的直径>75 μm的球体.
1.2.4 蛋白质印迹: 自噬标记物微管相关蛋白轻链(microtubule-associated protein light chain, LC3)-I/LC3-Ⅱ和P62及肝细胞生长因子(hepatocyte growth factor, HGF)表达通过蛋白质印迹在上述分选的细胞和不同的人和大鼠肝脏样品中检测, 有或没有处理. 还进行蛋白质印迹以检测上述分选细胞Met和JNK的磷酸化.
1.2.5 免疫组化及细胞凋亡分析: 在最后一次处理后4 wk(最后一次二乙基亚硝胺注射后12 wk), 切割具有不同自噬状态和不同处理的4 μm厚的大鼠肝硬化肝脏横切面, 并进行TUNEL(中国南通碧云天生物技术研究所)和Ki-67(碧云天)染色.
统计学处理 样本量通过使用网站上的两个比例比较公式计算: http://powerandsamplesize.com/Calculators/. 所有数据均以mean±SD表示. 在用Bartlett检验证明方差同质性之后, 使用单向方差分析, 然后在适当的情况下使用Student-Newman-Keuls检验来评估统计学显著性. P<0.05的值被认为是统计学上显著的. 所有实验至少重复三次.
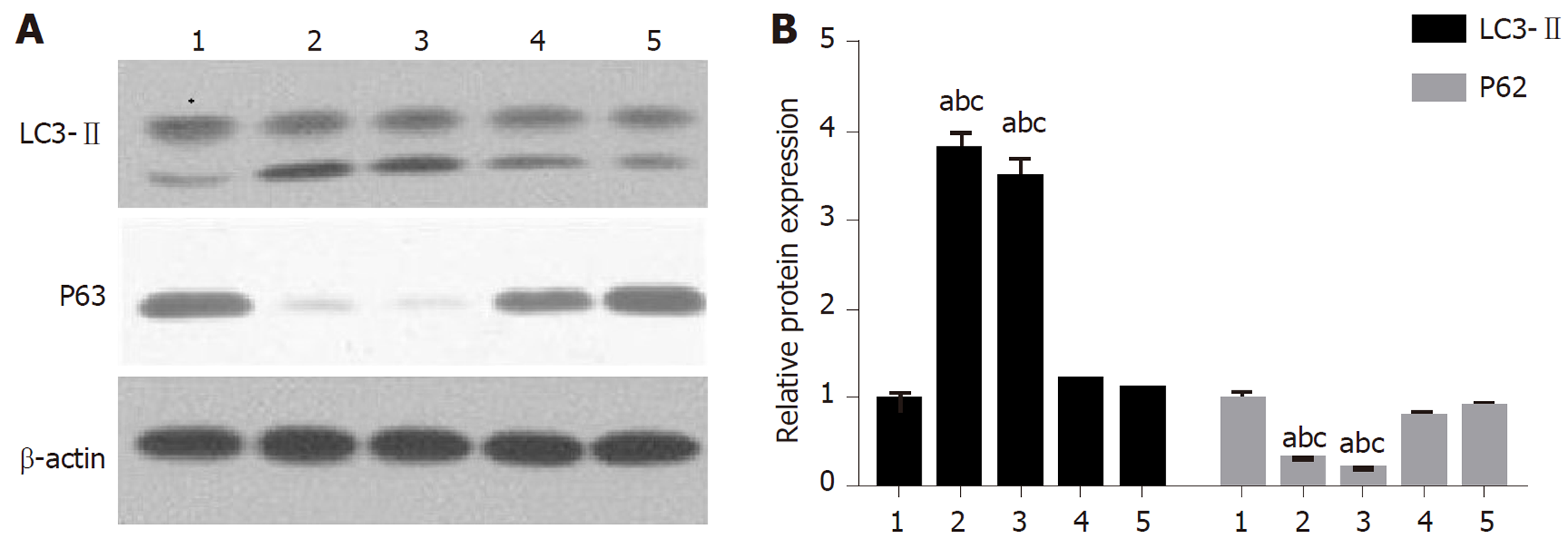
我们首先通过Western-blotting检测了不同肝硬化和进展为肝癌的肝硬化标本的自噬水平的变化, 结果如图1所示, 从图中可见, 相较于正常肝组织对照, 肝硬化患者的自噬水平显著升高(全部P<0.05), 而自噬水平的下降与肝硬化进展为肝癌有关. 这些结果显示在肝硬化进展为肝癌期间, Axin2+细胞向Axin2+CD90+细胞的转变与异常自噬有关. Axin2/增强绿色荧光蛋白(enhanced green fluorescent protein, EGFP)+CD90+细胞存在于具有异常自噬的人肝硬化样本中, 其进一步发展成维持Axin2/EGFP+CD90+细胞的肝癌.
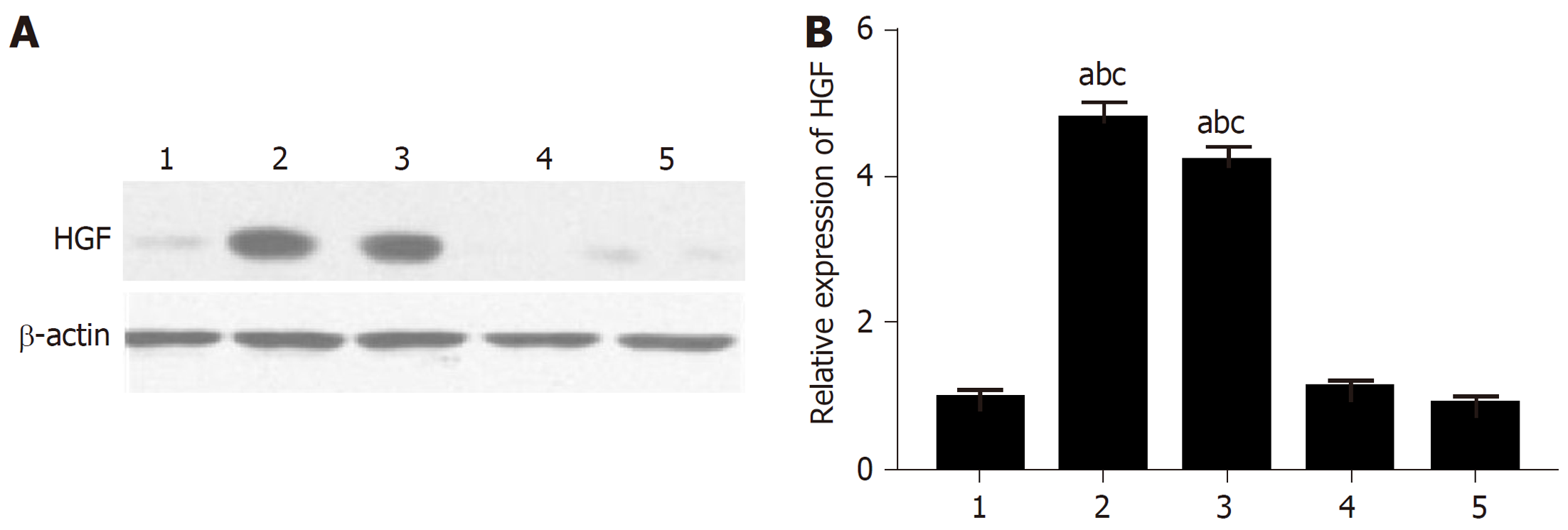
我们进一步通过Western-blotting分析上述人肝硬化样本的HGF水平. 结果如图2所示, 根据肝硬化中的自噬状态首先对所有样品进行分层, 发现肝硬化异常自噬样本中HGF的产生显著增加. 这些结果显示自噬依赖性HGF表达是肝硬化中产生Axin2+CD90+细胞所必需的.
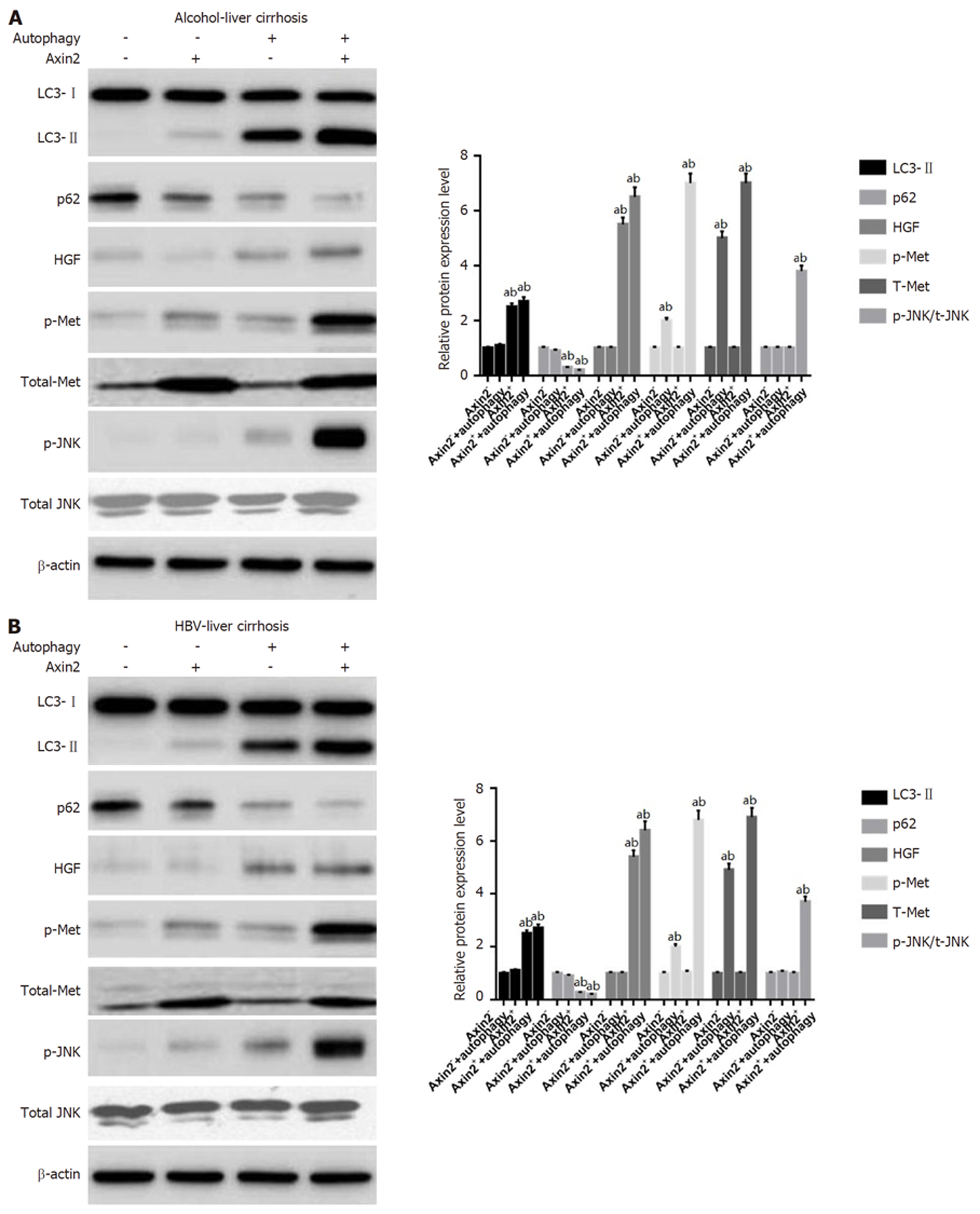
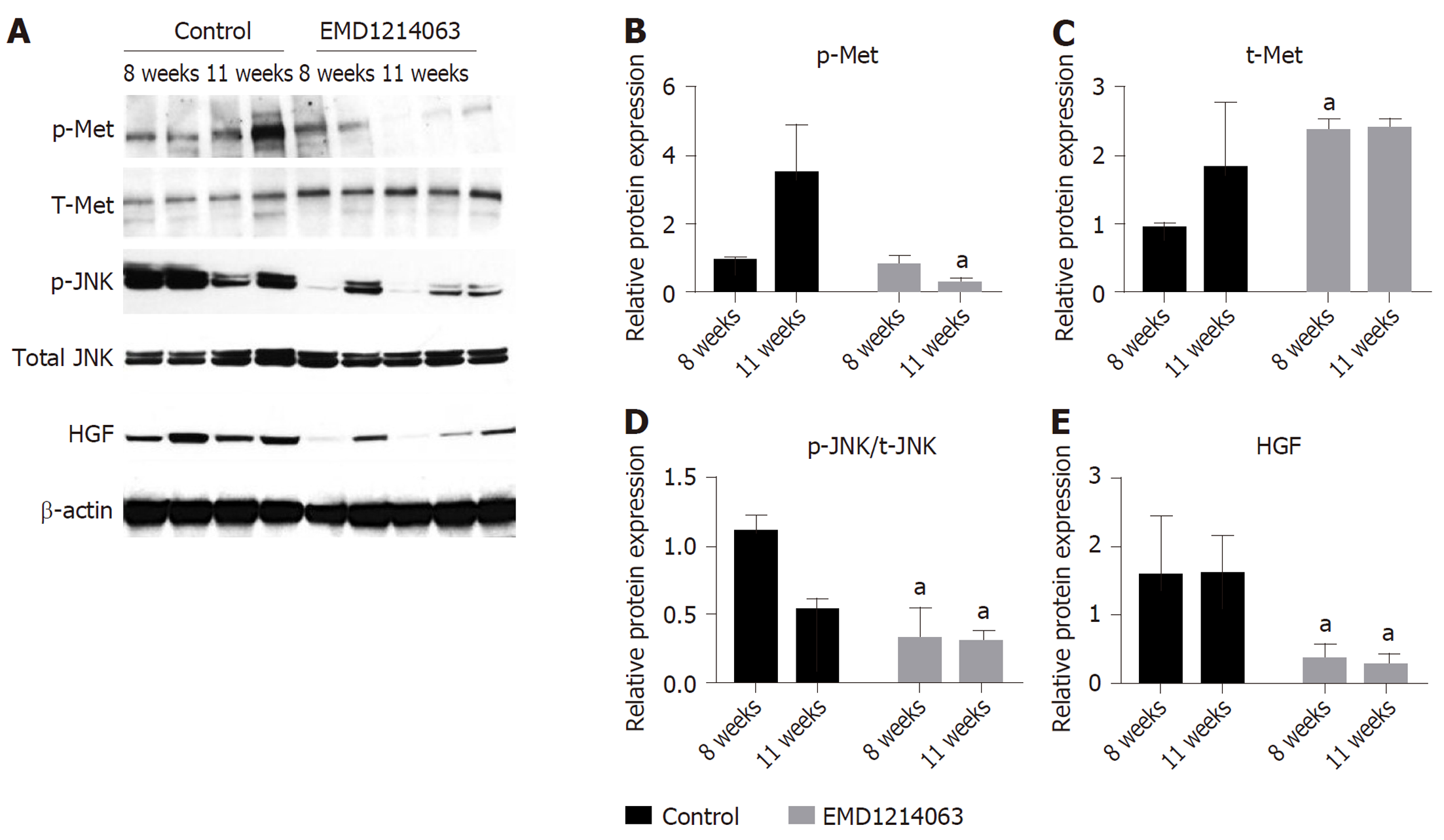
我们通过Western-blotting分析不同种类人肝硬化样本的自噬相关的HGF/Met/JNK途径分子水平, 结果如图3所示, 从图中可见, Axin2-细胞和Axin2+细胞从不同类型的人肝硬化肝脏中分选, 所述肝硬化肝脏根据自噬状态和HGF表达首先分层后发现p-Met、t-Met及p-JNK在水平在自噬增强的Axin2阳性细胞中显著升高(全部P<0.05). 自噬相关的HGF/Met/JNK信号通路用于在肝硬化中将Axin2+细胞转变成Axin2+CD90+细胞.
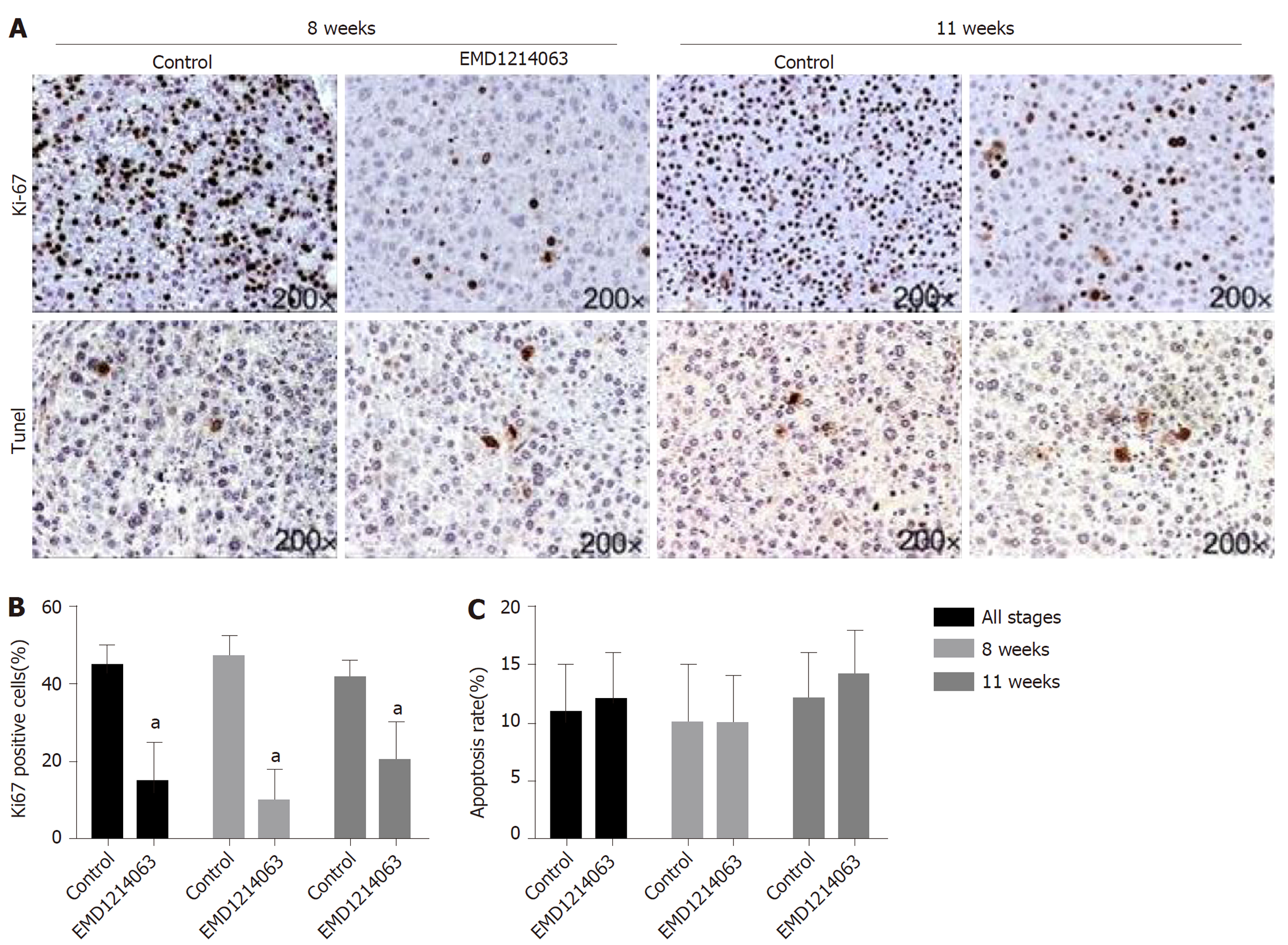
我们进一步建立大鼠肝硬化模型后, 采用c-Met抑制剂EMD1214063干预肝硬化大鼠, 结果如图4所示, Ki-67染色显示, 治疗8 wk和11 wk后细胞增殖显著减少(全部P<0.05), 而TUNEL染色的结果显示细胞的c-Met抑制剂EMD1214063对肝细胞的凋亡并无明显影响.
我们采用Western印迹分析第8周和第11周肝硬化大鼠肝组织中HGF/Met/JNK信号通路的表达, 结果显示, p-Met、p-JNK及HGF在11 wk的大鼠中显著降低, 而t-Met、p-JNK及HGF在8 wk的大鼠中显著降低(图5).
肝硬化对肝癌的发生具有很高的风险. 在这项研究中, 我们通过确定肝硬化肝脏中肝脏CSC样细胞的起源, 提出了从肝硬化到肝癌的新进展. 我们发现肝Axin2/EGFP+CD90+细胞来源于Axin2/EGFP+细胞, 在具有异常自噬的人和大鼠肝硬化肝脏中获得CSC特性, 并促成肝癌发生. 由于HGF表达的增加或减少, 肝硬化肝脏中自噬的诱导或抑制通过诱导或减少来自Axin2/EGFP+细胞的肝Axin2/EGFP+CD90+细胞的产生来促进或预防肝癌发生. 进一步的细胞学实验显示肝硬化中自噬依赖性HGF表达激活肝Axin2/EGFP+细胞中的Met/JNK信号传导, 导致向Axin2/EGFP+CD90+CSC样细胞的转变. HGF敲低或抑制肝硬化中Met/JNK传导的活化阻止了Axin2/EGFP+CD90+细胞的形成和进一步的肝癌发生. 我们的研究结果表明, 在肝硬化中CSCs产生的机制中, HGF/Met/JNK的自噬依赖性激活在肝癌发生中起着至关重要的作用, 破坏该过程可提供一种有希望的治疗方法来预防肝硬化进展为肝癌.
肝脏CSC是癌细胞的一小部分, 表达干细胞相关转录因子Sox2和Oct4, 具有自我更新, 分化和肿瘤发生的强大能力[1]. 目前, 肝脏CSCs起源的机制及其在肝癌发生中的作用尚不清楚. 理论上推测肝脏CSCs起源于正常干细胞[13], 最近的一项研究表明, 肝脏Axin2+细胞可以自我更新以响应Wnt/β-连环蛋白刺激[4]. 在本研究中, 我们使用肝硬化分选肝细胞. 干性反应标记物Axin2, 以及充分记录的CSC标记物CD90, 其在肝脏CSC中显示稳定表达, 在不同细胞系中不变[13]. 我们发现这些肝脏Axin2+CD90+细胞表达高水平的Sox2和Oct4并且能够在体外形成球体以及在体内产生肿瘤异种移植物. 此外, 与具有很少或没有Axin2+CD90+细胞的肝硬化肝脏相比, 具有高百分比的肝Axin2+CD90+细胞的肝硬化肝脏进展为肝癌. 此外, 这些Axin2+CD90+细胞也存在于肿瘤异种移植物和肝癌组织中, 其表现出CSC的不对称自我更新分裂性状[14]. 除了从Axin2Cre获得的肝EGFP+CD90+细胞获得的类似结果之外: Rosa26EGFP具有EGFP标记的Axin2细胞的肝硬化大鼠肝脏, 减少大鼠肝硬化中EGFP+CD90+细胞数量的治疗显著阻止肝癌发生. 这些发现表明肝脏Axin2+CD90+细胞在肝硬化进展为肝癌期间承担CSC的责任.
目前的研究进一步证明肝硬化中Axin2+细胞产生的肝Axin2+CD90+细胞依赖于Met/JNK信号传导的激活. 以往的研究表明, JNK和STAT3信号传导对于平滑肌肉瘤的肿瘤发生, 胶质瘤干细胞的自我更新[18]和非小细胞肺癌的CSC特性至关重要[15]. 但是, 我们发现Met的活化作为上游受体酪氨酸激酶对于激活下游JNK信号传导并诱导Axin2/EGFP+细胞中的CD90表达至关重要. 通过药理学抑制剂抑制肝硬化中的Met/JNK信号传导能够减少分选的肝Axin2/EGFP+细胞向Axin2/EGFP+CD90+细胞的转变并预防肝癌发生. 尽管Wnt/β-catenin信号在多种癌症中全面参与诱导和维持CSC表型[16,17], 之前的研究发现β-catenin在肝Axin2/EGFP+CD90-细胞和Axin2/EGFP+CD90+中均有显著表达. 来自肝硬化的细胞和β-连环蛋白表达不受磷酸化Met的调节, 表明肝Axin2/EGFP+细胞向Axin2/EGFP+CD90+细胞转变不需要Wnt/β-连环蛋白信号传导. 相反, Wnt/β-连环蛋白信号传导是正常肝脏中肝脏Axin2+细胞自我更新所必需的[4], 并且β-连环蛋白在Axin2/EGFP-细胞中不表达, 但在Axin2/EGFP+细胞中表达, 仍然表现出一定程度Sox2和Oct4的表达和克隆性, 表明Wnt/β-连环蛋白信号传导负责维持Axin2+细胞的正常干性特征, 并且Met/JNK信号传导负责Axin2/EGFP+CD90+细胞在肝脏中的肝硬化和致瘤性. 虽然Axin2的表观遗传失调会通过调节Wnt/β-连环蛋白信号传导而影响CSC样性状, 但之前研究的数据也表明[5,6], 在没有失调的情况下, Axin2/β-catenin信号为其他信号提供了干细胞背景. 产生肝脏CSC. 此外, 除了在肝Axin2/EGFP-细胞中不存在Met磷酸化之外, 肝Axin2/EGFP-细胞中的Met表达也显著低于Axin2/EGFP+细胞中的Met表达. 该发现表明, Met的充分表达可能是其磷酸化和下游JNK信号传导的激活的先决条件, 以诱导Axin2/EGFP+细胞向Axin2/EGFP+CD90+细胞的转变.
LC3被认为是自噬的标志, 其作为可溶性LC3-Ⅰ和脂质化LC3-Ⅱ存在. LC3-Ⅰ转化为LC3-Ⅱ并在自噬体与溶酶体融合后降解. 因此, LC3-Ⅱ是LC3的可靠标记, 并且LC3-Ⅱ的量与自噬体的数量相关, 其能够用于预测自噬活性[18]. 之前Lee等人[19]的研究显示LC3能够用于肝癌的预测. 另外, 自噬衔接蛋白p62能够用于识别泛素化蛋白聚集体, 并通过与LC3的结合将它们与自噬体联系起来, 而自噬体是选择性自噬过程中溶酶体降解所必需的载货过程. 有研究显示[20]p62参与到肝癌的发生发展调控中.
HGF是Met磷酸化的配体. 我们的结果显示Met和下游JNK和STAT3都在来自肝硬化的Axin2/EGFP+细胞中被磷酸化, 具有显著的HGF表达. 通过shRNA干扰抑制肝硬化肝脏中HGF的表达, 有效抑制EGFP+细胞中的Met和JNK磷酸化, 消除其向EGFP+CD90+细胞的转变, 减少肝癌发生, 表明肝硬化肝脏中EGFP+CD90+CSCs的产生和肝癌的发生. HGF/Met/JNK依赖性方式. 肝脏Axin2/EGFP-和Axin2/EGFP+细胞中的β-连环蛋白表达不受肝硬化中HGF表达的调节, 这进一步暗示HGF/Met/JNK信号传导是造成肿瘤发生过程中致瘤性的主要原因. Axin2+CD90+CSCs在肝硬化中的作用. 然而, 肝脏Axin2+/EGFP+细胞中HGF/Met/JNK信号传导的激活以及随后转变成Axin2+/EGFP+CD90+细胞依赖于肝硬化中的自噬. 由于病理改变, 肝硬化肝脏患有慢性营养不良损伤[11], 导致自噬, 通过营养和生长因子的产生支持细胞存活对抗营养[9]我们发现异常自噬的诱导来影响肝硬化肝脏[21]. 自噬存在能够进一步诱导肝硬化肝脏中HGF的表达. 肝硬化中的自噬缺乏抑制了HGF表达, 然后未能激活Axin2+细胞中的Met/JNK信号传导. 最重要的自噬缺陷或干扰通过抑制HGF/Met/JNK信号通过抑制Axin2+CD90+CSCs的产生, 有效地预防肝硬化中的肝癌发生, 支持自噬诱导促进肿瘤性肝结节的观点[22].
本研究存在一定的不足, 由于研究时间较短, 很难在短期内收集到大量的病例, 由于大部分患者均为手术切除病例, 部分活检病例在实验前均经患者及家属同意进行取样, 因此, 组织样本量是足够进行实验, 由于但样本数量较少, 可能会对实验结果造成偏倚, 在下一步的研究中我们将进一步扩大病例数进行研究.
总之, HGF/Met/JNK信号通路介导的细胞自噬参与到肝硬化癌变进程中, 并且c-Met抑制剂能够在肝硬化进程中发挥治疗作用.
肝硬化是由酒精性肝病和慢性肝炎等肝病引起的弥漫性的慢性肝损伤, 若不及时治疗, 可进一步发展为肝癌, 这是慢性肝病的自然过程. 目前对于肝硬化进展为肝癌的细胞和分子机制知之甚少.
自噬在肝硬化进展至肝癌的病理进程中发挥重要作用, 探求其具体发病机制, 为肝癌的防治提供新的靶点.
观察肝细胞生长因子(hepatocyte growth factor, HGF)/Met/JNK信号通路介导的细胞自噬在肝硬化进展至肝癌期间的作用, 旨在探求肝硬化进展至肝癌的发病机制.
选择非肝硬化手术标本及酒精相关、慢性乙型肝炎相关肝硬化活检样本及外科肝癌样本, 同时, 运用二乙基亚硝胺建立大鼠肝硬化模型, 并运用EMD1214063干预. Western-blotting检测人和大鼠肝组织自噬状态、HGF的水平及HGF/Met/JNK信号途径分子的变化. 评估大鼠肝组织中细胞增殖和凋亡.
肝硬化肝脏根据自噬状态和HGF表达首先分层后发现p-Met、t-Met及p-JNK在水平在自噬增强的Axin2阳性细胞中显著升高(全部P<0.05). p-Met、p-JNK及HGF在11 wk的大鼠中显著降低, 而t-Met、p-JNK及HGF在8 wk的大鼠中显著降低.
HGF/Met/JNK信号通路介导的细胞自噬与肝硬化癌变进程密切相关, 且c-Met抑制剂能够在肝硬化进程中发挥治疗作用.
HGF/Met/JNK信号通路介导的细胞自噬可能是肝硬化癌变进程中的重要机制, 并且c-Met抑制剂可能为防治肝硬化进展至肝癌提供了新的药物选择.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 3. | Lim X, Tan SH, Yu KL, Lim SB, Nusse R. Axin2 marks quiescent hair follicle bulge stem cells that are maintained by autocrine Wnt/β-catenin signaling. Proc Natl Acad Sci USA. 2016;113:E1498-E1505. [PubMed] [DOI] |
| 4. | Wang B, Zhao L, Fish M, Logan CY, Nusse R. Self-renewing diploid Axin2(+) cells fuel homeostatic renewal of the liver. Nature. 2015;524:180-185. [PubMed] [DOI] |
| 5. | Fang L, Cai J, Chen B, Wu S, Li R, Xu X, Yang Y, Guan H, Zhu X, Zhang L, Yuan J, Wu J, Li M. Aberrantly expressed miR-582-3p maintains lung cancer stem cell-like traits by activating Wnt/β-catenin signalling. Nat Commun. 2015;6:8640. [PubMed] [DOI] |
| 6. | Wu G, Liu A, Zhu J, Lei F, Wu S, Zhang X, Ye L, Cao L, He S. MiR-1207 overexpression promotes cancer stem cell-like traits in ovarian cancer by activating the Wnt/β-catenin signaling pathway. Oncotarget. 2015;6:28882-28894. [PubMed] [DOI] |
| 7. | Martins-Neves SR, Corver WE, Paiva-Oliveira DI, van den Akker BE, Briaire-de-Bruijn IH, Bovée JV, Gomes CM, Cleton-Jansen AM. Osteosarcoma Stem Cells Have Active Wnt/β-catenin and Overexpress SOX2 and KLF4. J Cell Physiol. 2016;231:876-886. [PubMed] [DOI] |
| 8. | Chai S, Ng KY, Tong M, Lau EY, Lee TK, Chan KW, Yuan YF, Cheung TT, Cheung ST, Wang XQ, Wong N, Lo CM, Man K, Guan XY, Ma S. Octamer 4/microRNA-1246 signaling axis drives Wnt/β-catenin activation in liver cancer stem cells. Hepatology. 2016;64:2062-2076. [PubMed] [DOI] |
| 10. | Wang X, Sun W, Shen W, Xia M, Chen C, Xiang D, Ning B, Cui X, Li H, Li X, Ding J, Wang H. Long non-coding RNA DILC regulates liver cancer stem cells via IL-6/STAT3 axis. J Hepatol. 2016;64:1283-1294. [PubMed] [DOI] |
| 12. | Zhang X, Jiang P, Shuai L, Chen K, Li Z, Zhang Y, Jiang Y, Li X. miR-589-5p inhibits MAP3K8 and suppresses CD90+ cancer stem cells in hepatocellular carcinoma. J Exp Clin Cancer Res. 2016;35:176. [PubMed] [DOI] |
| 13. | Oikawa T. Cancer Stem cells and their cellular origins in primary liver and biliary tract cancers. Hepatology. 2016;64:645-651. [PubMed] [DOI] |
| 15. | Kitanaka C, Sato A, Okada M. JNK Signaling in the Control of the Tumor-Initiating Capacity Associated with Cancer Stem Cells. Genes Cancer. 2013;4:388-396. [PubMed] [DOI] |
| 16. | Song W, Ma Y, Wang J, Brantley-Sieders D, Chen J. JNK signaling mediates EPHA2-dependent tumor cell proliferation, motility, and cancer stem cell-like properties in non-small cell lung cancer. Cancer Res. 2014;74:2444-2454. [PubMed] [DOI] |
| 17. | Gong L, Song J, Lin X, Wei F, Zhang C, Wang Z, Zhu J, Wu S, Chen Y, Liang J, Fu X, Lu J, Zhou C, Song L. Serine-arginine protein kinase 1 promotes a cancer stem cell-like phenotype through activation of Wnt/β-catenin signalling in NSCLC. J Pathol. 2016;240:184-196. [PubMed] [DOI] |
| 18. | Li S, Tan HY, Wang N, Cheung F, Hong M, Feng Y. The Potential and Action Mechanism of Polyphenols in the Treatment of Liver Diseases. Oxid Med Cell Longev. 2018;2018:8394818. [PubMed] [DOI] |
| 19. | Lee YJ, Hah YJ, Kang YN, Kang KJ, Hwang JS, Chung WJ, Cho KB, Park KS, Kim ES, Seo HY, Kim MK, Park KG, Jang BK. The autophagy-related marker LC3 can predict prognosis in human hepatocellular carcinoma. PLoS One. 2013;8:e81540. [PubMed] [DOI] |
| 20. | Manley S, Williams JA, Ding WX. Role of p62/SQSTM1 in liver physiology and pathogenesis. Exp Biol Med (Maywood). 2013;238:525-538. [PubMed] [DOI] |
| 21. | Bourdeau V, Ferbeyre G. CDK4-CDK6 inhibitors induce autophagy-mediated degradation of DNMT1 and facilitate the senescence antitumor response. Autophagy. 2016;12:1965-1966. [PubMed] [DOI] |
| 22. | Kowalik MA, Perra A, Ledda-Columbano GM, Ippolito G, Piacentini M, Columbano A, Falasca L. Induction of autophagy promotes the growth of early preneoplastic rat liver nodules. Oncotarget. 2016;7:5788-5799. [PubMed] [DOI] |