修回日期: 2020-12-02
接受日期: 2020-12-21
在线出版日期: 2021-01-28
lncRNA LINC02418在非小细胞肺癌、肺腺癌和结直肠癌等肿瘤中表达上调, 促进肿瘤的发展进程. 但是, LINC02418对肝癌发生发展的影响和机制还未知. LncBase Predicted v.2靶基因预测显示, LINC02418可能靶向结合miR-940. 本研究假设LINC02418可靶向调控miR-940影响肝癌细胞增殖、迁移、侵袭及凋亡, 进而影响肝癌发展进程.
探讨lncRNA LINC02418对肝癌细胞增殖、迁移、侵袭和凋亡的影响及作用机制.
RT-qPCR检测肝癌组织和对应癌旁组织中LINC02418和miR-940表达水平. 分别转染LINC02418小干扰RNA、miR-940模拟物至肝癌细胞HCCLM3, RT-qPCR检测转染效果, CCK-8、Transwell、流式细胞术和蛋白印迹法分别检测下调LINC02418表达或上调miR-940表达对HCCLM3细胞活性、迁移和侵袭、凋亡及CyclinD1、p21、MMP-2、MMP-9、Bcl-2和Bax蛋白表达的影响. 双荧光素酶报告基因实验验证miR-940与LINC02418调控关系.
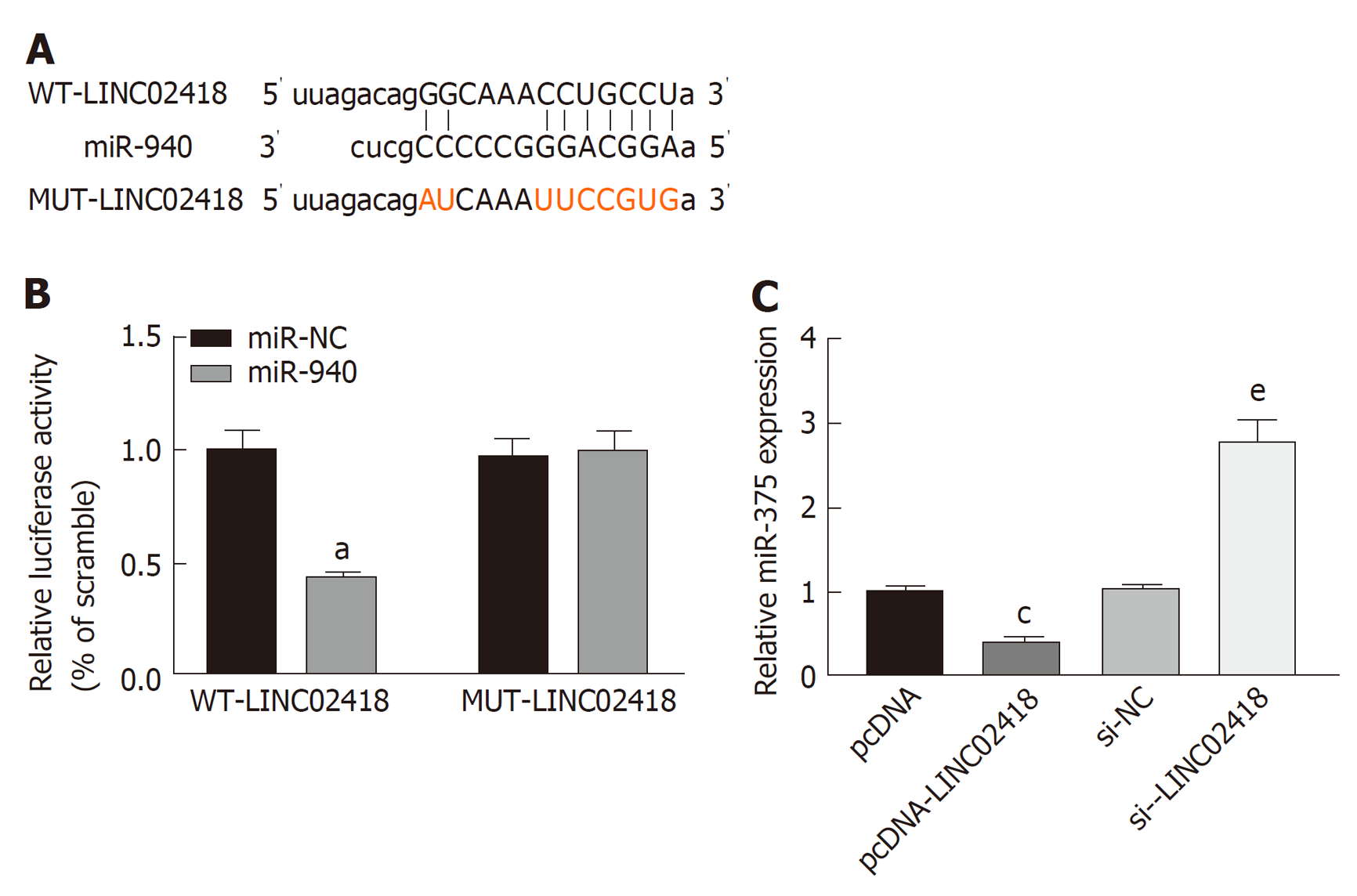
与癌旁组织比较, 肝癌组织中LINC02418表达水平升高(P<0.05), miR-940表达水平降低(P<0.05). 下调LINC02418或上调miR-940表达降低了HCCLM3细胞活性、迁移和侵袭数及CyclinD1、MMP-2、MMP-9和Bcl-2的蛋白表达(P<0.05), 而提高了细胞凋亡率、p21和Bax的蛋白表达(P<0.05). LINC02418靶向负调控miR-940表达. 下调miR-940表达逆转了下调LINC02418表达对HCCLM3细胞增殖、迁移、侵袭和凋亡的影响.
LINC02418在肝癌组织中表达升高, 下调其表达可能通过靶向上调miR-940抑制肝癌细胞的恶性生物学行为, 可作为肝癌治疗的分子靶点.
核心提要: LINC02418在肝癌中表达上调, 而miR-940表达下调, 双荧光素酶报告基因实验证实LINC02418可靶向结合miR-940, 下调LINC02418可靶向结合并负调控miR-940的表达抑制肝癌细胞增殖、迁移和侵袭, 并促进肝癌细胞凋亡.
引文著录: 方燕, 陈建欧, 郑旭旭. lncRNA LINC02418通过调控miR-940表达对肝癌细胞增殖、迁移、侵袭和凋亡的影响. 世界华人消化杂志 2021; 29(2): 65-74
Revised: December 2, 2020
Accepted: December 21, 2020
Published online: January 28, 2021
The long noncoding RNA (lncRNA) LINC02418 is up-regulated in non-small cell lung cancer, lung adenocarcinoma, colorectal cancer, and other tumors, and promotes the development of tumors. However, the role and mechanism of LINC02418 in the occurrence and development of liver cancer are unknown. Target gene prediction with LncBase Predicted v.2 shows that LINC02418 may target miR-940. This study hypothesized that LINC02418 can target and regulate miR-940 to affect the proliferation, migration, invasion, and apoptosis of liver cancer cells, thereby affecting the development of liver cancer.
To investigate the effect of lncRNA LINC02418 on the proliferation, migration, invasion, and apoptosis of hepatocellular carcinoma cells and the underlying mechanism.
RT-qPCR was used to detect the expression levels of LINC02418 and miR-940 in hepatocellular carcinoma cancer tissues and adjacent tissues. After LINC02418 small interfering RNA or miR-940 mimic was transfected into liver cancer HCCLM3 cells, RT-qPCR was used to detect the transfection efficiency, and CCK-8 assay, Transwell assay, flow cytometry, and Western blot were used to detect the effects of LINC02418 down-regulation or miR-940 up-regulation on HCCLM3 cell viability, migration, invasion, and apoptosis, as well as the protein expression levels of CyclinD1, p21, MMP-2, MMP-9, Bcl-2, and Bax. The regulatory relationship between miR-940 and LINC02418 was verified by double luciferase reporter gene assay.
Compared with adjacent tissues, the expression of LINC02418 in hepatocellular carcinoma tissues increased (P < 0.05), while the expression of miR-940 decreased (P < 0.05). Down-regulating LINC02418 or up-regulating miR-940 reduced HCCLM3 cell viability, the number of migrating and invading cells, and the protein expression of CyclinD1, MMP-2, MMP-9, and Bcl-2 (P < 0.05), but increased apoptosis and the protein expression of p21 and Bax (P < 0.05). LINC02418 negatively regulated the expression of miR-940. Down-regulating miR-940 reversed the effects of down-regulating LINC02418 on the proliferation, migration, invasion, and apoptosis of HCCLM3 cells.
The expression of LINC02418 is elevated in liver cancer tissues, and down-regulating its expression may inhibit the malignant biological behavior of hepatocellular carcinoma cells by up-regulating miR-940, which could be used as a molecular target for liver cancer treatment.
- Citation: Fang Y, Chen JO, Zheng XX. LncRNA LINC02418 affects proliferation, migration, invasion, and apoptosis of hepatocellular carcinoma cells by regulating miR-940 expression. Shijie Huaren Xiaohua Zazhi 2021; 29(2): 65-74
- URL: https://www.wjgnet.com/1009-3079/full/v29/i2/65.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i2.65
肝癌治疗困难, 易复发和转移[1], 其发生发展与癌基因或抑癌基因的异常表达密切相关[2], 探讨肝癌患者体内异常表达的基因及其对肝癌发生发展的影响对于肝癌治疗靶点的寻找具有重要意义. 长链非编码RNA(lncRNA)和微小RNA(miRNA)是两类参与调控细胞的增殖、凋亡、迁移等生命过程的非编码RNA, 且两者可靶向结合, 在肿瘤发生发展中起重要作用[3-5]. LINC02418是一种lncRNA, 在非小细胞肺癌、肺腺癌和结直肠癌等肿瘤中表达上调, 下调其表达可抑制肿瘤的发展进程[6-8]. 但目前, LINC02418在肝癌中的表达及其作用还未知. LncBase Predicted v.2生物信息学软件预测显示, miR-940可能是LINC02418的靶基因. miR-940在肝癌中表达下调, 上调miR-940表达可降低体外肝癌细胞的活力和侵袭性, 促进细胞凋亡, 并抑制体内肿瘤生长[9]. 因此, 本研究首先检测了肝癌组织中LINC02418和miR-940表达, 并以肝癌细胞HCCLM3为研究对象, 观察了下调LINC02418能否靶向调控miR-940影响HCCLM3细胞的增殖、迁移、侵袭和凋亡, 以期为肝癌的靶向分子治疗提供新靶点.
选取2017-01/2018-04于本院手术切除的25例肝癌组织及对应的癌旁组织, 液氮中保存. 其中男性16例, 女性9例, 平均年龄56.38岁±5.79岁. 参照2010年国际抗癌联盟标准Ⅰ期和Ⅱ期共13例, Ⅲ和Ⅳ期共12例; 低分化9例, 中分化10例, 高分化6例; 14例发生淋巴结转移, 11例未发生淋巴结转移. 纳入标准: 首次确诊; 经病理确诊均为肝细胞癌; 所有患者术前未行放疗和化疗等治疗. 排除标准: 合并其他恶性肿瘤患者; 合并心脏、肾脏等重要脏器功能障碍者; 合并高血压、糖尿病等慢性疾病患者. 本研究经本院伦理委员会批准同意, 患者自愿签署知情同意书.
细胞和试剂: 肝癌细胞系HCCLM3, 中国科学院上海细胞库; RPMI 1640培养基、细胞计数试剂盒-8(CCK-8)、二喹啉甲酸(BCA)蛋白检测试剂盒和膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡试剂盒, 北京索莱宝公司; 胎牛血清(FBS), 杭州四季青公司; LipofectamineTM 2000试剂盒、Trizol试剂, 美国Invitrogen公司; PCR引物、LINC02418小干扰RNA(si-LINC02418)、乱序无意义阴性序列(si-NC)、miR-940模拟物(mimcs)、模拟对照序列(miR-NC)、LINC02418过表达载体(pcDNA-LINC02418)、空载体(pcDNA)、miR-940抑制剂(anti-miR-940)及抑制剂阴性对照序列(anti-miR-NC), 上海吉玛制药技术有限公司;逆转录试剂盒和PCR试剂盒, 大连宝生物工程公司; 兔抗人细胞周期蛋白D1(CyclinD1)、细胞周期依赖性蛋白激酶抑制因子1A(p21)、基质金属蛋白酶2(MMP-2)、基质金属蛋白酶9(MMP-9)、B淋巴细胞瘤-2(Bcl-2)和B淋巴细胞瘤-2相关蛋白(Bax)抗体, 美国Abcam公司; 双荧光素酶活性检测试剂盒, 美国Promega公司.
1.2.1 实时荧光定量PCR(RT-qPCR)检测组织中LINC02418和miR-940表达: Trizol试剂提取组织中总RNA, 逆转录为cDNA后, 行PCR扩增. 引物序列LINC02418上游5'-TGTCAGGGATAGGGTGGAGA-3', 下游5'-GGTGGTTACTCTTCT GGCCT-3'; GAPDH上游5'-ACATCGCTCAGACACCATGG-3', 下游5'-GTAGTTGAGGTCAA TGAAGGG-3'; miR- 940上游5'-TGCGCAAGCTGCCAACGCG-3', 下游5'-CGCGCTGAATA GAAGCTAGTGT-3'; U6上游5'-CGCGTTGTGAACGACGTG-3', 下游5'-CGGTGTAAGCTAG CTGATCGCCC-3'. 2-△△Ct法计算LINC02418相对于GAPDH、miR-940相对于U6的表达水平.
1.2.2 细胞培养和转染: 用含10% FBS的RPMI 1640培养基培养HCCLM3细胞. 取对数增殖期的HCCLM3细胞以1×105个/孔接种于6孔板中, 用LipofectamineTM 2000脂质体法, 分别转染si-NC(si-NC组)、si-LINC02418(si-LINC02418组)、pcDNA(pcDNA组)、pcDNA-LINC02418(pcDNA-LINC02418组)、miR-940 mimcs(miR-940组)、miR-NC(miR-NC组)、共转染si-LINC02418与anti-miR-940(si-LINC02418+anti-miR-940组)、si-LINC02418与anti-miR-NC(si-LINC02418+anti-miR-NC组). 转染12 h后, 更换培养基. 再培养24 h, 0.25%胰蛋白酶消化, RT-qPCR法检测各组中LINC02418或miR-940表达水平验证转染效果, 并收集细胞备用.
1.2.3 CCK-8检测细胞活性: 将si-NC组、si-LINC02418组、miR-940组、miR-NC组、si-LINC02418+anti-miR-940组和si-LINC02418+anti-miR-NC组细胞均以5×103个/孔接种于96孔板中, 每组设3个复孔, 分别培养24 h、48 h和72 h. 加10 μL CCK-8试剂, 再孵育2 h, 于酶标仪490 nm处测光密度(OD)值. 实验重复3次, 取平均值.
1.2.4 Transwell检测细胞迁移和侵袭: 将si-NC组、si-LINC02418组、miR-940组、miR-NC组、si-LINC02418+anti-miR-940组和si-LINC02418+anti-miR-NC组细胞密度调整为1×105个/mL. 迁移实验: Transwell上室加100 μL细胞悬液, 下室加500 μL培养基. 培养48 h后, 弃培养基, 经多聚甲醛固定、结晶紫染色后, 显微镜观察, 随机取5个视野, 计数. 侵袭实验: 先在Transwell上室铺Matrigel胶, 晾干后再加100 μL细胞悬液, 剩余步骤同迁移实验.
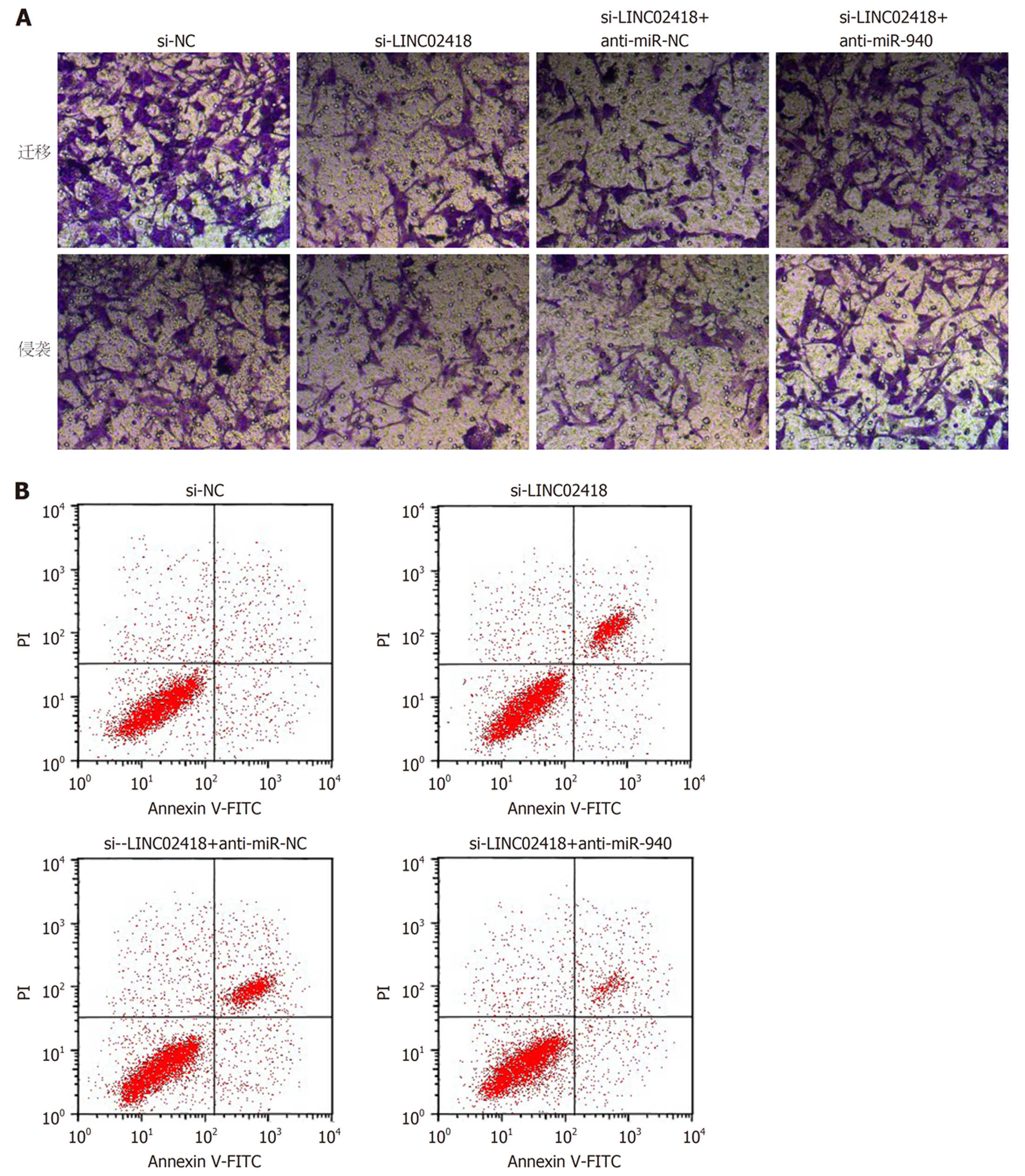
1.2.5 流式细胞仪检测细胞凋亡: 将si-NC组、si-LINC02418组、miR-940组、miR-NC组、si-LINC02418+anti-miR-940组和si-LINC02418+anti-miR-NC组细胞细胞以1×104个/孔接种于24孔板中, 培养48 h. 弃培养基, 收集细胞, PBS清洗2次. 参照Annexin V-FITC/PI试剂盒说明书, 采用流式细胞仪检测细胞凋亡.
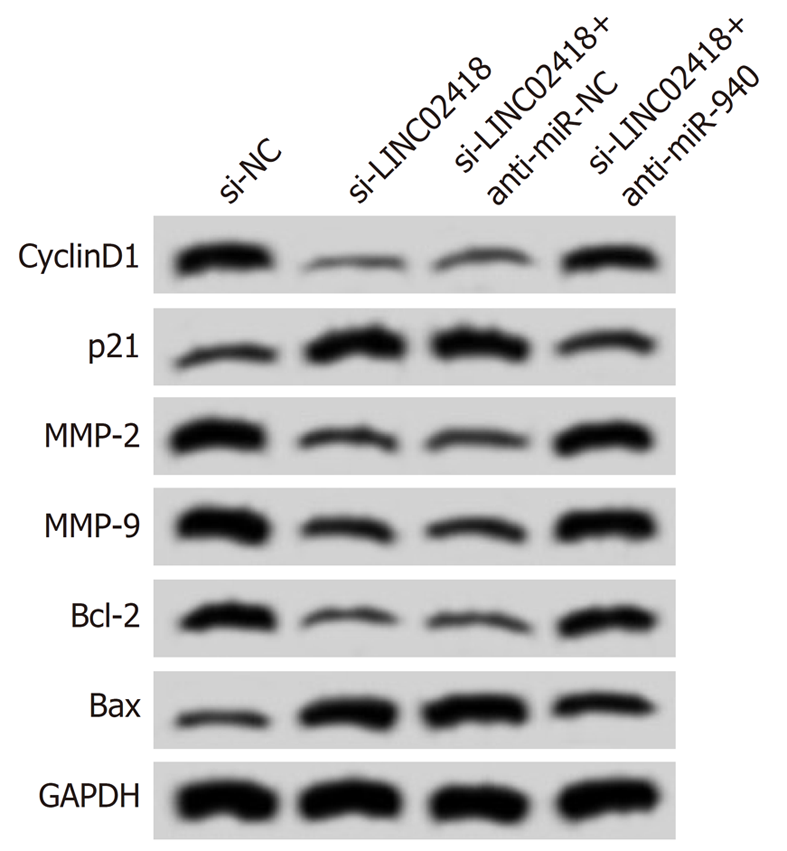
1.2.6 蛋白印迹法检测细胞中相关蛋白表达: 将si-NC组、si-LINC02418组、miR-940组、miR-NC组、si-LINC02418+anti-miR-940组和si-LINC02418+anti-miR-NC组细胞以1×104个/孔接种于24孔板中, 培养48 h后, 收集细胞. RIPA试剂细胞中总蛋白, BCA法对蛋白定量, 行10% SDS-PAGE电泳, 并将分离蛋白转至PVDF膜. 置于5%脱脂奶粉溶液中封闭1 h后, 分别于CyclinD1(1:1000)、p21(1:1000)、MMP-2(1:500)、MMP-9(1:500)、Bcl-2(1:1000)和Bax(1:1000)一抗孵育液中4 ℃过夜. 再于山羊抗兔二抗(1:2000)孵育液中37 ℃孵育1 h. 最后加显影液, 避光显影后曝光拍照.
1.2.7 双荧光素酶报告基因实验: 取对数增殖期的HCCLM3细胞以1×105个/孔接种于6孔板中, 用LipofectamineTM 2000脂质体法, 分别共转染WT-LINC02418与miR-940 mimic或miR-NC、MUT-LINC02418与miR-940 mimic、miR-NC. 转染12 h后, 更换培养基. 再培养24 h, 收集细胞并裂解, 3500 r/min离心收集上清, 检测上清荧光素酶活性. 以海肾荧光素酶活性为内参, 计算萤火虫荧光素酶活性.
统计学处理 SPSS 22.0软件进行统计分析. 计量资料以mean±SD表示. 两组间比较用独立样本t检验; 多组间比较用单因素方差分析, 进一步两两比较用SNK-q检验. 以P<0.05表示差异有统计学意义.
如表1所示, 肝癌组织中LINC02418表达高于癌旁组织(P<0.05), 而miR-940表达低于癌旁组织(P<0.05).
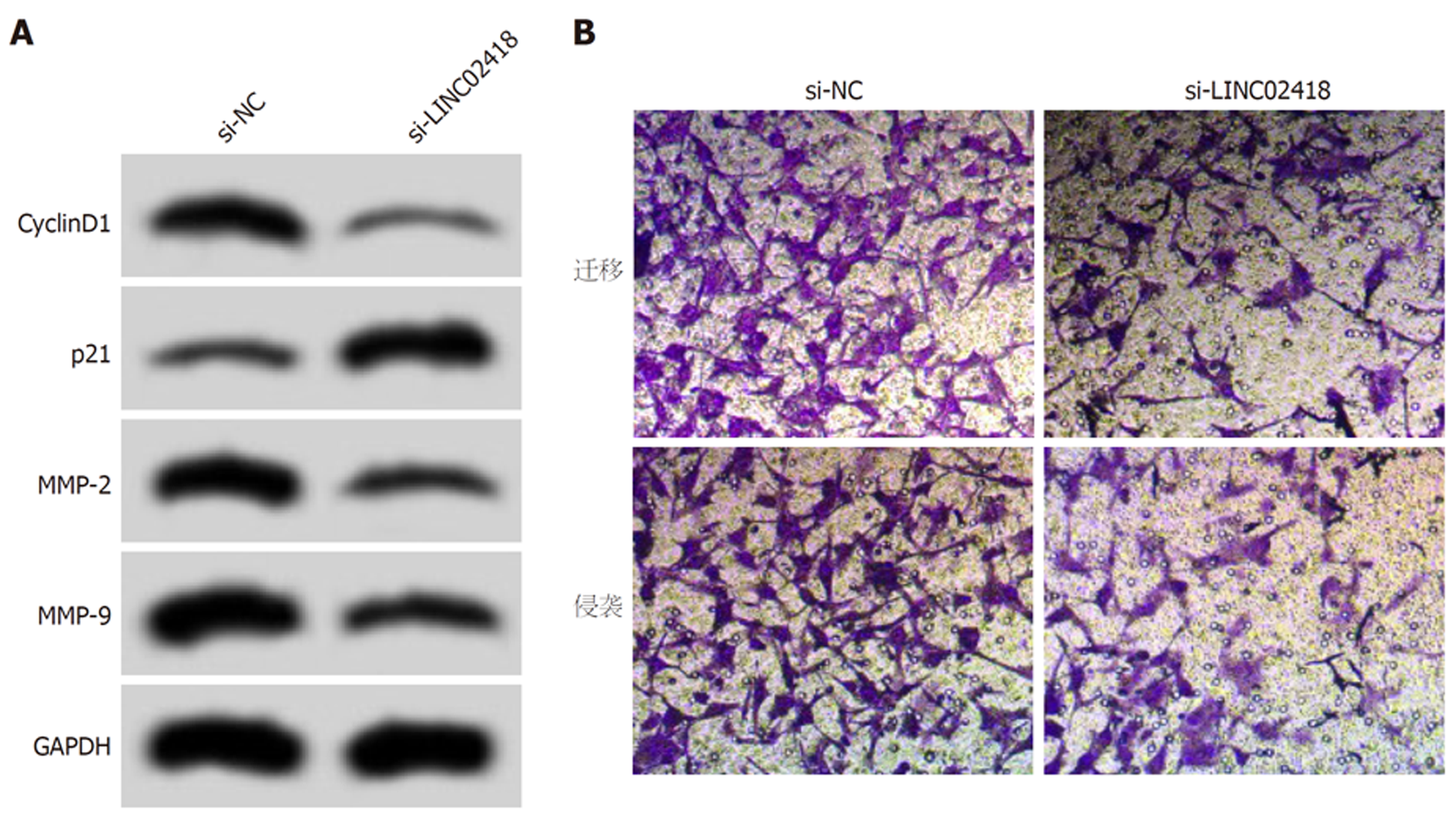
如图1和表2所示, 转染si-LINC02418后, HCCLM3细胞中LINC02418表达水平明显降低(P<0.05), HCCLM3细胞活性、迁移数和侵袭数降低(P<0.05), 同时, 与细胞增殖、迁移和侵袭相关的蛋白CyclinD1、MMP-2和MMP-9表达降低(P<0.05), 而p21表达升高(P<0.05).
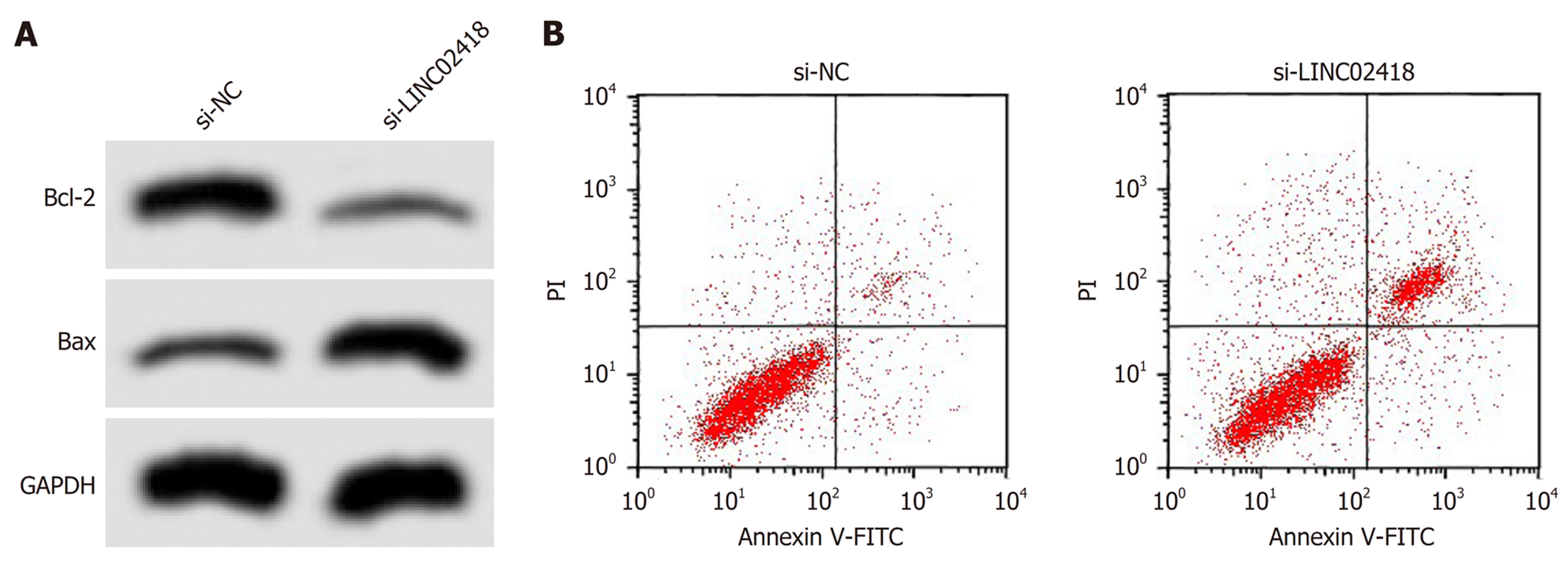
如图2和表3所示, 转染si-LINC02418后, HCCLM3细胞凋亡率升高(P<0.05), Bax蛋白表达升高(P<0.05), 而Bcl-2蛋白表达降低(P<0.05).
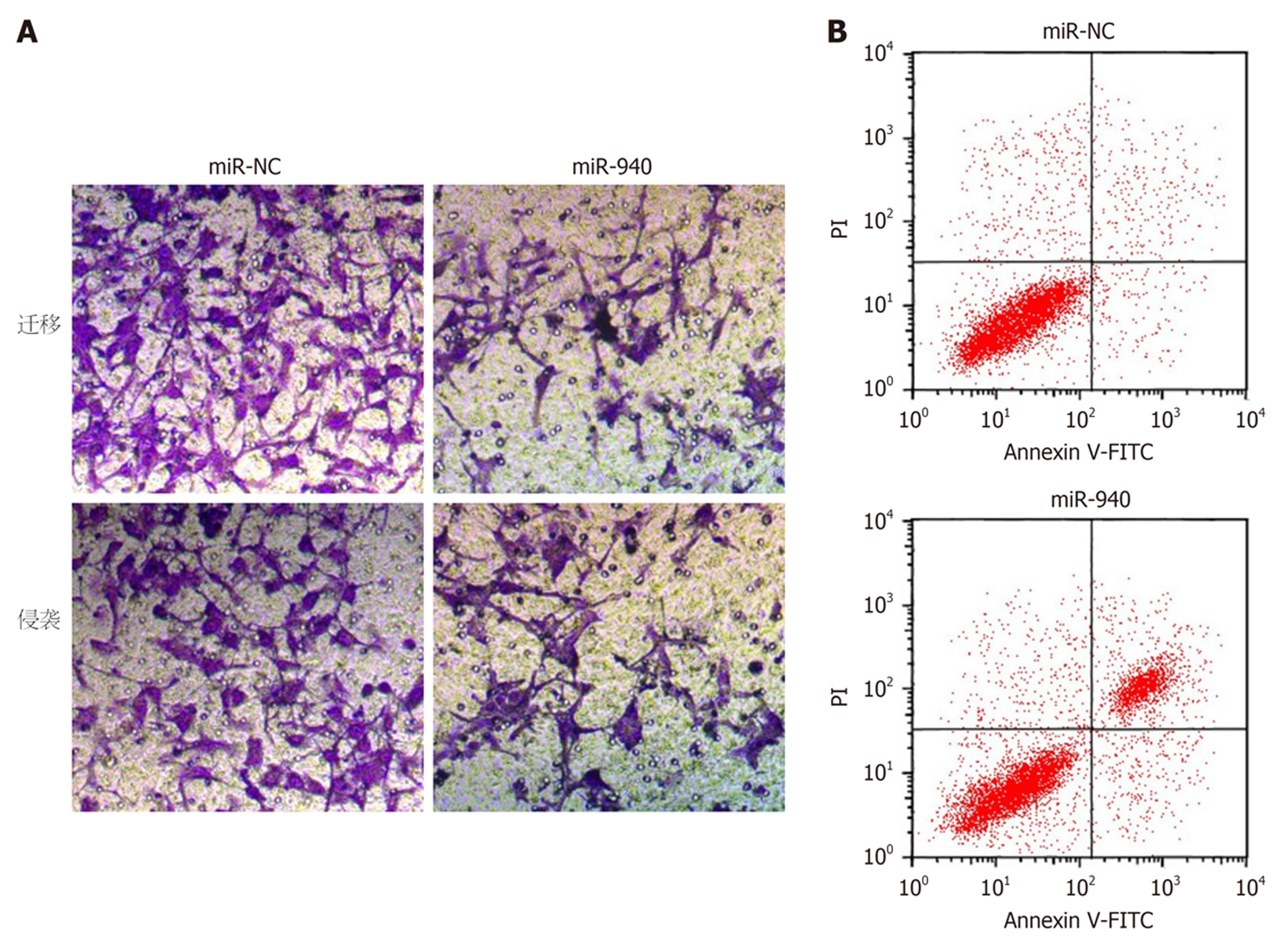
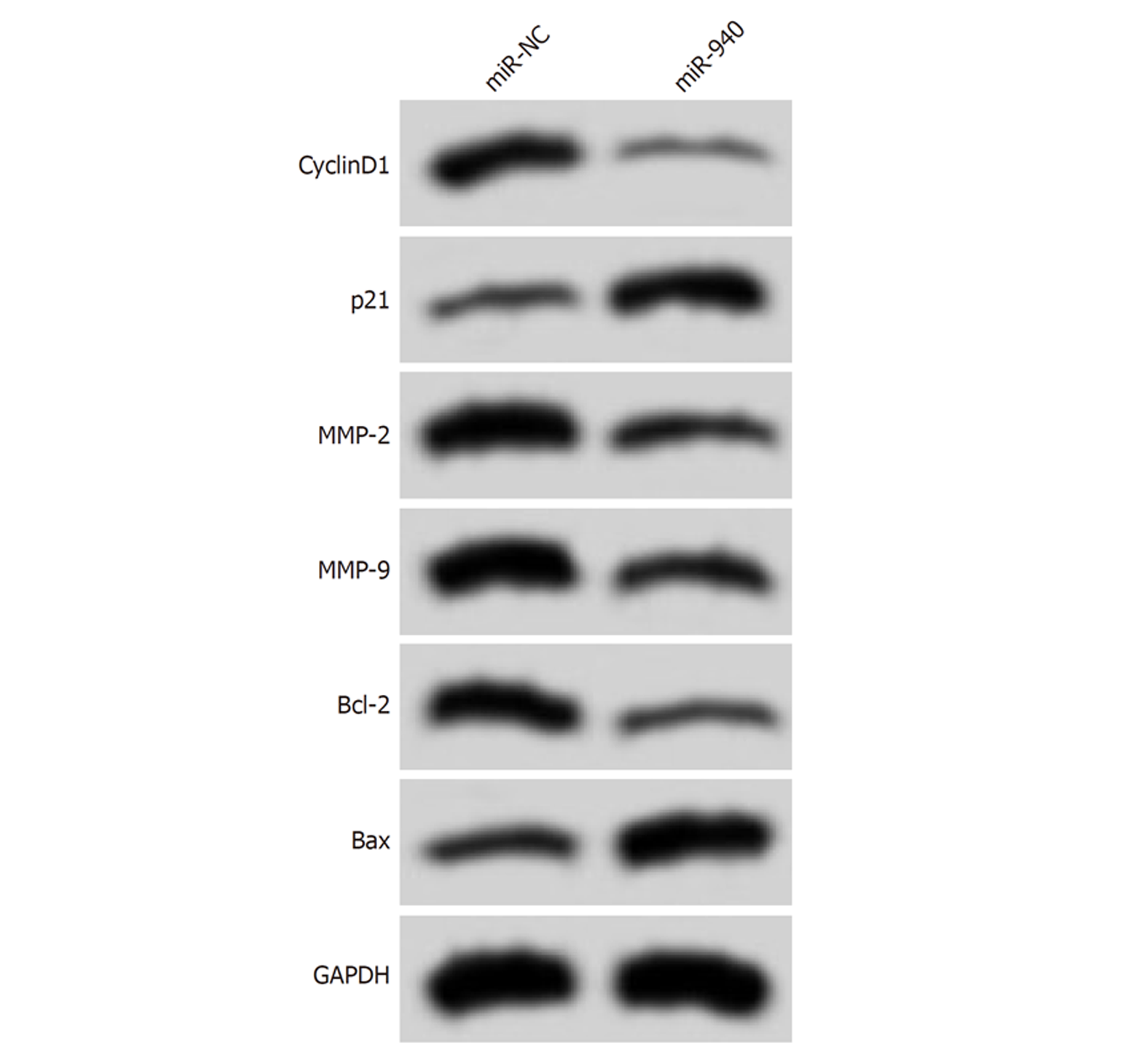
如图3、图4、表4和表5所示, 转染miR-940 mimics后, HCCLM3细胞活性、迁移数、侵袭数降低(P<0.05), 细胞凋亡率升高(P<0.05), 且与增殖、迁移、侵袭及凋亡相关的蛋白CyclinD1、MMP-2、MMP-9和Bcl-2表达降低(P<0.05), 而p21和Bax表达升高(P<0.05).
LINC02418与miR-940的核苷酸序列结合位点, 见图5A. 共转染WT-LINC02418与miR-940 mimics的细胞荧光素酶活性低于共转染WT-LINC02418与miR-NC的细胞(0.42±0.04比1.00±0.09, P<0.05), 但共转染MUT-LINC02418与miR-940 mimics的细胞荧光素酶活性与共转染WT-LINC02418与miR-NC的细胞荧光素酶活性无显著差异(0.99±0.09比0.97±0.08, P>0.05), 见图5B. pcDNA-LINC02418组细胞中miR-940表达水平低于pcDNA组(0.41±0.04比1.00±0.07, P<0.05), si-LINC02418组细胞中miR-940表达水平高于si-NC组(2.78±0.27比1.01±0.08, P<0.05), 见图5C.
如图6、图7、表6和表7所示, 与共转染si-LINC02418与anti-miR-NC的细胞比较, 共转染si-LINC02418与anti-miR-940的HCCLM3细胞活性、迁移数、侵袭数升高(P<0.05), 细胞凋亡率降低(P<0.05), 且CyclinD1、MMP-2、MMP-9和Bcl-2蛋白表达升高(P<0.05), 而p21和Bax蛋白表达降低(P<0.05).
| 分组 | miR-940 | OD值(450 nm) | 迁移细胞数(个) | 侵袭细胞数(个) | 凋亡率(%) | ||
| 24 h | 48 h | 72 h | |||||
| si-NC | 1.01±0.06 | 0.65±0.06 | 1.25±0.11 | 1.58±0.14 | 123.25±12.11 | 107.21±9.98 | 7.25±0.71 |
| si-LINC02418 | 2.61±0.26a | 0.53±0.04a | 0.73±0.06a | 0.96±0.07a | 64.15±6.41a | 56.32±5.61a | 22.36±2.17a |
| si-LINC02418+anti-miR-NC | 2.65±0.27 | 0.51±0.03 | 0.69±0.05 | 0.90±0.08 | 63.21±6.31 | 54.12±5.44 | 24.11±2.39 |
| si-LINC02418+anti-miR-940 | 1.51±0.15c | 0.63±0.05c | 1.12±0.09c | 1.47±0.13c | 108.25±10.21c | 91.36±8.45c | 10.58±1.12c |
| 分组 | CyclinD1蛋白 | p21蛋白 | MMP-2蛋白 | MMP-9蛋白 | Bcl-2蛋白 | Bax蛋白 |
| si-NC | 0.60±0.06 | 0.29±0.03 | 0.71±0.06 | 0.82±0.07 | 0.67±0.06 | 0.30±0.03 |
| si-LINC02418 | 0.18±0.02a | 0.68±0.06a | 0.31±0.03a | 0.38±0.03a | 0.24±0.03a | 0.76±0.07a |
| si-LINC02418+anti-miR-NC | 0.17±0.02 | 0.69±0.05 | 0.29±0.03 | 0.37±0.03 | 0.22±0.03 | 0.77±0.06 |
| si-LINC02418+anti-miR-940 | 0.49±0.03c | 0.37±0.03c | 0.60±0.6c | 0.69±0.06c | 0.56±0.05c | 0.41±0.04c |
lncRNA是真核生物体内广泛存在的长度超过200个核苷酸的小分子非编码RNA, 在肿瘤的发生发展中起重要调控作用. 研究已显示, 多个lncRNA在肝癌中异常表达, 参与肝癌的发生发展. Li等[10]研究显示, lncRNA HCG11在肝癌组织中表达升高, 其高表达与患者预后呈负相关, 其通过下调miR-26a-5p表达并促进自噬相关蛋白-12(ATG12)表达来促进肝癌细胞增殖、转移及鼠异种移植肿瘤的生长, 可能是治疗肝癌的潜在治疗靶标. Zhuang等[11]研究显示, lncRNA CDKN2B-AS1在肝癌中的表达明显高于正常组织, 其高表达与患者总生存期、肿瘤大小和TNM分期密切相关, 过表达CDKN2B-AS1可促进肝癌细胞增殖. Sun等[12]研究显示, 与邻近的正常组织相比, lncRNA FER1L4在肝癌组织中表达较低, 上调其表达可抑制体外肝癌细胞增殖及体内肝癌肿瘤生长, 其可能是肝癌的有效治疗靶标. Sheng等[13]研究显示, lncRNA RGMB-AS1在肝癌组织和细胞系中的表达明显降低, 上调lncRNA RGMB-AS1可明显减弱肝癌细胞的恶性生物学行为, 其在肝癌中具有抗癌作用. 这些研究表明不同的lncRNA在肝癌中发挥的作用不同, 探究肝癌中异常表达的lncRNA及其对肝癌发生发展的影响可为肝癌治疗提供新的分子靶标.
作为一种lncRNA, LINC02418参与多种肿瘤发展进程. 例如, Tian等[14]研究显示, LINC02418在结肠癌组织中表达升高, 其高表达与患者预后不良密切相关, 其可靶向miR-34b-5p/Bcl-2轴增强结肠癌细胞的增殖、迁移和侵袭性. 本研究以癌旁组织为对照, RT-qPCR检测了肝癌组织中LINC02418表达水平, 结果显示肝癌组织中LINC02418表达水平明显高于癌旁组织, 提示LINC02418可能促进肝癌发生发展. 进一步转染LINC02418小干扰RNA至肝癌细胞下调LINC02418表达降低了肝癌细胞的活性、迁移和侵袭数降低, 而凋亡率升高, 说明下调LINC02418可抑制肝癌细胞增殖、迁移和侵袭, 并促进细胞凋亡, 提示LINC02418可能是肝癌的潜在治疗靶点.
CyclinD1参与调控细胞周期进程, 可促进细胞周期由G1期向S期转变, 加速细胞周期进程, 促进细胞增殖[15]. p21是目前已知的肿瘤细胞生长抑制因子, 其表达增加可降低细胞增殖能力. MMP-2和MMP-9参与降解细胞外基质和基底膜, 对肿瘤细胞迁移和侵袭起促进作用[16]. Bax/Bcl-2参与调控细胞凋亡, 其中Bax表达增加时可形成通源二聚体, 改变细胞线粒体膜通透性, 引起细胞色素C释放量增加, 导致下游caspases级联反应被激活, 进而引起细胞凋亡; 而Bcl-2是抗凋亡分子, 其表达增加时与Bax形成异源二聚体, 减弱Bax的促凋亡作用[17]. 本研究显示, 下调LINC02418表达抑制了肝癌细胞中CyclinD1、MMP-2、MMP-9和Bcl-2的蛋白表达, 而促进了p21和Bax蛋白表达, 进一步说明LINC02418可能通过直接或间接调控与增殖、凋亡、迁移和侵袭相关蛋白分子的表达来影响肝癌细胞的恶性表型.
lncRNA可靶向结合miRNA, 共同影响肿瘤发生发展[18]. 生物信息学软件预测显示, LINC02418可能与miR-940靶向结合. 为了进一步探讨LINC02418影响肝癌细胞恶性生物学行为的作用机制, 本研究利用双荧光素酶报告基因实验和RT-qPCR检测LINC02418对miR-940表达的影响证实了LINC02418靶向结合并负调控miR-940表达. 研究显示, miR-940在非小细胞肺癌[19]、胶质瘤[20]和乳腺癌[21]等肿瘤中表达降低, 上调miR-940表达可抑制肿瘤发展进程. 本研究显示, miR-940在肝癌组织中表达下调, 上调其表达可有效降低肝癌细胞的增殖、迁移和侵袭能力, 同时加剧肝癌细胞凋亡, 与Yuan等[22]报道的结果一致, 说明miR-940作为抑癌基因参与肝癌发生发展, 靶向上调其表达可延缓肝癌发展进程. 本研究还显示, 下调miR-940表达逆转了下调LINC02418表达对肝癌细胞恶性生物学行为的影响, 进一步说明下调LINC02418表达通过靶向上调miR-940表达来发挥抗肝癌作用.
综上所述, LINC02418在肝癌组织中表达明显上调, 下调LINC02418可有效减弱肝癌细胞的增殖、迁移和侵袭能力, 并促进肝癌细胞凋亡, 其作用机制与靶向上调miR-940表达有关, LINC02418/miR-940轴可能为肝癌的治疗提供了潜在靶点. 但是, 本研究还存在一定的不足之处, 仅在体外细胞层面探讨了LINC02418对肝癌细胞恶性生物学行为的影响及可能机制, 未通过体内裸鼠移植瘤实验验证LINC02418/miR-940轴对肝癌发生发展的影响, 且LINC02418/miR-940轴下游靶基因及信号通路也还尚未进行探究, 因此, 接下来将利用裸鼠移植瘤实验在体内探究LINC02418对肝癌肿瘤生长的影响及其他可能的作用机制.
肝癌发病机制尚未明确, 已有研究显示lncRNA参与调控肝癌细胞恶性表型(增殖、凋亡、迁移和侵袭), 但LINC02418对肝癌细胞恶性表型的影响机制尚未可知.
LINC02418在等肿瘤中表达升高, 参与调控肿瘤增殖、迁移和侵袭等恶性表型, 但其对肝癌细胞恶性表型的影响及作用机制尚未可知. LncBase Predicted v.2靶基因预测显示, LINC02418可能靶向结合miR-940. 以有报道称, miR-940在肝癌中呈低表达, 上调miR-940可减弱肝癌细胞的活力和侵袭性, 促进细胞凋亡,且抑制体内肿瘤生长. 但LINC02418能否靶向调控miR-940影响肝癌细胞的恶性表型也还未知. 因此, 探究LINC02418对肝癌细胞增殖、迁移、侵袭和凋亡的影响及其能否靶向miR-940发挥作用, 以期为肝癌的靶向分子治疗提供新靶点.
探究LINC02418对肝癌细胞恶性表型(增殖、迁移、侵袭和凋亡)的影响及其能否靶向miR-940发挥作用, 为肝癌的靶向治疗提供新的分子靶点.
RT-qPCR检测肝癌组织和对应癌旁组织中LINC02418和miR-940表达. 分别转染LINC02418小干扰RNA、miR-940模拟物至肝癌细胞HCCLM3, RT-qPCR检测细胞中LINC02418或miR-940表达验证转染效果, CCK-8检测细胞增殖, Transwell检测细胞迁移和侵袭, 流式细胞术检测细胞凋亡, 蛋白印迹法检测细胞中CyclinD1、p21、MMP-2、MMP-9、Bcl-2和Bax蛋白表达. 双荧光素酶报告基因实验验证miR-940与LINC02418靶向调控关系.
肝癌组织中LINC02418呈高表达, miR-940呈低表达. 下调LINC02418或上调miR-940可降低肝细细胞活性、迁移和侵袭数及CyclinD1、MMP-2、MMP-9和Bcl-2的蛋白表达, 但促进细胞凋亡率及p21和Bax蛋白表达. LINC02418可靶向结合并负调控miR-940, 下调miR-940逆转下调LINC02418对肝癌细胞增殖、迁移、侵袭的抑制作用及凋亡促进作用.
肝癌组织中LINC02418表达升高, 下调LINC02418表达可降低肝癌细胞的增殖、迁移和侵袭能力, 并加剧肝癌细胞凋亡, 其作用机制可能与靶向上调miR-940表达有关, 为肝癌的靶向分子治疗提供了新的分子靶点.
miR-940下游靶基因及信号通路在肝癌发生发展中的作用还未知, 且本研究仅通过体外实验进行了初步探究, 尚需进一步通过裸鼠移植瘤实验在体内验证LINC02418/miR-940轴对肝癌发展的影响. LINC02418/miR-940轴可能为肝癌发生发展的分子机制的阐明提供了新思路并为其治疗提供了新的分子靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): D
E级 (差): E, E
科学编辑: 刘继红 制作编辑:张砚梁
| 2. | 王 逸超, 赵 长久. MicroRNA-21对肿瘤生物学行为的影响及其分子靶向成像与治疗的研究进展. 中华核医学与分子影像杂志. 2018;38:362-366. [DOI] |
| 3. | Song W, Mei JZ, Zhang MZ. Long noncoding RNA PlncRNA-1 promotes colorectal cancer cell progression by regulating the PI3K/Akt signaling pathway. Oncol Res. 2018;26:261-268. [DOI] |
| 4. | Cai N, Hu L, Xie Y, Gao JH, Zhai W, Wang L, Jin QJ, Qin CY, Qiang R. MiR-17-5p promotes cervical cancer cell proliferation and metastasis by targeting transforming growth factor-β receptor 2. Eur Rev Med Pharmacol Sci. 2018;22:1899-1906. [DOI] |
| 5. | Zhao W, Geng D, Li S, Chen Z, Sun M. LncRNA HOTAIR influences cell growth, migration, invasion, and apoptosis via the miR-20a-5p/HMGA2 axis in breast cancer. Cancer Med. 2018;7:842-855. [PubMed] [DOI] |
| 6. | Han B. LncRNA LINC02418 regulates proliferation and apoptosis of non-small cell lung cancer cells by regulating miR-4677-3p/SEC61G. Eur Rev Med Pharmacol Sci. 2019;23:10354-10362. [DOI] |
| 7. | Wang T, Zhai R, Lv X, Wang K, Xu J. LINC02418 promotes malignant behaviors in lung adenocarcinoma cells by sponging miR-4677-3p to upregulate KNL1 expression. BMC Pulm Med. 2020;20:217. [PubMed] [DOI] |
| 8. | Zhao Y, Du T, Du L, Li P, Li J, Duan W, Wang Y, Wang C. Long noncoding RNA LINC02418 regulates MELK expression by acting as a ceRNA and may serve as a diagnostic marker for colorectal cancer. Cell Death Dis. 2019;10:568. [PubMed] [DOI] |
| 9. | Ding D, Zhang Y, Yang R, Wang X, Ji G, Huo L, Shao Z, Li X. miR-940 Suppresses Tumor Cell Invasion and Migration via Regulation of CXCR2 in Hepatocellular Carcinoma. Biomed Res Int. 2016;2016:7618342. [PubMed] [DOI] |
| 10. | Li ML, Zhang Y, Ma LT. LncRNA HCG11 accelerates the progression of hepatocellular carcinoma via miR-26a-5p/ATG12 axis. Eur Rev Med Pharmacol Sci. 2019;23:10708-10720. [DOI] |
| 11. | Zhuang H, Cao G, Kou C, Li D. Overexpressed lncRNA CDKN2B-AS1 is an independent prognostic factor for liver cancer and promotes its proliferation. J BUON. 2019;24:1441-1448. [PubMed] |
| 12. | Sun X, Zheng G, Li C, Liu C. Long noncoding RNA Fer1like family member 4 suppresses hepatocellular carcinoma cell proliferation by regulating PTEN in vitro and in vivo. Mol Med Rep. 2019;19:685-692. [PubMed] [DOI] |
| 13. | Sheng N, Li Y, Qian R, Li Y. The clinical significance and biological function of lncRNA RGMB-AS1 in hepatocellular carcinoma. Biomed Pharmacother. 2018;98:577-584. [PubMed] [DOI] |
| 14. | Tian J, Cui P, Li Y, Yao X, Wu X, Wang Z, Li C. LINC02418 promotes colon cancer progression by suppressing apoptosis via interaction with miR-34b-5p/BCL2 axis. Cancer Cell Int. 2020;20:460. [PubMed] [DOI] |
| 15. | Xi X, Teng M, Zhang L, Xia L, Chen J, Cui Z. MicroRNA-204-3p represses colon cancer cells proliferation, migration, and invasion by targeting HMGA2. J Cell Physiol. 2020;235:1330-1338. [PubMed] [DOI] |
| 16. | Alrehaili AA, Gharib AF, Karam RA, Alhakami RA, El Sawy WH, Abd Elrahman TM. Clinical significance of plasma MMP-2 and MMP-9 levels as biomarkers for tumor expression in breast cancer patients in Egypt. Mol Biol Rep. 2020;47:1153-1160. [PubMed] [DOI] |
| 17. | Katifelis H, Lyberopoulou A, Mukha I, Vityuk N, Grodzyuk G, Theodoropoulos GE, Efstathopoulos EP, Gazouli M. Ag/Au bimetallic nanoparticles induce apoptosis in human cancer cell lines via P53, CASPASE-3 and BAX/BCL-2 pathways. Artif Cells Nanomed Biotechnol. 2018;46:S389-S398. [PubMed] [DOI] |
| 18. | Wang YG, Liu J, Shi M, Chen FX. LncRNA DGCR5 represses the development of hepatocellular carcinoma by targeting the miR-346/KLF14 axis. J Cell Physiol. 2018;234:572-580. [PubMed] [DOI] |
| 19. | Jiang K, Zhao T, Shen M, Zhang F, Duan S, Lei Z, Chen Y. MiR-940 inhibits TGF-β-induced epithelial-mesenchymal transition and cell invasion by targeting Snail in non-small cell lung cancer. J Cancer. 2019;10:2735-2744. [PubMed] [DOI] |
| 20. | Xu T, Zhang K, Shi J, Huang B, Wang X, Qian K, Ma T, Qian T, Song Z, Li L. MicroRNA-940 inhibits glioma progression by blocking mitochondrial folate metabolism through targeting of MTHFD2. Am J Cancer Res. 2019;9:250-269. [PubMed] |
| 21. | Liu W, Xu Y, Guan H, Meng H. Clinical potential of miR-940 as a diagnostic and prognostic biomarker in breast cancer patients. Cancer Biomark. 2018;22:487-493. [PubMed] [DOI] |
| 22. | Yuan B, Liang Y, Wang D, Luo F. MiR-940 inhibits hepatocellular carcinoma growth and correlates with prognosis of hepatocellular carcinoma patients. Cancer Sci. 2015;106:819-824. [PubMed] [DOI] |