修回日期: 2021-06-08
接受日期: 2021-08-24
在线出版日期: 2021-10-08
重型颅脑损伤后多数患者存在胃肠动力不足现象, 当机体受到外界机械创伤时, 易引发感染、呕吐、胃内容物反流等现象, 使早期胃肠功能出现障碍, 影响营养摄入, 加重脑水肿, 延迟伤口愈合, 不利于患者预后. 莫沙必利为临床常用促胃肠动力药, 可提升胃肠道动力, 加快胃排空. 同时, 嗜酸乳杆菌可调节肠道内菌群, 保护肠道黏膜屏障、维持肠道平衡状态、缓解胃动力. 本研究旨在探讨嗜酸乳杆菌联合莫沙必利治疗对颅脑损伤术后胃肠功能障碍患者肠内营养达标时间、肠道菌群、康复进程等方面的影响, 分析其临床应用效果.
观察嗜酸乳杆菌联合莫沙必利治疗颅脑损伤术后胃肠功能障碍临床效果.
选取2018-02/2021-02我院颅脑损伤术后胃肠功能障碍患者92例, 以随机数字表法按1:1比例分为研究组、对照组, 各46例. 常规治疗基础上, 对照组予以莫沙必利, 研究组予以嗜酸乳杆菌联合莫沙必利, 均治疗1 wk. 比较两组临床疗效、肠内营养达标时间、康复进程、28 d病死率以及治疗前、治疗3 d、1 wk后胃动力指标[腹内压(intra-abdominal pressure, IAP)、胃残留量(gastric residual volume, GRA)]、肠道屏障功能指标[D-乳酸(D-lactic acid, D-LA)、二胺氧化酶(diamine oxidase, DAO)]水平、肠道菌群(双歧杆菌、乳酸杆菌、肠球菌、肠杆菌)数量.
研究组总有效率93.48%较对照组78.26%高(P<0.05); 研究组肠内营养达标时间、机械通气时间、重症监护病房住院时间较对照组短(P<0.05); 两组28 d病死率相比, 差异无统计学意义; 研究组治疗3 d、1 wk后IAP、GRA及D-LA、DAO水平均低于对照组(P<0.05); 研究组治疗3 d、1 wk后双歧杆菌、乳酸杆菌数量均多于对照组, 肠球菌、肠杆菌数量均少于对照组(P<0.05).
嗜酸乳杆菌联合莫沙必利治疗颅脑损伤术后胃肠功能障碍疗效显著, 可缩短肠内营养达标时间, 调节肠道菌群, 保护肠黏膜屏障, 促进胃肠道功能恢复, 加快患者康复进程.
核心提要: 重型颅脑损伤后易出现胃肠功能障碍, 影响患者康复进程与临床获益. 应用嗜酸乳杆菌联合莫沙必利治疗可有效能够对肠道内菌群进行调控, 维持肠道平衡状态, 保护肠道黏膜屏障, 使紊乱的肠道菌群状态得到控制, 明显改善胃肠道功能. 嗜酸乳杆菌与莫沙必利治疗颅脑损伤术后胃肠功能障碍, 可有效促进患者病情恢复, 改善疾病预后. 但本研究对两组28 d病死率进行对比发现无显著差异, 可能与本研究样本量较少, 随访时间较短有关.
引文著录: 金蓓, 罗凤飞. 嗜酸乳杆菌联合莫沙必利治疗颅脑损伤术后胃肠功能障碍的临床研究. 世界华人消化杂志 2021; 29(19): 1130-1137
Revised: June 8, 2021
Accepted: August 24, 2021
Published online: October 8, 2021
Most patients with severe craniocerebral injury have gastrointestinal motility deficiency. When the body is exposed to external mechanical trauma, infection, vomiting, and gastric content reflux tend to occur, which causes early gastrointestinal dysfunction, affects nutrient intake, aggravates brain edema, delays wound healing, and is not conducive to the prognosis of patients. Mosapride is a commonly used gastrointestinal motility agent, which can improve gastrointestinal motility and speed up gastric emptying. Lactobacillus acidophilus can regulate the intestinal flora, protect the intestinal mucosal barrier, maintain intestinal balance, and relieve gastric motility. The purpose of this study was to investigate the effects of Lactobacillus acidophilus combined with mosapride treatment on the time to reach enteral nutrition standards, intestinal flora, rehabilitation process, and other aspects of patients with gastrointestinal dysfunction after craniocerebral injury, and to evaluate its clinical effects.
To observe the clinical effects of Lactobacillus acidophilus combined with mosapride in the treatment of gastrointestinal dysfunction after craniocerebral injury.
A total of 92 patients with gastrointestinal dysfunction after craniocerebral injury at our hospital from February 2018 to February 2021 were selected and divided into a study group and a control group at a ratio of 1:1 using a random number table, with 46 cases in each group. On the basis of conventional treatment, the control group was given mosapride, and the study group was given Lactobacillus acidophilus combined with mosapride for 1 wk. The clinical efficacy, time to reach enteral nutrition standards, recovery progress, 28-d mortality rate, gastric motility indexes [intra-abdominal pressure (IAP) and residual gastric volume (GRA)], and intestinal motility before treatment and after 3 d and 1 wk of treatment were compared between the two groups. Intestinal barrier function indexes [D-lactic acid (D-LA) and diamine oxidase (DAO)] and intestinal flora (Bifidobacterium, Lactobacillus, Enterococcus, and Enterobacter) were also compared.
The total effective rate of the study group was higher than that of the control group (93.48% vs 78.26%, P < 0.05). The time to reach enteral nutrition standards, time to mechanical ventilation, and the length of ICU stay in the study group were shorter than those of the control group (P < 0.05). There was no significant difference in the 28-d mortality rate between the two groups (P > 0.05). The APACHE II and SOFA scores of the study group were lower than those of the control group after 3 d and 1 wk of treatment, and the Glasgow Coma scale scores were higher than those of the control group (P < 0.05). The levels of IAP, GRA, D-LA, and DAO in the study group were lower than those of the control group after 3 d and 1 wk of treatment (P < 0.05). The numbers of Bifidobacterium and Lactobacillus in the study group were more than those of the control group after 3 d and 1 wk of treatment, and the numbers of Enterococcus and Enterobacter were less than those of the control group (P < 0.05).
Lactobacillus acidophilus and mosapride are effective in treating gastrointestinal dysfunction after craniocerebral injury. They can shorten the time to reach enteral nutrition standards, adjust the intestinal flora, protect the intestinal mucosal barrier, promote the recovery of the gastrointestinal tract and nerve function, and accelerate the recovery process of patients.
- Citation: Jin B, Luo FF. Clinical effects of Lactobacillus acidophilus combined with mosapride in treatment of gastrointestinal dysfunction after craniocerebral injury. Shijie Huaren Xiaohua Zazhi 2021; 29(19): 1130-1137
- URL: https://www.wjgnet.com/1009-3079/full/v29/i19/1130.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i19.1130
胃肠功能紊乱属于重症颅脑损伤患者较为常见并发症之一, 具有较高发病率, 报道显示, 重型颅脑损伤后, 约80%患者存在胃肠动力不足, 易发生腹胀、呕吐、胃潴留及返流现象, 引起胃肠功能障碍[1,2]. 相关调查研究表明, 胃肠功能紊乱者因长期营养不良易加重脑水肿, 延迟伤口愈合, 还可引发肠道内细菌移位产生肠源性感染等并发症[3]. 莫沙必利属促胃肠动力药, 可增强胃动力, 加速胃排空, 利于改善机体胃肠道功能. 有研究发现, 肠道益生菌, 如嗜酸乳杆菌等可对肠道内菌群进行有效调控, 保护肠道黏膜屏障、维持肠道平衡状态、缓解胃动力, 对应激引发的急性胃黏膜损伤具有良好防治作用[4]. 基于此, 本研究尝试分析嗜酸乳杆菌联合莫沙必利治疗颅脑损伤术后胃肠功能障碍疗效及对肠内营养达标时间、肠道菌群及康复进程的影响. 具体分析如下.
一般资料: 选取2018-02/2021-02我院颅脑损伤术后胃肠功能障碍患者92例, 以随机数字表法按1:1比例分为研究组、对照组, 各46例. 两组患者年龄、体质量、性别、格拉斯哥昏迷量表(glasgow coma scale, GCS)评分、疾病类型及致伤原因均衡可比(P>0.05), 见表1.
| 项目 | 研究组(n = 46) | 对照组(n = 46) | t/χ2/u | P |
| 年龄(岁) | 29-58 (43.12±6.02) | 27-59 (42.09±6.51) | 0.788 | 0.433 |
| 体质量(kg) | 48-82 (65.12±7.11) | 46-83 (66.07±6.85) | 0.653 | 0.516 |
| 性别 | ||||
| 男 | 27 (58.70) | 22 (47.83) | 1.092 | 0.296 |
| 女 | 19 (41.30) | 24 (52.17) | ||
| GCS评分 | ||||
| 4-5分 | 15 (32.61) | 18 (39.13) | 0.632 | 0.527 |
| 6-7分 | 18 (39.13) | 17 (36.96) | ||
| 8分 | 13 (28.26) | 11 (23.91) | ||
| 疾病类型 | ||||
| 硬膜外血肿 | 20 (43.48) | 17 (36.96) | 0.821 | 0.412 |
| 硬膜下血肿 | 15 (32.61) | 14 (30.43) | ||
| 脑挫裂伤 | 11 (23.91) | 15 (32.61) | ||
| 致伤原因 | ||||
| 打击伤 | 10 (21.74) | 11 (23.91) | 0.063 | 0.950 |
| 交通伤 | 19 (41.30) | 17 (36.96) | ||
| 坠落伤 | 11 (23.91) | 13 (28.26) | ||
| 其他 | 6 (13.04) | 5 (10.87) |
选取标准: 纳入标准: (1)符合第八版《外科学》中重症颅脑损伤诊断标准[5]; (2)伤后24 h内入院, 昏迷时间≥6 h, 入院时GCS评分4-8分; (3)基础营养状况良好; (4)符合欧洲危重病医学会(ESICM)制订的胃肠功能障碍诊断标准[6], 且急性胃肠损伤Ⅱ级及以上.
排除标准: (1)合并胸腹部严重外伤、颅底骨折及口鼻外伤出血等; (2)肠内营养前合并低蛋白血症者; (3)胃肠道功能不允许或不耐受肠内营养者; (4)血流动力学不稳定, 休克未纠正; (5)存在胃肠原发性基础疾病; (6)入组前接受促胃动力治疗者; (7)脑死亡者.
两组术后均予以控制血压及颅内压、保护胃黏膜、预防感染和肠内营养等常规基础治疗.
对照组予以莫沙必利(亚宝药业集团股份有限公司, 国药准字: H20090158), 5 mg/次, 药物研磨后用20 mL温水溶解, 经胃管注入胃内, 3次/d.
研究组在对照组基础上予以嗜酸乳杆菌(通化金马药业集团股份有限公司, 国药准字: H10940114) 0.5 g治疗, 药物研磨后用20 mL温水溶解, 经胃管注入胃内, 3次/d, 两组均治疗1 wk.
疗效评估标准: 显效: 治疗后1 d内排气、排便、饮食及体温均恢复正常, 肠鸣音3-5次/min; 有效: 治疗后2 d内排气、排便趋于正常, 肠鸣音较弱, 进食后存在轻度腹胀, 体温在37 ℃-38 ℃; 好转: 治疗后3 d内病人排气、排便有所好转, 肠鸣音0-2次/min, 体温在38 ℃以上; 无效: 未达上述标准者. 总有效率 = (好转+有效+显效)/总例数×100%.
观察指标: 临床统计. 统计比较两组临床疗效、肠内营养达标时间、机械通气时间、重症监护病房(intensive care unit, ICU)住院时间、28 d病死率. 其中肠内营养达标时间, 需计算每日所需总热卡量, 根据胃残留量(gastric residual volume, GRA)调整肠内营养饲入速度及饲人量等, 记录肠内营养达到目标热卡量所需时间.
分别于治疗前、治疗3 d后、治疗1 wk后比较两组胃动力指标、肠道屏障功能指标水平、肠道菌群数量. (1)胃动力指标: 采用间接测量法每6 h监测1次腹内压(intra-abdominal pressure, IAP)、GRA, 取其平均值记录当日IAP、GRA; (2)肠道屏障功能指标: 采集患者空腹静脉血5 mL, 以3500 r/min转速离心15 min, 取上层血清, 采用比色法检测血清D-乳酸(D-lactic acid, D-LA)、二胺氧化酶(diamine oxidase, DAO)水平, DAO试剂盒购自北京百奥莱博科技有限公司, D-LA试剂盒购自南京森贝伽生物科技有限公司; (3)肠道菌群数量: 取患者粪便2 g, 将粪便逐渐稀释至10-20倍, 分别接种于双歧杆菌、乳酸杆菌、肠球菌、肠杆菌等不同培养基中, 置于37 ℃恒温箱中培养24-72 h, 进行菌落计数(cfu/g), 取其对数值.
统计学处理 数据处理采用SPSS 22.0软件, 计数资料以例数描述, 采用χ2检验, 计量资料以平均数±标准差描述, 两组间比较采用独立样本t检验, 不同时间、组间交互作用下指标采用重复测量方差分析, P<0.05表示差异有统计学意义.
经治疗, 研究组总有效率93.48%较对照组78.26%高, 差异有统计学意义(P<0.05). 见表2.
| 组别 | 例数 | 无效 | 好转 | 有效 | 显效 | 总有效率 |
| 研究组 | 46 | 3 (6.52) | 5 (10.87) | 20 (43.48) | 18 (39.13) | 43 (93.48) |
| 对照组 | 46 | 10 (21.74) | 8 (17.39) | 15 (32.61) | 13 (28.26) | 36 (78.26) |
| χ2 | 4.390 | |||||
| P | 0.036 |
研究组肠内营养达标时间、机械通气时间、ICU住院时间较对照组短, 差异有统计学意义(P<0.05); 两组28 d病死率相比, 差异无统计学意义. 见表3.
| 组别 | 例数 | 肠内营养达标时间(d) | 机械通气时间(d) | ICU住院时间(d) | 28 d病死率(%) |
| 研究组 | 46 | 4.18±0.94 | 6.83±2.29 | 9.05±3.14 | 0 (0.00) |
| 对照组 | 46 | 5.26±1.47 | 8.42±2.87 | 11.72±4.36 | 2 (4.35) |
| t/χ2 | 4.198 | 2.937 | 4.198 | 0.511 | |
| P | <0.001 | <0.001 | <0.001 | 0.475 |
整体分析显示, 两组IAP、GRA水平组间、不同时间点及交互作用相比, 差异有统计学意义(P<0.05), 研究组IAP、GRA水平降低幅度更明显. 进一步两两比较, 组间比较, 两组治疗前上述指标水平相比, 差异无统计学意义, 研究组治疗3 d、1 wk后上述指标水平均低于对照组, 差异有统计学意义(P<0.05); 组内比较, 两组治疗3 d、1 wk后上述指标水平均较本组治疗前降低, 差异有统计学意义(P<0.05). 见表4.
| 组别 | 例数 | IAP (cmH2O) | GRA (mL) | ||||
| 治疗前 | 治疗3 d后 | 治疗1 wk后 | 治疗前 | 治疗3 d后 | 治疗1 wk后 | ||
| 研究组 | 46 | 17.94±2.47 | 14.69±2.06ab | 12.28±1.69ab | 271.92±83.47 | 174.43±57.26ab | 123.49±47.83ab |
| 对照组 | 46 | 17.36±1.98 | 16.24±1.75b | 14.75±1.52b | 262.86±78.25 | 225.07±63.95b | 182.74±54.28b |
| F组间, P组间 | F = 11.068, P<0.001 | F = 9.841, P = 0.015 | |||||
| F时间, P时间 | F = 20.109, P<0.001 | F = 19.602, P<0.001 | |||||
| F交互, P交互 | F = 15.266, P<0.001 | F = 17.422, P<0.001 | |||||
整体分析显示, 两组血清D-LA、DAO水平组间、不同时间点及交互作用相比, 差异有统计学意义(P<0.05), 研究组血清D-LA、DAO水平降低幅度更明显. 进一步两两比较, 组间比较, 两组治疗前上述指标水平相比, 差异无统计学意义, 研究组治疗3 d、1 wk后上述指标水平均低于对照组, 差异有统计学意义(P<0.05); 组内比较, 两组治疗3 d、1 wk后上述指标水平均较本组治疗前降低, 差异有统计学意义(P<0.05). 见表5.
| 组别 | 例数 | D-LA (mg/L) | DAO (U/L) | ||||
| 治疗前 | 治疗3 d后 | 治疗1 wk后 | 治疗前 | 治疗3 d后 | 治疗1 wk后 | ||
| 研究组 | 46 | 26.42±7.14 | 19.36±4.57ab | 16.23±3.84ab | 15.86±4.47 | 11.59±2.48ab | 8.97±1.93ab |
| 对照组 | 46 | 25.09±6.32 | 22.83±5.08b | 19.47±4.56b | 14.69±4.82 | 13.28±3.60b | 10.72±2.54b |
| F组间, P组间 | F = 8.154, P = 0.029 | F = 8.652, P = 0.026 | |||||
| F时间, P时间 | F = 16.911, P<0.001 | F = 12.698, P<0.001 | |||||
| F交互, P交互 | F = 9.023, P = 0.019 | F = 10.051, P<0.001 | |||||
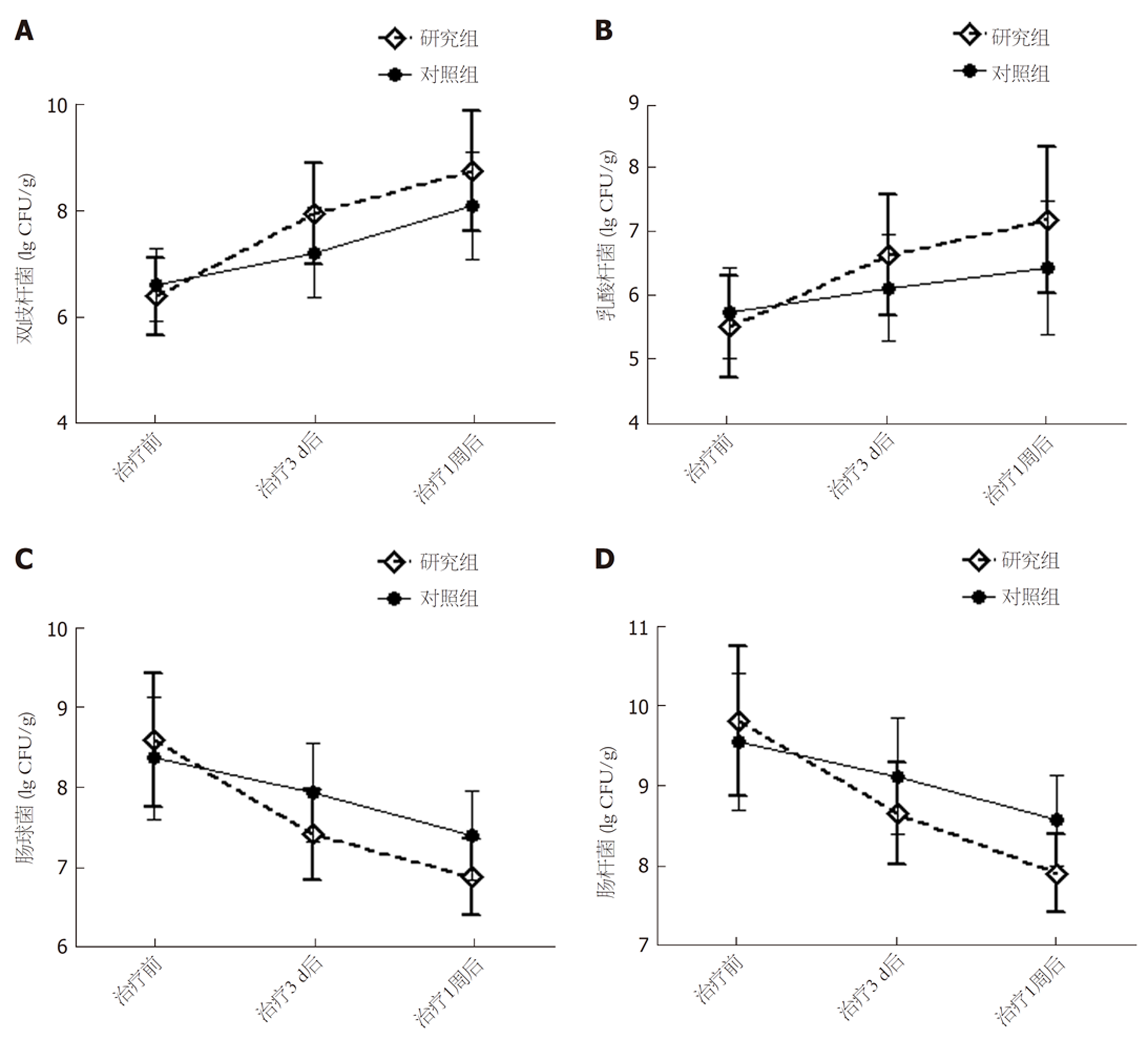
整体分析显示, 两组双歧杆菌、乳酸杆菌、肠球菌、肠杆菌数量组间、不同时间点及交互作用相比, 差异有统计学意义(P<0.05), 研究组双歧杆菌、乳酸杆菌、肠球菌、肠杆菌数量改善幅度更明显. 进一步两两比较, 组间比较, 两组治疗前双歧杆菌、乳酸杆菌、肠球菌、肠杆菌数量相比, 差异无统计学意义, 研究组治疗3 d、1 wk后双歧杆菌、乳酸杆菌数量均多于对照组, 肠球菌、肠杆菌数量均少于对照组, 差异有统计学意义(P<0.05); 组内比较, 两组治疗3 d、1 wk后双歧杆菌、乳酸杆菌数量均较本组治疗前增加, 肠球菌、肠杆菌数量均较本组治疗前减少, 差异有统计学意义(P<0.05). 见表6、图1.
| 组别 | 例数 | 双歧杆菌 | 乳酸杆菌 | 肠球菌 | 肠杆菌 | ||||||||
| 治疗前 | 治疗3 d后 | 治疗1 wk后 | 治疗前 | 治疗3 d后 | 治疗1 wk后 | 治疗前 | 治疗3 d后 | 治疗1 wk后 | 治疗前 | 治疗3 d后 | 治疗1 wk后 | ||
| 研究组 | 46 | 6.38 ± 0.74 | 7.95 ± 0.97ab | 8.76 ± 1.13ab | 5.46 ± 0.80 | 6.58 ± 0.95ab | 7.14 ± 1.16ab | 8.61 ± 0.84 | 7.43 ± 0.57ab | 6.89 ± 0.48ab | 9.84 ± 0.94 | 8.67 ± 0.64ab | 7.92 ± 0.49ab |
| 对照组 | 46 | 6.60 ± 0.69 | 7.21 ± 0.85b | 8.09 ± 1.02b | 5.68 ± 0.72 | 6.07 ± 0.84b | 6.39 ± 1.05b | 8.39 ± 0.77 | 7.95 ± 0.62b | 7.41 ± 0.56b | 9.57 ± 0.86 | 9.14 ± 0.73b | 8.59 ± 0.57b |
| F组间, P组间 | F = 7.026, P = 0.039 | F=6.598, P = 0.042 | F = 6.180, P = 0.048 | F = 7.985, P = 0.031 | |||||||||
| F时间, P时间 | F = 13.121, P<0.001 | F = 15.603, P<0.001 | F = 16.034, P<0.001 | F = 14.180, P<0.001 | |||||||||
| F交互, P交互 | F = 7.263, P<0.001 | F = 11.394, P<0.001 | F = 14.119, P<0.001 | F = 12.033, P<0.001 | |||||||||
脑外伤因其多发性、高致残性, 越来越受到临床重视, 重型颅脑损伤极易引起胃肠功能障碍, 不但加重原发病, 还可造成多器官功能障碍, 导致住院时间延长, 病死率增加[7-9]. 因此, 采取有效措施, 及时改善重型颅脑损伤患者的胃肠功能状况极为重要.
目前临床治疗胃肠功能障碍仍以综合措施为主, 包括原发疾病治疗、有效液体复苏、早期肠内营养支持、促进胃肠动力等对症治疗[10-11]. 莫沙必利是临床常用促胃肠动力药物之一, 通过作用于5-羟色胺受体, 促进乙酰胆碱释放, 提升胃肠道动力, 加快胃排空速度, 且对胃酸分泌无影响, 可缓解术后呃逆、腹胀、便秘等胃肠反应[12]. 近年来微生态制剂联合早期肠内营养用于重型颅脑损伤逐渐得到临床重视, 有研究显示[13], 微生态制剂可调节肠道菌群紊乱, 保护胃肠黏膜屏障, 防止细菌和内毒素移位, 具有改善机体免疫平衡等作用. 方裕民等[14]研究发现, 在早期肠内营养干预基础上加用复方嗜酸乳杆菌片, 可改善重型颅脑损伤患者营养状况, 提高肠道分泌型免疫球蛋白水平, 增强肠道黏膜局部免疫力. 在上述研究基础上, 本研究尝试将嗜酸乳杆菌、莫沙必利联合用于颅脑损伤术后胃肠功能障碍患者, 发现治疗总有效率得到提升, 肠内营养达标时间、机械通气时间、ICU住院时间均显著缩短. 究其原因, 嗜酸乳杆菌是乳杆菌科重要菌种之一, 其具有双向调节胃肠动力作用, 既可调节肠动力不足, 又可抑制肠道收缩过度, 通过刺激肠道产生移行性复合波, 增加胃肠蠕动, 促进营养物质吸收, 有助于缩短肠内营养达标时间, 提高疾病治疗效果, 促进患者康复. 本研究还选择反映胃肠动力的IAP、GRA和肠道屏障功能的D-LA、DAO作为观察指标, 对患者胃肠功能状况进行对比分析, 发现研究组治疗3 d、1 wk后IAP、GRA及D-LA、DAO水平均低于对照组(P<0.05), 表明嗜酸乳杆菌、莫沙必利联合用于颅脑损伤术后患者, 可改善其胃肠功能障碍. 本研究在莫沙必利治疗基础上加用嗜酸乳杆菌, 通过口服嗜酸乳杆菌并分解糖类产生乳酸, 降低肠道pH值, 进而提高肠道酸度, 有助于重建胃肠道菌群屏障, 保护胃肠黏膜, 减少胃肠道功能紊乱发生.
经过近半个世纪的临床应用与研究, 早期肠内营养支持在颅脑损伤术后的应用得到普遍认可, 首选肠内营养的主要目为维护肠道功能, 防止细菌移位[15,16]. 本研究发现, 研究组治疗3 d、1 wk后双歧杆菌、乳酸杆菌数量均多于对照组, 肠球菌、肠杆菌数量均少于对照组(P<0.05), 说明予以嗜酸乳杆菌治疗的肠内营养支持更有助于改善颅脑损伤患者术后肠道微生态环境、调节肠道菌群紊乱. 这可能与口服嗜酸乳杆菌片可直接补充肠道生理性有益菌群, 或选择性刺激正常菌群生长繁殖有关, 通过刺激肠道黏膜局部免疫功能, 提高肠黏膜免疫力, 竞争性抑制内源性条件致病菌过度生长及外源性细菌定植, 进而调控肠道内菌群失调, 维持肠道内各菌种之间生态平衡[17,18]. 此外, 莫沙必利、嗜酸乳杆菌联合应用可有效减轻胃肠道应激性损伤, 进而改善胃肠功能紊乱, 促进肠道对肠内营养物质的吸收, 改善机体营养状况, 最终加快脑组织及整体生理健康恢复[19]. 本研究对两组28 d病死率进行对比发现无显著差异, 可能与本研究样本量较少, 随访时间较短有关, 在今后研究中可通过多中心研究、增加样本量及延长随访时间, 进一步探究上述治疗方案对疾病预后的影响.
综上, 嗜酸乳杆菌联合莫沙必利治疗颅脑损伤术后胃肠功能障碍疗效确切, 可对肠道内菌群进行有效调控, 保护肠道黏膜屏障, 改善胃肠道功能, 缩短肠内营养达标时间, 加快患者康复进程.
重型颅脑创伤后, 接近80%患者出现胃肠动力不足现象. 胃肠功能紊乱为重症颅脑损伤后常见并发症, 早期会出现胃肠黏膜受损、吸收排泄障碍、黏膜屏障受损, 继而导致机体营养缺陷、免疫功能下降、炎症反应增强, 严重者可导致全身性器官炎症综合征, 对患者的生活质量以及身体健康造成严重威胁. 莫沙必利、嗜酸乳杆菌均可调节胃肠功能, 但两者联合应用于重症颅脑损伤后胃肠功能障碍患者的效果尚不明确.
希望通过分组对照研究, 得出嗜酸乳杆菌联合莫沙必利治疗颅脑损伤术后胃肠功能障碍患者的有效性证据, 为此类患者提供有效治疗方案.
保证颅脑损伤术后胃肠功能障碍患者于治疗过程中有效用药.
选取颅脑损伤术后胃肠功能障碍患者92例, 随机分为研究组、对照组, 各46例. 常规治疗基础上, 对照组予以莫沙必利, 研究组予以嗜酸乳杆菌联合莫沙必利. 统计对比两组临床疗效、肠内营养达标时间、康复进程、28 d病死率以及治疗前、治疗3 d、1 wk后胃动力指标、肠道屏障功能指标水平、肠道菌群数量变化.
经治疗, 研究组总有效率93.48%高于对照组78.26%; 研究组肠内营养达标时间、机械通气时间、重症监护病房住院时间短于对照组; 研究组治疗3 d、1 wk后腹内压、胃残留量及D-乳酸、二胺氧化酶水平低于对照组; 研究组治疗3 d、1 wk后双歧杆菌、乳酸杆菌数量多于对照组, 肠球菌、肠杆菌数量少于对照组;研究组28 d病死率0.00%与对照组4.35%相比, 差异无统计学意义.
嗜酸乳杆菌联合莫沙必利治疗颅脑损伤术后胃肠功能障碍可缩短肠内营养达标时间, 调节肠道菌群, 保护肠黏膜屏障, 促进胃肠道功能恢复, 加快患者康复进程, 提高治疗效果.
人体包含益生菌多种多样, 在未来研究中可尽可能提取易于人类健康微生物群, 在治疗胃肠道疾病中起到其不可替代的效用.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Nicholson SE, Watts LT, Burmeister DM, Merrill D, Scroggins S, Zou Y, Lai Z, Grandhi R, Lewis AM, Newton LM, Eastridge BJ, Schwacha MG. Moderate Traumatic Brain Injury Alters the Gastrointestinal Microbiome in a Time-Dependent Manner. Shock. 2019;52:240-248. [PubMed] [DOI] |
| 3. | 任 晋瑞, 甄 自刚, 任 少华, 张 刚利, 贾 贵军, 吉 宏明. 鼻肠管联合鼻胃管的肠内营养方式治疗重型颅脑损伤患者的疗效分析. 中华神经外科杂志. 2018;34:1143-1147. [DOI] |
| 6. | Reintam Blaser A, Malbrain ML, Starkopf J, Fruhwald S, Jakob SM, De Waele J, Braun JP, Poeze M, Spies C. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems. Intensive Care Med. 2012;38:384-394. [PubMed] [DOI] |
| 7. | Fan M, Wang Q, Fang W, Jiang Y, Li L, Sun P, Wang Z. Early Enteral Combined with Parenteral Nutrition Treatment for Severe Traumatic Brain Injury: Effects on Immune Function, Nutritional Status and Outcomes. Chin Med Sci J. 2016;31:213-220. [PubMed] [DOI] |
| 9. | 高 慧, 杨 洁, 胡 云霞, 陈 秋华, 鲁 俊, 王 醒, 陈 明祺. 升降散对重型颅脑损伤患者胃肠功能障碍及预后影响的临床研究. 中国中医急症. 2019;28:565-567, 571. [DOI] |
| 11. | 罗 文辉, 何 兴祥. 肠道屏障功能在创伤性脑损伤中的研究进展. 胃肠病学和肝病学杂志. 2021;30:51-54. [DOI] |
| 12. | 王 建明, 何 毅, 袁 彩霞, 张 蕊, 胡 建军, 王 光辉. 莫沙必利联合氟西汀治疗结直肠癌患者术后胃肠功能障碍临床疗效. 中国现代应用药学. 2018;35:582-585. [DOI] |
| 15. | Malekahmadi M, Moradi Moghaddam O, Islam SMS, Tanha K, Nematy M, Pahlavani N, Firouzi S, Zali MR, Norouzy A. Evaluation of the effects of pycnogenol (French maritime pine bark extract) supplementation on inflammatory biomarkers and nutritional and clinical status in traumatic brain injury patients in an intensive care unit: A randomized clinical trial protocol. Trials. 2020;21:162. [PubMed] [DOI] |