修回日期: 2021-07-31
接受日期: 2021-08-24
在线出版日期: 2021-10-08
肝细胞癌(hepatocellular carcinoma, HCC), 是世界上第六大常见恶性肿瘤和第三大癌症死亡原因, 在过去的30年里, 全世界肝癌患者的发病率从每10万人1.6人上升到4.6人. 广西是我国HCC的高发区, 其死亡率居广西肿瘤死因谱首位, 约占全部恶性肿瘤的40%. 因此探讨色素框同源物2 (chromobox homolog 2, CBX2)在肝细胞癌免疫中的作用, 将为HCC治疗提供潜在的价值.
探讨CBX2基因在HCC组织中的表达及其免疫和预后意义.
采用组织微阵列和免疫组织化学方法检测75例HCC及其对应癌旁非肿瘤组织中的CBX2的表达, 分析CBX2与HCC的临床病理特征以及患者生存预后之间的关系. 探讨CBX2与免疫调节因子之间的关系, 并通过GO和KEGG通路富集分析确定CBX2与免疫事件有关. 使用COX回归模型开发多基因风险预测模型, 由此产生的风险评分是一个独立的预测因子. 我们使用接受者操作特性 (receiver operating characteristic, ROC)曲线方法评估风险评分的预测准确性. 最后, 构建了带有校准曲线的预后诺模图, 以预测个体的3年和5年生存概率.
CBX2在HCC组织中的阳性表达为66.7% (50/75), 明显高于癌旁非肿瘤组织25.3% (19/75), 差异有统计学意义(P<0.01). 结合临床病理学特征分析发现, CBX2的表达与HCC患者的TNM分期和AFP具有相关性(P<0.05). 进一步生存分析发现, CBX2阳性组患者的生存时间明显高于阴性组, 提示CBX2阴性表达可能与HCC患者的不良预后相关; CBX2表达与辅助型T细胞2的浸润水平呈正相关; 我们确定了CBX2与10个免疫抑制因子和23个免疫刺激因子之间的关系, 相关的GO和KEGG通路富集分析表明CBX2与介导的免疫事件相关.
CBX2阳性表达是HCC患者的预后危险因素; CBX2可能是HCC的潜在免疫预后标志物.
核心提要: 本文发现色素框同源物2 (chromobox homolog 2, CBX2)在肝细胞癌(hepatocellular carcinoma, HCC)组织中的高表达. 并且结合临床病理学特征分析发现, CBX2的高表达与HCC患者的TNM分期和AFP具有相关性并且与HCC患者的预后不良相关. CBX2高表达与中性粒细胞、巨噬细胞和CD8+T细胞的浸润水平呈正相关; 我们确定了CBX2与10个免疫抑制因子和23个免疫刺激因子之间的关系. 基于这33个免疫调节剂, 我们建立了多基因风险预测模型, 得到的风险评分是一个独立的预后预测因子, 最后, 构建了一个带有校准曲线的预测诺模图来预测个体的3年和5年生存概率. CBX2阳性表达是HCC患者的预后危险因素并且可能是HCC的潜在免疫治疗靶点.
引文著录: 宋鑫, 王添贤, 朱小年, 谭盛葵. 肝细胞癌中CBX2的免疫和预后意义的综合分析. 世界华人消化杂志 2021; 29(19): 1118-1129
Revised: July 31, 2021
Accepted: August 24, 2021
Published online: October 8, 2021
The number of cases of hepatocellular carcinoma (HCC), the sixth most common malignancy and the third leading cause of cancer death worldwide, has risen from 1.6 to 4.6 per 100000 people worldwide over the past 30 years. Guangxi has a high incidence of HCC in China, and its death rate ranks first in the spectrum of causes of tumor death in Guangxi, accounting for about 40% of all deaths from malignant tumors. Exploring the role of chromobox homolog 2 (CBX2) in HCC immunity will provide potential value for the treatment of this malignancy.
To investigate the expression of CBX2 and analyze its immunological and prognostic significance in HCC.
The expression of CBX2 in 75 cases of HCC and matched non-tumor tissues was detected by tissue microarray and immunohistochemistry. The relationship of CBX2 expression with the clinicopathologic features of HCC and survival prognosis was analyzed. Then, the differential expression of CBX2 between HCC and normal tissues was verified in The Cancer Genomic Atlas (TCGA). Next, we explored the association between CBX2 expression and immunocyte infiltration, determined the relationship between CBX2 expression and immunosuppressors and immunostimulators, and identified the immune events that CBX2 was involved in through relevant GO and KEGG pathway enrichment analyses. A multi-gene risk prediction model was developed using a COX regression model, thereby generating a risk score that is an independent predictor of survival prognosis. ROC analysis was performed to assess the predictive accuracy of the risk score. Finally, a prognostic model with a calibration curve was constructed to predict the patients' survival probability at 3 and 5 years.
The positive expression of CBX2 in HCC tissue was 66.7% (50/75), which was significantly higher than that in matched non-tumor tissues (25.3% (19/75); P < 0.01). The expression of CBX2 was associated with TNM stage and AFP status (P < 0.05). The survival time of patients in the CBX2 positive group was significantly lower than that of the CBX2 negative group, suggesting that CBX2 positive expression may be related to the prognosis of HCC patients. TCGA database verification reached the same conclusion. The expression of CBX2 was positively correlated with the infiltration levels of T helper 2 cells. CBX2 was identified to be associated with 10 immunosuppressors and 23 immunostimulators, and enriched analysis of related GO and KEGG pathways showed that CBX2 was associated with immune events such as intestinal immune network for immunoglobulin A production, cytokine-cytokine receptor interactions, cell adhesion molecules, and rheumatoid arthritis.
CBX2 positive expression may be a prognostic risk factor in HCC patients. Our findings provide evidence for the role of CBX2 in tumor immunity in HCC, suggesting that CBX2 may be a potential immunoprognostic marker for HCC.
- Citation: Song X, Wang TX, Zhu XN, Tan SK. Immunological and prognostic significance of CBX2 expression in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2021; 29(19): 1118-1129
- URL: https://www.wjgnet.com/1009-3079/full/v29/i19/1118.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i19.1118
肝细胞癌(hepatocellular carcinoma, HCC)是世界上常见的癌症之一. 2020年全球新发癌症病例1929万例, 其中HCC新发癌症病例91万, 是全球第六大癌症[1]. 2020年中国癌症新发病例457万例, 癌症死亡人数300万, 其中HCC新发病例41万, 死亡人数39万, 位居肿瘤死因谱第二位[2]. 当前, 在HCC所有治疗手段中, 手术切除仍是大多数早期及部分中晚期患者的首选[3,4]. 随着科学技术的发展, 免疫治疗已经逐渐成为热点话题, 肝细胞癌的治疗方案已经扩展到包括免疫治疗, 例如免疫检查点抑制剂阿替唑珠单抗联合抗血管生成药物贝伐单抗治疗肝细胞癌[5]. 有研究表明, 在炎症条件下, 各种细胞因子(如IL-10、IL-35和转化生长因子-β)持续表达, 大量免疫细胞(如Treg、Th2型巨噬细胞和M2巨噬细胞)被招募到肝脏. 这些细胞因子和细胞协同作用构成了肿瘤细胞生长的缺氧免疫抑制微环境[6], 因此肝细胞癌的发生发展可能与免疫细胞与肿瘤微环境相关. 尽管虽然科学家们对HCC的致癌分子机制进行了广泛深入的研究, 但目前为止关于肝癌细胞和免疫细胞之间相互作用的机制尚未完全清楚, 因此进一步探讨免疫细胞浸润与肿瘤细胞之间的相互作用将为HCC的治疗提供新的思路.
多梳蛋白家族(polycombgroup, PCG)最初是在研究果绳同源异性基因及其调控时发现的, 随后在哺乳动物和其他多细胞动物的研究证明, 它是一组通过染色质修饰调控靶基因的转录抑制子, 主要通过对组蛋白H3的第27位赖氨酸甲基化修饰从而使靶基因沉默, PCG蛋白作用于编码转录因子、信号蛋白等多种重要基因, 来调控细胞周期、维持胚胎干细胞多潜能性和自我更新能力、肿瘤发生等生物学过程[7-9]. 色素框同源蛋白2 (chromobox protein homolog, CBX2)属于PCG的重要成员, 参与调控细胞的分化、衰老等以及在肿瘤的发生发展中起着重要作用. 研究发现, CBX2在前列腺癌[10]、卵巢癌[11]、食管癌[12]、膀胱癌[13]、乳腺癌[14]、卵巢癌[15]、骨肉瘤的组织中的表达明显高于邻近正常组织[16]. HCC是消化系统常见的恶性肿瘤, 目前国内外认为由慢性肝炎病毒感染而导致的肝硬化、肝纤维化是目前已知的引起HCC最主要的危险因素[17], 但肝癌确切致病机制仍未完全阐明, 缺乏有效的早诊和预测病程进展的分子标志物.
本文旨在探讨CBX2在HCC中的预后和免疫意义. 我们从癌症基因组图谱(the cancer genomic atlas, TCGA)数据库下载数据进行详细分析. 通过免疫组织化学SP法检测CBX2在HCC和癌旁组织中的表达, 探讨CBX2与HCC临床病理特征及预后之间的关系. 本研究系统地评价了CBX与免疫细胞浸润的关系, 以及CBX2介导的相关信号通路. 此外, 我们使用CBX2相关的免疫调节剂确定了一个免疫预后信号, 之后在TCGA数据库的HCC数据集中验证了它的预后准确性. 最后结合免疫特征和临床病理特征建立了诺模图.
1.1.1 组织标本: 所有样本均取自2007-2015年间桂林医科大学第一附属医院收治的经组织病理学诊断为肝癌的患者. 所有肝癌患者术前均未接受过任何治疗, 均有完整的临床资料, 包括患者的年龄、性别、HBV感染情况、肿瘤数量、病理分级、临床分期等. 所有患者均通过门诊复查或电话随访获得随访. 生存时间以月为单位, 从术后第一天开始计算, 直到患者出现肿瘤转移、复发、死亡或随访结束. 本研究经桂林医科大学伦理委员会批准, 并征得参与研究的每位患者的书面知情同意.
1.1.2 CBX2在TCGA HCC和CCLE肝癌细胞系中的表达: 从TCGA数据库(https://portal.gdc.cancer.gov/)下载HCC基因表达谱文件, 共424份CBX2基因表达谱样本(374份HCC样本和50份癌旁样本), 用R语言包整理数据, 进行差异分析和生存分析. 我们从癌症细胞系百科全书(motivations for the cancer cell line encyclopedia, CCLE)下载并处理了25个肝癌细胞系的RNAseq数据, 提取了CBX2的表达谱, 筛选了与CBX2表达相关的基因进行GSEA分析.
1.1.3 免疫组织化学SP法: 采用免疫组织化学SP法检测CBX2表达, 具体步骤如下:先将组织芯片放于60 ℃烘箱中烤片2 h后取出经二甲苯脱蜡, 梯度乙醇水化, 置于pH = 8.0的EDTA缓冲液中高压加热抗原修复2.5 min, 滴加内源性过氧化物酶阻断剂孵育10 min去除内源性过氧化物酶, PBS缓冲液清洗后滴加羊血清封闭20 min, 甩干后滴加CBX2一抗(工作浓度1:50), 4 ℃过夜; 第2天用PBS缓冲液清洗后, 滴加羊抗兔二抗, 室温下孵育30 min, PBS缓冲液清洗后滴加DAB显色,显微镜下观察5-10 min至显色合适为止. 苏木精复染、1%的盐酸酒精分化、流水返蓝、梯度酒精脱水、透明、中性树胶封片固定, 全程无干片情况.
结果判定: (1)在400倍镜下随机选取5个不同的视野, 计数细胞总数和阳性细胞数, 按阳性细胞数所占的百分数计分: 阳性细胞数≤5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分; (2)按细胞染色的颜色强弱程度计分: 无染色计0分, 淡黄色计1分, 棕黄色计2分. 棕褐色计3分. 最后将上述两项指标的积分数相乘: 0分为(-), 1-4分为(+), 5-8分为(++), 9-12分为(+++). 实验结果总分≤4分为低表达, >4分为高表达.
1.1.4 CBX2与肿瘤免疫浸润的关系: CBX2与免疫细胞的相关性: 我们使用R软件, 利用GSVA包(1.34.0版本)分析了来自TCGA肝细胞肝癌项目中RNAseq数据. 这些细胞类型包括T细胞、幼稚和记忆B细胞、浆细胞、NK细胞和髓系细胞亚群, 这些细胞类型包括aDC(activated DC); B cells; CD8 T cells; Cytotoxic cells; DC; Eosinophils; iDC(immature DC); Macrophages; Mast cells; Neutrophils; NK CD56bright cells; NK CD56dim cells; NK cells; pDC (Plasmacytoid DC); T cells; T helper cells; Tcm (T central memory); Tem (T effector memory); Tfh (T follicular helper); Tgd (T gamma delta); Th1 cells; Th17 cells; Th2 cells; Treg.
1.1.5 CBX2与免疫调节剂的相关性: 从在线集成数据库TISIDB (http://cis.hku)检索与CBX2相关的免疫调节剂. 阐明肿瘤与免疫系统的相互作用. 这个门户网站是基于从以下资源收集和整合的数据建立的: PubMed数据库、研究肿瘤细胞对T细胞毒细胞反应的高通量筛查数据、免疫治疗患者的外显子组和RNA测序数据、TCGA和其他公共数据库. 我们选择了与CBX2基因表达显著相关的免疫抑制剂和免疫刺激剂(Spearman相关检验, P<0.05). 接下来, 我们使用两个基于网络的工具(https://string-db.org/)和基于网络的基因集分析工具包(http://www.webgestalt.org/). 对所得到的蛋白质网络进行GO注释和KEGG途径富集分析.
1.1.6 风险预测模型的构建: 我们试图从CBX2相关的免疫调节剂中开发出一种可预测预后的免疫基因信号. 利用COX模型中的Akaike信息准则, 选择免疫基因, 生成一个称为风险评分的预后指数: 风险评分 = β1x1+β2x2+...+βIXI, 其中Xi是每个基因的表达水平, βi是由COX模型得出的每个基因的风险系数. 采用Kaplan-Meier生存曲线、对数秩和检验和单变量Cox分析评价免疫相关基因特征与临床特征和总生存率的关系. 对风险评分进行多变量COX分析, 调整了年龄、性别、T、N、M和TNM分期. 时间相关的受试者操作特征(receiver operating characteristic, ROC)曲线被用来确定使用风险评分的预后准确性.
1.1.7 诺模图的构造: 今天, 诺模图越来越多地被用来预测癌症的预后. 这种统计方法按分数对每个影响参数进行评分, 例如年龄、性别、TNM分期和风险分数. 对于每个人来说, 所有这些分数加在一起就得到了一个总分, 分数越高, 意味着发生事件的可能性就越高. 在这项研究中, 我们使用诺模图结合患者的临床特征和风险评分来预测癌症的预后. 我们通过R软件的RMS软件包创建了诺模图, 并应用Bootstrap方法(1000个重复)构建校准曲线, 来可视化预测概率与实际发生的偏差. 用一致性指数(C指数)衡量诺模图的预测准确性.
统计学处理 我们使用R版本4.0.4 (R Foundation for Statistics Computing, 奥地利维也纳)实现所有统计分析, 并由IBM SPSS Statistics 19.0 (IBM, Inc., Armonk, NY, USA)补充. 统计学意义阈值设为P<0.05.
通过免疫组化实验, 我们发现CBX2在癌组织及其癌旁组织中的阳性率分别为66.67% (50/75)、25.33% (19/75), CBX2在HCC中阳性表达明显高于癌旁组织, 组间比较差异具有统计学意义(图1A, B) (P<0.05). 并通过分析从TCGA数据验证了我们的发现(图1C, D). 在HCC患者临床病理特征中CBX2高表达与TNM分期、血清AFP水平具有显著相关性(P<0.05, 表1). 为了探讨CBX2在HCC中的预后价值, 我们用Kaplan-Meier模型分析了CBX2表达对HCC患者预后的影响, 发现CBX2表达阳性的HCC患者的生存率明显低于CBX2表达阴性的HCC患者(图1E), TCGA数据库中的生存分析同样如此(图1F) (P<0.01). 单因素分析发现CBX2高表达与血清AFP相关, 在校正性别年龄之后Cox比例风险模型的多因素预后分析显示, CBX2是HCC患者的独立预后因素(表2). 我们还分析了从CCLE下载的25个肝癌细胞系的RNA-SEQ数据. 根据CBX2 mRNA的平均表达水平将细胞分为CBX2高表达组和CBX2低表达组. 如图1G所示, GSEA分析表明, CBX2与多种癌症相关信号通路有关, 包括胰腺癌、RNA降解、抗原的呈递与处理、脂肪酸代谢、神经营养素信号通路和PPAR信号通路等.
| 临床病理参数 | N | CBX2 | χ2值 | P值 | |
| 阳性 | 阴性 | ||||
| 年龄 | |||||
| <50 | 35 | 22 | 13 | 0.178 | 0.673 |
| ≥50 | 40 | 27 | 13 | ||
| 性别 | |||||
| 男 | 61 | 41 | 20 | 0.510 | 0.475 |
| 女 | 14 | 8 | 6 | ||
| 吸烟 | |||||
| 无 | 48 | 32 | 16 | 0.105 | 0.764 |
| 有 | 27 | 17 | 10 | ||
| 饮酒 | |||||
| 无 | 45 | 32 | 13 | 1.658 | 0.198 |
| 有 | 30 | 17 | 13 | ||
| 肿瘤家族史 | |||||
| 无 | 61 | 42 | 19 | 0.530 | 0.478 |
| 有 | 12 | 7 | 5 | ||
| 肿瘤大小 | |||||
| <5 | 61 | 42 | 19 | 0.503 | 0.478 |
| ≥5 | 12 | 7 | 5 | ||
| 病理分级 | |||||
| Ⅰ+Ⅱ | 63 | 41 | 22 | 0.011 | 0.916 |
| Ⅲ | 12 | 8 | 4 | ||
| TNM分期 | |||||
| T1+T2 | 48 | 28 | 20 | 2.885 | 0.089 |
| T3+T4 | 27 | 21 | 6 | ||
| 肝硬化 | |||||
| 无 | 51 | 33 | 18 | 0.028 | 0.868 |
| 有 | 24 | 16 | 8 | ||
| 血清AFP (ng/ml) | |||||
| <400 | 29 | 13 | 16 | 8.778 | 0.003 |
| ≥400 | 46 | 36 | 10 | ||
| 因素 | B | Wald | P值 | OR | 95%CI | |
| Lower | Upper | |||||
| CBX2 | -1.399 | 4.177 | 0.041 | 0.247 | 0.065 | 0.944 |
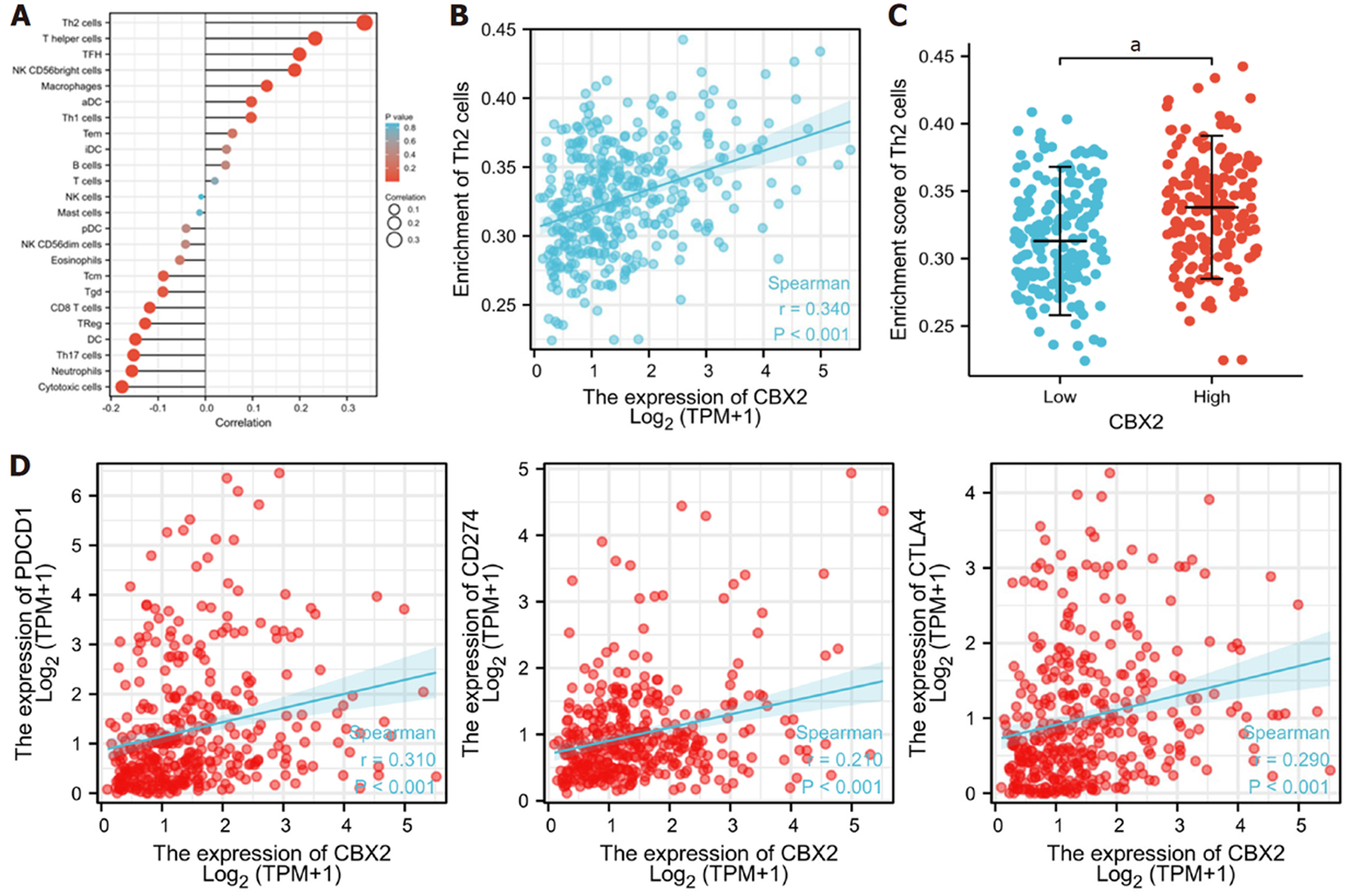
在HCC中, CBX2 mRNA水平与Th2 cell (辅助型T细胞2)具有正相关(图2B), 并且通过分组比较发现在高表达的CBX2组织里Th2 cell水平也相应较高(图2C). 接着我们分析了CBX2与3种免疫检查点的相关性, 发现CBX2与PDCD1具有较强相关性(图2D).
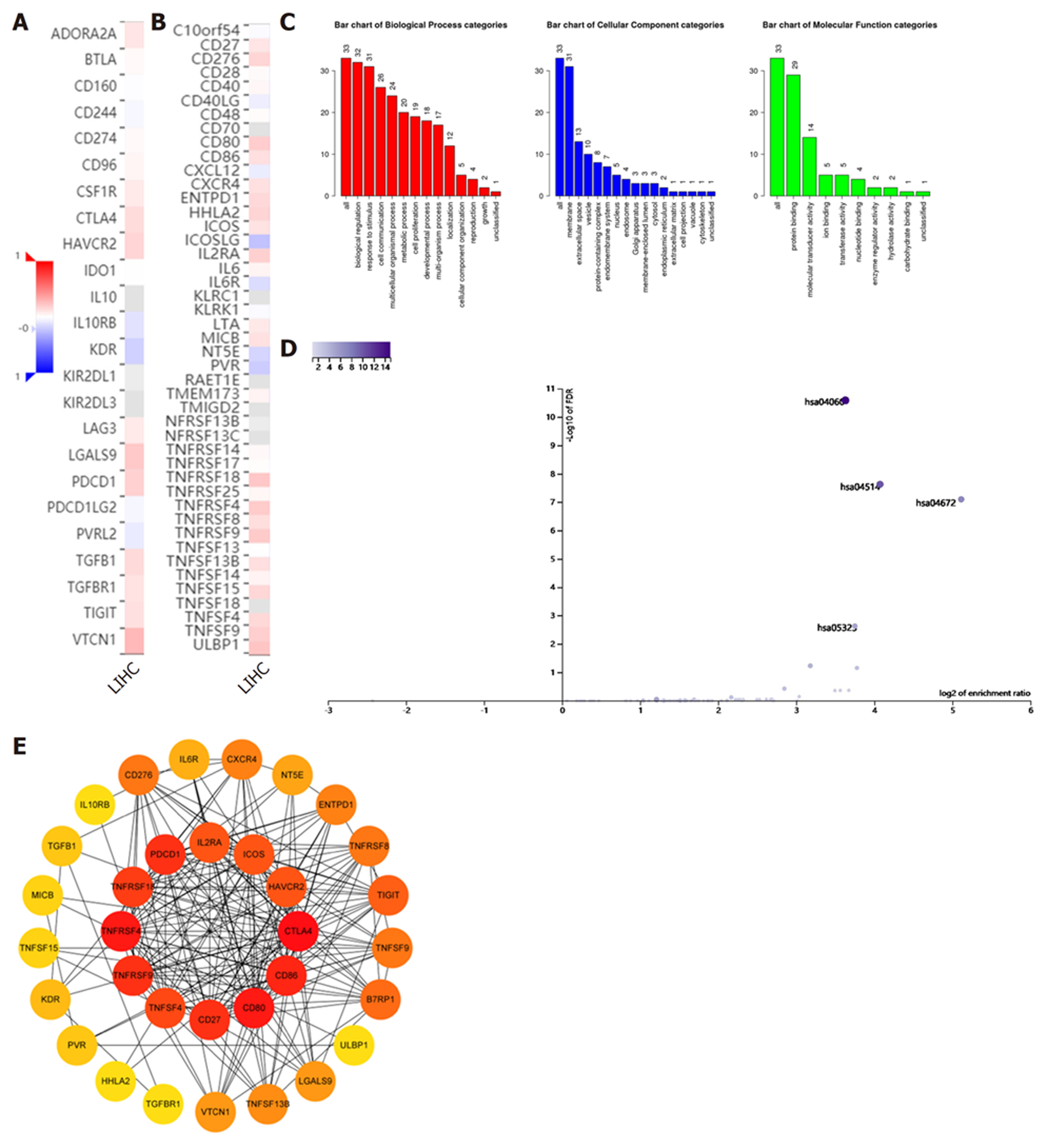
接下来, 我们探讨了CBX2在HCC中的潜在免疫调节作用, 我们鉴定了10个与CBX2相关的免疫抑制因子(CTLA4、HAVCR2、IL10RB、KDR、LGALS9、PDCD1、TGFB1、TGFBR1、TIGIT、VTCN1)和23个免疫刺激因子(CD27、CD276、CD80、CD86、CXCR4、ENTPD1、HHLA2、ICOS、ICOSLG、IL2RA、IL6R、MICB、NT5E、PVR、TNFRSF18、TNFRSF4、TNFRSF8、TNFRSF9、TNFSF13B、TNFSF15、TNFSF4、TNFSF9、ULBP1)(图3A、B). 基于这33个基因构建了PPI网络(图3E). GO和KEGG途径富集分析显示, 产生免疫球蛋白A的肠道免疫网络、细胞因子-细胞因子受体相互作用、细胞粘附分子、类风湿性关节炎与CBX2介导的免疫事件相关(图3C, D).
为了研究CBX2相关免疫调节剂在HCC中的预后价值, 我们将这些变量输入到单变量Cox回归分析中, 筛选出8个预后相关基因(图4A), 4个独立预后基因(图4B). 随后通过将每个样本表达值和每个基因的相关系数的乘积相加来计算风险得分. Kaplan-Meier生存曲线显示, 低风险评分的患者生存时间明显长于高风险评分的患者(P<0.001)(图4C). 危险评分ROC曲线下面积(AUC值)为0.647(图4D). 当合并风险评分和分期时, AUC值为0.726. HCC相关的风险评分、生存状态和特征性基因表达谱的分布如图4E所示. 在单变量Cox回归模型中, 风险评分与TCGA-HCC的生存率显著相关(图4F). 多因素Cox回归分析显示, 在校正了年龄、性别等因素后, 风险评分是影响肝细胞癌预后的独立预后因素(HR = 1.861, 95%CI = 1.319-2.627, P<0.0 5)(图4G).
最后, 我们在HCC中构建了一个预后诺模图来预测个体生存概率得分, 通过对风险评分、分期、T、N、M、年龄和性别进行校正, 以用于诺模图(图5A). 校准曲线显示, 诺模图可以很好地预测HCC患者3年和5年的OS(图5B、C). 我们还使用了一个C指数来评估诺模图的预测判别能力, 它量化了从诺模图得出的概率与死亡的实际观察之间的一致程度. 我们预测诺模图一致性的C指数达到了0.7312.
肿瘤的发生发展, 与抑癌基因密切相关, 抑癌基因启动子区的CpG岛序列被甲基化修饰后, 改变了抑癌基因的表达模式, 导致基因产物表达的下调或者缺失[18-20]. 多梳组基因编码转录抑制因子, 它们以复杂的组合方式组装形成两个主要的多梳抑制复合物(PRC1和PRC2)[21]. PRC1在表观遗传的调控中起着非常重要作用, 表观遗传的畸变可以引起癌症的典型特征,研究表明PCR1也可以独立的发挥作用. 在PCG介导的经典沉默模型中, PCR1可以沉默未被H3K27me3标记的基因组区域[22], PRC2通过催化活性亚基EZH2甲基化组蛋白H3赖氨酸27 (H3K27me)[23]. 5种染色域的蛋白(CBX2、CBX4、CBX6、CBX7和CBX8)可直接识别H3K27me, 这些蛋白的 C端的多梳抑制框结构域(polycombrepressorbox, PC)与E3泛素连接酶Ring1b相互作用, 将PRC1招募到染色质中[24], Ring1b与H3K27me的特定位点结合后泛素化组蛋白H2A (H2AK119ub)上的赖氨酸119, 从而进一步抑制目标位点的转录[25]. CBX2蛋白是参与PRC1复合物的主要成分从而表现出修饰组蛋白并抑制靶基因转录酶的活性[26].
本研究发现HCC组织中的CBX2相比于癌旁非肿瘤组织中的CBX2明显上调(P<0.05), 这与之前乳腺癌、前列腺癌等中的研究结果相一致[10,14]. 结合相关的临床病理资料发现CBX2的阳性表达与AFP水平具有相关性. 有研究表明HCC的临床病理特征与肿瘤的预后密切相关, 包括肿瘤的大小、数目、分期、甲胎蛋白水平、转移、肝硬化、血管侵犯等往往提示HCC的预后不良[27-31]. 进一步采用Kaplan-Meier生存分析模型发现CBX2阳性患者组的生存时间显著低于CBX2阴性患者组, COX多因素分析表明CBX2的高表达是HCC的独立危险因素, 这一研究结果与目前所知研究结果相吻: CBX2的上调率在所有合并肿瘤中平均为10%, 但在卵巢、乳房和肺肿瘤中超过30%[32]. GSEA分析显示CBX2与多种癌症相关信号通路有关, 包括胰腺癌、RNA降解、抗原的呈递与处理、脂肪酸代谢、神经营养素信号通路和PPAR信号通路等, 提示我们CBX2在癌症的发生发展中起着重要的作用. 本研究发现, CBX表达水平与Th2 细胞具有正相关性. 有研究指出, Th2细胞和Tcm与前列腺癌根治术后复发有关, 是复发的独立保护因素[33]; 骨髓瘤细胞通过 Th2-骨髓瘤细胞相互作用增强 Th2 细胞增殖和骨髓瘤克隆形成[34], 因此我们推测CBX2过表达与Th2细胞免疫浸润可能促进HCC细胞的增值, 具体作用机制有待进一步研究. 此外我们分析了CBX2与免疫检查点的关系, 结果显示CBX2与PDCD1具有正相关性, 有研究指出: PDCD1与TMB、MSI和免疫细胞浸润密切相关, 可作为多种癌症的预后标志物[35]. 近年来, 在免疫检查点抑制剂中, PD-1抑制剂显示出良好的治疗效果, 其中一些已被批准用于某些癌症治疗[36]. 为了探索CBX2在HCC中潜在的免疫调节作用, 我们鉴定出了与CBX2相关的10种免疫抑制因子和23种免疫刺激因子, 基于这33个基因构建了PPI网络, GO和KEGG通路分析表明: 产生IgA的肠道免疫网络、细胞因子-细胞因子受体相互作用等与CBX2介导的免疫事件相关. 有研究证明通过诱导的IgA产生信号传导途径的肠道免疫网络能够抑制HCC细胞的增殖和迁移[37]. 并且基于这33种免疫调节剂, 我们筛选出IL10RB、KDR、LGALS9、TGFB1、CD276、MICB、TNFRSF4和TNFSF4作为HCC免疫相关的预后基因, 其中KDR、TGFB1、MICB和TNFSF4是HCC的独立预后基因. 我们对样本进行风险评分, 通过Kaplan-Meier生存分析证明, 低风险评分患者的生存期明显长于高风险患者(P<0.001). 近年来, 诺模图被广泛用于癌症的预后[38-40], 因此本研究构建了CBX2的个性化的预测预后的诺模图, 其C指数为0.7312.
综上所述, 我们的研究报道了CBX2的表达与HCC临床及预后的关系, 实验结果证明CBX2的阳性表达是HCC不良预后的危险因素; 免疫分析结果提示CBX2与相关免疫调节剂可能参与了肿瘤的免疫调控作用, 并且来自CBX2相关免疫调节剂的风险评分可以独立预测HCC的总存活率. 但由于本研究的样本量较少, 患者术后有无接受药物处理等患者相关信息不够全面, 存在信息偏差, 因此CBX2能否成为单一预后的分子标志物及免疫相关靶点, 还需要全面的、大样本、多种族、前瞻性、结合相关通路深入基因分子水平探索其相关发病机制,进一步验证CBX2在肿瘤防治中的作用.
CBX2阳性表达是HCC患者的预后危险因素并且CBX2可能是HCC的潜在免疫预后标志物.
肝细胞癌(hepatocellular carcinoma, HCC), 是世界上第六大常见恶性肿瘤和第三大癌症死亡原因, 在过去的30年里, 全世界肝癌患者的发病率从每10万人1.6人上升到4.6人. 广西是我国HCC的高发区, 其死亡率居广西肿瘤死因谱首位, 约占全部恶性肿瘤的40%.
探索CBX2能否成为HCC患者的预后危险因素以及CBX2与免疫的关系.
探讨色素框同源物2 (chromobox homolog 2, CBX2)在肝细胞癌免疫中的作用.
采用组织微阵列和免疫组织化学方法检测75例HCC及其对应癌旁非肿瘤组织中的CBX2的表达, 分析CBX2与HCC的临床病理特征以及患者生存预后之间的关系.运用R语言等生物信息学工具分析CBX2在肝细胞癌中的免疫作用及机制
CBX2阴性表达可能与HCC患者的不良预后相关; CBX2表达与辅助型T细胞2的浸润水平呈正相关;确定了CBX2与10个免疫抑制因子和23个免疫刺激因子之间的关系, 相关的GO和KEGG通路富集分析表明CBX2与介导的免疫事件相关.
CBX2阳性表达是HCC患者的预后危险因素; CBX2可能是HCC的潜在免疫预后标志物.
近几年, 肿瘤免疫治疗由于其卓越的疗效和创新性, 在2013年被《科学》杂志评为年度最重要的科学突破, 目前已在多种肿瘤如黑色素瘤, 非小细胞肺癌、肾癌和前列腺癌等实体瘤的治疗中展示出了强大的抗肿瘤活性, 多个肿瘤免疫治疗药物已经获得美国FDA (Food And Drug Administration)批准临床应用, 本研究可能为肿瘤免疫治疗提供新的思路.
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | The International Agency for Research on Cancer of the World Health Organization. The latest global cancer burden data for 2020[EB/OL]. Available from: https://www.iarc.fr/faq/latest-global-cancer-data-2020-qa. |
| 2. | Cao M, Li H, Sun D, Chen W. Cancer burden of major cancers in China: A need for sustainable actions. Cancer Commun (Lond). 2020;40:205-210. [PubMed] [DOI] |
| 3. | Ji F, Liang Y, Fu S, Chen D, Cai X, Li S, Peng B, Liang L, Hua Y. Prognostic value of combined preoperative prognostic nutritional index and body mass index in HCC after hepatectomy. HPB (Oxford). 2017;19:695-705. [PubMed] [DOI] |
| 4. | Lim C, Shinkawa H, Hasegawa K, Bhangui P, Salloum C, Gomez Gavara C, Lahat E, Omichi K, Arita J, Sakamoto Y, Compagnon P, Feray C, Kokudo N, Azoulay D. Salvage liver transplantation or repeat hepatectomy for recurrent hepatocellular carcinoma: An intent-to-treat analysis. Liver Transpl. 2017;23:1553-1563. [PubMed] [DOI] |
| 5. | Ogasawara S, Choo SP, Li JT, Yoo C, Wang B, Lee D, Chow PKH. Evolving Treatment of Advanced Hepatocellular Carcinoma in the Asia-Pacific Region: A Review and Multidisciplinary Expert Opinion. Cancers (Basel). 2021;13. [PubMed] [DOI] |
| 6. | Zongyi Y, Xiaowu L. Immunotherapy for hepatocellular carcinoma. Cancer Lett. 2020;470:8-17. [PubMed] [DOI] |
| 7. | Aloia L, Di Stefano B, Di Croce L. Polycomb complexes in stem cells and embryonic development. Development. 2013;140:2525-2534. [PubMed] [DOI] |
| 8. | Müller J, Verrijzer P. Biochemical mechanisms of gene regulation by polycomb group protein complexes. Curr Opin Genet Dev. 2009;19:150-158. [PubMed] [DOI] |
| 9. | Richly H, Aloia L, Di Croce L. Roles of the Polycomb group proteins in stem cells and cancer. Cell Death Dis. 2011;2:e204. [PubMed] [DOI] |
| 10. | Ngollo M, Lebert A, Daures M, Judes G, Rifai K, Dubois L, Kemeny JL, Penault-Llorca F, Bignon YJ, Guy L, Bernard-Gallon D. Global analysis of H3K27me3 as an epigenetic marker in prostate cancer progression. BMC Cancer. 2017;17:261. [PubMed] [DOI] |
| 11. | Li H, Cai Q, Godwin AK, Zhang R. Enhancer of zeste homolog 2 promotes the proliferation and invasion of epithelial ovarian cancer cells. Mol Cancer Res. 2010;8:1610-1618. [PubMed] [DOI] |
| 12. | He LR, Liu MZ, Li BK, Rao HL, Liao YJ, Guan XY, Zeng YX, Xie D. Prognostic impact of H3K27me3 expression on locoregional progression after chemoradiotherapy in esophageal squamous cell carcinoma. BMC Cancer. 2009;9:461. [PubMed] [DOI] |
| 13. | Liu J, Li Y, Liao Y, Mai S, Zhang Z, Liu Z, Jiang L, Zeng Y, Zhou F, Xie D. High expression of H3K27me3 is an independent predictor of worse outcome in patients with urothelial carcinoma of bladder treated with radical cystectomy. Biomed Res Int. 2013;2013:390482. [PubMed] [DOI] |
| 14. | Chen WY, Zhang XY, Liu T, Liu Y, Zhao YS, Pang D. Chromobox homolog 2 protein: A novel biomarker for predicting prognosis and Taxol sensitivity in patients with breast cancer. Oncol Lett. 2017;13:1149-1156. [PubMed] [DOI] |
| 15. | Wheeler LJ, Watson ZL, Qamar L, Yamamoto TM, Post MD, Berning AA, Spillman MA, Behbakht K, Bitler BG. CBX2 identified as driver of anoikis escape and dissemination in high grade serous ovarian cancer. Oncogenesis. 2018;7:92. [PubMed] [DOI] |
| 16. | Han Q, Li C, Cao Y, Bao J, Li K, Song R, Chen X, Li J, Wu X. CBX2 is a functional target of miRNA let-7a and acts as a tumor promoter in osteosarcoma. Cancer Med. 2019;8:3981-3991. [PubMed] [DOI] |
| 17. | Zhu Q, Li N, Zeng X, Han Q, Li F, Yang C, Lv Y, Zhou Z, Liu Z. Hepatocellular carcinoma in a large medical center of China over a 10-year period: evolving therapeutic option and improving survival. Oncotarget. 2015;6:4440-4450. [PubMed] [DOI] |
| 18. | Raynal NJ, Lee JT, Wang Y, Beaudry A, Madireddi P, Garriga J, Malouf GG, Dumont S, Dettman EJ, Gharibyan V, Ahmed S, Chung W, Childers WE, Abou-Gharbia M, Henry RA, Andrews AJ, Jelinek J, Cui Y, Baylin SB, Gill DL, Issa JP. Targeting Calcium Signaling Induces Epigenetic Reactivation of Tumor Suppressor Genes in Cancer. Cancer Res. 2016;76:1494-1505. [PubMed] [DOI] |
| 19. | Stirzaker C, Song JZ, Ng W, Du Q, Armstrong NJ, Locke WJ, Statham AL, French H, Pidsley R, Valdes-Mora F, Zotenko E, Clark SJ. Methyl-CpG-binding protein MBD2 plays a key role in maintenance and spread of DNA methylation at CpG islands and shores in cancer. Oncogene. 2017;36:1328-1338. [PubMed] [DOI] |
| 20. | Thomson JP, Ottaviano R, Unterberger EB, Lempiäinen H, Muller A, Terranova R, Illingworth RS, Webb S, Kerr AR, Lyall MJ, Drake AJ, Wolf CR, Moggs JG, Schwarz M, Meehan RR. Loss of Tet1-Associated 5-Hydroxymethylcytosine Is Concomitant with Aberrant Promoter Hypermethylation in Liver Cancer. Cancer Res. 2016;76:3097-3108. [PubMed] [DOI] |
| 21. | Satijn DP, Gunster MJ, van der Vlag J, Hamer KM, Schul W, Alkema MJ, Saurin AJ, Freemont PS, van Driel R, Otte AP. RING1 is associated with the polycomb group protein complex and acts as a transcriptional repressor. Mol Cell Biol. 1997;17:4105-4113. [PubMed] [DOI] |
| 22. | Tavares L, Dimitrova E, Oxley D, Webster J, Poot R, Demmers J, Bezstarosti K, Taylor S, Ura H, Koide H, Wutz A, Vidal M, Elderkin S, Brockdorff N. RYBP-PRC1 complexes mediate H2A ubiquitylation at polycomb target sites independently of PRC2 and H3K27me3. Cell. 2012;148:664-678. [PubMed] [DOI] |
| 23. | Cao R, Wang L, Wang H, Xia L, Erdjument-Bromage H, Tempst P, Jones RS, Zhang Y. Role of histone H3 lysine 27 methylation in Polycomb-group silencing. Science. 2002;298:1039-1043. [PubMed] [DOI] |
| 24. | Kaustov L, Ouyang H, Amaya M, Lemak A, Nady N, Duan S, Wasney GA, Li Z, Vedadi M, Schapira M, Min J, Arrowsmith CH. Recognition and specificity determinants of the human cbx chromodomains. J Biol Chem. 2011;286:521-529. [PubMed] [DOI] |
| 25. | van der Stoop P, Boutsma EA, Hulsman D, Noback S, Heimerikx M, Kerkhoven RM, Voncken JW, Wessels LF, van Lohuizen M. Ubiquitin E3 ligase Ring1b/Rnf2 of polycomb repressive complex 1 contributes to stable maintenance of mouse embryonic stem cells. PLoS One. 2008;3:e2235. [PubMed] [DOI] |
| 26. | Carracedo A, Cantley LC, Pandolfi PP. Cancer metabolism: fatty acid oxidation in the limelight. Nat Rev Cancer. 2013;13:227-232. [PubMed] [DOI] |
| 27. | Zhu AX, Chen D, He W, Kanai M, Voi M, Chen LT, Daniele B, Furuse J, Kang YK, Poon RT, Vogel A, Chiang DY. Integrative biomarker analyses indicate etiological variations in hepatocellular carcinoma. J Hepatol. 2016;65:296-304. [PubMed] [DOI] |
| 28. | Xiao S, Chang RM, Yang MY, Lei X, Liu X, Gao WB, Xiao JL, Yang LY. Actin-like 6A predicts poor prognosis of hepatocellular carcinoma and promotes metastasis and epithelial-mesenchymal transition. Hepatology. 2016;63:1256-1271. [PubMed] [DOI] |
| 29. | Uchino K, Tateishi R, Shiina S, Kanda M, Masuzaki R, Kondo Y, Goto T, Omata M, Yoshida H, Koike K. Hepatocellular carcinoma with extrahepatic metastasis: clinical features and prognostic factors. Cancer. 2011;117:4475-4483. [PubMed] [DOI] |
| 30. | Jin J, Niu X, Zou L, Li L, Li S, Han J, Zhang P, Song J, Xiao F. AFP mRNA level in enriched circulating tumor cells from hepatocellular carcinoma patient blood samples is a pivotal predictive marker for metastasis. Cancer Lett. 2016;378:33-37. [PubMed] [DOI] |
| 31. | Farinati F, Vitale A, Spolverato G, Pawlik TM, Huo TL, Lee YH, Frigo AC, Giacomin A, Giannini EG, Ciccarese F, Piscaglia F, Rapaccini GL, Di Marco M, Caturelli E, Zoli M, Borzio F, Cabibbo G, Felder M, Sacco R, Morisco F, Biasini E, Foschi FG, Gasbarrini A, Svegliati Baroni G, Virdone R, Masotto A, Trevisani F, Cillo U; ITA. LI.CA study group. Development and Validation of a New Prognostic System for Patients with Hepatocellular Carcinoma. PLoS Med. 2016;13:e1002006. [PubMed] [DOI] |
| 32. | Clermont PL, Sun L, Crea F, Thu KL, Zhang A, Parolia A, Lam WL, Helgason CD. Genotranscriptomic meta-analysis of the Polycomb gene CBX2 in human cancers: initial evidence of an oncogenic role. Br J Cancer. 2014;111:1663-1672. [PubMed] [DOI] |
| 33. | Rui X, Shao S, Wang L, Leng J. Identification of recurrence marker associated with immune infiltration in prostate cancer with radical resection and build prognostic nomogram. BMC Cancer. 2019;19:1179. [PubMed] [DOI] |
| 34. | Tian F, Lu B, Chen Z, Liu J, Ji D, Li J, Tang M, Zhu W, Li J. Microbial antigens-loaded myeloma cells enhance Th2 cell proliferation and myeloma clonogenicity via Th2-myeloma cell interaction. BMC Cancer. 2019;19:1246. [PubMed] [DOI] |
| 35. | Miao Y, Wang J, Li Q, Quan W, Wang Y, Li C, Wu J, Mi D. Prognostic value and immunological role of PDCD1 gene in pan-cancer. Int Immunopharmacol. 2020;89:107080. [PubMed] [DOI] |
| 36. | Darvin P, Toor SM, Sasidharan Nair V, Elkord E. Immune checkpoint inhibitors: recent progress and potential biomarkers. Exp Mol Med. 2018;50:1-11. [PubMed] [DOI] |
| 37. | Yang Z, Tao Y, Xu X, Cai F, Yu Y, Ma L. Bufalin inhibits cell proliferation and migration of hepatocellular carcinoma cells via APOBEC3F induced intestinal immune network for IgA production signaling pathway. Biochem Biophys Res Commun. 2018;503:2124-2131. [PubMed] [DOI] |
| 38. | Pan X, Yang W, Chen Y, Tong L, Li C, Li H. Nomogram for predicting the overall survival of patients with inflammatory breast cancer: A SEER-based study. Breast. 2019;47:56-61. [PubMed] [DOI] |
| 39. | Jeong SH, Kim RB, Park SY, Park J, Jung EJ, Ju YT, Jeong CY, Park M, Ko GH, Song DH, Koh HM, Kim WH, Yang HK, Lee YJ, Hong SC. Nomogram for predicting gastric cancer recurrence using biomarker gene expression. Eur J Surg Oncol. 2020;46:195-201. [PubMed] [DOI] |
| 40. | Dong D, Fang MJ, Tang L, Shan XH, Gao JB, Giganti F, Wang RP, Chen X, Wang XX, Palumbo D, Fu J, Li WC, Li J, Zhong LZ, De Cobelli F, Ji JF, Liu ZY, Tian J. Deep learning radiomic nomogram can predict the number of lymph node metastasis in locally advanced gastric cancer: an international multicenter study. Ann Oncol. 2020;31:912-920. [PubMed] [DOI] |