修回日期: 2021-05-24
接受日期: 2021-07-07
在线出版日期: 2021-08-28
龙胆苦苷(gentiopicroside, GPS)属于环烯醚萜苷类单体化合物, 可抑制肺癌和卵巢癌等肿瘤细胞的恶性行为,但其能否抑制胃癌细胞恶性行为还未知. 本研究假设GPS能够通过调控微小RNA-34c-5p(microRNA-34c-5p, miR-34c-5p)/X盒结合蛋白1(X-box binding protein-1, XBP1)轴抑制胃癌细胞恶性行为.
探讨GPS对胃癌细胞HGC-27增殖、迁移和侵袭的影响及可能机制.
体外培养HGC-27细胞, 分为对照组、不同剂量(6、30、150 μg/mL)GPS组、miR-34c-5p组、miR-NC组、150 μg/mL GPS+anti-miR-34c-5p组和150 μg/mL GPS+anti-miR-NC组, 细胞计数试剂盒-8(cell counting kit-8, CCK-8)法检测细胞增殖, Transwell检测细胞迁移和侵袭, 实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction, RT-qPCR)检测细胞中miR-34c-5p表达, 蛋白质印迹法检测细胞中XBP1蛋白表达. 双荧光素酶报告基因实验验证miR-34c-5p和XBP1靶向调控关系.
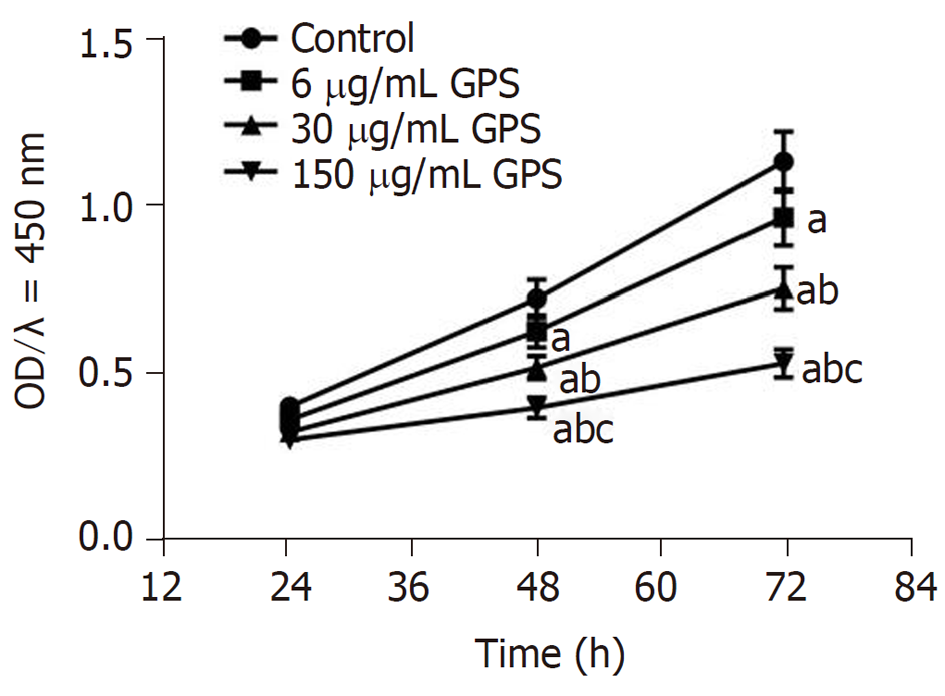
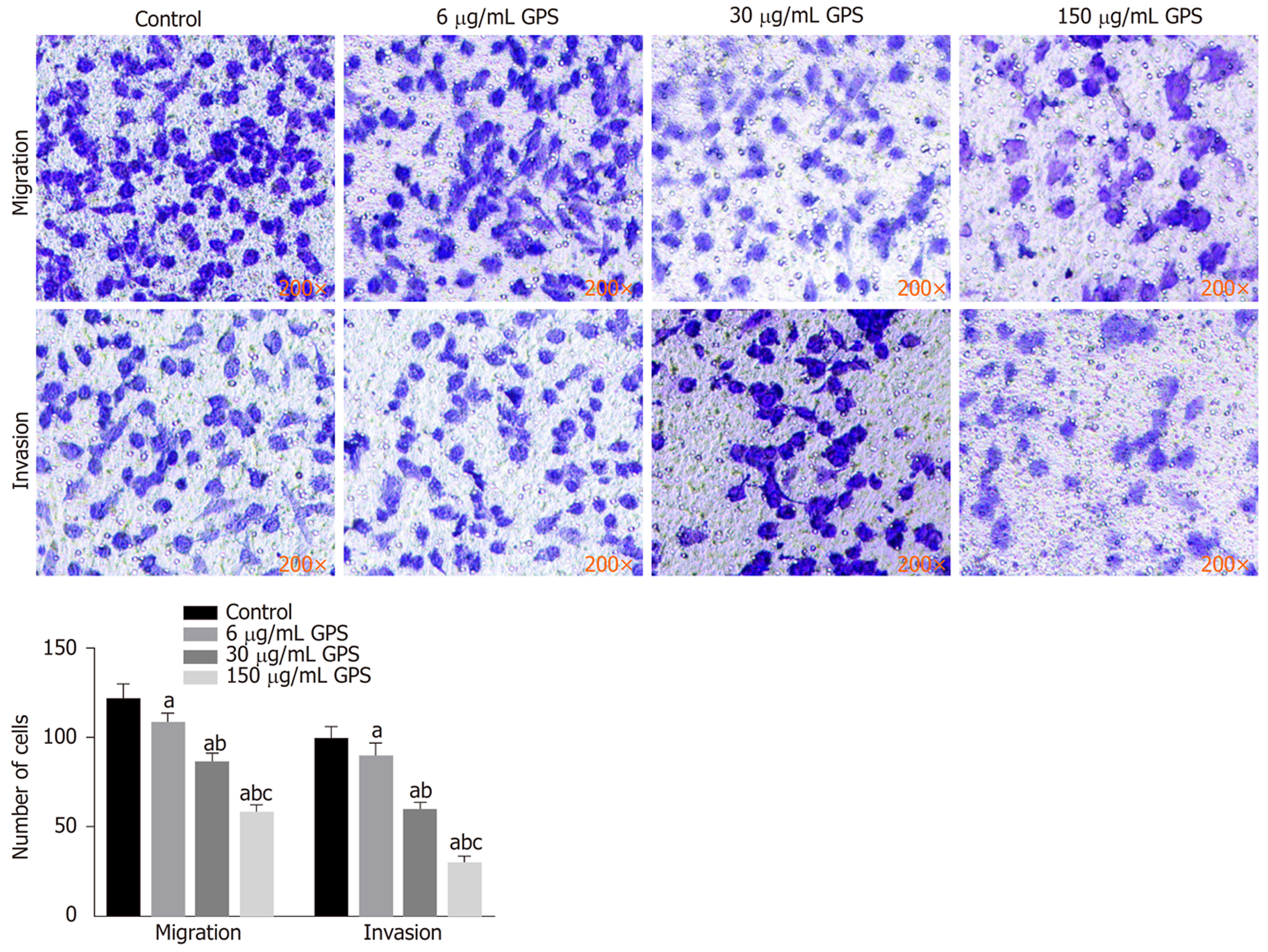
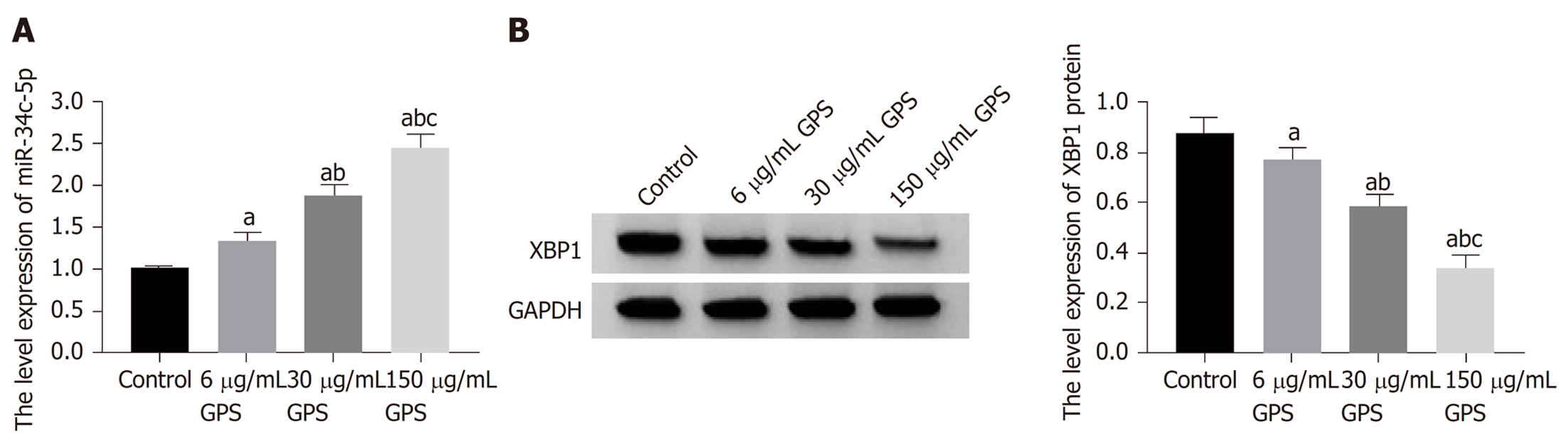
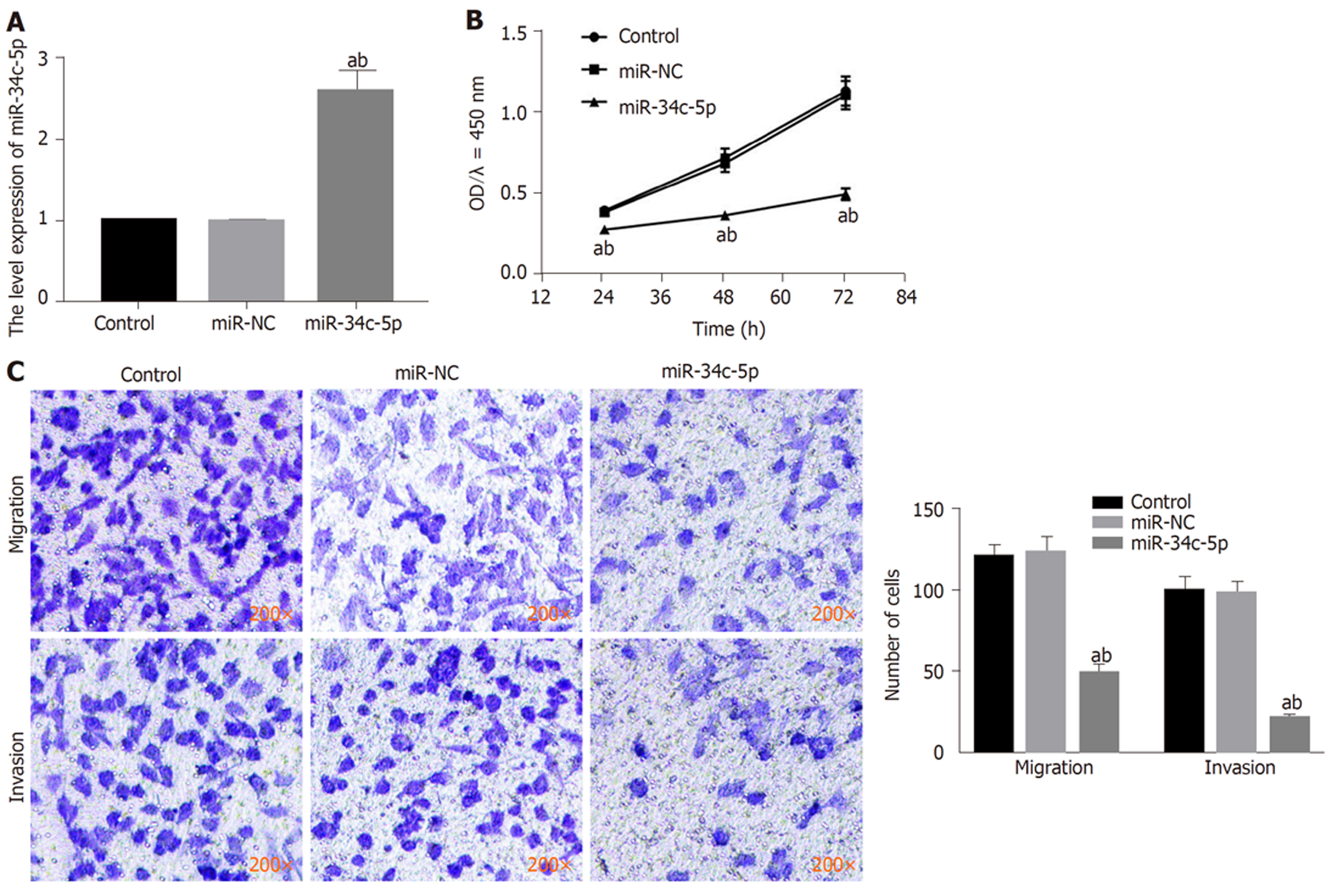
与对照组比较, 不同剂量(6、30、150 μg/mL)GPS组HGC-27细胞活性、迁移数和侵袭数及细胞中XBP1蛋白表达均降低(P<0.05), miR-34c-5p表达升高(P<0.05). miR-34c-5p组HGC-27细胞活性、迁移数和侵袭数及细胞中XBP1蛋白表达均低于对照组和miR-NC组(P<0.05). miR-34c-5p靶向负调控XBP1. 与150 μg/mL GPS组或150 μg/mL GPS+anti-miR-NC组比较, 150 μg/mL GPS+anti-miR-34c-5p组HGC-27细胞活性、迁移数和侵袭数及细胞中XBP1蛋白表达均升高(P<0.05).
龙胆苦苷可抑制胃癌细胞HGC-27增殖、迁移和侵袭, 其作用机制可能调控miR-34c-5p/XBP1轴有关.
核心提要: 龙胆苦苷可能通过上调细胞中微小RNA-34c-5p(microRNA-34c-5p, miR-34c-5p)进而抑制X盒结合蛋白1(X-box binding protein-1, XBP1)的表达来阻碍胃癌细胞HGC-27增殖、迁移和侵袭.
引文著录: 周为东, 徐镇杰, 蒉乙文. 龙胆苦苷通过调控miR-34c-5p/XBP1轴抑制作胃癌细胞HGC-27增殖、迁移和侵袭的分子机制研究. 世界华人消化杂志 2021; 29(16): 926-933
Revised: May 24, 2021
Accepted: July 7, 2021
Published online: August 28, 2021
Gentiopicroside (GPS) is a monomer compound of iridoid glycoside, which can inhibit the malignant behavior of lung cancer and ovarian cancer cells, but it is unknown whether it can inhibit the malignant behavior of gastric cancer cells. We hypothesized that GPS could inhibit the malignant behavior of gastric cancer cells by regulating the microRNA-34c-5p(miR-34c-5p)/X-box binding protein-1 (XBP1) axis.
To explore the effect of GPS on the proliferation, migration, and invasion of gastric cancer cells HGC-27 and the possible mechanism.
HGC-27 cells were cultured in vitro and divided into a control group, low-, medium-, and high-dose GPS groups (6, 30, and 150 μg/mL, respectively), a miR-34c-5p group, a miR-NC group, a 150 μg/mL GPS + anti-miR-34c-5p group, and a 150 μg/mL GPS + anti-miR-NC group. Cell counting kit-8 (CCK-8) method was used to detect cell proliferation; cell migration and invasion were detected by Transwell assay; real-time quantitative polymerase chain reaction (RT-PCR) was used to detect the expression of miR-34c-5p. The expression of XBP1 protein in cells was detected by Western blot. The dual luciferase reporter gene assay was used to verify the targeted relationship between miR-34c-5p and XBP1.
Compared with the control group, the cell viability, the number of migrated cells, the number of invaded cells, and the expression of XBP1 protein in the GPS groups (6, 30, and 150 μg/mL) were significantly reduced (P < 0.05), but the expression of miR-34c-5p was significantly increased (P < 0.05). The cell viability, the number of migrated cells, the number of invaded cells, and the expression of XBP1 protein in the miR-34c-5p group were significantly lower than those in the control group and miR-NC group (P < 0.05). miR-34c-5p could regulate the expression of XBP1. Compared with the 150 μg/mL GPS group or 150 μg/mL GPS + anti-miR-NC group, the viability of HGC-27 cells, the number of migrated cells, the number of invaded cells, and the expression of XBP1 protein in the 150 μg/mL GPS + anti-miR-34c-5p group were significantly increased (P < 0.05).
Gentiopicroside inhibits the proliferation, migration, and invasion of gastric cancer cells via mechanisms that may be related to the regulation of the miR-34c-5p/XBP1 axis.
- Citation: Zhou WD, Xu ZJ, Kui YW. Gentiopicroside inhibits proliferation, migration, and invasion of gastric cancer HGC-27 cells by regulating miR-34c-5p/XBP1 axis. Shijie Huaren Xiaohua Zazhi 2021; 29(16): 926-933
- URL: https://www.wjgnet.com/1009-3079/full/v29/i16/926.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i16.926
胃癌发病率呈增长趋势, 严重威胁人类生命健康[1]. 目前, 胃癌的治疗缺乏有效的药物. 龙胆苦苷(gentiopicroside, GPS)主要存在于龙胆草、秦艽等龙胆科龙胆属植物中, 属于环烯醚萜苷类单体化合物, 具有治疗风湿、抗肝损伤及抗炎等功效[2,3]. 研究显示, 龙胆苦苷还发挥一定的抗肿瘤作用. 钟春蕾等[4]研究显示, 龙胆苦苷可抑制非小细胞肺癌A549细胞分泌炎症因子及细胞侵袭和上皮间质转化, 发挥抗肺癌作用. 陈杰等[5]研究显示, 龙胆苦苷对卵巢癌SKOV3细胞氧化应激和细胞凋亡起促进作用, 其可能通过抑制Nrf2通路发挥抗卵巢癌作用. 然而, 龙胆苦苷对胃癌的影响尚未见报道.
微小RNA-34c-5p(microRNA-34c-5p, miR-34c-5p)属于微小RNA(microRNA, miRNA), 其在在结肠癌[6]、骨肉瘤[7]和鼻咽癌[8]等肿瘤中表达降低, 上调miR-34c-5p表达能够抑制肿瘤细胞的恶性表型, 进而对肿瘤的发展进程起抑制作用. 有报道称, miR-34c-5p在紫杉醇耐药的胃癌细胞中表达下调, 过表达miR-34c-5p可增加对紫杉醇耐药的胃癌细胞的化学敏感性[9]. 然而, miR-34c-5p对胃癌细胞恶性表型的影响还未知. Starbase靶基因预测软件显示, X盒结合蛋白1(X-box binding protein-1, XBP1)可能是miR-34c-5p的靶基因. XBP1是有一种转录调节因子, 参与细胞内质网应激, 可促进肿瘤细胞细胞活性. 有报道称, XBP1在胃癌组织中表达升高, 敲减其表达可降低胃癌细胞的增殖、迁移和侵袭能力[10]. 因此, 本研究主要观察了龙胆苦苷对胃癌细胞HGC-27增殖、迁移和侵袭的影响, 并基于miR-34c-5p/XBP1轴探讨了龙胆苦苷影响HGC-27细胞增殖、迁移和侵袭的分子机制, 以期为其用于胃癌的治疗提供一定的实验依据.
HGC-27细胞系, 中国科学院上海细胞库; 龙胆苦苷, 纯度>98%, 成都普菲德生物技术有限公司; RPMI 1640培养液、细胞计数试剂盒-8(cell counting kit-8, CCK-8)试剂盒、双荧光素酶活性检测试剂盒和二喹啉甲酸(bicinchoninicacid, BCA)蛋白检测试剂盒, 北京索莱宝; LipofectamineTM 2000试剂盒, 美国Invitrogen公司; miR-34c-5p抑制剂(anti-miR-34c-5p)和阴性对照序列(anti-miR-NC)、miR-34c-5p模拟物(mimics)和模拟对照序列(miR-NC), 上海吉玛制药技术; 胎牛血清(fetal bovine serum, FBS), 杭州四季青; RNA抽提试剂盒、逆转录试剂盒和PCR试剂盒, 大连宝生物; 兔抗人XBP1和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体, 美国Santa Cruz公司.
1.2.1 细胞培养和转染: 复苏HGC-27细胞, 加含10% FBS的RPMI 1640培养液培养. 取对数期HGC-27细胞接种至6孔板中(2.5×105个/孔), 培养12 h后, 弃培养基. 用LipofectamineTM 2000脂质体法, 分别转染miR-34c-5p mimics、miR-NC、anti-miR-34c-5p和anti-miR-NC至HGC-27细胞. 转染6 h后, 更换为含10% FBS的RPMI 1640培养液, 再培养24 h, 收集细胞, 实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction, RT-qPCR)检测细胞中miR-34c-5p表达验证转染效果, 并用于后续实验.
1.2.2 细胞分组处理: HGC-27细胞分为对照组和不同剂量(6、30、150 μg/mL)GPS组, 其中对照组细胞用含10% FBS的RPMI 1640培养液培养, 不同剂量(6、30、150 μg/mL)GPS组细胞分别用含6、30、150 μg/mL[11]GPS和10% FBS的RPMI 1640培养液培养. 转染miR-34c-5p、miR-NC的HGC-27细胞处理同对照组, 分别记为miR-34c-5p组、miR-NC组. 转染anti-miR-34c-5p和anti-miR-NC的HGC-27细胞处理同150 μg/mL GPS组, 分别记为150 μg/mL GPS+anti-miR-34c-5p组和150 μg/mL GPS+anti-miR-NC组.
1.2.3 CCK-8法检测细胞增殖: 将HGC-27细胞及转染miR-34c-5p mimics、miR-NC、anti-miR-34c-5p和anti-miR-NC的HGC-27细胞均接种至96孔板中(2.5×104个/孔), 培养4 h后, 弃培养液, 按1.2.2分组处理. 培养一定时间(24 h、48 h和72 h)后, 加10 μL CCK-8. 孵育2 h, 酶标仪(λ = 450 nm)测光密度(optical density, OD)值.
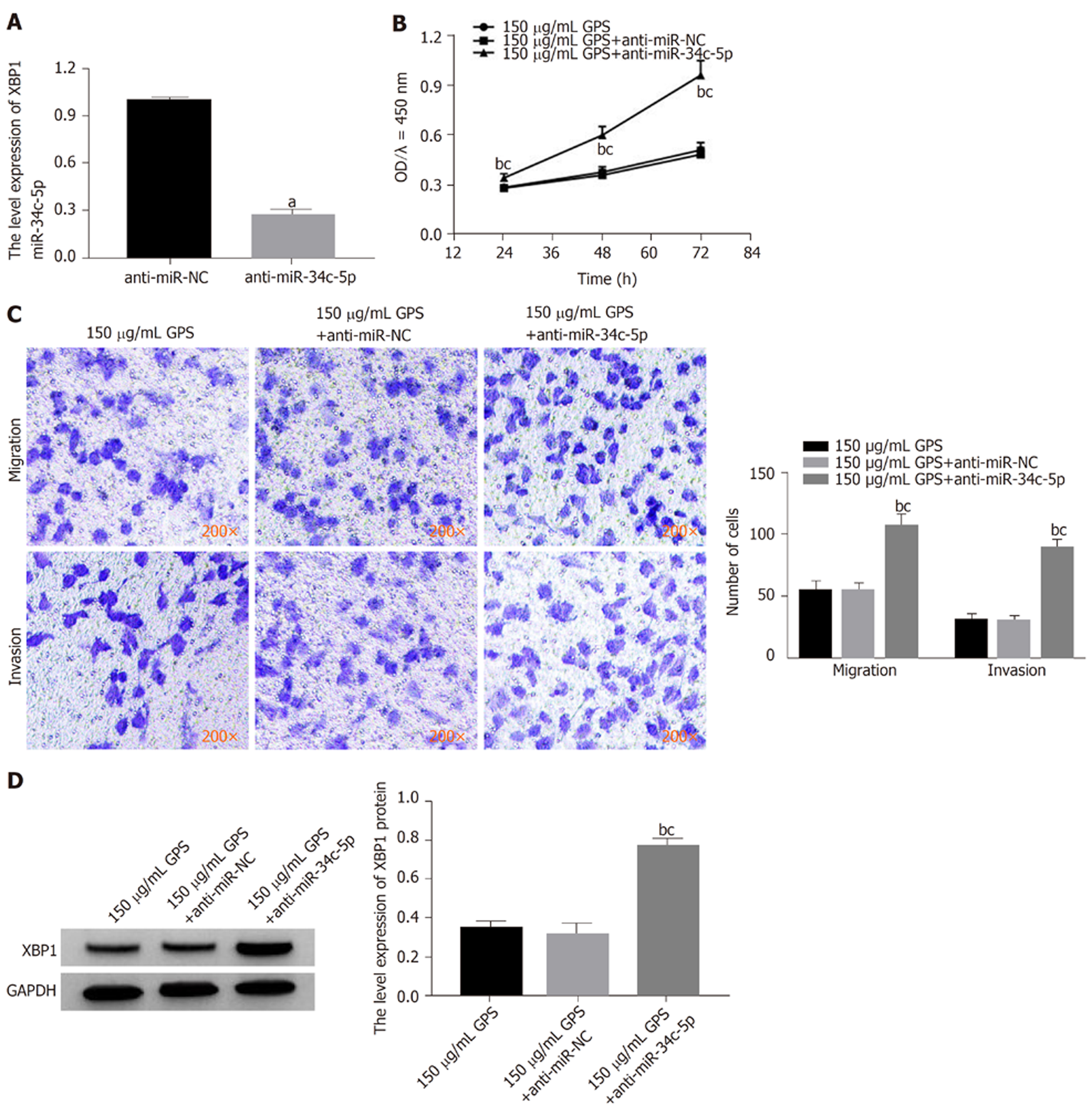
1.2.4 Transwell检测细胞迁移和侵袭: 将HGC-27细胞及转染miR-34c-5p mimics、miR-NC、anti-miR-34c-5p和anti-miR-NC的HGC-27细胞均接种至6孔板中(1.0×105个/孔), 培养4 h后, 弃培养液, 按1.2.2分组处理. 培养24 h后, 收集各组细胞. 迁移实验: 将Transwell小室置于24孔板中, 将收集的各组细胞悬液分别加至上室(5.0×104个/孔), 下室加500 μL培养液. 培养24 h后, 弃培养液, 用多聚甲醛固定、结晶紫染色后, 显微镜观察, 计数. 侵袭实验: 在Transwell小室上室铺适量厚度的基质胶, 晾干后, 加各组细胞悬液(5.0×104个/孔), 后续操作同迁移实验.
1.2.5 RT-qPCR检测细胞中miR-34c-5p表达: 将HGC-27细胞及转miR-34c-5p mimics、miR-NC、anti-miR-34c-5p和anti-miR-NC的HGC-27细胞均接种至6孔板中(1.0×105个/孔), 培养4 h后, 弃培养液, 按1.2.2分组处理. 培养24 h后, 用miRNA抽提试剂盒提取细胞中总RNA. 经转录后, 行PCR扩增. 引物序列: miR-34c-5p上游5'-GCTGCTGTAGGCAGTGTAGTTAG-3', 下游5'-CTCAACTGGTGTCGTGGAGTC-3'; U6上游5'-CTCGCTTCGGCAGCAA-3', 下游5'-AACGCTTCACGAATTGCGT-3'. 2-△△Ct法计算miR-34c-5p相对U6的表达量.
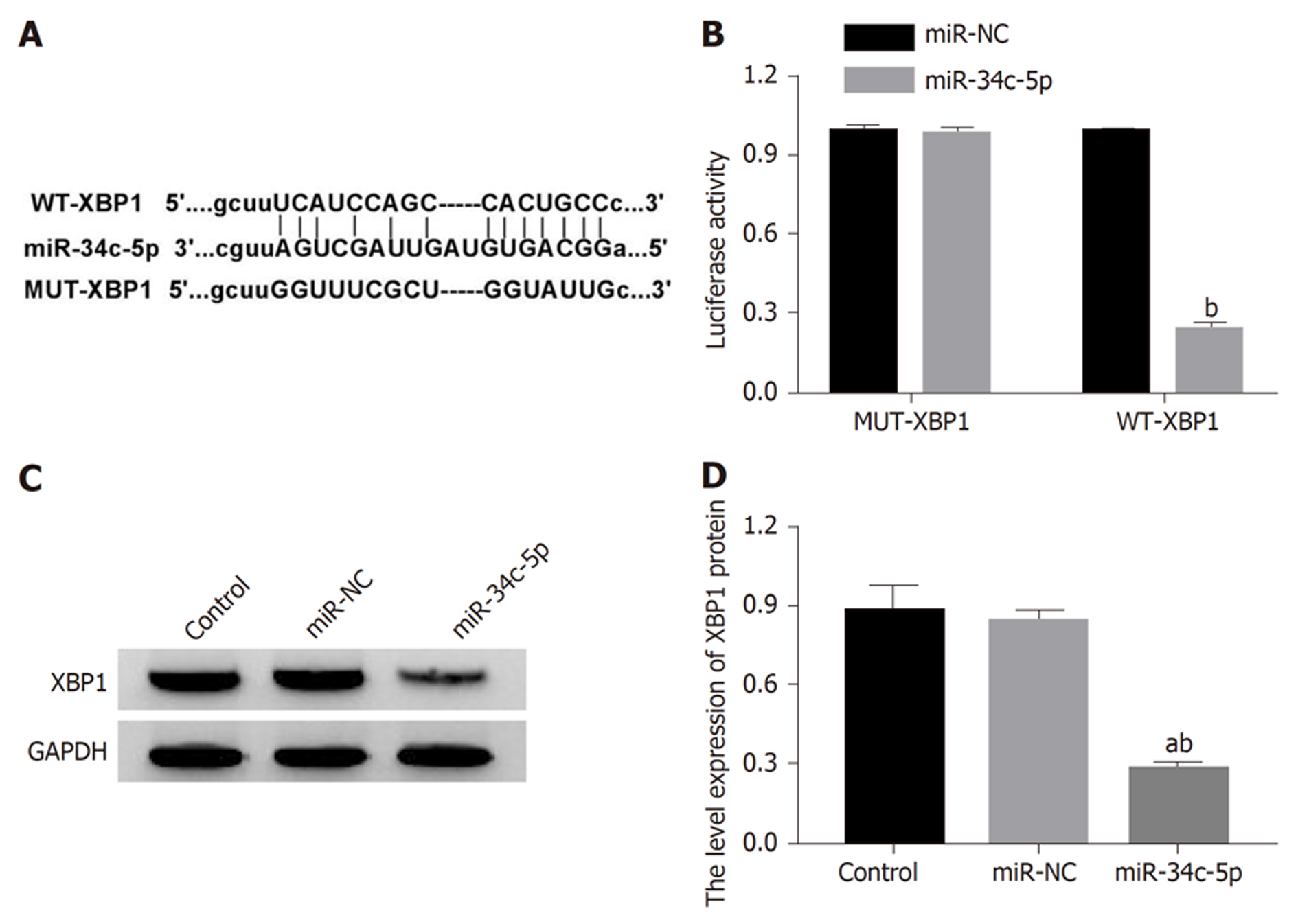
1.2.6 蛋白质印迹法检测XBP1蛋白表达: 将HGC-27细胞及转miR-34c-5p mimics、miR-NC、anti-miR-34c-5p和anti-miR-NC的HGC-27细胞均接种至6孔板中(1.0×105个/孔), 培养4 h后, 弃培养液, 按1.2.2分组处理. 培养24 h后, 用RIPA试剂提取细胞中总蛋白, 并用BCA试剂盒对蛋白样品定量. 然后电泳、转膜及封闭后, 分别于XBP1(1:500)和GAPDH(1:1000)一抗孵育液4 ℃孵育过夜, 洗膜后, 再于山羊抗兔二抗(1:2000)孵育液中37 ℃孵育1 h. 加显影液避光显影, 拍照, Image J软件进行灰度分析, 以XBP1与GAPDH灰度值的比值表示XBP1表达量.
1.2.7 双荧光素酶报告基因实验: 将HGC-27细胞接种至6孔板中(2.5×105个/孔), 培养12 h后, 弃培养液. 用LipofectamineTM 2000脂质体法, 分别共转染WT-XBP1与miR-34c-5p mimics、WT-XBP1与miR-NC、MUT-XBP1与miR-34c-5p mimics、或MUT-XBP1与miR-NC至HGC-27细胞. 转染6 h后, 更换为含10% FBS的RPMI 1640培养液, 再培养24 h, 收集细胞, 加裂解液进行裂解. 离心(3500 r/min、10 min)后, 取上清, 检测荧光素酶活性.
统计学处理 SPSS 22.0软件分析实验数据. 计量资料以均数±标准差(mean±SD)表示, 两组间比较行独立样本t检验; 多组间比较用单因素方差分析, 进一步两组间比较用LSD-t检验. 以P<0.05表示差异有统计学意义.
与对照组比较, 胃癌细胞HGC-27经不同剂量(6、30、150 μg/mL)龙胆苦苷干预后, 细胞活性明显降低(P<0.05), 且呈剂量依赖性(图1).
与对照组比较, 胃癌细胞HGC-27经不同剂量(6、30、150 μg/mL)龙胆苦苷干预后, 细胞迁移数和侵袭数均明显降低(P<0.05), 且呈剂量依赖性(图2).
与对照组比较, 胃癌细胞HGC-27经不同剂量(6、30、150 μg/mL)龙胆苦苷干预后, 细胞中miR-34c-5p表达升高(P<0.05), XBP1蛋白表达明显降低(P<0.05), 且呈剂量依赖性(图3).
与对照组或miR-NC组比较, miR-34c-5p组HGC-27细胞中miR-34c-5p表达明显升高(P<0.05), 表明过表达miR-34c-5p的HGC-27细胞构建成功. miR-34c-5p组胃癌细胞HGC-27活性、迁移数和侵袭数均明显低于对照组或miR-NC组(P<0.05)(图4).
Starbase靶基因在线软件预测显示的miR-34c-5p与XBP1的结合位点见图5A. 双荧光素酶报告基因实验结果显示, miR-34c-5p与WT-XBP1共转染后的胃癌细胞HGC-27荧光素酶活性显著降低(P<0.05), 而与MUT-XBP1共转染后的胃癌细胞HGC-27荧光素酶活性无明显变化(P>0.05), 提示miR-34c-5p可与XBP1靶向结合(图5B). 与对照组或miR-NC组比较, miR-34c-5p组胃癌细胞HGC-27中XBP1蛋白表达降低(P<0.05)(图5C).
与转染anti-miR-NC的胃癌细胞HGC-27比较, 转染anti-miR-34c-5p的胃癌细胞HGC-27中miR-34c-5p表达明显降低(P<0.05), 表明敲减miR-34c-5p的HGC-27细胞构建成功; 与150 μg/mL GPS组或150 μg/mL GPS+anti-miR-NC组比较, 150 μg/mL GPS+anti-miR-34c-5p组胃癌细胞HGC-27活性、迁移数和侵袭数及细胞中XBP1蛋白表达均明显升高(P<0.05), 表明敲减miR-34c-5p可降低龙胆苦苷对胃癌细胞HGC-27增殖、迁移和侵袭及XBP1蛋白表达的抑制作用(图6).
近年来, 中草药或天然植物及其活性成分在肿瘤治疗中的作用备受关注. 龙胆苦苷是龙胆草、秦艽等龙胆科龙胆属植物的主要活性成分, 具有多种药理活性. 研究显示, 龙胆苦苷可抑制肝癌细胞增殖, 并阻滞肝癌细胞的细胞周期进程[12]; 龙胆苦苷可阻碍人上皮性卵巢癌HO8910细胞增殖和迁移, 并促进HO8910细胞凋亡, 其可能通过激活P38丝裂原活化蛋白激酶M信号通路发挥作用[13]. 本研究将不同剂量(6、30、150 μg/mL)的龙胆苦苷作用于胃癌细胞HGC-27, 首次探究了龙胆苦苷对胃癌细胞增殖、迁移和侵袭的影响, 结果显示, 龙胆苦苷可呈剂量依赖性降低胃癌细胞HGC-27的增殖、迁移和侵袭能力, 提示其具有治疗胃癌的潜在价值.
miRNA是一类小分子非编码RNA, 其可靶向靶基因的表达参与调控肿瘤细胞增殖、迁移和侵袭等恶性表型, 为肿瘤的治疗提供了分子靶点[14]. 研究显示, miR-34c-5p在骨肉瘤组织和细胞中表达降低, 过表达miR-34c-5p可通过靶向抑制脂筏标记蛋白-2(flotillin-2, FLOT2)削弱骨肉瘤细胞的增殖、迁移和侵袭能力, 是骨肉瘤治疗的潜在分子靶点[15]. 本研究通过将miR-34c-5p模拟物转染至胃癌细胞HGC-27中, 观察了过表达miR-34c-5p对HGC-27细胞增殖、迁移和侵袭的影响, 结果显示, 过表达miR-34c-5p可显著降低HGC-27细胞的增殖、迁移和侵袭能力, 提示miR-34c-5p也可能成为胃癌治疗的分子靶点. 本研究结果还显示, 龙胆苦苷可呈剂量依赖性促进胃癌细胞中miR-34c-5p的表达, 而敲减miR-34c-5p降低了龙胆苦苷对胃癌细胞增殖、迁移和侵袭的抑制作用, 提示龙胆苦苷可能通过上调细胞中miR-34c-5p表达来抑制胃癌细胞增殖、迁移和侵袭.
为了进一步探究龙胆苦苷可能通过上调细胞中miR-34c-5p表达来抑制胃癌细胞增殖、迁移和侵袭的分子机制, 本研究证实了XBP1是miR-34c-5p的靶基因, 且过表达miR-34c-5p抑制胃癌细胞中XBP1蛋白表达. XBP1参与调控细胞增殖、凋亡、转移及耐药, 其过度表达可导致肿瘤发生及促进肿瘤进展[16]. 本研究结果还显示, 龙胆苦苷可抑制胃癌细胞中XBP1蛋白表达, 而敲减miR-34c-5p降低龙胆苦苷对胃癌细胞中XBP1蛋白表达的抑制作用, 进一步提示龙胆苦苷可能通过调控miR-34c-5p/XBP1轴来影响胃癌细胞增殖、迁移和侵袭.
综上, 龙胆苦苷对胃癌细胞HGC-27的增殖、迁移和侵袭具有一定的抑制作用, 其作用机制可能与上调细胞中miR-34c-5p表达进而抑制XBP1蛋白表达有关, 具有治疗胃癌的潜在价值. 但本研究仅通过体外单细胞进行了探究, 还需要增加细胞种类及进一步通过裸鼠移植瘤实验在体内验证龙胆苦苷对胃癌发生发展的影响和机制.
胃癌发病隐匿, 治疗疗效不佳, 寻找用于胃癌治疗的药物尤为重要. 龙胆苦苷(gentiopicroside, GPS)具有抗肝癌、肺癌和卵巢癌功效, 但其能否发挥抗胃癌作用还未知. 本研究探究GPS对胃癌细胞HGC-27增殖、迁移和侵袭的影响及可能机制, 为其用于胃癌的治疗提供一定的实验依据.
观察GPS对胃癌细胞HGC-27增殖、迁移和侵袭的影响及其能否通过调控微小RNA-34c-5p(microRNA-34c-5p, miR-34c-5p)/X盒结合蛋白1(X-box binding protein-1, XBP1)轴发挥作用, 以探究GPS是否具有抗胃癌作用及其可能的机制.
本研究主要是为了明确GPS能否通过调控miR-34c-5p/XBP1轴影响胃癌细胞HGC-27的增殖、迁移和侵袭能力, 并进一步通过裸鼠移植瘤实验在体内验证GPS对胃癌发生发展的影响, 以期为胃癌治疗药物的研发提供新途径.
本研究采用细胞计数试剂盒-8(cell counting kit-8, CCK-8)法、Transwell、实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction, RT-qPCR)、蛋白质印迹法依次检测了细胞增殖、迁移和侵袭、细胞中miR-34c-5p表达、XBP1蛋白表达. 此外, 用双荧光素酶报告基因实验验证了miR-34c-5p和XBP1靶向调控关系.
本实验结果表明, 一定浓度的GPS可降低胃癌细胞HGC-27的增殖、迁移和侵袭能力, 其作用机制可能与上调细胞中miR-34c-5p表达进而抑制XBP1表达有关.
本研究首次发现, GPS可在一定程度上抑制胃癌细胞HGC-27增殖、迁移和侵袭, 且作用机制与调控miR-34c-5p/XBP1轴有关, 具有治疗胃癌的潜在价值.
本研究仅通体外细胞实验进行了初步探究, 尚需进一步在体内验证GPS对胃癌发生发展的影响和机制. 通过探究GPS对胃癌发生发展的影响可能为胃癌治疗药物的研发提供新途径.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Wang Z, Liu Q, Huang P, Cai G. miR-299-3p suppresses cell progression and induces apoptosis by downregulating PAX3 in gastric cancer. Open Life Sci. 2021;16:266-276. [PubMed] [DOI] |
| 3. | 谢 小倩, 李 贺, 王 亚乐, 刘 晶晶, 万 志杰, 罗 沙沙, 赵 则月, 李 晓天. 龙胆苦苷对佐剂性关节炎大鼠的抗炎作用. 中国实验方剂学杂志. 2020;26:66-71. [DOI] |
| 6. | Wan Y, Shen A, Qi F, Chu J, Cai Q, Sferra TJ, Peng J, Chen Y. Pien Tze Huang inhibits the proliferation of colorectal cancer cells by increasing the expression of miR-34c-5p. Exp Ther Med. 2017;14:3901-3907. [PubMed] [DOI] |
| 7. | Shen Y, Xu J, Pan X, Zhang Y, Weng Y, Zhou D, He S. LncRNA KCNQ1OT1 sponges miR-34c-5p to promote osteosarcoma growth via ALDOA enhanced aerobic glycolysis. Cell Death Dis. 2020;11:278. [PubMed] [DOI] |
| 8. | Xu X, Yan H, Zhang L, Liu J, Huang Y, Cheng H. Up-regulation of miR-34c-5p inhibits nasopharyngeal carcinoma cells by mediating NOTCH1. Biosci Rep. 2020;40. [PubMed] [DOI] |
| 9. | Wu H, Huang M, Lu M, Zhu W, Shu Y, Cao P, Liu P. Regulation of microtubule-associated protein tau (MAPT) by miR-34c-5p determines the chemosensitivity of gastric cancer to paclitaxel. Cancer Chemother Pharmacol. 2013;71:1159-1171. [PubMed] [DOI] |
| 11. | 孟 松, 周 耀柱, 马 永超, 徐 松涛, 金 少举. 龙胆苦苷对人胰腺癌细胞PANC-1凋亡及IL-6/JAK2/STAT3信号通路的影响. 中国药房. 2020;31:1836-1841. [DOI] |
| 13. | 高 天勤, 李 欣, 董 圣军, 程 春雷, 史 荣军, 贾 龙, 王 健, 刘 宝辉. 龙胆苦苷对人上皮性卵巢癌细胞增殖、凋亡、迁移的影响及机制. 山东医药. 2019;59:22-25. [DOI] |
| 14. | Kang J, Huang X, Dong W, Zhu X, Li M, Cui N. MicroRNA-1269b inhibits gastric cancer development through regulating methyltransferase-like 3 (METTL3). Bioengineered. 2021;12:1150-1160. [PubMed] [DOI] |
| 15. | Wang Y, Wang X, Tang J, Su X, Miao Y. The study of mechanism of miR-34c-5p targeting FLOT2 to regulate proliferation, migration and invasion of osteosarcoma cells. Artif Cells Nanomed Biotechnol. 2019;47:3559-3568. [PubMed] [DOI] |