修回日期: 2021-04-14
接受日期: 2021-05-11
在线出版日期: 2021-08-28
随着药物的大量使用, 加之新的药物又不断开发与应用, 药物性肝损伤的发病率一直居高不下. 有关药物性肝损伤的发病机制目前尚未完全明了, 因此, 在治疗上也无重大突破. 药物性肝损伤的诊断仍依靠用药史、临床、影像检查、生化检测和肝活检. 本文旨在对药物性肝损伤的发病率与分类、发病风险因素、血清标志物的近年进展进行介绍与评述.
核心提要: 特异性药物性肝损伤(drug-induced liver injury, IDILI)是一种罕见但可能危及生命的事件, 其原因是药物在通常的治疗剂量下, 在大多数接受治疗的患者中不会引起任何肝损伤的生化或临床证据. IDILI最常见的临床表型是"急性肝炎"、"混合性肝细胞胆汁淤积性肝炎"和"胆汁淤积性肝炎", 这些都是通过临床、生化和组织学特征来区分的. 抗微生物药、草药和膳食补充剂现在是药物性肝损伤中最常涉及的原因. 现已有几个量表被用来描述IDILI事件的严重性. 但目前尚无可靠的方法来准确预测IDILI事件的过程. 在临床试验中, "金标准"的肝脏安全信号是"海氏病例"的发生. 迄今为止, 药物性肝损伤在诊断(对乙酰氨基酚-半胱氨酸蛋白加合物)、预测(遗传生物标记物)和预后(microRNA-122、高迁移率族蛋白盒1、角蛋白-18、谷氨酸脱氢酶、线粒体DNA)的生物标记物的鉴定方面取得了进展. 其中许多生物标志物也提供了机制上的见解. 在治疗上近年无重大突破.
引文著录: 池肇春. 药物性肝损伤研究现状与进展. 世界华人消化杂志 2021; 29(16): 915-925
Revised: April 14, 2021
Accepted: May 11, 2021
Published online: August 28, 2021
The incidence rate of drug-induced liver injury has been high with the extensive use of drugs and the development and application of new drugs. The pathogenesis of drug-induced liver injury is not fully understood, so there is no significant breakthrough in its treatment. The diagnosis of drug-induced liver injury still depends on drug history, clinical manifestations, imaging, biochemical tests, and liver biopsy. This article reviews the recent progress in the understanding of the incidence rate, classification, risk factors, and serum markers of drug-induced liver injury.
- Citation: Chi ZC. Research status and progress of drug induced liver injury. Shijie Huaren Xiaohua Zazhi 2021; 29(16): 915-925
- URL: https://www.wjgnet.com/1009-3079/full/v29/i16/915.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i16.915
药物是人类为预防、诊断或治疗疾病, 或为改善生理功能和提高健康水平. 随着用药种类增多, 又常常缺乏正规的用药方法, 因此由药物引起的不良反应的发生率居高不下. 药物性肝损伤如此常见, 追究其原因除药物质量低劣外, 不合理用药是主要原因, 包括药物的滥用、误用、患者及其家属的医药素质知识水平低等. 此外还有缺乏科学管理、医德医风等社会问题. 因此加强药物管理, 提高用药的安全性, 减少不良反应的发生率势在必行. 鉴于上述原因有必要对近几年药物性肝损伤的现状和进展作一介绍和评述, 为我国做好药物性肝损伤的防治搭建一个学习平台.
我国药物不良反应发生率约占住院患者的10%-30%. 目前人类正暴露于6万种以上化学物质的威胁下, 药物性肝损伤(drug-induced liver injury, DILI)约占黄疸住院患者的2%-5%, 占所谓"急性肝炎"住院患者的10%, 占老年肝病的20%. 尽管临床上药物性肝损伤屡见不鲜, 但尚未引起人们和临床医师足够和广泛的重视. 根据《国家药品不良反应监测年度报告(2020年)》化学药品占83.0%、中药占13.4%、生物制品占1.1%、无法分类者占2.5%, 其中严重不良反应占10.6%. 不良反应事件中, 累及器官系统排名前3位依次为胃肠系统疾病、皮肤及皮下组织类疾病、疾病及给药部位各种反应. 在欧美国家DILI约占急性肝功能衰竭病因 的30%-40%, 而在美国36%的DILI为非类固醇类抗炎药引起. 据统计, 药物消化道的不良反应占全部药物不良反应的20%-40%, 药物性肝损伤的发生率仅次于皮肤、黏膜损害和药物热. 2007年年底中华医学会中华肝脏病学分会成立了药物性肝病学组, 这为我国药物性肝损伤的防治提供了组织和技术保证[1].
药物性肝损伤占肠胃内科医生所见急性肝损伤的<1%, 是美国和欧洲急性肝衰竭最常见的原因[2]. 占美国所有急性肝衰竭(acute liver failure, ALF)病例的一半以上. 根据法国和冰岛的调查, DILI的年发病率约为每10万居民14至19人[3]. DILI也是药物开发中化合物消耗的主要原因之一, 也是药物撤回、限制和项目终止的两个最常见的原因之一. 事实上很难确定DILI的真正发病率. 尽管人们对肝毒性的认识不断提高, 而且毒性较低的替代品也越来越多, 但随着处方数量和可用药物范围的增加, 肝药物反应的绝对频率似乎并未降低[4,5].
根据药物不良反应的临床药理作用的关系将药物性肝损伤分为: (1)A型不良反应(内源性肝毒素, DILI): 主要是由于药理作用过强所致, 通常与剂量有关, 可以预测停药或减量后症状很快减轻或消失, 在人群中的发生率虽高, 但死亡率低; (2)B型不良反应(特异的肝毒素, 特异性药物性肝损伤, IDILI): 是与正常药理应用完全无关的异常反应, 与剂量无关, 一般难以预测, 常规毒理学筛查难以发现, 但死亡率高. 大多数导致ALF引起的DILI病例是由于过量使用醋氨酚, 而醋氨酚被认为是一种"内在的"肝毒素. 药物所致的内在肝毒性表现为对肝细胞的直接化学损伤、较短的潜伏期和明显的剂量依赖性反应. 内源性肝毒素如果他们接受了足够的过量,虽然毒性反应的阈值可以显示出明显的个体间的差异. 但也会导致几乎所有患者的肝脏损伤.
特异的(不可预测的)药物性肝损伤(idiosyncratic drug induced liver injury, IDILI)是肝病学家面临的最具挑战性的肝脏疾病之一, 因为临床上使用了大量的药物, 可用的草药和膳食补充剂具有潜在的肝毒性, 这种疾病表现出多种临床和病理表型的能力以及目前缺乏特定的生物标志物. 这使得药物性肝损伤的诊断是一个不确定的过程, 因此, 需要对病情有高度的认识, 并仔细排除肝病的其他病因, 以取得正确的诊断. 特异性肝毒性可能是严重的, 导致特别严重的各种急性肝功能衰竭, 目前还没有有效的治疗方法[6]. IDILI只在极少数接受治疗的个体中引起重大的DILI, 发生率通常不到1/10000. 虽然罕见, 然而IDILI事件有很大的肝衰竭风险. 虽然似乎需要一个剂量阈值来诱发IDILI, 但在大多数接受治疗的患者中, 过量通常不会产生肝脏毒性[5]. 从治疗开始到IDILI发作, 往往有较长的潜伏期.
2.1.1年龄: 据报道, 严重药物不良反应(severe adverse drug reaction, ADRs)的发生率随着年龄的增长而上升. 老年人中很大一部分ADRs与剂量有关, 可能是由于年龄增长与药物清除障碍有关. 老年人也被认为是DILI的一个一般风险因素. 事实上, 从DILI大型前瞻性登记处获得的数据, 不要认为年龄越大是一个普遍的危险因素. 在西班牙DILI登记处, 46%的DILI患者在发病时≥60岁, 美国DILI报告16.6%的DILI患者为65岁或以上[5]. 然而, 冰岛一项基于人口的研究数据显示, DILI发病率随着年龄的增长而明显增加, 其中15-29岁患者的发病率为9/100000, 70岁以上患者的发病率为41/100000. 年龄对DILI感染发生率的影响与药物使用的增加是平行的, 这表明年龄本身可能不会增加DILI感染的风险, 而是老年人通常服用更多的药物所致.
然而, 年龄似乎影响了由特定病原体引起的DILI感染的风险. 回顾性数据库评估, 在美国, 377名接受异烟肼治疗的成年人发现, 35-49岁患者的肝毒性病例几乎是25-34岁患者的两倍, 50岁以上患者的肝毒性病例几乎是25-34岁患者的5倍. 有人推测, 改变的药代动力学和/或累积的线粒体功能损害可能是老年患者异烟肼相关肝损伤的发生率更高的原因[7]. 相反, 年轻似乎是丙戊酸钠诱发DILI的危险因素, 10岁以下儿童发生DILI的风险更高, 2岁以下儿童发生致命性结局的风险最高, 可能是由于与药物代谢的差异和血浆蛋白结合的减少有关.
除易感性外, 年龄似乎对DILI表型也有影响, 年轻患者更常发生肝细胞损伤, 而老年患者更容易发生胆汁淤积型损伤. 此外, 年龄越大, 发生持续性/慢性肝脏生化异常的DILI风险越高, 这可能是由于年龄越大, 组织修复功能下降所致[8,9].
2.1.2种族: 种族对个体药物反应的影响主要归因于不同种族人群中单核苷酸多态性(single-nucleotide polymorphism, SNPs)的差异. 最近的一项对列研究报告了不同种族人群中导致DILI的药物有显著差异. 在非裔美国人中, 甲氧苄啶/磺胺甲恶唑、甲基多巴和苯妥英钠更常是DILI的病因, 而在高加索人中, 阿莫西林-克拉维酸盐是一种明显较高比例的病原体[10]. 尽管这些变异可能与遗传因素有关, 但同样, 这些药物的适应证等因素也与此有关, 因为处方模式的变化可以解释不同人群之间的差异. 相反, 非裔美国人发生严重皮肤反应的频率明显高于白人, 在控制选定的协变量后, 住院率、肝移植率或肝相关死亡率也明显高于白人.
对研究药物代谢酶(drug-metabolising enzyme, DME)多态性与抗结核治疗药物性肝损伤(TBC-DIL)风险的候选基因研究结果的meta分析显示, N-乙酰基转移酶2 (N-Acetyltransferase 2, NAT2)和DILI的单核苷酸多态性及1116例DILI(定义可变)和2655名对照者慢乙酰基转移酶2(NAT2)基因型与东亚和中东血统人群患DILI的风险增加有关, 但在高加索人中未发现相关性. 相反, 最近一项涉及印度抗TBC (antituberculosis) DILI病例和药物暴露对照组的全基因组关联研究(genome-wide association study, GWAS)未发现质疑NAT2基因型在确定DILI易感性中的作用的全基因组显著信号[11]. 然而, 考虑到后一项研究涉及大量表现为黄疸和腹泻的患者因急性肝衰竭而导致死亡或肝移植, NAT2基因型可能主要影响发病的初始步骤. 因此, 在单纯肝酶升高的人群中, 它仍可能与DILI有关.
此外, 某一特定族裔群体中危险等位基因的次要等位基因频率可能解释了不同群体对某种药物继发于DILI的易感性的一些差异. HLA-DRB1*15:02等位基因仅在0.7%的高加索人群中流行, 而在南亚人群中流行率为13%-18%. 最近的一份报告已经确定HLA-DRB1*15:02-DQB1*06:01是南亚裔个体中阿莫西林-克拉维酸盐相关性暴发性肝衰竭需要肝移植的潜在危险因素. 药物性肝损伤是抗结核药物治疗的并发症, 特别是在含异烟肼的治疗方案中. 为了调查遗传危险因素, Kaliyaperumal等进行了一项全基因组关联研究(GWAS), 涉及抗结核DILI病例(55名印度人和70名欧洲人)和对照组(1199名印度人和10397名欧洲人). 大多数病例采用标准抗结核药物方案治疗, 均接受异烟肼治疗. 推测单核苷酸多态性和HLA基因型, 并对GWAS和候选基因基因型进行跨种族Meta分析. GWAS只在欧洲人身上发现了一个显著的关联(Rs117491755). HLA中HLA-B*52: 01有显着性差异. N-乙酰转移酶2 (NAT 2)的频率较低(OR为0.69, 95%CI为0.57-0.83, P = 0.01). NAT 2*6和NAT 2*7以NAT 2*6和/或NAT 2*7的纯合子为主(OR = 1.89, 95%CI: 0.84-4.22, P = 0.004). 结果认为HLA基因型对结核病药物相关性DILI的贡献很小, NAT 2的贡献是复杂的, 但与以前的研究结果一致, NAT 2*5与NAT 2*6和NAT 2*7的代谢效应存在差异[12].
2.1.3 慢性肝病: 慢性肝病可能与代谢减少和药物清除有关的假设没有强有力的证据支持. 对酒精性肝病和代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD)的研究发现, 不同DME活性的诱导、下调或无变化的结果不一致[13], 这些变异中的一些可能是由所研究的个体的不同程度的肝损伤所解释的, 而另一些则是由于所使用的方法所造成的, 然而, 还不能概括对于慢性肝病中肝功能对药物处置的影响. 最近一项涉及379名(包括128名慢性病毒性肝炎患者)接受抗结核(TBC)治疗的回顾性研究发现HCV本身或与HBV结合与DILI的发病率增加有关[14]. 研究还表明, HIV感染可使抗TBC DILI的风险增加4倍, 与HCV合并感染可使该风险增加14倍.
慢性肝病患者(16%)的死亡率明显高于无肝病患者(5.2%). 在107名慢性肝病患者(包括58名接受抗TBC治疗的肝硬化患者)队列中, 17%的患者经历过DILI, 其中24%患有慢性肝炎, 15%患有代偿性肝硬化[15].
2.2.1 剂量和肝药物代谢: 药物剂量在内源性DILI中起着至关重要的作用, DILI发生在服用过量药物的患者身上, 例如对乙酰氨基酚肝毒性. 在推荐的每日剂量药物治疗后出现特异性DILI的事实最初导致人们相信特异性DILI是一种剂量无关的反应. 1999年, Uetrecht强调了这样一个事实: 每天服用10 mg或更少的药物是很少的, 与特异性DILI的高发病率有关. 药物剂量在特异性DILI中起作用的观点首次在向瑞典药物不良反应咨询委员会报告的598例瑞典DILI病例的研究中得到证实, 发现77%的病例涉及剂量≥50 mg/天的病原体. 此后, 西班牙DILI登记处和冰岛DILI全国性研究证实了推荐剂量≥50 mg/天的病原体占优势, 在这两个队列中, 这些病原体分别占77%和88%, 也就是说, 今天大部分的药物需要>50 mg/天的剂量才能达到预期的效果. 因此, 很难确定DILI的特异性是否与高剂量有关, 或者DILI病例的高识别率是否是由于推荐剂量大于50 mg/天的药物(例如抗生素)导致的.
然而, 现在假设剂量实际上在特异性DILI中起作用, 需要超过某种形式的阈剂量才能发生反应. 然而, 这种阈值剂量可能因个体而异[16]. 这一点在DILI案例中得到了证明, 即患者对初始较低浓度的药物有耐受性, 但当需要增加剂量(仍在推荐的每日剂量范围内)以获得更好的药理作用时, 会出现DILI. 此外, 研究发现, 由每日剂量≥50 mg 的病原体诱发的DILI的潜伏期明显短于服用低剂量药物诱发的DILI[17].
除了剂量, 肝脏药物代谢被认为影响药物的肝毒性潜力. 大多数药物都需要某种形式的生物转化才能被消除, 而且通常还需要生产活性药物成分. 这一过程通常需要形成反应性代谢物, 这些代谢物可导致共价结合的半抗原和/或易感细胞环境中的细胞应激, 从而引发或共同刺激产生适应性免疫应答的发展, 从而导致DILI. 药物代谢特征与肝毒性潜在性之间的关系已有报道. 一项对美国207种广泛使用的口服药物的分析发现, 肝代谢显著(>50%)的药物有更高的ALT升高和肝衰竭的报告频率. 此外, 发现具有显著肝脏代谢和每日剂量>50 mg的药物具有显著更大的肝毒性风险[18].
2.2.2 亲脂性: 众所周知, 亲脂性(通常以辛醇-水分配系数的对数来衡量)会影响各种药物相关方面, 如药效、药代动力学和毒性, 具有较高亲脂性的药物似乎增加了靶外结合, 并增加了引起一般毒性事件的可能性. 亲脂性与每日剂量相结合, 被称为"二元法则", 被认为反映了药物的潜在肝毒性. 亲脂性是化合物优先在非极性脂介质中分配, 而不在水相中分配的一种趋势. 它对药物的其他属性具有重要的决定作用. Log P为化合物油水分配系数P的对数值, 指未解离的分子在油相与水相的分配平衡. 在化合物的所有分子均以中性形式存在的pH条件下, 其在一种有机相(例如辛醇)和一种水相(例如缓冲液)中分配系数的对数即为Log P. 高亲脂性(LogP >3)和每日剂量(>100 mg)与DILI风险增加有关, 根据对美国164种已批准药物的分析, 推测较高的亲脂性可促进药物进入肝细胞和随后的肝代谢, 从而增加活性代谢物的数量, 可能会增加DILI的风险[19]. 亲脂性药物通常需要肝的代谢, 因此, LogP可能只是广泛生物转化和肝脏暴露于活性代谢物的替代物. 最近对5个公开药物数据集的LogP、每日剂量和肝脏代谢程度的分析发现, 亲脂性和肝脏代谢都是DILI的个体风险因素, 当与剂量结合考虑时, 风险增加[20]. 二元法则作为肝毒性预测工具,在支持药物研究和开发方面的潜在适用性已在慢性丙型肝炎病毒感染的直接作用抗病毒药物上得到证实[21].
2.2.3 反应性代谢物与氧化应激: 反应性代谢物是已知的DILI发病的危险因素. 在药物开发过程中, 通过共价蛋白结合体外人体肝脏模型评估反应性代谢物的形成. 反应性中间体在反应性上表现出很大的差异, 这反映了它们与蛋白质或其他分子结合的速度和选择性有关. 共价结合的可能后果是: (1)改变靶蛋白的功能或位置; (2)形成新抗原; 或(3)没有副作用或临床影响. 例如, 如果只有很少的蛋白质被修饰. 由于活性代谢物可以改变细胞蛋白质的功能和结构, 因此被列为DILI的一个重要危险因素. 除了它们的直接毒性作用外, 反应性代谢物被认为是特异性DILI发病的第一步, 因为共价结合的蛋白质形成免疫原性半抗原, 可触发下游免疫反应发生[22].
据Liver Tox数据库估计, 2000例接受治疗的患者中约有1例出现急性肝损伤. 形成反应性代谢物的肝毒性药物包括非甾体抗炎药(NSAID)双氯芬酸布洛芬和萘普生、对乙酰氨基酚、托卡彭、奈法唑酮、扎鲁司特、三苯氧胺、氟他胺, 胺碘喹、磺胺甲恶唑、异烟肼、特比萘芬、非氨酸、氟烷和卡马西平. 另一份报告导致DILI的前10名药物依次为: 阿莫西林克拉维酸盐、氟氯西林、阿托伐他汀、双硫仑、双氯芬酸、辛伐他汀、卡马西平、布洛芬、红霉素和合成代谢类固醇. 在这10种药物中, 阿莫西林克拉维酸盐的DILI病例数最高, 合成代谢类固醇的病例数最低[23].
毒素直接作用于肝细胞可引起氧化性细胞器应激, 如内质网和线粒体应激, 导致细胞凋亡或坏死. 对乙酰氨基酚的肝毒性代谢物乙酰苯醌亚胺(acetylbenzoquinone imine, NAPQI)氧化蛋白质巯基并产生活性氧(reactive oxygen, ROS). NAPQI和ROS损伤线粒体DNA, 激活氨基末端激酶(N-terminal kinase, JNK)信号通路, 进一步放大线粒体ROS的产生, 导致线粒体膜通透性转换孔(mitochondrial permeability transition pore, MPTP)的开放. MPT的开放导致ATP合成所需的线粒体膜电位崩溃, 并导致膜间蛋白的释放, 从而引发坏死细胞死亡[24].
2.2.4 线粒体危害: 线粒体毒性的例子是氟脲(fialuridine), 一种引起微泡性脂肪肝和急性肝衰竭的核苷类似物. Fialuridine导致线粒体DNA缺失, 慢性乙型肝炎患者出现体重减轻、黄疸, 胰腺炎和乳酸酸中毒. 微泡性脂肪变性也见于胺碘酮、丙戊酸钠、四环素和各种抗病毒核苷类似物, 其特征是线粒体数量减少. 患者表现为低血糖、高氨血症和乳酸酸中毒, 但ALT水平仅轻度升高[25]. 丙戊酸钠抑制线粒体β-氧化脂肪酸和线粒体呼吸链, 从而减少氧化磷酸化和消耗细胞内ATP水平. 这也会导致产生过量的活性氧, 从而导致进一步的细胞损伤.
Aleo等人研究了美国食品与药物管理局(FDA)的肝毒性知识库(liver toxicity knowledge base, LTKB)中包含的72种化合物对线粒体呼吸的影响以及对人类 胆盐输出泵(bile salt export pump, BSEP)转运活动的抑制. LTKB将可能引起DILI的药物被归类为: (1)大多数DILI相关药物(盒装警告或从实验室撤回; (2)较少涉及DILI的药物(标签中提到DILI风险)和(3)不涉及DILI的药物(标签中没有DILI指征)[26]. 通过结合临床研究的因果关系评估和药物标签信息来改进DILI分类, 以提高其准确性[27]. 具有双重线粒体和BSEP抑制剂的效力, 其与更严重的人类DILI高度相关, 并且人对高度血浆药物浓度(highest plasma drug concentration, Cmax)更敏感[26].
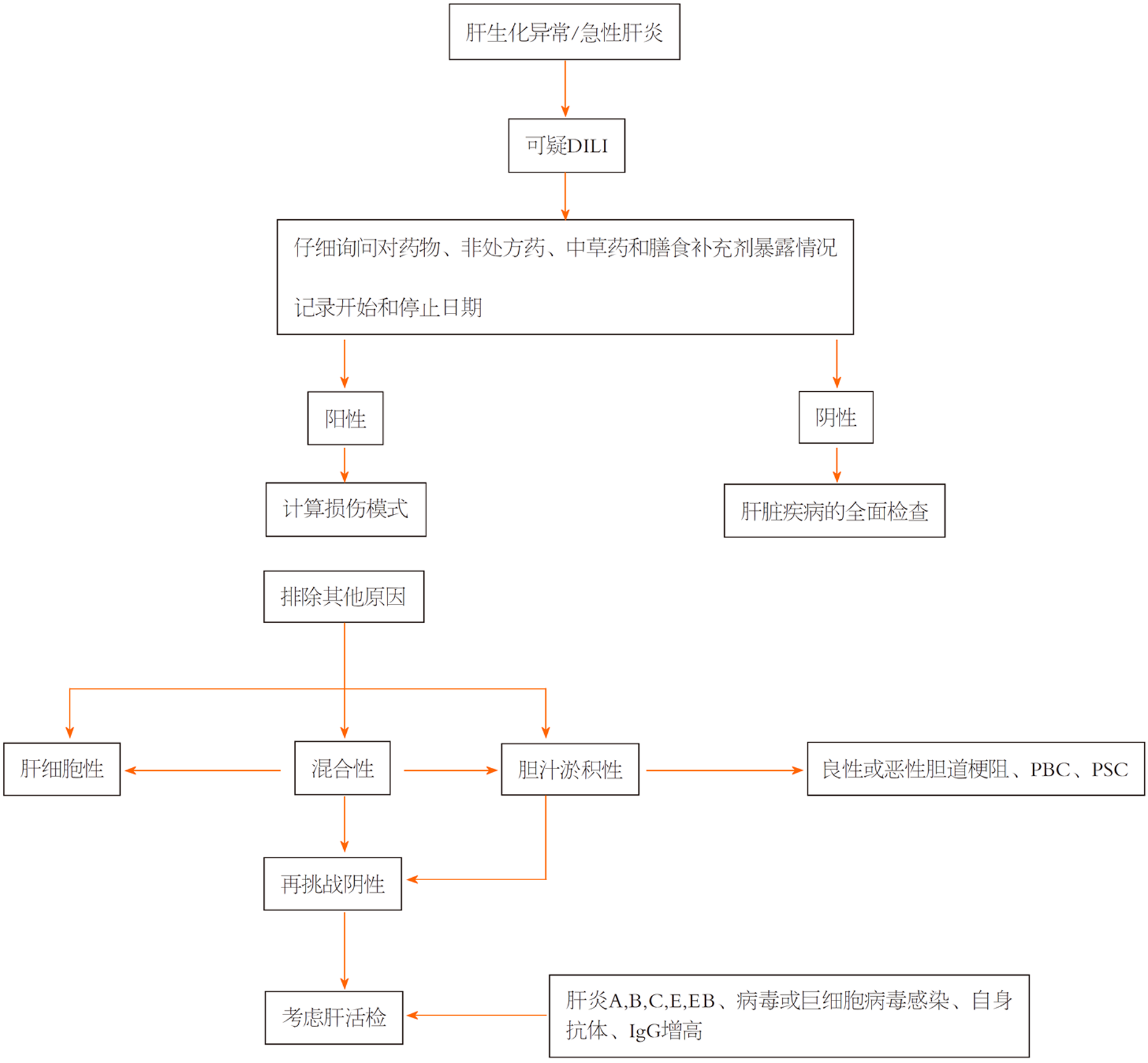
肝损伤的表型按R值分类, 定义为谷丙转氨酶(alanine aminotransferase, ALT)/ULN: ALP/ULN比值. ≥5的R值提示肝细胞损伤、≤2提示胆汁淤积性损伤和2-5提示为混合型损伤[28]. 药物性肝损伤(DILI)诊断检查流程图见图1.
近半个世纪以来, 临床和临床中常用于检测和管理药物性肝损伤的血清标志物是丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(alkaline phosphatase, ALP)和总胆红素(total bilirubin, TBIL). 丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)存在于肝细胞内, 在急性药物性肝损伤事件中, 血清ALT和AST水平的升高与肝细胞死亡和释放的速率密切相关. 血清ALP升高通常表示对胆管膜或胆管上皮细胞的损伤. TBIL水平升高可反映肝脏功能损害或胆红素生成(溶血)或加工改变. 然而, 这些传统的血清标志物存在着一些缺陷. 这些标记物中没有一种是完全针对肝脏损伤的, 也没有提供对损伤模式的深刻理解. 此外, 当肝细胞损伤已经发生时, ALT、AST等细胞损伤生物标志物被释放到循环中, 因此, 在肝细胞损伤出现之前, 这些生物标志物不能被用来鉴别药物性肝损伤的潜在作用. 此外, 血清ALT/AST的升高可能发生在药物治疗期间, 这些药物不会对进行性肝损伤造成很大或任何风险(例如他汀类、肝素和胆碱). 即使药物能够引起进展性和临床上重要的肝损伤, 大多数药物引起的血清ALT和AST升高仍能得到控制解决[3].
Hy's法则是评估肝脏特定实验室参数时的基本经验法则, 即当药物性肝损伤出现血清ALT>3×ULN, 且血清TBIL>2×ULN升高时, 通常提示预后不良. 经实践认识到血清ALT和AST在新药物候选药物临床试验中评估肝脏安全性的局限性, 2009年美国食品与药物管理局(FDA)指南将"Hy's法则"案例定义为最准确地预测到药物可能导致急性肝衰竭. 药物性肝损伤的国际登记处证实, 由于药物导致的肝细胞性黄疸患者至少有10%的机会发展为肝衰竭[2,29]. 根据2014年由FDA/药物评价与研究中心(CDER)主办的DILI专题讨论会, 大会主席Senior谈到新药肝脏安全性评估与挑战时指出: (1)肝损伤的严重程度不能仅依靠ALT水平确定, 对于非常少见的事件, 受试者操作特征曲线经常失败; (2)DILI不能仅通过血液生化检测或肝活检来进行诊断, 而是要求掌握相关详尽的临床信息; (3)目前还没有一种生物标志物足够特异.
假设血清TBIL升高是由于肝细胞大量丧失而导致肝功能全面丧失所致. 值得注意的是, 在一个真正的Hy's法则案例中, 血清ALT和TBIL的联合升高并不是预测严重肝损伤可能性的生物标志物, 而是证明在这一课题中发生了严重和潜在威胁生命的肝损伤的生物标记物.
解释Hy's法则案例的一个挑战是, 药物可能会导致血清TBIL升高, 原因不是全面的(整体的)肝功能障碍的损害. 其原因包括溶血(血红素负荷增加)、药物对转运胆红素的摄取或流出蛋白的抑制, 或抑制与胆红素结合的主要肝细胞酶(hepatocyte enzyme that conjugates bilirubin, UGT1A1). 最近, 定量系统药理学已被应用于评估一种药物对肝脏暴露的估计, 以及药物对抑制转运蛋白和UGT1A1的量化效应. 离体系统这一方法提高了对药物引起的血清TBIL升高的认识和预测, 而不是由于全面的肝功能障碍所致[29].
最近也有人提出, 在急性药物性肝损伤事件中死亡的肝细胞百分比可以通过血清ALT的连续测量来评估[30]. 这是基于这样的观点, 即每个肝细胞都含有一定数量的ALT, 而ALT在细胞死亡期间是被动释放的. 因此, 血清ALT与时间曲线下的面积应与丢失的肝细胞数量相对应. 此外, 还提出用这种方法估算肝细胞丢失量, 可以根据聚集肝功能的隐含损失来预测血清胆红素升高的幅度. 动物的肝切除研究表明, 在血清TBIL升高到足以引起黄疸之前, 必须有超过70%的肝细胞丢失. 然而, 在急性药物性肝损伤事件中, 在可能不会发生细胞死亡的部分肝细胞中, 功能将受到损害. 将这一现象纳入丙氨酸氨基转移酶(ALT)的肝细胞丢失估计值的支持性数据, 可能是几十年前对因醋氨酚过量而发生肝损伤的患者进行的一项肝活检研究. 根据本研究提供的数据, 可以得出结论: 40%以上的肝细胞必须在血清TBIL升高到大于2×ULN之前死亡. 根据一系列的血清ALT值估计, 每个受试者的肝细胞丢失率均小于40%[31]. 模型的结论是, 血清TBIL的升高并不仅仅是由于肝细胞毒性所致. 如果系统药理学方法表明药物对转运体和/或酶的抑制可能导致血清TBIL的升高, 这一结论将得到进一步的支持. 这些方法有可能完善对潜在的Hy's定律案例的解释[29]. 用连续血清ALT值来评估肝细胞丢失百分比, 认为大多数ALT进入循环是肝细胞随着ALT含量的释放而死亡的结果. 这种情况很可能发生在严重的药物性肝损伤事件中, 但血清ALT的大幅升高也可能是由于肌肉疾病或损伤引起的[32].
3.2.1 凋亡指数: 最近提出了一种基于血清生物标志物的凋亡指数(apoptotic index, AI)来估计凋亡和坏死在肝损伤中的相对贡献. AI为半胱氨酸天门冬氨酸蛋白酶(caspase)裂解角蛋白18 (caspase cleaved keratin 18, ccK 18)与总角蛋白18 (K18)的比值, K18包括全长K18和caspase裂解片段. K18是一种I型中间丝, 存在于上皮细胞中, 为细胞提供结构支持. 细胞凋亡早期, K18被caspase切割, 形成稳定的蛋白片段(ccK 18), 并释放到循环中. 坏死时, 全长K18被动释放入循环, 但有少量ccK 18反应释放. 现已研究在醋氨酚诱导的肝损伤(acetaminophen-induced liver injury, AILI)中检测血中K18或ccK 18浓度的质谱(小鼠)或免疫分析(针对人类), 以确定它们是否与肝脏中发生的坏死程度和凋亡程度相关. 研究发现在小鼠中, ccK 18水平的升高与caspase 3的表达密切相关, 与caspase 3的处理、DNA断裂和凋亡肝细胞的出现密切相关. 此外, 还发现ccK 18与K18的比值反映了肝脏从混合凋亡/坏死向主要坏死损伤的时间依赖性转变. 还注意到, 在醋氨酚诱导的肝损伤(AILI), 在ALT水平显著上升之前, K18和ccK 18的水平都有很大的提高[33]. 这些数据表明, 至少在临床前模型中, 量化K18和ccK 18既可以早期发现肝细胞死亡, 也可以定量估计肝细胞凋亡与坏死的相对数量. 由于K18并不局限于肝起源的上皮细胞, 因此利用它本身作为药物性肝损伤生物标记物可能会有问题. miR-122或谷氨酸脱氢酶(GLDH)/K18的比值可能允许这样的结论, 但这一点尚未得到调查.
血清K18和ccK 18的定量也是在药物性肝损伤临床背景下进行的. 与ALT相比, 这两种方法对肝损伤的检测都具有更高的敏感性[34]. 血清K18和ccK 18也有可能作为预测肝衰竭和死亡的生物标志物[35]. 在这些调查中, 在符合国王学院标准(King's College Criteria, KCC)的患者中, K18和ccK 18的水平都显著高于未达到这些标准的患者(KCC), KCC是一种预测AILI肝衰竭的模型. AI的估计显示, 与未发生KCC的患者相比, KCC患者的值更低(坏死更多). 这些结果与坏死性肝损伤相对于凋亡损伤更为严重和危险的观点是一致的[36].
然而, 应当指出, 在使用商业上可获得的ELISAs时, 计算人工智能可能是一项挑战. 在癌症患者血清中进行的实验证据表明, 当K18和ccK 18水平较低, 这一比率可能并不有用. 因此, 建议只有在K18和ccK 18的值都超过某些背景阈值时才能进行人工智能[37]. 当K18水平较低时, 测量的ccK 18水平可能会超过测量的总K18水平, 原因是由于非特定背景结合水平的增加所致. 同样, 这也支持这样的观点, 即只有当值高于特定的背景级别时, 以及当K18水平超过ccK 18水平时, 才能计算AI. 当需要计算AI时ELISA制造商推荐使用较早版本的K18 ELISA(M65)®. 最后, 这些ELISAs目前还不适用于啮齿类动物.
3.2.2 谷氨酸脱氢酶: 谷氨酸脱氢酶(glutamate dehydrogenase, GLDH)是一种位于线粒体基质中的酶, 参与氨基酸的氧化和尿素的产生. 这种蛋白主要表达在肝脏的中心周区, 但在肾脏和大脑中也有较低水平的GLDH表达. 在最近对啮齿动物进行的一项AILI研究中, 发现GLDH在识别肝细胞坏死方面略优于ALT, 并显示出与损伤严重程度之间的相关性[38]. 同样, 在一项狗的研究中, 血清GLDH水平与ALT水平相比, 在研究终止时能更准确地反映组织学观察到的肝损伤的缺失. 一项临床研究表明血清GLDH与ALT水平有很强的相关性, 表明GLDH对多种病因所致肝损害患者的肝损伤有较高的诊断能力[39]. 提示由于GLDH的半衰期短于ALT的半衰期(分别为~16小时和~47小时), 血清GLDH水平能更准确地反映肝脏损伤的进展.
GLDH向血清中的释放可能是线粒体毒性的信号, 可能是肝损伤的机制之一. 这一观点源于这样一个事实, 即如果发生坏死而不导致线粒体毒性, 则可通过离心("线粒体后上清液")从新鲜血清中去除释放的完整线粒体. 利用这一技术, AILI小鼠的研究中证明了GLDH作为线粒体损伤生物标志物的证据, 该研究检测了从或速尿诱导的肝脏毒性所获得的线粒体后上清液中GLDH的含量[40]. 虽然这两种毒物引起的中心周区坏死和血清丙氨酸氨基转移酶峰值升高的模式相似, 但仅在AILI线粒体后血清上清液中GLDH水平显著升高, 而速尿处理小鼠未见明显升高. 这与对乙酰氨基酚已知的线粒体毒性和速尿所致线粒体毒性的缺乏相一致, 提示在药物性肝损伤期间分析线粒体后上清液中的GLDH升高可能是由于多种药物所致[3].
3.2.3 miR-122: MicroRNAs是一种小而非编码的RNA, 有助于转录后基因的调控. 这些物种的一个吸引人的特点是它们在生物液体中的高度稳定性. MicroRNA-122是由肝细胞特异性表达的, 它占肝脏miRNA总量的70%, 有可能成为药物性肝损伤生物标记物的理想候选物, 因为ALT等传统生物标志物并不完全是肝脏特异性的[41].
在AILI小鼠中, miR-122在血浆中的含量很高, 同时在肝组织中减少. 此外, 与丙氨酸氨基转移酶(ALT)相比, 循环中的miR-122水平在早期和低剂量对乙酰氨基酚(APAP)后均升高. 在临床上, 多次药物性肝损伤研究表明, 循环中的miR-122水平在ALT升高之前就会升高[34,42]. 在另一项研究中, 急性肝损伤患者血清miR-122水平升高, 而健康对照组和服用过量醋氨酚但未发生肝损伤的患者则未见升高. 研究表明miR-122的血清半衰期比ALT短, 因此能够更准确地反映持续肝损伤的程度[43].
在从成人和儿童获得的临床醋氨酚诱导的肝损伤(AILI)数据集中也进行了大量的miRNA分析研究. 在所有的研究中, miR-122是循环中最高水平的miRNAs之一. 有趣的是, 在一项涉及评估AILI和缺血性肝损伤的研究中, 两种损伤类型的miRNAs分布有明显的差异[44].
尽管人们对miR-122作为肝损伤敏感和特异的生物标志物有很大的兴趣, 但最近的一些观察表明, miR-122的肝细胞释放可能受到调控, 而不仅仅是反映肝细胞死亡过程中的被动释放. 例如, 最近在大鼠身上进行的一项研究表明, 与对照组相比, 对乙酰氨基酚治疗后2小时, 大鼠血浆miR-122水平显著降低[45]. 血清miR-122水平随肝坏死的发生而升高. 此外, 最近有报道说, miR-122是在急性肝反应期间释放出来的, 可能是由于慢性炎症状态下经常观察到的贫血而向肾脏移动有关[46]. miR-122也被发现在健康志愿者身上有很大程度的内部和内部变异. 这种多变性在一定程度上促使预测性案例测试联盟(PSTC)剥夺了miR-122作为药物性肝损伤生物标记物的优势, 而GLDH具有较低的学科间和内部变异性为其优点.
现在看来, 许多甚至是大多数的IDILI反应都是由肝脏的适应性免疫攻击引起的. 这就要求人体的免疫系统将肝脏看作是外来的, 这可能是药物诱导的肝细胞表面Ⅰ类HLA分子所产生的新抗原的结果. 然而, 仅仅提出新的抗原并不足以引起肝脏的适应性免疫攻击. 这被认为需要激活天然免疫细胞, 特别是肝脏中的库普弗细胞. 这就需要药物诱导释放损伤相关的分子模式, 即抑制, 从而启动天然免疫细胞的激活[47]. 如果是这样的话, 在没有损伤相关分子模式(damage associated molecular pattern molecules, DAMPs)释放的情况下, 血清ALT升高和(或)缺乏天然免疫细胞的激活应意味着肝脏不会发生适应性免疫攻击. 因此, 人们一直在积极寻找肝细胞释放出的适当的DAMPs, 以及能够检测肝脏中先天免疫细胞活化的生物标志物. 迄今为止, 高迁移率组1 (HMGB 1)及其各种翻译后修改形式在这方面得到了最广泛的关注.
为了引起肝脏的适应性免疫攻击, 认为药物必须引起肝细胞应激或死亡, 导致肝细胞损伤相关分子模式的释放, 进而激活天然免疫细胞, 尤其是肝脏中的库普弗细胞. 激活的天然免疫细胞释放细胞因子和趋化因子, 将炎症细胞引入肝脏, 这一过程被认为是针对肝脏的适应性免疫攻击的先决条件.
3.3.1 高迁移率族组1: 高迁移率族组1 (high mobility group box 1, HMGB 1)这种无处不在的核蛋白主要发挥DNA结合和转录调节的作用; 然而, 它也可以积极地分泌到细胞外环境中. 有证据表明, HMGB 1是被动地从受损或死亡的肝细胞中释放到循环中的, 并且可以起到DAMP的作用, 引发免疫反应[48]. 这一功能似乎是由HMGB 1中特定残基的氧化还原状态介导的. 在这些残基处完全或部分减少的HMGB 1亚型在坏死时释放, 并促进先天免疫细胞趋化和细胞因子的释放. 相反, 在这些关键部位被完全氧化的HMGB 1是由凋亡细胞释放的, 并不引起先天免疫反应.
重要的是, HMGB 1也可以在一个需要关键赖氨酸残基高度乙酰化的过程中积极分泌. 当在药物性肝损伤事件中在血清中检测到时, 大多数高乙酰化HMGB 1被认为是由先天免疫细胞释放的, 这意味着受到DAMPs的激活; 然而, 肝细胞也被证明在某些条件下分泌这种异型.
非临床和临床研究都表明HMGB 1是AILI的敏感生物标志物. 小鼠血清HMGB 1明显早于ALT升高, 并以较快的速度回归基线, 与肝坏死的组织病理学观察密切相关[33]. 与坏死细胞渗出HMGB 1促进免疫细胞炎症和HMGB 1活性释放的观点一致, 血清中高乙酰化HMGB 1的升高与肝内炎性细胞的出现同时发生. 此外, 在最近的一项小鼠研究中, 用一种嵌合的人源化抗HMGB 1抗体减轻了对乙酰氨基酚所致的肝脏损伤, 支持了该蛋白在药物性肝损伤因该药物所致的进展中的作用[49].
在临床醋氨酚诱导的肝损伤(AILI)研究中, HMGB 1对肝毒性检测的敏感性高于ALT[42]. 在一项研究中, 从ALT水平仍在正常范围内的患者在提交时收集了测量结果. 在这些样本中, HMGB 1的总水平仅在后来发生肝损伤的患者中显著升高. 在第二项研究中, 高乙酰化HMGB 1只在死亡或需要肝移植的AILI患者中观察到, 与那些自发存活的患者相比, 表明这种形式的HMGB 1可能是AILI预后不良的预后因素[50]. 虽然总HMGB 1可以通过免疫测定来量化, 但目前还没有能够解释不同异构体的抗体, 因此需要质谱来测定HMGB 1的翻译后状态. 然而, 在上述AILI研究中, 总HMGB 1的测定也被证明是药物性肝损伤的一个敏感的生物标记物.
3.3.2 外显子是真核生物基因的一部分: 外显子(expressed region, Exons)是最后出现在成熟RNA中的基因序列, 又称表达序列. 如前所述, 肝细胞坏死时可释放DAMPs, 并启动肝内先天免疫细胞的激活, 这被认为是必要的, 但不足以引发肝脏的适应性免疫攻击. 然而, 有越来越多的证据表明, 肝细胞坏死并不一定是需要释放DAMP和最终启动肝脏适应性免疫攻击的先决条件. 例如, 在ximelagatran(希美加群, 一种口服凝血酶抑制剂)、lumiracoxib (一种新型,选择性的COX-2抑制剂)和lapatinib[拉帕替尼, 是一个靶向Her2和EGFR的小分子的酪氨酸激酶抑制剂(TKI)]的临床试验中, 观察到较强的HLA相关性, 血清ALT升高相对较小. 此外, 在因抗生素异烟肼引起的IDILI病例中, 在血清ALT升高之前, 患者血液中已经发现了药物反应性T细胞. 这些观察表明, 血清ALT的轻度升高并不一定反映药物直接引起的肝细胞坏死, 而会引发适应性免疫攻击, 而最初的肝细胞死亡是由适应性免疫攻击介导的. 在没有肝细胞死亡的情况下, 可以触发对肝脏的适应性免疫攻击, 这与乙肝感染是一致的. 乙型肝炎病毒不是细胞溶解, 而是产生肝脏特异性的适应性免疫攻击, 导致肝细胞坏死和临床疾病[51]. 最近的数据表明, 在没有细胞死亡的情况下, 这些DAMPs可能会通过药物诱导的肝细胞应激而在肝细胞外小体中传播[45]. 观察还表明, 与对照肝细胞释放的外显子相比, 用醋氨酚亚毒性剂量的醋氨酚处理肝细胞释放的外显子对单核细胞的激活更大. 这是合理的, 应当强调, 但没有死亡的肝细胞释放DAMPs (可能是新抗原), 在外显子, 然后移动和激活先天免疫细胞. 这是一个重要的研究领域, 因为, 由于肝内皮细胞的多孔窗, 肝源性外显子可以进入血液循环, 并有可能作为血液生物标志物. 因此, 从外周血中分离出外显子, 并对HMGB 1等HMGB1进行分析, 可能是早期预测进展和临床重要的药物性肝损伤电位的生物标记物[3].
研究人肝毒性时已经发现了危险等位基因的存在, 这些等位基因对药物性肝损伤的易感性的风险比要高得多. HLA等位基因检测具有较高的阴性预测价值, 因此, 由于药物的特殊性, 已被用于排除DILI. 当病人服用一种以上的肝毒性药物时, 基因检测的高阴性预测价值已被用于鉴别DILI的正确药物. 纳入基因测试可以改善DILI因果关系评估工具的性能特征[52]. 长期以来, 人类基因组中个体间的变异一直被认为是导致药物反应和药物不良反应敏感性差异的原因之一.
3.4.1 基因检测在临床诊断中的应用: 诊断DILI的"基因测试"的表现通常被描述为根据病例对照研究计算的敏感性和特异性, 这些研究旨在识别风险等位基因. 大多数与DILI相关的HLA等位基因具有极高的阴性预测值(>0.95). 因此, 当明确诊断的重要性时, 它们可以用来排除由特定药物引起的肝脏不良反应. 这将允许继续有效的药物治疗, 并提请注意一种非典型的可治疗情况的表现, 如自身免疫性肝炎, 在没有经典的自身抗体模式的情况下, 有缓解和复发的过程. 基因测试的高阴性预测值可用于在病人接触过两种可能导致DILI的药物时, 识别DILI的正确药物. 在最近的一份报告中, 一位患有胆汁淤积性肝炎的患者暴露于氟西林和雄激素合成类固醇, 缺乏Hla-B*5701等位基因被用来排除氟氯西林作为冒犯剂, DILI被认为是合成类固醇[53]. 另一种在黄疸临床评估过程中有效利用基因检测的类似临床情况,在急性肝损伤的研究中, 临床医生正在使用基因检测作为诊断工具, 其中, 药物所致的DILI是鉴别诊断之一. 对怀疑DILI的事件进行因果关系评估是一个具有挑战性的过程, 在特定情况下纳入基因测试可能会提高诸如Roussel Uclaf因果关系评估方法(Roussel Uclaf causality assessment method, RUCAM)等因果关系评估工具的一致性和准确性[54].
3.4.2 药物遗传学的未来: 迄今为止的调查已经证实, 一些常见的基因变异与DILI密切相关. 然而, 肝毒性遗传因素的基础知识还不足以使其在临床上得到广泛的应用. 较罕见的基因变异对DILI的影响可能要大得多; 由于其受检测方法的限制, 全基因组关联分析(genome-wide association study, GWAS)无法检测到这些变异. 全基因组测序技术涉及可挖掘整个人类基因组对药物不良反应的遗传贡献; 这些进展有望大大增加可与基因分型相联系或可使诊断不良反应的检出率增加.
在过去的十年里, 对影响DILI易感性的非遗传因素的认识也有了很大的提高. 例如, 如果接触氟氯西林的每万人中就有一人患上了DILI, 那么携带氟氯西林的人患上DILI的风险就Hla-B*5701等位基因为1/500, 同时携带危险等位基因的65岁以上人群的估计风险上升到1/100. 因此, 将影响DILI发展风险的lumiracoxib(罗美昔布, COX-2抑制剂)与药物有关的、遗传的和非遗传的宿主因素结合在一起进行分析, 与单独使用的遗传测试相比, 性能特征有了很大的改善[55]. 因此, 增加了集成算法的临床适用性. 也从而提高了DILI的检出率.
深入研究DILI的发病机制, 为治疗提供更多新途径, 开展更多的非创伤性新血清标记物和基因检测的研究, 这将是今后DILI防治的努力方向与期待.
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 2. | Fontana RJ, Hayashi PH, Gu J, Reddy KR, Barnhart H, Watkins PB, Serrano J, Lee WM, Chalasani N, Stolz A, Davern T, Talwakar JA; DILIN Network. Idiosyncratic drug-induced liver injury is associated with substantial morbidity and mortality within 6 months from onset. Gastroenterology. 2014;147:96-108.e4. [PubMed] [DOI] |
| 3. | Church RJ, Watkins PB. The transformation in biomarker detection and management of drug-induced liver injury. Liver Int. 2017;37:1582-1590. [PubMed] [DOI] |
| 4. | Björnsson ES, Bergmann OM, Björnsson HK, Kvaran RB, Olafsson S. Incidence, presentation, and outcomes in patients with drug-induced liver injury in the general population of Iceland. Gastroenterology. 2013;144:1419-1425, 1425.e1-3; quiz e19-20. [PubMed] [DOI] |
| 5. | Chalasani N, Bonkovsky HL, Fontana R, Lee W, Stolz A, Talwalkar J, Reddy KR, Watkins PB, Navarro V, Barnhart H, Gu J, Serrano J; United States Drug Induced Liver Injury Network. Features and Outcomes of 899 Patients With Drug-Induced Liver Injury: The DILIN Prospective Study. Gastroenterology. 2015;148:1340-52.e7. [PubMed] [DOI] |
| 6. | European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu; Clinical Practice Guideline Panel: Chair; Panel members; EASL Governing Board representative:. EASL Clinical Practice Guidelines: Drug-induced liver injury. J Hepatol. 2019;70:1222-1261. [PubMed] [DOI] |
| 7. | Boelsterli UA, Lee KK. Mechanisms of isoniazid-induced idiosyncratic liver injury: emerging role of mitochondrial stress. J Gastroenterol Hepatol. 2014;29:678-687. [PubMed] [DOI] |
| 8. | Medina-Caliz I, Robles-Diaz M, Garcia-Muñoz B, Stephens C, Ortega-Alonso A, Garcia-Cortes M, González-Jimenez A, Sanabria-Cabrera JA, Moreno I, Fernandez MC, Romero-Gomez M, Navarro JM, Barriocanal AM, Montane E, Hallal H, Blanco S, Soriano G, Roman EM, Gómez-Dominguez E, Castiella A, Zapata EM, Jimenez-Perez M, Moreno JM, Aldea-Perona A, Hernández-Guerra M, Prieto M, Zoubek ME, Kaplowitz N, Lucena MI, Andrade RJ; Spanish DILI registry. Definition and risk factors for chronicity following acute idiosyncratic drug-induced liver injury. J Hepatol. 2016;65:532-542. [PubMed] [DOI] |
| 9. | Fontana RJ, Hayashi PH, Barnhart H, Kleiner DE, Reddy KR, Chalasani N, Lee WM, Stolz A, Phillips T, Serrano J, Watkins PB; DILIN Investigators. Persistent liver biochemistry abnormalities are more common in older patients and those with cholestatic drug induced liver injury. Am J Gastroenterol. 2015;110:1450-1459. [PubMed] [DOI] |
| 10. | Chalasani N, Reddy KRK, Fontana RJ, Barnhart H, Gu J, Hayashi PH, Ahmad J, Stolz A, Navarro V, Hoofnagle JH. Idiosyncratic Drug Induced Liver Injury in African-Americans Is Associated With Greater Morbidity and Mortality Compared to Caucasians. Am J Gastroenterol. 2017;112:1382-1388. [PubMed] [DOI] |
| 11. | Nicoletti P, Devarbhavi H, Goel A, Venkatesan R, Eapen CE, Grove JI, Zafer S, Bjornsson E, Lucena MI, Andrade RJ, Pirmohamed M, Wadelius M, Larrey D, Maitland-van der Zee AH, Ibanez L, Watkins PB, Daly AK, Aithal GP. Genetic Risk Factors in Drug-Induced Liver Injury Due to Isoniazid-Containing Antituberculosis Drug Regimens. Clin Pharmacol Ther. 2021;109:1125-1135. [PubMed] [DOI] |
| 12. | Kaliyaperumal K, Grove JI, Delahay RM, Griffiths WJH, Duckworth A, Aithal GP. Pharmacogenomics of drug-induced liver injury (DILI): Molecular biology to clinical applications. J Hepatol. 2018;69:948-957. [PubMed] [DOI] |
| 13. | Merrell MD, Cherrington NJ. Drug metabolism alterations in nonalcoholic fatty liver disease. Drug Metab Rev. 2011;43:317-334. [PubMed] [DOI] |
| 14. | Kim WS, Lee SS, Lee CM, Kim HJ, Ha CY, Kim HJ, Kim TH, Jung WT, Lee OJ, Hong JW, You HS, Cho HC. Hepatitis C and not Hepatitis B virus is a risk factor for anti-tuberculosis drug induced liver injury. BMC Infect Dis. 2016;16:50. [PubMed] [DOI] |
| 15. | Park WB, Kim W, Lee KL, Yim JJ, Kim M, Jung YJ, Kim NJ, Kim DH, Kim YJ, Yoon JH, Oh MD, Lee HS. Antituberculosis drug-induced liver injury in chronic hepatitis and cirrhosis. J Infect. 2010;61:323-329. [PubMed] [DOI] |
| 16. | Han D, Dara L, Win S, Than TA, Yuan L, Abbasi SQ, Liu ZX, Kaplowitz N. Regulation of drug-induced liver injury by signal transduction pathways: critical role of mitochondria. Trends Pharmacol Sci. 2013;34:243-253. [PubMed] [DOI] |
| 17. | Vuppalanchi R, Gotur R, Reddy KR, Fontana RJ, Ghabril M, Kosinski AS, Gu J, Serrano J, Chalasani N. Relationship between characteristics of medications and drug-induced liver disease phenotype and outcome. Clin Gastroenterol Hepatol. 2014;12:1550-1555. [PubMed] [DOI] |
| 18. | Lammert C, Bjornsson E, Niklasson A, Chalasani N. Oral medications with significant hepatic metabolism at higher risk for hepatic adverse events. Hepatology. 2010;51:615-620. [PubMed] [DOI] |
| 19. | Chen M, Suzuki A, Borlak J, Andrade RJ, Lucena MI. Drug-induced liver injury: Interactions between drug properties and host factors. J Hepatol. 2015;63:503-514. [PubMed] [DOI] |
| 20. | McEuen K, Borlak J, Tong W, Chen M. Associations of Drug Lipophilicity and Extent of Metabolism with Drug-Induced Liver Injury. Int J Mol Sci. 2017;18. [PubMed] [DOI] |
| 21. | Mishra P, Chen M. Direct-Acting Antivirals for Chronic Hepatitis C: Can Drug Properties Signal Potential for Liver Injury? Gastroenterology. 2017;152:1270-1274. [PubMed] [DOI] |
| 22. | Weaver RJ, Betts C, Blomme EAG, Gerets HHJ, Gjervig Jensen K, Hewitt PG, Juhila S, Labbe G, Liguori MJ, Mesens N, Ogese MO, Persson M, Snoeys J, Stevens JL, Walker T, Park BK. Test systems in drug discovery for hazard identification and risk assessment of human drug-induced liver injury. Expert Opin Drug Metab Toxicol. 2017;13:767-782. [PubMed] [DOI] |
| 23. | Teschke R. Top-ranking drugs out of 3312 drug-induced liver injury cases evaluated by the Roussel Uclaf Causality Assessment Method. Expert Opin Drug Metab Toxicol. 2018;14:1169-1187. [PubMed] [DOI] |
| 24. | Iorga A, Dara L, Kaplowitz N. Drug-Induced Liver Injury: Cascade of Events Leading to Cell Death, Apoptosis or Necrosis. Int J Mol Sci. 2017;18. [PubMed] [DOI] |
| 25. | Tujios S, Fontana RJ. Mechanisms of drug-induced liver injury: from bedside to bench. Nat Rev Gastroenterol Hepatol. 2011;8:202-211. [PubMed] [DOI] |
| 26. | Chen M, Vijay V, Shi Q, Liu Z, Fang H, Tong W. FDA-approved drug labeling for the study of drug-induced liver injury. Drug Discov Today. 2011;16:697-703. [PubMed] [DOI] |
| 27. | Funk C, Ponelle C, Scheuermann G, Pantze M. Cholestatic potential of troglitazone as a possible factor contributing to troglitazone-induced hepatotoxicity: in vivo and in vitro interaction at the canalicular bile salt export pump (Bsep) in the rat. Mol Pharmacol. 2001;59:627-635. [PubMed] |
| 28. | Kullak-Ublick GA, Andrade RJ, Merz M, End P, Benesic A, Gerbes AL, Aithal GP. Drug-induced liver injury: recent advances in diagnosis and risk assessment. Gut. 2017;66:1154-1164. [PubMed] [DOI] |
| 29. | Yang K, Battista C, Woodhead JL, Stahl SH, Mettetal JT, Watkins PB, Siler SQ, Howell BA. Systems pharmacology modeling of drug-induced hyperbilirubinemia: Differentiating hepatotoxicity and inhibition of enzymes/transporters. Clin Pharmacol Ther. 2017;101:501-509. [PubMed] [DOI] |
| 30. | Howell BA, Siler SQ, Shoda LK, Yang Y, Woodhead JL, Watkins PB. A mechanistic model of drug-induced liver injury AIDS the interpretation of elevated liver transaminase levels in a phase I clinical trial. CPT Pharmacometrics Syst Pharmacol. 2014;3:e98. [PubMed] [DOI] |
| 31. | Longo DM, Generaux GT, Howell BA, Siler SQ, Antoine DJ, Button D, Caggiano A, Eisen A, Iaci J, Stanulis R, Parry T, Mosedale M, Watkins PB. Refining Liver Safety Risk Assessment: Application of Mechanistic Modeling and Serum Biomarkers to Cimaglermin Alfa (GGF2) Clinical Trials. Clin Pharmacol Ther. 2017;102:961-969. [PubMed] [DOI] |
| 32. | McMillan HJ, Gregas M, Darras BT, Kang PB. Serum transaminase levels in boys with Duchenne and Becker muscular dystrophy. Pediatrics. 2011;127:e132-e136. [PubMed] [DOI] |
| 33. | Antoine DJ, Williams DP, Kipar A, Jenkins RE, Regan SL, Sathish JG, Kitteringham NR, Park BK. High-mobility group box-1 protein and keratin-18, circulating serum proteins informative of acetaminophen-induced necrosis and apoptosis in vivo. Toxicol Sci. 2009;112:521-531. [PubMed] [DOI] |
| 34. | Thulin P, Nordahl G, Gry M, Yimer G, Aklillu E, Makonnen E, Aderaye G, Lindquist L, Mattsson CM, Ekblom B, Antoine DJ, Park BK, Linder S, Harrill AH, Watkins PB, Glinghammar B, Schuppe-Koistinen I. Keratin-18 and microRNA-122 complement alanine aminotransferase as novel safety biomarkers for drug-induced liver injury in two human cohorts. Liver Int. 2014;34:367-378. [PubMed] [DOI] |
| 35. | Rutherford A, King LY, Hynan LS, Vedvyas C, Lin W, Lee WM, Chung RT; ALF Study Group. Development of an accurate index for predicting outcomes of patients with acute liver failure. Gastroenterology. 2012;143:1237-1243. [PubMed] [DOI] |
| 36. | Bechmann LP, Jochum C, Kocabayoglu P, Sowa JP, Kassalik M, Gieseler RK, Saner F, Paul A, Trautwein C, Gerken G, Canbay A. Cytokeratin 18-based modification of the MELD score improves prediction of spontaneous survival after acute liver injury. J Hepatol. 2010;53:639-647. [PubMed] [DOI] |
| 37. | Linder S, Olofsson MH, Herrmann R, Ulukaya E. Utilization of cytokeratin-based biomarkers for pharmacodynamic studies. Expert Rev Mol Diagn. 2010;10:353-359. [PubMed] [DOI] |
| 38. | Thulin P, Hornby RJ, Auli M, Nordahl G, Antoine DJ, Starkey Lewis P, Goldring CE, Park BK, Prats N, Glinghammar B, Schuppe-Koistinen I. A longitudinal assessment of miR-122 and GLDH as biomarkers of drug-induced liver injury in the rat. Biomarkers. 2017;22:461-469. [PubMed] [DOI] |
| 39. | Schomaker S, Warner R, Bock J, Johnson K, Potter D, Van Winkle J, Aubrecht J. Assessment of emerging biomarkers of liver injury in human subjects. Toxicol Sci. 2013;132:276-283. [PubMed] [DOI] |
| 40. | McGill MR, Sharpe MR, Williams CD, Taha M, Curry SC, Jaeschke H. The mechanism underlying acetaminophen-induced hepatotoxicity in humans and mice involves mitochondrial damage and nuclear DNA fragmentation. J Clin Invest. 2012;122:1574-1583. [PubMed] [DOI] |
| 41. | Lagos-Quintana M, Rauhut R, Yalcin A, Meyer J, Lendeckel W, Tuschl T. Identification of tissue-specific microRNAs from mouse. Curr Biol. 2002;12:735-739. [PubMed] [DOI] |
| 42. | Dear JW, Antoine DJ, Starkey-Lewis P, Goldring CE, Park BK. Early detection of paracetamol toxicity using circulating liver microRNA and markers of cell necrosis. Br J Clin Pharmacol. 2014;77:904-905. [PubMed] [DOI] |
| 43. | Harrill AH, Eaddy JS, Rose K, Cullen JM, Ramanathan L, Wanaski S, Collins S, Ho Y, Watkins PB, Lecluyse EL. Liver biomarker and in vitro assessment confirm the hepatic origin of aminotransferase elevations lacking histopathological correlate in beagle dogs treated with GABAA receptor antagonist NP260. Toxicol Appl Pharmacol. 2014;277:131-137. [PubMed] [DOI] |
| 44. | Ward J, Kanchagar C, Veksler-Lublinsky I, Lee RC, McGill MR, Jaeschke H, Curry SC, Ambros VR. Circulating microRNA profiles in human patients with acetaminophen hepatotoxicity or ischemic hepatitis. Proc Natl Acad Sci USA. 2014;111:12169-12174. [PubMed] [DOI] |
| 45. | Holman NS, Mosedale M, Wolf KK, LeCluyse EL, Watkins PB. Subtoxic Alterations in Hepatocyte-Derived Exosomes: An Early Step in Drug-Induced Liver Injury? Toxicol Sci. 2016;151:365-375. [PubMed] [DOI] |
| 46. | Rivkin M, Simerzin A, Zorde-Khvalevsky E, Chai C, Yuval JB, Rosenberg N, Harari-Steinfeld R, Schneider R, Amir G, Condiotti R, Heikenwalder M, Weber A, Schramm C, Wege H, Kluwe J, Galun E, Giladi H. Inflammation-Induced Expression and Secretion of MicroRNA 122 Leads to Reduced Blood Levels of Kidney-Derived Erythropoietin and Anemia. Gastroenterology. 2016;151:999-1010.e3. [PubMed] [DOI] |
| 47. | Mosedale M, Watkins PB. Drug-induced liver injury: Advances in mechanistic understanding that will inform risk management. Clin Pharmacol Ther. 2017;101:469-480. [PubMed] [DOI] |
| 48. | Huebener P, Pradere JP, Hernandez C, Gwak GY, Caviglia JM, Mu X, Loike JD, Schwabe RF. The HMGB1/RAGE axis triggers neutrophil-mediated injury amplification following necrosis. J Clin Invest. 2015;125:539-550. [PubMed] [DOI] |
| 49. | Lundbäck P, Lea JD, Sowinska A, Ottosson L, Fürst CM, Steen J, Aulin C, Clarke JI, Kipar A, Klevenvall L, Yang H, Palmblad K, Park BK, Tracey KJ, Blom AM, Andersson U, Antoine DJ, Erlandsson Harris H. A novel high mobility group box 1 neutralizing chimeric antibody attenuates drug-induced liver injury and postinjury inflammation in mice. Hepatology. 2016;64:1699-1710. [PubMed] [DOI] |
| 50. | Antoine DJ, Jenkins RE, Dear JW, Williams DP, McGill MR, Sharpe MR, Craig DG, Simpson KJ, Jaeschke H, Park BK. RETRACTED: Molecular forms of HMGB1 and keratin-18 as mechanistic biomarkers for mode of cell death and prognosis during clinical acetaminophen hepatotoxicity. J Hepatol. 2012;56:1070-1079. [PubMed] [DOI] |
| 51. | Chisari FV, Isogawa M, Wieland SF. Pathogenesis of hepatitis B virus infection. Pathol Biol (Paris). 2010;58:258-266. [PubMed] [DOI] |
| 52. | Aithal GP. Pharmacogenetic testing in idiosyncratic drug-induced liver injury: current role in clinical practice. Liver Int. 2015;35:1801-1808. [PubMed] [DOI] |
| 53. | El Sherrif Y, Potts JR, Howard MR, Barnardo A, Cairns S, Knisely AS, Verma S. Hepatotoxicity from anabolic androgenic steroids marketed as dietary supplements: contribution from ATP8B1/ABCB11 mutations? Liver Int. 2013;33:1266-1270. [PubMed] [DOI] |
| 54. | Aithal GP, Watkins PB, Andrade RJ, Larrey D, Molokhia M, Takikawa H, Hunt CM, Wilke RA, Avigan M, Kaplowitz N, Bjornsson E, Daly AK. Case definition and phenotype standardization in drug-induced liver injury. Clin Pharmacol Ther. 2011;89:806-815. [PubMed] [DOI] |
| 55. | Aithal GP. Hepatotoxicity related to antirheumatic drugs. Nat Rev Rheumatol. 2011;7:139-150. [PubMed] [DOI] |