修回日期: 2021-03-12
接受日期: 2021-05-25
在线出版日期: 2021-06-28
传统肝动脉栓塞化疗在治疗肝癌时, 肿瘤细胞仍会残留, 患者预后不理想. 载药脂质微球可以帮助进一步杀死残留的癌细胞并发挥重要作用.
探讨载药脂微球结合肝动脉栓塞化疗治疗老年肝细胞癌的效果, 并分析其对患者生存获益、程序性死亡配体1(programmed death ligand, PD-L1)、程序性死亡分子1(programmed death 1, PD-1)水平的影响.
选取2015-10/2018-10我院老年肝细胞癌患者112例, 根据对照设计试验原则, 以随机抽签法分为观察组(n = 56)、对照组(n = 56). 对照组采取传统肝动脉栓塞化疗, 观察组采取HepaSphere载药脂微球结合肝动脉栓塞化疗. 比较两组疗效、血清肿瘤标志物[甲胎蛋白(alpha-fetoprotein, AFP)、癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原199(carbohydrate antigen 199, CA199)、胸苷激酶1(thymidine kinase 1, TK-1)]、肿瘤血管生成有关指标[血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、微血管密度(microvessel density, MVD)]、组织PD-L1、PD-1水平, 并统计两组治疗期间不良反应、治疗后6 mo、1年及2年生存情况.
观察组治疗总有效率为83.93%, 高于对照组的67.86%(P<0.05); 与治疗前相比, 两组治疗后血清AFP、CEA、CA199、TK-1水平均明显降低, 且观察组低于对照组(P<0.05); 与治疗前相比, 两组治疗后血清VEGF、bFGF水平及MVD均明显降低, 且观察组低于对照组(P<0.05); 与治疗前相比, 两组治疗后组织PD-L1、PD-1水平均明显降低, 且观察组低于对照组(P<0.05); 治疗期间, 观察组恶心、呕吐、腹痛、发热、乏力发生率与对照组比较差异无统计学意义(P>0.05); 观察组治疗后1年、2年生存率高于对照组(P<0.05).
载药脂微球结合肝动脉栓塞化疗治疗老年肝细胞癌的效果显著, 可有效抑制癌组织中PD-L1、PD-1表达, 有助于改善患者生存情况.
核心提要: 传统肝动脉栓塞化疗在肝癌的治疗中肿瘤细胞会有残留, 患者预后改善不理想. 载药脂微球可辅助进一步杀伤残留的癌细胞, 并对免疫反应中的程序性死亡配体1(programmed death ligand, PD-L1)和程序性死亡分子1(programmed death 1, PD-1)起到重要调节作用.
引文著录: 王浩, 马军杰, 戴献毅. 载药脂微球配合肝动脉栓塞化疗治疗老年肝细胞癌的效果及对生存获益、PD-L1、PD-1水平影响. 世界华人消化杂志 2021; 29(12): 647-654
Revised: March 12, 2021
Accepted: May 25, 2021
Published online: June 28, 2021
Traditional hepatic artery embolization chemotherapy for treatment of liver cancer is often associated with an unsatisfactory prognosis since the tumor cells remain. Drug-loaded lipid microspheres can assist in further killing residual cancer cells and play an important role in the regulation of PD-1 and PD-L1 in the immune response.
To evaluate the efficacy of drug-loaded lipid microspheres combined with transcatheter arterial chemoembolization in the treatment of hepatocellular carcinoma in elderly patients, and to analyze its effect on the survival benefit and programmed death-1 ligand (PD-L1) and programmed death 1 (PD-1) levels.
From October 2015 to October 2018, 112 elderly patients with hepatocellular carcinoma treated at our hospital were selected. According to the principle of controlled design, the patients were randomly divided into either an observation group (n = 56) or a control group (n = 56). The control group received traditional transcatheter arterial chemoembolization, and the observation group received HepaSphere drug-loaded lipid microspheres combined with transcatheter arterial chemoembolization. The efficacy and serum tumor markers [alpha-fetoprotein (AFP), carcinoembryonic antigen (CEA), carbohydrate antigen 199 (CA199), thymidine kinase 1 (TK-1)], tumor angiogenesis-related indicators [vascular endothelial cell growth factor (VEGF), basic fibroblast growth factor (bFGF), and microvessel density (MVD)], and tissue PD-L1 and PD-1 levels were compared between the two groups. The adverse reactions during the treatment period and the survival status of the two groups at 6 mo, 1 year, and 2 years after treatment were also recorded.
The total effective rate in the observation group was 83.93%, which was higher than that (67.86%) of the control group (P < 0.05). Compared with the values before treatment, serum AFP, CEA, CA199, and TK-1 levels in the two groups were significantly reduced after treatment; these tumor markers in the observation group were significantly lower than those of the control group after treatment (P < 0.05). Compared with the values before treatment, the levels of serum VEGF, bFGF, and MVD in the two groups were significantly reduced after treatment; these tumor angiogenesis-related indicators in the observation group were significantly lower than those of the control group (P < 0.05). Compared with the values before treatment, the levels of PD-L1 and PD-1 in the two groups were significantly reduced after treatment; they were also significantly lower in the observation group than in the control group (P < 0.05). During treatment, there was no significant difference in the incidence of nausea, vomiting, abdominal pain, fever, or fatigue between the two groups (P > 0.05). The 1- and 2-year survival rates of the observation group were significantly higher than those of the control group (P < 0.05).
Drug-loaded lipid microspheres combined with transcatheter arterial chemoembolization have a significant effect in the treatment of hepatocellular carcinoma in elderly patients, and this combination therapy can effectively inhibit the expression of PD-L1 and PD-1 in cancer tissues and help improve the survival of patients.
- Citation: Wang H, Ma JJ, Dai XY. Drug-loaded lipid microspheres combined with transcatheter arterial chemoembolization for treatment of hepatocellular carcinoma in elderly patients: Efficacy and impact on survival benefit and PD-L1 and PD-1 levels. Shijie Huaren Xiaohua Zazhi 2021; 29(12): 647-654
- URL: https://www.wjgnet.com/1009-3079/full/v29/i12/647.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i12.647
肝细胞癌为临床最常见恶性肿瘤之一, 受人们饮食习惯及生活方式变化的影响, 近年来肝细胞癌患病率呈逐渐升高趋势, 其发病率、病死率在我国恶性肿瘤中高居第2、3位, 严重威害我国人民身体健康[1,2]. 老年群体是肝细胞癌的多发群体, 多数患者不能耐受手术或无法行手术治疗, 肝动脉栓塞化疗作为无法手术治疗肝癌患者的首选治疗方案, 目前广泛应用于老年肝细胞癌患者治疗中, 是除手术之外控制肿瘤进展、延长患者生存期的最有效治疗方法[3]. 相关研究指出[4], 传统肝动脉栓塞化疗虽能取得一定疗效, 但肿瘤供血血管难以完全栓塞坏死, 导致肿瘤细胞残留, 并通过侧支循环继续增殖、转移, 不利于患者预后改善. 近年来, 国内外均有研究[5,6]证实载药脂微球是控制肝癌进展的安全、有效方法. 此外, 新近报道显示[7], 程序性死亡分子1(programmed death-1, PD-1)及程序性死亡配体1(programmed death receptor 1, PD-L1)在肝细胞癌的发生发展中起到重要调节作用, 可作为肝细胞癌治疗的靶指标. 基于此, 本研究尝试探讨载药脂微球结合肝动脉栓塞化疗治疗老年肝细胞癌的效果, 并分析其对患者生存获益、PD-L1、PD-1的影响. 报告如下.
经我院伦理委员会审批通过, 选取2015-10/2018-10我院老年肝细胞癌患者112例, 根据对照设计试验原则, 以随机抽签法分为观察组(n = 56)、对照组(n = 56). 对比两组性别、年龄、体质量指数(body mass index, BMI)、Child肝功能分级[8]、肿瘤数目、肿瘤直径, 均无显著差异(P>0.05). 见表1.
| 组别 | 例数 | 性别(男/女) | 年龄(岁) | BMI | Child肝功能分级 | 肿瘤数目(例) | 肿瘤直径 | |||
| A级 | B级 | 单发 | 多发 | 3-5 cm | >5 cm | |||||
| 观察组 | 56 | 30/26 | 60-79 (70.53±4.23) | 18.4-28.3 (24.36±1.96) | 21(37.50) | 35(62.50) | 48(85.71) | 8(14.29) | 20(35.71) | 36(64.29) |
| 对照组 | 56 | 35/21 | 60-78 (69.84±4.08) | 18.8-27.9 (23.95±2.17) | 25(44.64) | 31(55.36) | 51(91.07) | 5(8.93) | 24(42.86) | 32(57.14) |
| χ2/t/u | 0.917 | 0.879 | 1.049 | 0.590 | 0.783 | 0.599 | ||||
| P | 0.338 | 0.382 | 0.296 | 0.442 | 0.376 | 0.439 | ||||
纳入标准: (1)符合肝细胞癌诊断标准[9]; (2)年龄≥60岁; (3)首次确诊; (4)预计生存时间>3 mo; (5)病灶未发生远处转移; (6)至少有1个可测量病灶; (7)Karnofsky功能状态[10]评分>60分; (8)患者知晓本研究, 已签署同意书.
排除标准: (1)精神疾病或心理障碍患者; (2)合并其他恶性肿瘤者; (3)继发性肝癌患者; (4)肝癌终末期患者; (5)血液系统疾病患者; (6)伴有严重心脑血管疾病、肺肾功能不全及门静脉血栓疾病者; (7)自身免疫性疾病患者; (8)严重感染性疾病患者.
对照组: 采取传统肝动脉栓塞化疗, 完善血常规、尿常规等各项检查, 建立静脉通道, 采用改良Seldinger法穿刺患者右侧股动脉, 穿刺成功后先后置入动脉鞘、导管, 至肿瘤病灶供血动脉, 采用碘化油(上海万巷制药有限公司, 国药准字H20064893)进行动脉化疗栓塞, 将超液化碘化油与20-60 mg吡柔比星(浙江海正药业股份有限公司, 国药准字H20045982)混合制成混悬乳剂, 进行动脉化疗栓塞.
观察组: 采取HepaSphere载药脂微球(麦瑞通医疗器械有限公司, 20191104)结合肝动脉栓塞化疗, 穿刺部位及方法同对照组, 选用HepaSphere载药微球, 化疗药物为吡柔比星, 将载药微球与20-60 mg吡柔比星混合2 h, 随后将多余液体废弃, 进行动脉化疗栓塞, 摄片提示沉积良好后拔管加压止血. 两组术后均常规给予保肝药物治疗, 根据患者病灶变化情况决定下次治疗时间, 两次介入治疗间隔6-8 wk, 两组治疗次数保持一致.
(1)两组疗效, 再次行介入治疗前评估疗效, 参照实体肿瘤疗效评价标准评估[11]: 完全缓解: 肿瘤病灶消失, 持续时间≥4 wk; 部分缓解: 肿瘤病灶最长径总和缩小≥30%, 维持时间≥4 wk; 疾病进展: 肿瘤病灶最长径总和增大≥20%, 或有新病灶出现; 疾病稳定: 介于部分缓解与疾病进展之间; 总有效率 = (完全缓解+部分缓解)/总例数×100%; (2)两组治疗前、治疗后血清肿瘤标志物[甲胎蛋白(alpha feto protein, AFP)、癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原199(carbohydrate antigen 199, CA199)、胸苷激酶1(thymidine kinase 1, TK-1)]、肿瘤血管生成有关指标[血管内皮细胞生长因子(vascular epithelial growth factor, VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、微血管密度(micro vessel density, MVD)]、组织PD-L1、PD-1水平, 采集患者各时间段空腹静脉血6 mL、癌组织标本, 取血液标本以3500 r/min转速离心处理5 min, 取血清, 由专业检测人员采用蛋白芯片-化学发光法血清AFP、CEA、CA19-9水平, 试剂盒购自上海裕隆生物科技有限公司; 采用酶联免疫吸附试验测定血清TK-1、VEGF、bFGF水平, 试剂盒购自北京百奥莱博科技有限公司. 癌组织标本采用细针活检采集, 取癌组织标本采用4%中性福尔马林固定, 常规行石蜡包埋后进行连续切片, 作免疫组化标记以及革兰染色待用, 采用SP免疫组化法检测组织中MVD表达水平, 兔抗人单克隆抗体均购自北京中杉公司, 采用国际常用的Weidner改进式方法测量MVD水平, 记录5个高倍视野内的微血管数, 取其平均数作为最终MVD值; 采用酶联免疫吸附试验测定组织中PD-L1、PD-1表达情况, 具体检测操作参照相关文献[12]; (3)两组治疗期间不良反应, 包括恶心、呕吐、腹痛、发热、乏力; (4)两组治疗后6 mo、1年及2年生存情况.
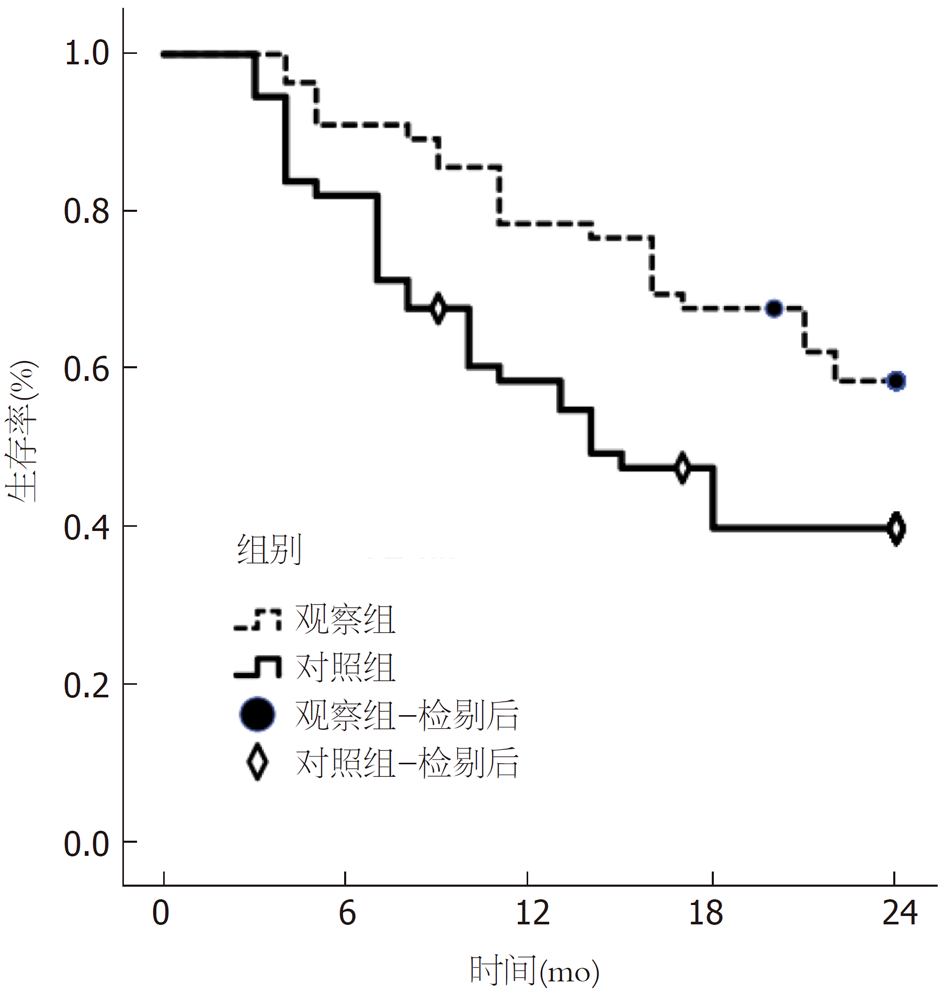
统计学处理 数据处理采用SPSS 22.0软件, 计数资料以例数描述, 采用χ2检验, 计量资料采以mean±SD描述, 两组间比较采用独立样本t检验, 采用Kaplan-Meier曲线分析患者生存情况, Log-Rank检验, 均采用双侧检验, P<0.05为差异有统计学意义.
观察组治疗后总有效率较对照组高(P<0.05). 见表2.
| 组别 | 例数 | 疾病进展 | 疾病稳定 | 部分缓解 | 完全缓解 | 总有效率 |
| 观察组 | 56 | 1(1.79) | 8(14.29) | 21(37.50) | 26(46.43) | 47(83.93) |
| 对照组 | 56 | 3(5.36) | 15(26.79) | 20(35.71) | 18(32.14) | 38(67.86) |
| χ2 | 3.953 | |||||
| P | 0.047 |
组间比较, 两组治疗前血清AFP、CEA、CA199、TK-1水平相比, 差异无统计学意义, 观察组治疗后血清AFP、CEA、CA199、TK-1水平均低于对照组(P<0.05); 组内比较, 两组治疗后血清各指标水平均较本组治疗前降低(P<0.05). 见表3.
| 时间 | 组别 | 例数 | AFP(ng/mL) | CEA(ng/mL) | CA199(kU/L) | TK-1(pmol/L) |
| 治疗前 | 观察组 | 56 | 89.27±9.68 | 124.27±15.32 | 56.15±7.48 | 2.59±1.47 |
| 对照组 | 56 | 88.02±8.93 | 122.59±13.50 | 55.22±6.67 | 2.43±1.68 | |
| t | 0.710 | 0.616 | 0.694 | 0.536 | ||
| P | 0.479 | 0.539 | 0.489 | 0.593 | ||
| 治疗后 | 观察组 | 56 | 35.84±4.62a | 58.97±8.41a | 21.79±2.52a | 1.04±0.65a |
| 对照组 | 56 | 50.06±6.85a | 79.86±9.26a | 35.44±4.18a | 1.42±0.77a | |
| t | 12.879 | 12.497 | 20.928 | 2.822 | ||
| P | <0.001 | <0.001 | <0.001 | 0.006 |
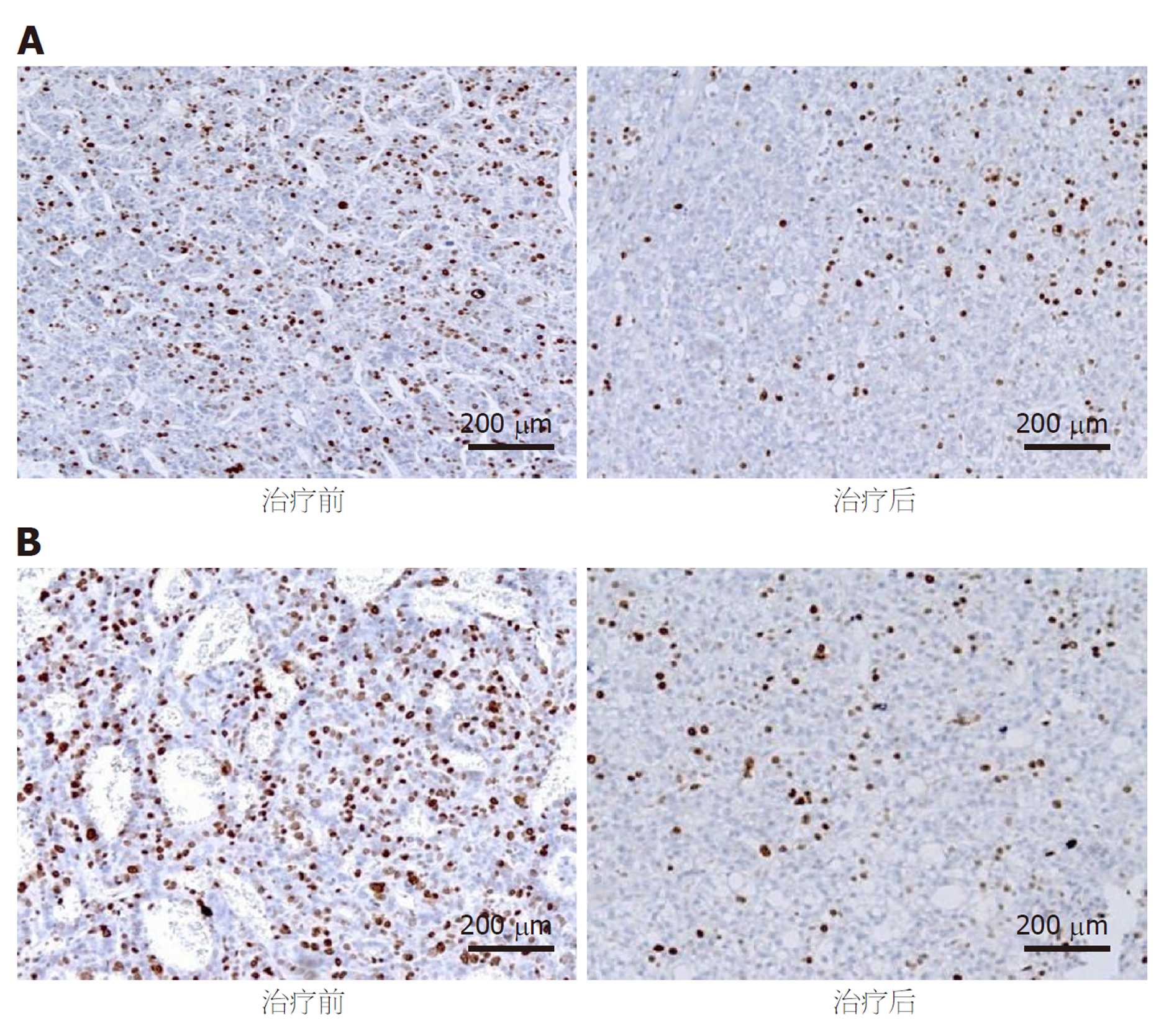
组间比较, 两组治疗前血清VEGF、bFGF水平及MVD相比, 差异无统计学意义, 观察组治疗后血清VEGF、bFGF水平及MVD均低于对照组(P<0.05); 组内比较, 两组治疗后上述各指标均较本组治疗前降低(P<0.05). 见表4. MVD免疫组化检测图片见图1.
组间比较, 两组治疗前组织PD-L1、PD-1水平相比, 差异无统计学意义, 观察组治疗后组织PD-L1、PD-1水平均低于对照组(P<0.05); 组内比较, 两组治疗后上述各指标水平均较本组治疗前降低(P<0.05). 见表5.
两组治疗期间不良反应发生率相比, 差异无统计学意义(P>0.05). 见表6.
| 组别 | 例数 | 恶心 | 呕吐 | 腹痛 | 发热 | 乏力 |
| 观察组 | 56 | 4(7.14) | 3(5.36) | 8(14.29) | 4(7.14) | 5(8.93) |
| 对照组 | 56 | 8(14.29) | 6(10.71) | 12(21.43) | 7(12.50) | 8(14.29) |
| χ2 | 1.493 | 0.483 | 0.974 | 0.907 | 0.783 | |
| P | 0.222 | 0.487 | 0.324 | 0.341 | 0.376 |
肝细胞癌的发病具有隐匿性, 且进展快、恶性程度高, 多数患者首次确诊时已错过手术治疗时机, 预后非常差. 国内外指南[13,14]均推荐采用肝动脉栓塞化疗治疗无法手术的肝细胞癌患者, 其通过将导管超选择插入肿瘤供血动脉、注入栓塞剂使之闭塞, 引起肿瘤组织缺血坏死, 是治疗肝细胞癌的可靠方法.
本研究发现, 采用传统肝动脉栓塞化疗对老年肝细胞癌患者进行治疗, 可获得良好治疗效果, 但仍有较多患者病情未得到有效缓解. 传统肝动脉栓塞化疗通常采用碘化油与化疗药混合乳液作为栓塞材料, 治疗过程中无法稳定肿瘤局部药浓度, 且癌周侧支循环冲刷导致碘油流失, 加之碘油可降解, 均会影响疗效[15].
本研究发现, 采用HepaSphere载药脂微球结合肝动脉栓塞化疗治疗老年肝细胞癌的总有效率明显高于传统肝动脉栓塞化疗, 提示HepaSphere载药脂微球的应用可显著改善治疗效果. HepaSphere载药微球是一种新型不可降解型载药微球, 治疗前事先对微球进行化疗药物球加载, 通过加载正电荷蒽环类化疗药并缓慢释放, 可使化疗药物与肿瘤接触时间延长, 并降低药物毒性, 同时能够有效地提高局部化疗药物浓度, 降低外周血药物浓度, 从而保护肝功能, 增强疗效[16]. 本研究结果2.2显示, 传统肝动脉栓塞化疗、载药脂微球结合肝动脉栓塞化疗均能明显下调患者血清AFP、CEA、CA199、TK-1水平, 而后者作用更明显. 其中AFP被证实在80%左右肝癌患者的血清中呈高表达状态, 是评估病情和疗效的理想指标[17]; CEA为广谱性肿瘤标志物, CA199主要由肿瘤细胞表面的抗原物质或是肿瘤细胞产生, 二者在肝癌患者血清中明显升高, 明确其水平变化可辅助临床监测病情发展、评估疗效和预后[18,19]; TK-11是细胞DNA合成周期S期特异性激酶, 与细胞增殖密切相, 肿瘤细胞DNA合成剧增, 导致TK-11水平异常升高[20]. 由此可见, 载药脂微球结合肝动脉栓塞化疗能进一步增强抗肿瘤效果, 从而明显下调上述肿瘤标志物水平. 资料显示, 肝癌的发生、转移与新生肿瘤血管形成密切相关, 而肿瘤血管形成则受多种生成因子的调控, VEGF、bFGF及MVD均为反映肿瘤血管形成的指标, 其水平越高提示肿瘤组织内新生血管数量越多, 肿瘤增殖、侵袭、转移等恶性生物学行为越强[21]. 本研究发现载药脂微球结合肝动脉栓塞化疗能明显下调患者血清VEGF、bFGF水平及MVD, 提示其在抑制肿瘤血管形成方面具有明显优势, 可能也是其增强抗肿瘤效果的主要机制之一.
肝细胞癌的发病机制非常复杂, 随着肿瘤免疫学研究的深入, 发现肿瘤细胞可通过多种策略逃离宿主免疫监视与杀伤作用. PD-1/PD-L1通路的激活被证实是介导肿瘤细胞免疫逃逸的重要途径[22]. 周晓思等[23]、哈福双等[24]研究均证实肝癌组织中PD-L1、PD-1表达明显升高, 具有促进肝癌进展的作用. 本研究发现载药脂微球结合肝动脉栓塞化疗在下调肝癌组织中PD-L1、PD-1表达水平方面同样具有显著优势, 提示其能通过抑制PD-1/PD-L1通路, 从而增强机体免疫功能的抗肿瘤作用. 且本研究发现载药脂微球结合肝动脉栓塞化疗并未增加不良反应发生率, 且能明显改善患者生存情况, 进一步证实其是一种治疗老年肝细胞癌患者的安全、可靠方案. 需要指出的是, HepaSphere载药微球加载药物后会发生膨胀, 本研究采用的是50-100 μm规格的HepaSphere载药微球, 加载化疗药物后其粒径膨胀至200-300 μm, 对肿瘤远端血管栓塞能力不尽理想, 但并不会对其整体疗效造成明显影响.
综上可知, 对老年肝细胞癌开展载药脂微球结合肝动脉栓塞化疗治疗, 可有效抑制癌组织中PD-L1、PD-1表达及肿瘤微血管生成, 进一步下调血清AFP、CEA、CA199、TK-1水平, 明显提高治疗效果, 有效改善患者生存情况, 且具有一定安全性, 具有较高推广应用价值.
不少老年肝癌患者不适宜采取手术治疗, 目前肝动脉栓塞化疗是治疗非手术肝癌常见的方式, 肿瘤的复发和患者生存期的延长均有所改善, 但是依然存在肿瘤供血血管难以完全栓塞坏死, 无法彻底消除残留的不足.
针对肝动脉栓塞化疗无法有效根除老年患者肝癌的情况, 同时尚未有更有效的药物代替该方法, 因此联合治疗成为治疗该病最有前景的方式. 载药脂微球能够提高局部肿瘤药物的浓度, 延长药物时间, 延长患者生存期, 为进一步根除癌细胞提供借鉴.
本研究将载药脂微球治疗与肝动脉栓塞化疗治疗相结合, 观察对老年肝癌患者的生存获益以及免疫反应中程序性死亡分子1(programmed death-1, PD-1)及程序性死亡配体1(programmed death receptor 1, PD-L1)水平的变化. 为不方便进行手术治疗的老年肝癌患者提供临床治疗的借鉴.
本研究通过联合用药的治疗方法, 检测和随访获取相关数据, 统计学方法进行分析, 通过对照比较的方法, 验证联合用药组与单一用药组的差异, 突出载药脂微球治疗在肝癌治疗中的功效.
治疗后, 观察组总有效率高于对照组; 观察组血清甲胎蛋白(alpha feto protein, AFP)、癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原199(carbohydrate antigen 199, CA199)、胸苷激酶1(thymidine kinase 1, TK-1)水平和组织中PD-L1、PD-1水平均低于对照组; 两组以上各指标较本组治疗前均降低. 观察组治疗后1年、2年生存率较对照组高.
载药脂微球治疗联合肝动脉栓塞化疗治对老年肝癌患者的治疗效果更好, 可有效控制相关因子表达水平, 且生存期限更长, 为载药脂微球治疗在肝癌中的进一步治疗提供有力支撑.
载药脂微球治疗可以辅助化疗取得更有益的治疗效果, 但是载药脂微球受到使用方法、术者技术和载药饱和度等因素影响, 因此还需加大对载药微球稳定性的进一步研究以保证最佳效果的可持续性.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 4. | 刘 娟芳, 段 旭华, 任 建庄, 焦 德超, 韩 新巍. CalliSpheres载药微球与碘油经导管动脉化疗栓塞治疗原发性巨块型肝癌的疗效对比. 中华肝脏病杂志. 2019;27:460-462. [DOI] |
| 6. | Kennoki N, Saguchi T, Sano T, Takara Y, Moriya T, Shirota N, Otaka J, Chiba N, Kawachi S, Serizawa H, Koizumi K, Tokuuye K. Long-term Histopathologic Follow-up of a Spherical Embolic Agent; Observation of the Transvascular Migration of HepaSphereTM. BJR Case Rep. 2019;5:20180066. [PubMed] [DOI] |
| 9. | 中国抗癌协会肝癌专业委员会, 中华医学会肝病学分会肝癌学组, 中国抗癌协会病理专业委员会, 中华医学会病理学分会消化病学组, 中华医学会外科学分会肝脏外科学组, 中国抗癌协会临床肿瘤学协作专业委员会, 全国肝胆肿瘤及移植病理协作组. 中华肝脏病杂志. 2015;23:321-327. [DOI] |
| 10. | Thuluvath PJ, Thuluvath AJ, Savva Y. Karnofsky performance status before and after liver transplantation predicts graft and patient survival. J Hepatol. 2018;69:818-825. [PubMed] [DOI] |
| 11. | Vogel A, Cervantes A, Chau I, Daniele B, Llovet JM, Meyer T, Nault JC, Neumann U, Ricke J, Sangro B, Schirmacher P, Verslype C, Zech CJ, Arnold D, Martinelli E. Hepatocellular carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2019;30:871-873. [PubMed] [DOI] |
| 14. | Meyers BM, Knox J, Cosby R, Beecroft JR, Chan KKW, Coburn N, Feld J, Jonker D, Mahmud A, Ringash J; Gastrointestinal Disease Site Group. Nonsurgical management of advanced hepatocellular carcinoma: a clinical practice guideline. Curr Oncol. 2020;27:e106-e114. [PubMed] [DOI] |
| 16. | 陈 猛, 许 荣德, 胡 宝山, 陈 晓明, 李 伟科, 周 泽健, 庄 文行, 麦 启聪. HepaSphere载药微球栓塞治疗原发性肝癌的近期疗效及安全性. 肿瘤防治研究. 2019;46:627-631. [DOI] |
| 21. | 段 彬, 罗 成静, 罗 海阳. Callispheres可载药栓塞微球联合多西紫杉醇TACE对原发性肝癌患者bFGF VEGF和MVD的影响. 河北医学. 2019;25:14-18. [DOI] |