修回日期: 2019-03-13
接受日期: 2019-03-24
在线出版日期: 2019-04-28
近距离放射治疗是治疗癌症的靶向放射疗法, 类弹性蛋白多肽(elastin-like peptide, ELP)是一种人工合成的弹性蛋白, 其具有的自组装性、温度响应性和非免疫原性等独特优势, 为其成为放射性核素131I的载体提供了可能.
制备放射性核素131I标记的ELP, 研究不同放射性浓度131I-ELP对兔VX2肝癌模型近距离放射治疗的有效性及差异性, 为其临床应用提供依据.
应用Iodogen法对ELP进行131I碘化标记, 制备100 mCi/mL和50 mCi/mL放射浓度的131I-ELP; 在B超引导下将不同浓度131I-ELP药物及ELP溶液随机注入15只VX2模型兔的肝肿瘤内进行近距离放射性治疗及空白对照观察, 以注入100 mCi/mL 131I-ELP为高放射浓度治疗组(H组, n = 5); 注入50 mCi/mL 131I-ELP为低放射浓度治疗组(L组, n = 5)及注入ELP溶液为空白对照组(C组, n = 5). 治疗后, 定期行B超及血液学检查以观察治疗效果, 治疗组行单光子发射计算机断层扫描/计算机断层扫描(single-photon emission computed tomography/computed tomography, SPECT/CT)检查, 观察三组动物的自然生存时间和病理学检查.
H组的动物生存期最长(61.4 d±10.50 d), L组的动物生存期为(52.6 d±8.85 d), C组的动物生存期最短(39.2 d±5.63 d), 三组之间有显著差异(P<0.05). 治疗后7 d、14 d, SPECT/CT示治疗组的放射性持续位于肿瘤内部. H和L组的肿瘤生长率显著低于C组(P<0.05). H和L组治疗后7 d、14 d肝功能指标丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase, AST)显著低于C组(P<0.05), 治疗后7 d L组的ALT水平显著低于H组(P<0.05); 治疗后14 d, L组AST数值显著低于H组(P<0.05), 提示H组的肝功能受损更严重. 治疗后7 d、14 d三组Hb、RBC计数无显著差异. 病理组织学检查示H组癌旁正常肝组织存在小叶中央静脉淤血、肝窦及汇管区小胆管扩张、肝内纤维增生, 在肿瘤组织内发现大片状坏死. L组的癌旁正常组织则仅见少量纤维增生.
131I-ELP近距离放射疗法可杀伤肝癌细胞, 放射性浓度为100 mCi/mL的131I-ELP较50 mCi/mL的杀伤作用更强, 但其放射性损伤也更大.
核心提要: 类弹性蛋白多肽(elastin-like peptide, ELP)作为一种新型生物医学材料, 一直是近年来药物载体、药物控释研究领域的热点, 本研究拟探讨其作为放射性核素131I的载体近距离放射治疗兔的VX2肝癌模型的有效性及不同放射性浓度131I-ELP疗效的差异性.
引文著录: 李茜, 刘欣培, 王多伟, 申一鸣, 贾强, 刘文天. 不同浓度131I-ELP近距离放射治疗兔VX2肝癌模型的实验研究. 世界华人消化杂志 2019; 27(8): 485-493
Revised: March 13, 2019
Accepted: March 24, 2019
Published online: April 28, 2019
Brachytherapy is a targeted radiation therapy for cancer. The elastin-like peptide (ELP) is a genetically engineered peptide that has unique advantages such as self-assembly, temperature responsiveness, and non-immunogenicity, which make it possible to become the carrier of the radionuclide 131I.
To evaluate the effectiveness of brachytherapy in a rabbit model of VX2 liver tumor using elastin-like polypeptide as a radionuclide 131I carrier and compare the effectiveness of 131I-ELP at different radioactive concentrations to provide evidence for its clinical application.
ELP as a carrier was labeled with 131I by the iodogen method, and different concentrations of 131I-ELP were prepared. Under ultrasound guidance, different concentrations of 131I-ELP and ELP solution were randomly injected into 15 rabbits with VX2 liver tumor for brachytherapy and blank control observation. The rabbits were divided into the following groups: high-dose radiation group (injection with 100 mCi/mL 131I-ELP; group H, n = 5); low-dose radiation group (injection with 50 mCi/mL 131I-ELP; group L, n = 5); and blank control group (injection with ELP solution; group C, n = 5). Periodic biochemical and sonographic examinations were performed to assess the therapeutic efficacy after treatment. Single-photon emission computed tomography/computed tomography (SPECT/CT) was additionally performed in the treatment groups. The natural survival time of animals in the three groups was determined. In addition, histopathological examination was performed.
The survival time of animals was the longest in group H (61.4 d ± 10.50 d) and the shortest (39.2 d ± 5.63 d) in group C. The survival time of animals in group L was 52.6 d ± 8.85 d. Significant differences were observed in the survival time among the three groups (P < 0.05). At 7 and 14 d after treatment, SPECT/CT showed that 131I-ELP was continuously localized in liver tumors in groups H and L. The tumor growth rates in groups H and L were significantly lower than that in group C (P < 0.05). Alanine aminotransferase (ALT) and aspartate aminotransferase (AST) at 14 d after treatment in groups H and L were significantly lower than those in group C (P < 0.05). At 7 d after treatment, ALT level in group L was significantly lower than that in group H (P < 0.05). At 14 d after treatment, AST value in group L was significantly lower than that in group H (P < 0.05), suggesting that group L is better than group H with regard to ameliorating ALT and AST levels (P < 0.05). There were no significant differences in Hb or RBC levels between the three groups at 7 and 14 d after treatment. Histopathological examination showed that normal tissues around the tumor in group H were destroyed; proliferation of cord-like fibers, expansion of hepatic sinus, and dilatation of small bile ducts in the portal area were observed. In group L, no radioactive damage was observed in normal liver tissues around the tumor.
131I-ELP brachytherapy has curative effects in inhibiting tumor growth. 131I-ELP at a radiation dose of 100 mCi/mL inhibits tumor growth better than 131I-ELP at a radiation dose of 50 mCi/mL; however, the higher dose causes greater radiation damage to normal liver tissues around the tumor.
- Citation: Li Q, Liu XP, Wang DW, Shen YM, Jia Q, Liu WT. Brachytherapy using elastin-like polypeptide with different concentrations of 131I for treatment of VX2 liver tumor in rabbits. Shijie Huaren Xiaohua Zazhi 2019; 27(8): 485-493
- URL: https://www.wjgnet.com/1009-3079/full/v27/i8/485.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i8.485
世界上每年约有75万肝癌新发病例, 其中一半发生在中国. 原发性肝癌是我国常见的恶性肿瘤之一, 是社会和人民沉重的负担[1]. 肝癌的治疗方法主要有手术、放疗、化疗、局部射频消融和肝移植等, 但其复发率高、预后差预示着现有治疗方法的局限性[2]. 放射性粒子植入是肝癌局部治疗的有效方法, 其通过持续低剂量辐射, 能最大程度杀伤肿瘤细胞[3]. 为使剩余正常肝组织能够得到再生, 放疗野的设计便成为放射性粒子植入的关键, 类弹性蛋白多肽(elastin-like peptide, ELP)因其可注射、可自组装、可降解及良好的的生物相容性[4,5], 有望成为新型核素载体. 本实验拟探讨ELP作为放射性核素131I的载体近距离放射治疗兔VX2肝癌模型的有效性及不同放射性浓度治疗效果的差异性.
VX2荷瘤兔2只(南京市华兔生物有限公司); 健康新西兰大白兔18只, 雌雄各半, 平均体质量3.5-4.5 kg, 月龄3-4 mo(天津市奥臣实验动物销售有限公司); 1%碘化钾口服液(天津医科大学总医院); Na - I131溶液(天津医科大学总医院); ELP由美国Duke大学生物医学工程系设计合成, 分子量为50 kDa, 其含有120个五肽(VPGXG)重复序列, 相变温度为23.82 ℃, 羧基端添加7个酪氨酸残基以便于同位素的标记[6]; 无菌实验台; 兔解剖台; 高压灭菌器; 动物手术器械包; 游标卡尺; ALOKA Prosound超声诊断仪; Discovery NM/CT 670单光子发射计算机断层扫描/计算机断层扫描(single-photon emission computed tomography/computed tomography, SPECT/CT); 无菌纱布; 无菌洞巾; 注射器; 采血针等, 以上仪器由天津医科大学总医院提供.
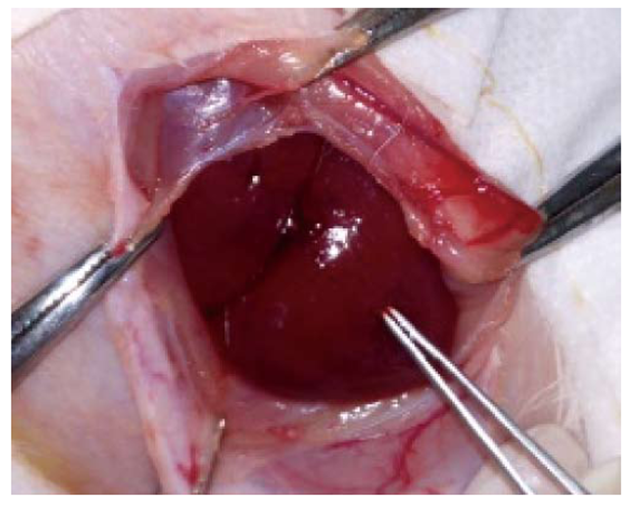
1.2.1 建立兔肝癌模型, 检测治疗前的基线指标: 采用直视下肿瘤组织小块包埋法建立兔VX2肝癌模型(图1), 应用B超监测肝脏肿瘤的生长情况, 将建模14 d经B超检查确认有肝癌生长的动物随机分为高放射浓度治疗(H)组(n = 5), 低放射浓度治疗(L)组(n = 5)和空白对照(C)组(n = 5), 记录建模14 d后瘤体最长径(a)和最短径(b), 按照体积计算公式(V = 1/2×ab2)计算出肿瘤体积; 经耳缘静脉采取兔外周静脉血, 使用血液分析仪检测血常规, 使用全自动生化分析仪检测兔丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase, AST); 于治疗前一周至治疗结束在动物饮用水中加入1%碘化钾, 以防其甲状腺摄取放射性碘.
1.2.2 制备131I-ELP并检测其稳定性: 依据造模后14 d B超量取的肿瘤体积, 计算出所需131I-ELP的体积(40 μL/150 mm3)[6], 计算公式为V药 = V瘤/150×40, H组所需Na-I131 = V药×100, L组所需Na-I131 = V药×50, 具体注射体积见(表1), 采用iodogen法对ELP进行131I碘化标记并配置成放射性浓度为50 mCi/mL及100 mCi/mL溶液, 置于冰浴中备用; 使用同位素纸层析法分别于配置后0 h, 24 h, 48 h, 72 h和96 h测定131I-ELP的放射化学纯度, 以评估其体外稳定性.
| 分组 | 放射性活度/mCi | 131I-ELP/μL |
| H组(100 mCi/mL 131I-ELP溶液) | 16.0 | 160 |
| 15.2 | 152 | |
| 17.3 | 173 | |
| 14.4 | 144 | |
| 16.8 | 168 | |
| L组 (50 mCi/mL131I-ELP溶液) | 8.8 | 176 |
| 10.0 | 200 | |
| 10.4 | 208 | |
| 9.2 | 184 | |
| 9.6 | 192 | |
| C组 (ELP溶液) | - | 160 |
| - | 208 | |
| - | 189 | |
| - | 152 | |
| - | 181 |
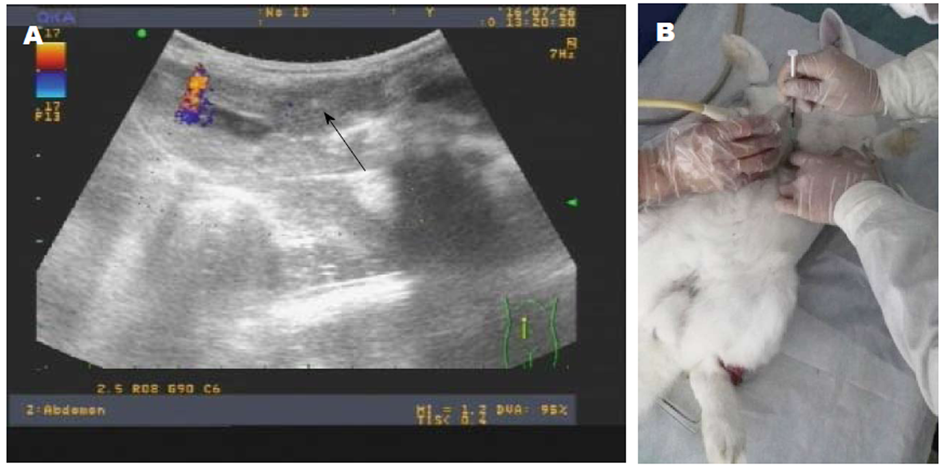
1.2.3 放射治疗: 实验兔麻醉(10%水合氯醛溶液, 5 mL/kg腹腔注射), 在B超引导下定位肝脏肿瘤, 确定穿刺的部位、方向及深度, 避开血管, 分别将放射性浓度为50 mCi/mL、100 mCi/mL 131I-ELP溶液及ELP溶液注入肿瘤内, 停留60 s后拔针, 使用纱布进行加压包扎, 超声图像及治疗过程见(图2); H和L组动物注入药物后, 利用SPECT/CT扫描观察放射性药物是否成功植入.
1.2.4 影像学监测: 三组在治疗后7 d、14 d行B超检查, 量取肿瘤最长径和最短径, 得出肿瘤体积及肿瘤增长率; 分别于治疗后7 d、14 d为H、L组行SPECT/CT检查放射性131I的组织分布.
1.2.5 检测肝功能及血常规数值: 三组动物均于治疗后7 d和14 d在兔耳缘静脉取血, 采用全自动生化分析仪检测ALT与AST水平, 采用血液分析仪检测兔血常规.
1.2.6 记录动物生存期: 观察自肿瘤植入日起三组动物的自然生存时间.
1.2.7 病理组织学检查: 动物自然死亡后进行尸检, 离体观察肝脏肿瘤及其周围组织器官情况并进行组织病理学检查, 观察是否出现腹腔内出血及腹膜炎等并发症.
统计学处理 实验数据采用SPSS 23.0统计软件进行分析, 计量资料以mean±SD表示, 组间计量资料比较使用单因素方差分析; 两组间比较采用SNK(Student-Newman-Keuls)q检验; P<0.05时有统计学意义.
131I-ELP在冰浴条件中存放96 h, 其放化纯度仍能维持在97.3%.
H组、L组和C组治疗前(VX2肝癌建模后第14天)的肿瘤体积、肝功能(ALT、AST)和血常规(Hb、RBC)等基线指标无显著差异(表2和表3)
| 治疗前基线指标 | 最大径(cm) | 最小径(cm) | 体积(cm3) |
| H组 | 1.48 ± 0.09 | 0.90 ± 0.05 | 0.60 ± 0.06 |
| L组 | 1.50 ± 0.12 | 0.99 ± 0.07 | 0.72 ± 0.06 |
| C组 | 1.35 ± 0.05 | 1.00 ± 0.10 | 0.69 ± 0.14 |
| F值 | 2.18 | ||
| P值 | 0.16 |
| 治疗前基线指标 | AST(U/L) | ALT(U/L) | Hb(g/L) | RBC(×1012/L) |
| H组 | 42.75 ± 15.88 | 35.25 ± 9.88 | 118.00 ± 5.89 | 5.92 ± 0.39 |
| L组 | 34.25 ± 7.50 | 23.75 ± 5.32 | 121.50 ± 7.33 | 5.60 ± 0.36 |
| C组 | 41.50 ± 11.82 | 36.00 ± 8.41 | 121.25 ± 7.37 | 5.89 ± 0.55 |
| F值 | 0.56 | 2.88 | 0.32 | 0.65 |
| P值 | 0.59 | 0.11 | 0.73 | 0.54 |
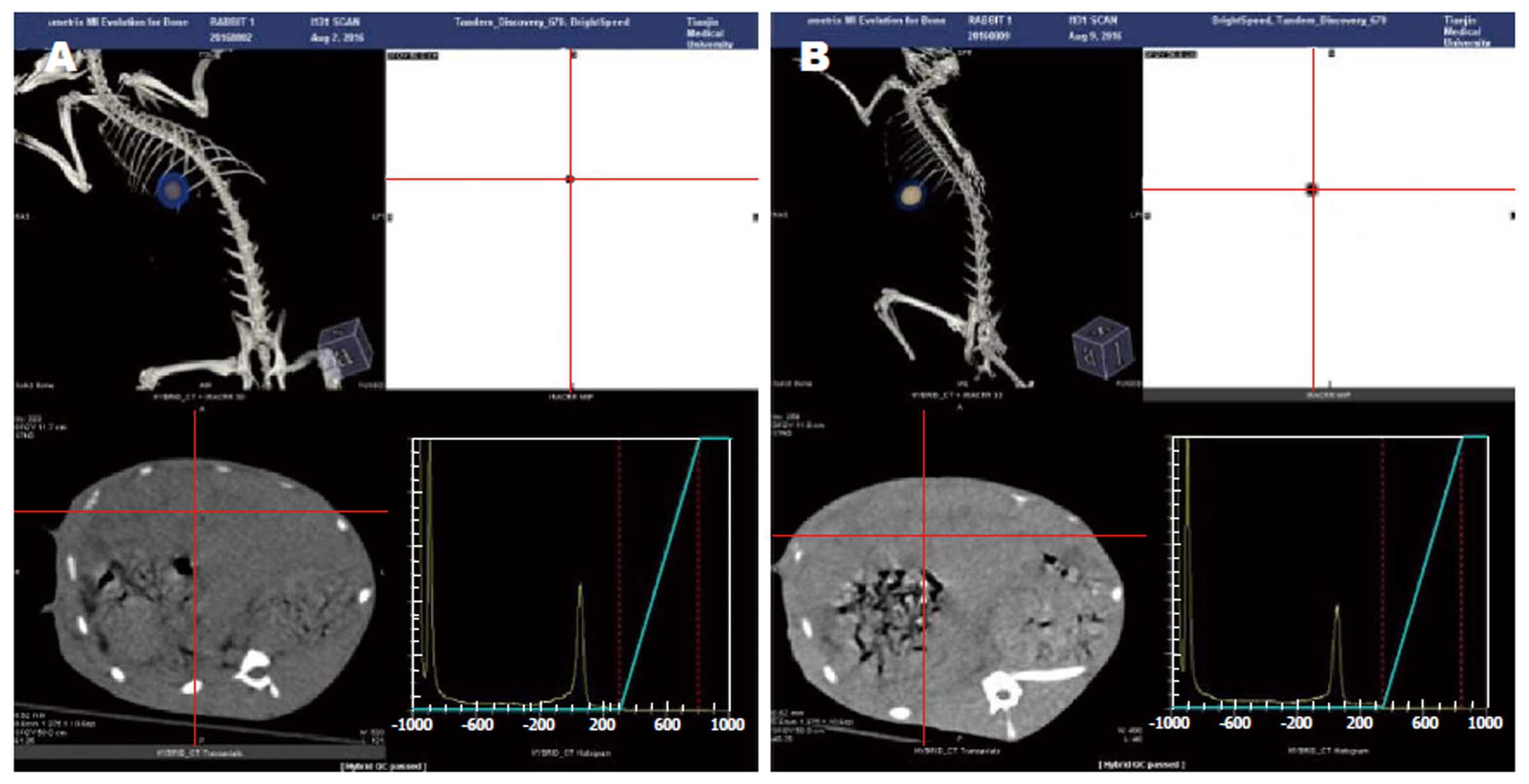
治疗后7 d、14 d的SPECT/CT结果示治疗组的放射性持续位于肿瘤内部, 未见其它放射性摄取组织(图3).
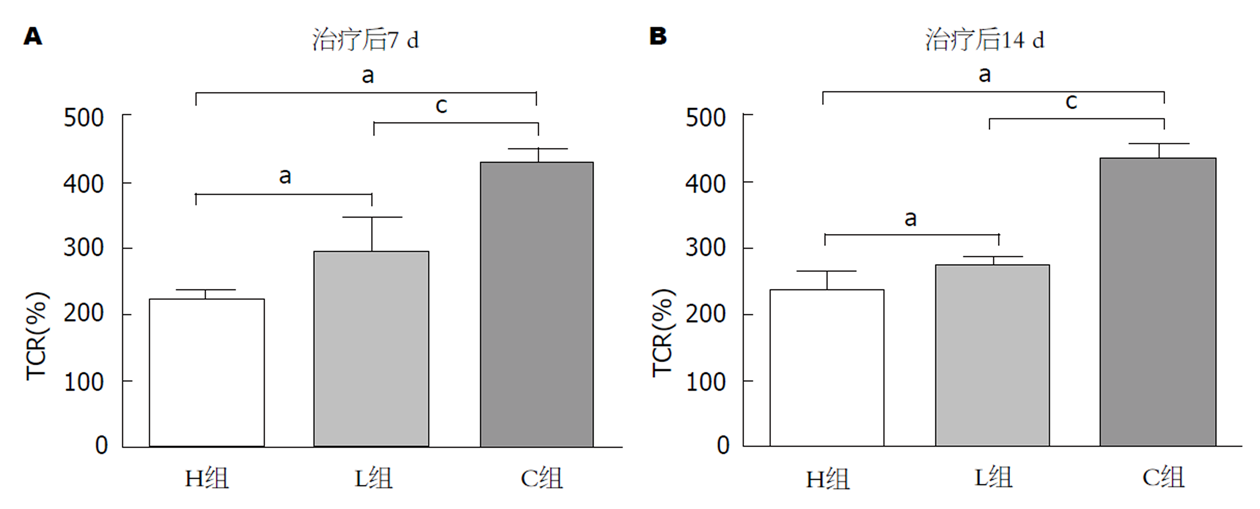
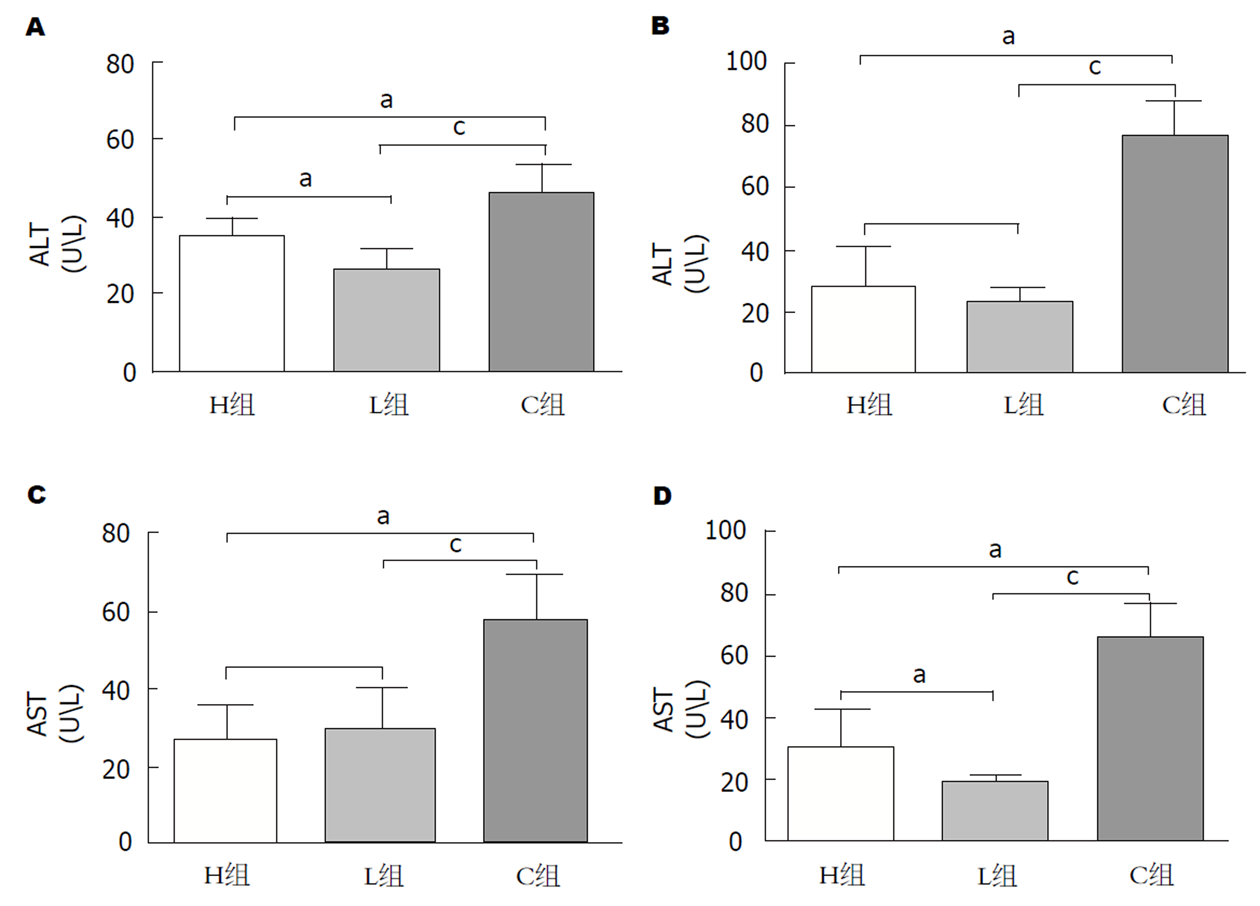
随着时间的推移, 治疗后三组肿瘤体积较治疗前均出现进行性增加(图4A和B), H组肿瘤生长率(tumor growth rate, TGR)最小, C组TGR最大, 三组比较有显著性差异(P<0.05).
随着时间的推移, 治疗后H和L组动物的血清ALT、AST出现了先升高后降低的变化, C组ALT、AST数值则持续上升(图5). 治疗后7 d L组动物ALT数值最低, C组ALT数值最高, 三组差异有统计学意义(P<0.05), C组AST数值显著高于H和L组(P<0.05), 但H和L组的AST数值无显著差异; 治疗后14 d C组ALT数值显著高于H和L组(P<0.05), 而H组和L组的ALT水平无显著差异, L组动物AST数值最低, C组AST数值最高, 三组差异具有统计学意义(P<0.05). 三组动物Hb、RBC计数无显著差异(表4).
| 治疗后7 d | 治疗后14 d | |||
| Hb(g/L) | RBC(×1012/L) | Hb(g/L) | RBC(×1012/L) | |
| H组 | 109.50 ± 11.79 | 5.43 ± 0.66 | 100.50 ± 10.02 | 4.50 ± 0.43 |
| L组 | 117.00 ± 7.44 | 5.52 ± 0.22 | 102.50 ± 15.44 | 4.65 ± 0.61 |
| C组 | 119.50 ± 8.27 | 6.07 ± 0.61 | 108.75 ± 14.97 | 5.77 ± 0.68 |
| F值 | 1.28 | 1.70 | 0.40 | 3.87 |
| P值 | 0.34 | 0.24 | 0.69 | 0.06 |
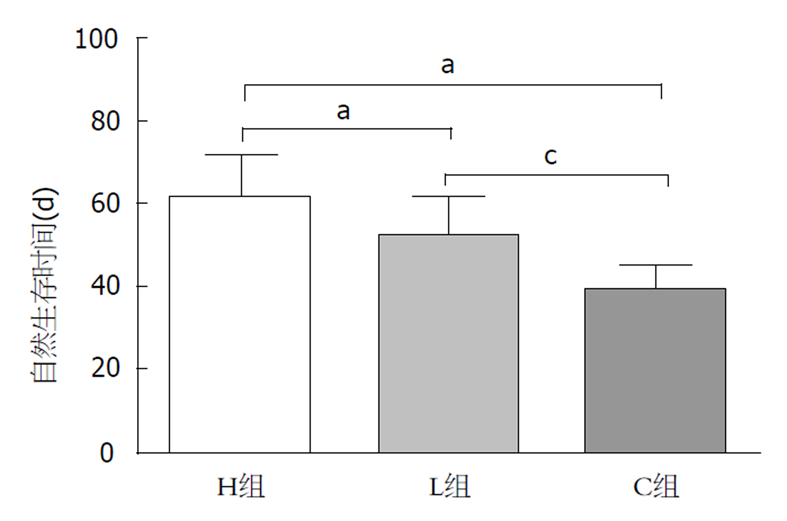
分析自然生存时间(自肿瘤种植之日算起, 图6)发现, H组为61.4 d±10.50 d, L组为52.6±8.85 d, C组为39.2 d±5.63 d, 三组动物的生存期相比较有统计学差异(P<0.05).
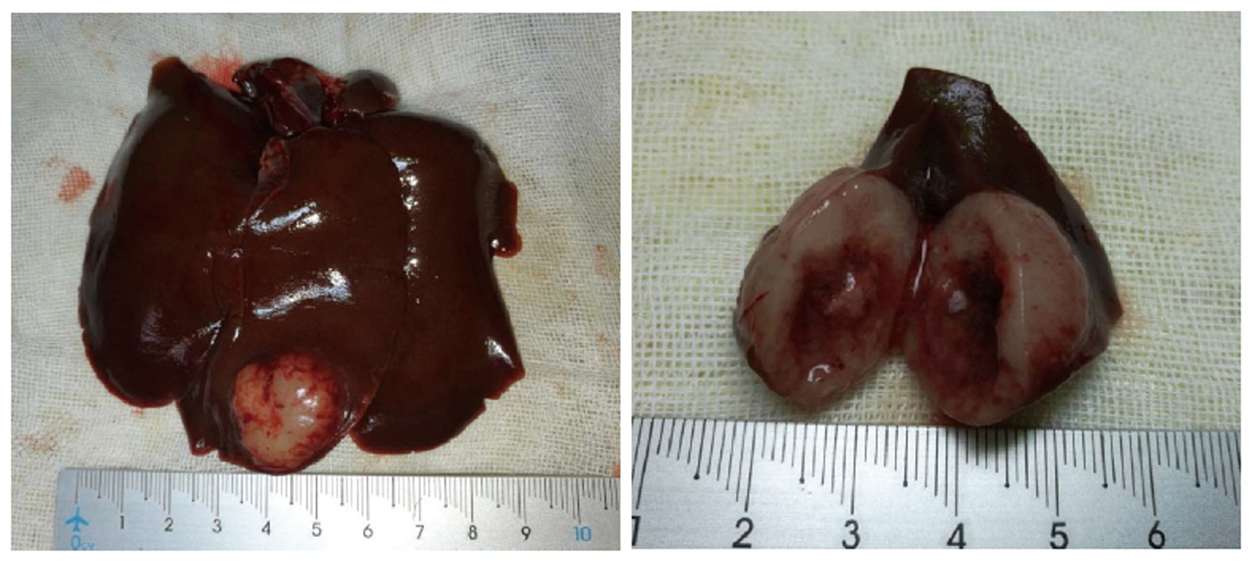
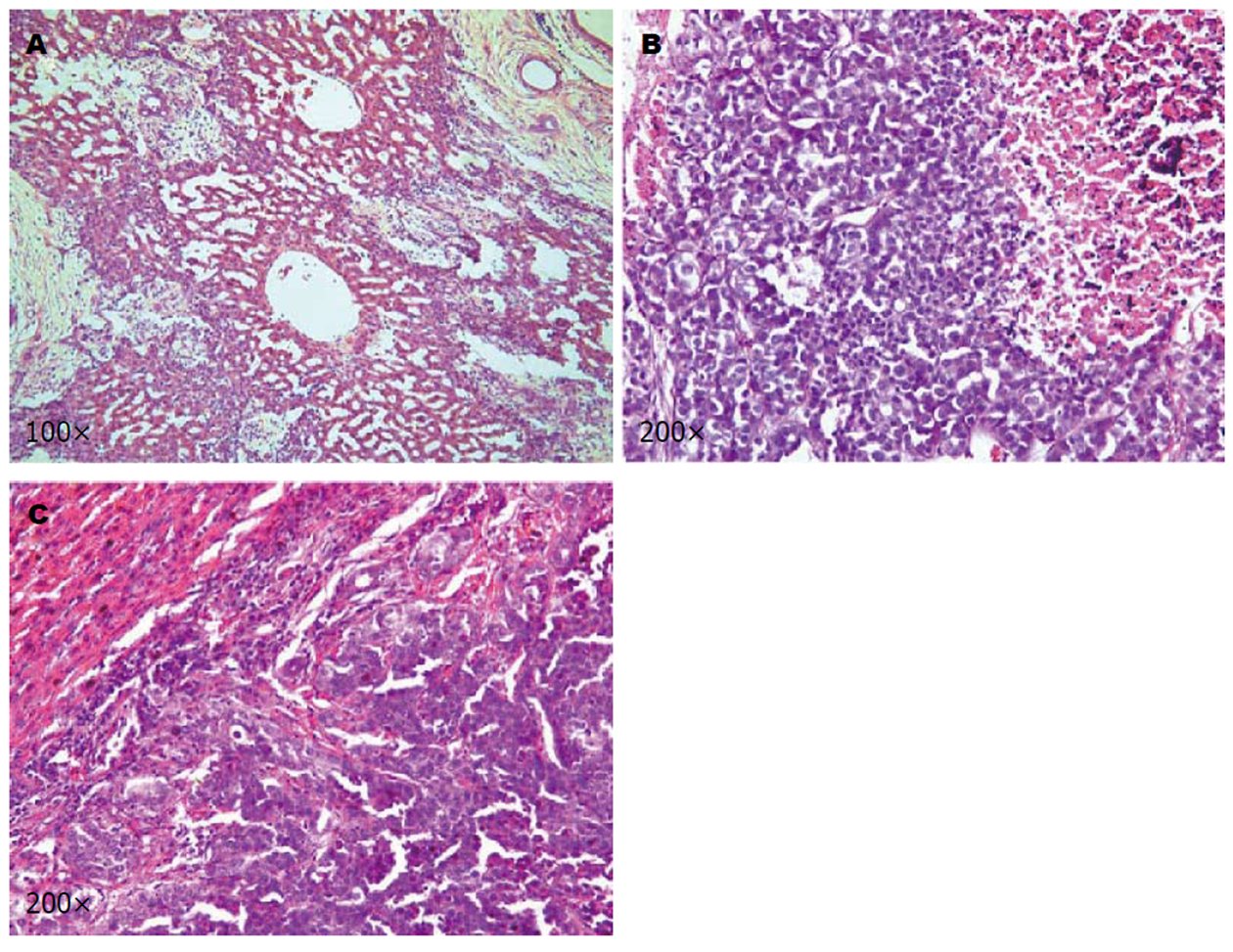
动物死亡后尸检发现, H组动物未见有腹膜炎和腹腔积液等并发症, L组一只(20%)出现腹膜炎, C组一只(20%)出现腹腔积液、一只(20%)出现肺转移. VX2肝癌与正常组织边界清晰, 瘤体呈圆形或椭圆形, 质硬, 切面中心可见黄白色干酪样坏死物(图7).
肝癌是世界上癌症相关死亡的第二大原因, 过去二十年来, 与肝癌相关的年死亡率显著增加, 其中大多数来自亚太地区[7]. 因肝癌起病隐匿, 早期症状不典型, 有超过70%的肝癌患者发现即为中、晚期, 失去了手术切除的机会[2], 这严重影响了肝癌患者的总体预后. 因此, 肝癌的非手术治疗显得尤为重要. 近距离放射治疗不受肿瘤位置和大小影响, 适用于大多数的肝癌患者[8], 其植入的放射性粒子能够精准、持续地发出射线, 从而杀伤肿瘤细胞、抑制肿瘤的生长. 131I因其可在短距离衰减并在目标部位保持较高的累计计量, 且能减少邻近正常组织损害等优点被广泛应用于肿瘤的治疗[9]. 有研究发现, 与单独应用射频消融术相比, 联合应用放射性125I可显著降低小肝癌的复发率并延长其生存期[10]. ELP是一种新型生物医学材料, 因其可逆温敏相变性、良好的组织相容性、可降解性等优点, 一直是近年来药物载体、药物控释研究领域的热点[11,12]. 我们的前期研究发现, 应用ELP作为一种内镜黏膜下剥离术的黏膜注射液, 可持久地维持黏膜厚度并减少出血量, 有利于黏膜的剥离和切除[13]. 凝胶状的ELP在体内可以存留7 d以上, 131I的有效半衰期为3.5-5 d, 一般4个半衰期后放射性残留基本消失, 根据SPECT/CT显示, 治疗14 d后131I仍持续位于肿瘤内. ELP这一特性大大减少了放射性物质的迁移, 从而更精准地杀伤肿瘤细胞. 使用131I-ELP对人前列腺癌裸鼠移植癌进行近距离放射治疗, 发现植入一周后131I-ELP的瘤内保存率高达85%, 131I-ELP能有效延缓肿瘤生长及延长裸鼠的生存时间[6]. 动物实验发现, 以ELP为载体携带131I对兔VX2肝癌进行放射性治疗可显著抑制肿瘤生长并改善肝功能[14]. 本次研究在B超引导下将放射性131I-ELP直接注入动物的肝肿瘤内, 不经血液循环代谢, 提高了131I在肿瘤局部的治疗效果. 分析实验中的TGR结果发现, 与C组相比, 100 mCi/mL、50 mCi/mL两种放射性浓度的131I-ELP均可抑制肿瘤生长, 且放射性浓度较高的H组的肿瘤抑制效果更强. 分析治疗前后血中AST、ALT水平的变化, 发现在治疗后7 d, H、L组的AST、ALT水平升高而后在治疗后14 d下降, 原因可能为131I的有效半衰期为3.5-5 d, 放射性核素的第一个半衰期杀伤作用最强, 使癌旁正常肝细胞变性坏死, 因此, ALT、AST出现短暂上升, 随着放射性核素的衰减, ALT、AST水平逐渐下降, 因此, 我们认为131I-ELP可改善肝功能的恶化, 其中放射性浓度为50 mCi/mL的L组的治疗效果更佳, 镜下观察病理组织切片发现, H组的癌旁正常肝组织破坏较L组严重, 分析原因可能为100 mCi/mL的H组对癌旁正常组织的损伤更大. 分析治疗前后血Hb、RBC含量发现, 131I-ELP无骨髓抑制等副作用. 比较实验动物生存期可见, 131I-ELP放射性治疗可延长肝癌动物的生存时间, 且放射性浓度越高, 生存期越长.
总之, 131I-ELP可抑制肝癌细胞的生长、延缓肝功能的恶化、延长动物生存时间且无骨髓抑制等副作用, 说明131I-ELP近距离放射疗法对兔VX2肝癌具有肯定的疗效; 其中放射性浓度为100 mCi/mL的131I-ELP抑癌效果更强, 但也对癌旁正常肝组织造成了更大的伤害. 因此, 还需进一步实验以优化放疗药物的浓度或增加治疗频率, 使131I-ELP对肝癌的近距离放射疗法的安全性和有效性达到平衡, 令患者获得最大的收益.
近距离放射性治疗是一种将放射性粒子植入肿瘤组织内以精准杀伤肿瘤细胞的治疗手段, 但植入与移除操作复杂、植入粒子易迁移等缺点限制了它的应用, 因此, 迫切需要一种新的给药系统以替代传统的放射性治疗方法.
本研究拟通过寻找一种植入和移除操作过程简便、安全性较高的物质作为放射性核素的载体, 以开发出传统近距离放射治疗的替代方案.
探索不同放射性浓度131I-类弹性蛋白多肽(elastin-like peptide, ELP)近距离放射治疗对VX2肝癌的有效性及差异性, 为肝癌的治疗提供可靠的实验依据.
本研究采用Iodogen法用131I对ELP标记, 在B超引导下将不同浓度的131I-ELP注入到兔的肝肿瘤内进行近距离放射性治疗, 定期进行影像学和生化监测以评估不同浓度131I-ELP的治疗效果. 该方法操作简便、定位精准, 安全可靠, 有望成为近距离放射性治疗的新方法.
影像学和生化监测结果表明, 131I-ELP进行近距离放射治疗可显著改善肝功能和抑制肿瘤生长, 高放射浓度治疗组抑制肿瘤的效果更强, 但其对癌旁正常组织的损伤也更大. 该研究为ELP作为131I的载体近距离放射性治疗肝癌的可行性和治疗剂量提供了实验依据.
131I-ELP具有较高的标记率和体外稳定性, 应用131I-ELP进行肝肿瘤的近距离放射治疗是高效、安全的治疗方法. 100 mCi/mL的高放射浓度组抑制肿瘤的效果更佳, 但放射性损伤更大. 本研究为肿瘤的近距离放射治疗提供了新思路, 有潜在的应用价值.
本研究发现高放射浓度组抑制肿瘤的效果更佳, 但放射性损伤更大, 应在后续实验中进一步优化放射性核素的剂量, 同时在分子水平等更深层次上探讨131I-ELP对肿瘤的影响.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | 孙 可欣, 郑 荣寿, 曾 红梅, 张 思维, 邹 小农, 顾 秀瑛, 夏 昌发, 杨 之洵, 李 贺, 陈 万青, 赫 捷. 2014年中国恶性肿瘤发病和死亡分析. 中华肿瘤杂志. 2018;40:5-13. [DOI] |
| 2. | Lee EW, Alanis L, Cho SK, Saab S. Yttrium-90 Selective Internal Radiation Therapy with Glass Microspheres for Hepatocellular Carcinoma: Current and Updated Literature Review. Korean J Radiol. 2016;17:472-488. [PubMed] [DOI] |
| 3. | Korean Liver Cancer Study Group (KLCSG); National Cancer Center, Korea (NCC). 2014 Korean Liver Cancer Study Group-National Cancer Center Korea practice guideline for the management of hepatocellular carcinoma. Korean J Radiol. 2015;16:465-522. [PubMed] [DOI] |
| 4. | Despanie J, Dhandhukia JP, Hamm-Alvarez SF, MacKay JA. Elastin-like polypeptides: Therapeutic applications for an emerging class of nanomedicines. J Control Release. 2016;240:93-108. [PubMed] [DOI] |
| 5. | Zhang W, Song Y, Eldi P, Guo X, Hayball JD, Garg S, Albrecht H. Targeting prostate cancer cells with hybrid elastin-like polypeptide/liposome nanoparticles. Int J Nanomedicine. 2018;13:293-305. [PubMed] [DOI] |
| 6. | Liu W, McDaniel J, Li X, Asai D, Quiroz FG, Schaal J, Park JS, Zalutsky M, Chilkoti A. Brachytherapy using injectable seeds that are self-assembled from genetically encoded polypeptides in situ. Cancer Res. 2012;72:5956-5965. [PubMed] [DOI] |
| 7. | Shariff MI, Cox IJ, Gomaa AI, Khan SA, Gedroyc W, Taylor-Robinson SD. Hepatocellular carcinoma: current trends in worldwide epidemiology, risk factors, diagnosis and therapeutics. Expert Rev Gastroenterol Hepatol. 2009;3:353-367. [PubMed] [DOI] |
| 8. | Schnapauff D, Collettini F, Steffen I, Wieners G, Hamm B, Gebauer B, Maurer MH. Activity-based cost analysis of hepatic tumor ablation using CT-guided high-dose rate brachytherapy or CT-guided radiofrequency ablation in hepatocellular carcinoma. Radiat Oncol. 2016;11:26. [PubMed] [DOI] |
| 9. | Jaber T, Waguespack SG, Cabanillas ME, Elbanan M, Vu T, Dadu R, Sherman SI, Amit M, Santos EB, Zafereo M, Busaidy NL. Targeted Therapy in Advanced Thyroid Cancer to Resensitize Tumors to Radioactive Iodine. J Clin Endocrinol Metab. 2018;103:3698-3705. [PubMed] [DOI] |
| 10. | Chen K, Chen G, Wang H, Li H, Xiao J, Duan X, He J, He K, Xiang G. Increased survival in hepatocellular carcinoma with iodine-125 implantation plus radiofrequency ablation: a prospective randomized controlled trial. J Hepatol. 2014;61:1304-1311. [PubMed] [DOI] |
| 11. | Zai-Rose V, West SJ, Kramer WH, Bishop GR, Lewis EA, Correia JJ. Effects of Doxorubicin on the Liquid-Liquid Phase Change Properties of Elastin-Like Polypeptides. Biophys J. 2018;115:1431-1444. [PubMed] [DOI] |
| 12. | Lin R, Wang S, Liu W. Protein-derived Smart Materials for Medical Applications: Elastin-like Polypeptides. Curr Pharm Des. 2018;24:3008-3013. [PubMed] [DOI] |
| 13. | Liu W, Zhao M, Liu W, Zheng Z, Zhang X. A feasibility study of a thermally sensitive elastin-like polypeptide for submucosal injection application in endoscopic resection in 3 animal models. Gastrointest Endosc. 2015;82:944-952. [PubMed] [DOI] |
| 14. | Liu X, Shen Y, Zhang X, Lin R, Jia Q, Chang Y, Liu W, Liu W. Brachytherapy Using Elastin-Like Polypeptides with (131)I Inhibit Tumor Growth in Rabbits with VX2 Liver Tumor. Dig Dis Sci. 2016;61:2921-2927. [PubMed] [DOI] |