修回日期: 2019-02-19
接受日期: 2019-03-01
在线出版日期: 2019-04-08
麻醉胃镜检查已经作为一种常规胃镜检查方式在国内开展. 低氧血症仍然是麻醉胃镜检查中发生率较高的不良事件, 但国外就其发生率的报道情况相差较大(<1%至85%), 国内缺乏相关高质量报道. 丙泊酚作为用于门诊患者麻醉胃镜检查的镇静药物, 其安全、有效性已经得到认可, 《中国消化内镜诊疗镇静/麻醉的专家共识意见》(2014年)推荐使用, 国外仍然有对其安全性的质疑, 本研究中, 我们将其作为门诊患者胃镜检查的镇静药物使用, 观察其对低氧血症发生率的影响.
观察麻醉胃镜检查中低氧血症的发生率,并分析其危险因素.
纳入上海长海医院消化内镜中心2018-09-01/ 2018-11-30经麻醉医师施行丙泊酚镇静的门诊麻醉胃镜检查患者, 共计580例. 观察患者在检查过程中有无低氧血症, 记为发生低氧血症(110例)和未发生低氧血症(470例)两组, 记录两组患者的基本信息、麻醉过程和内镜操作相关信息.
单因素分析发现打鼾史、活检、年龄、体重指数、腹围、内镜操作时间、丙泊酚的量、患者ASA分级、内镜医师分级在两组间存在差异(P<0.05). 多因素Logistic回归分析, 发现年龄(>75岁, OR值 8.955, 95%CI: 2.070-38.746)和丙泊酚用量(>197 mg, OR值2.360, 95%CI: 1.320-4.219)是低氧血症的独立危险因素.
对高龄患者(特别是>75岁患者)和需要较大量丙泊酚(特别是>197 mg)镇静的患者需要加以主动干预, 以预防低氧血症的发生.
核心提要: 通过观察上海长海医院消化内镜中心低氧血症的发生率及其危险因素, 以期制定预防策略, 保障麻醉胃镜顺利实施, 即在保障患者安全的前提下, 让患者体验无痛医疗.
引文著录: 封莉莉, 丁文霞, 孙媛媛, 张莹莹, 袁宁平, 张丽君, 韩文军, 席惠君. 麻醉胃镜检查中低氧血症的危险因素分析. 世界华人消化杂志 2019; 27(7): 427-434
Revised: February 19, 2019
Accepted: March 1, 2019
Published online: April 8, 2019
Gastrointestinal endoscopy under anesthesia has been carried out as a routine procedure in China. Hypoxemia is still an adverse event with a high incidence in routine anesthesia for gastrointestinal endoscopy, but the incidence of hypoxemia varies greatly across countries (< 1% to 85%), and there is a lack of relevant high-quality reports in China. Propofol, as a sedative for anesthetic gastroscopy in outpatients, has been recognized for its safety and effectiveness and is recommended by the expert consensus on Sedation/Anesthesia for Digestive Endoscopic Diagnosis and Treatment in China (2014). However, there are still some debate over its safety in foreign countries. In this study, we used propofol as a sedative for gastroscopy in outpatients to observe its effect on the incidence of hypoxemia.
To observe and analyze the incidence of and risk factors for hypoxemia in anesthesia for gastrointestinal endoscopy.
A total of 580 outpatients who were sedated with propofol from September 1, 2018 to November 30, 2018 in Digestive Endoscopy Center of Shanghai Changhai Hospital were included in the study. These patients were divided into either a hypoxemia (n = 110) group or a non-hypoxemia group (n = 470). The basic information, anesthesia procedure, and endoscopic operation related information of the two groups were recorded.
The information of patients in the two groups was compared and analyzed. It was found that there were significantly differences between the two groups in snoring history, biopsy, age, body mass index, abdominal circumference, endoscopic operation time, propofol dosage, ASA classification, and endoscopic physician classification (P < 0.05). Multivariate Logistic regression analysis showed that age (>5 years, OR = 8.955, 95 %CI: 2.070-38.746) and propofol dosage (>197 mg, OR = 2.360, 95 %CI: 1.320-4.219) were independent risk factors for hypoxemia.
Intervention is needed for elderly patients (especially patients over 75 years old) and patients requiring large amounts of propofol (especially > 197 mg) to prevent the occurrence of hypoxemia.
- Citation: Feng LL, Ding WX, Sun YY, Zhang YY, Yuan NP, Zhang LJ, Han WJ, Xi HJ. Risk factors for hypoxemia during routine anesthesia for gastrointestinal endoscopy. Shijie Huaren Xiaohua Zazhi 2019; 27(7): 427-434
- URL: https://www.wjgnet.com/1009-3079/full/v27/i7/427.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i7.427
消化内镜检查是诊断和治疗许多胃肠道疾病的标准工具. 据估计, 每1000名成人患者中有8.6人需要胃镜检查[1]. 由于丙泊酚的短效药代动力学特性, 国际指南建议在胃镜检查中使用丙泊酚, 以消除患者的疼痛、改善患者舒适度[2-4]. 然而, 丙泊酚可引起呼吸抑制、气道阻塞和血流动力学不稳定[5]. 缺氧是胃镜检查中常见的情况, 长期缺氧则心脏心律失常和冠状动脉缺血的最常见原因[6-8]. 据报道低氧血症发生率在<1%-85%[9-11], 这和"低氧血症"的定义及医护人员的主观判断有关. 本研究旨在通过对580例连续门诊麻醉胃镜检查患者的观察, 评价麻醉胃镜检查中低氧血症的发生率及其危险因素, 以期制定预防策略.
选取上海长海医院自2018-09-01/2018-11-30经麻醉医师施行丙泊酚镇静的门诊麻醉胃镜检查患者, 共计580例, 其中男性257例, 女性323例, 年龄14-80周岁, 平均年龄58.1岁±9.3岁. 所有患者均由麻醉医生询问病史, 在与患者及家属充分沟通麻醉风险后, 取得患者与家属的知情同意, 最后判断是否纳入研究. 纳入标准: (1)接受胃镜检查的门诊患者; (2)年龄14-80周岁; (3)签署知情同意书; 排除标准: (1)凝血功能不全; (2)明确诊断心脏疾病(心力衰竭、心绞痛、心肌梗死等); (3)明确诊断肺部疾病(哮喘、慢性阻塞性肺疾病、肺栓塞、肺水肿或肺癌); (4)怀孕; (5)肝脏疾病; (6)肾脏疾病; (7)颅内压增高等紧急情况或多系统创伤; (8)ASA Ⅳ以上身体状况分类; (9)上呼吸道感染; (10)对异丙酚、鸡蛋、大豆或白蛋白过敏. 即为了确保患者的安全, 我们排除了复杂病情患者. 本研究经过我院的伦理委员会批准.
1.2.1 研究过程: 所有患者入检查室后开始给予鼻导管吸氧(2 L/min), 并行三导联模拟心电图、脉氧饱和度和无创右上臂血压监测. 开放左上肢外周静脉通道, 给予乳酸钠林格注射液静滴. 通过静脉通道上的三通接头给予丙泊酚静注, 诱导剂量为1 mg/kg. 30-60 s后观察患者反应并判断是否给予补充剂量, 每次补充剂量为10-20 mg. 术中根据患者的疼痛反应继续追加丙泊酚. 术中严密监测患者生命体征, 根据呼吸、循环系统的反应分别给予对症处理. 检查或操作结束后, 转移患者至术后恢复室, 继续监测模拟心电图、脉氧饱和度、无创血压, 并给予鼻导管吸氧(2 L/min), Alderete评分(出复苏室标准)>9分者准予出室.
1.2.2 临床资料收集: 包括是否出现低氧血症、内镜检查医师分级、麻醉医师分级、丙泊酚使用量、内镜操作时间、是否病理活检、患者年龄、性别、体重指数(body mass index, BMI)、腹围、吸烟史、饮酒史、ASA分级、高血压病史、糖尿病史、心电图诊断(正常或者异常)、心脏疾病史、呼吸系统疾病史、过敏史、手术史、既往普通胃镜检查史、既往无痛胃镜检查史. 其中, 内镜检查医师及麻醉医师分级: 初学者 = 1、进修医师 = 2、专科培训医师 = 3、住院医师 = 4、主治医师及以上 = 5. 术中及苏醒期生命体征记录患者心率、血压和氧饱和度, 每5分钟记录一次. 氧饱和度记录最低值.
1.2.3 低氧血症定义: 在监护功能正常的情况下, 患者氧饱和度低于90%, 持续时间>10 s.
1.2.4 计量资料转换成等级资料: (1)年龄分为4个级别: <45岁 = 1; 45-60岁 = 2; 61-75岁 = 3; >75岁 = 4. (2)丙泊酚使用量按照百分位数分为4个级别: <140 mg = 1; 140-162 mg = 2; 163-197 mg = 3; >197 mg = 4. (3)BMI用体重/身高平方(kg/m2)计算, 分为4个级别: <18.5 kg/m2 = 1; 18.5-25.0 kg/m2 = 2; 25.1-30.0 kg/m2 = 3; >30.0 kg/m2 = 4. (4)内镜操作时间分别4个级别: <5 min = 1; 5-7 min = 2; 7.1-10分钟 = 3; >10 min = 4. (5)腹围用毫米皮尺测量. 测量腰围时, 皮尺放置与髂嵴上3-4横指处. 按照性别分为3个级别: 男性, <94 cm = 1; 94-101.9 cm = 2; ≥102 cm = 3; 女性: <80 cm = 1; 80-87.9 cm = 2; ≥88 cm = 3.
统计学处理 采用SPSS 21.0 Windows软件进行统计学处理. 性别、吸烟史等计数资料采用χ2检验; 本课题计量资料均为非正态分布, 用中位数(下四分位数, 上四分位数)表示, 采用Mann-Whitney U非参数检验, 当P<0.05时, 差异具有统计学意义. 为便于临床分析, 在后续统计分析中将计量数据根据"1.2.4 计量资料转换成等级资料"进行分级. 低氧血症发生率的多因素分析采取用Logistic回归统计模型. P<0.05时认为差异有统计学意义.
计数资料单因素分析: 麻醉胃镜检查中出现低氧血症(110例)与未出现低氧血症(470例)两组间各因素对比. 结果显示: 打鼾史[(52, 47.3%)和(157, 33.4%)]和胃镜检查过程中活检[(61, 55.5%)和(204, 43.4%)]这两个因素的组间差异有统计学意义(P<0.05), 详见表1.
| 变量 | 低氧血症 (n = 110) | 非低氧血症 (n = 470) | χ2 | P值 | |
| 性别 | 男 | 50 (45.5) | 207 (44.0) | 0.072 | 0.788 |
| 女 | 60 (54.5) | 263 (56.0) | |||
| 吸烟史 | 有 | 27 (24.5) | 91 (19.4) | 1.478 | 0.224 |
| 无 | 83 (75.5) | 379 (80.6) | |||
| 饮酒史 | 有 | 24 (21.8) | 71 (15.1) | 2.932 | 0.087 |
| 无 | 86 (78.2) | 399 (84.9) | |||
| 打鼾史 | 有 | 52 (47.3) | 157 (33.4) | 7.438 | 0.006 |
| 无 | 58 (52.7) | 313 (66.6) | |||
| 高血压病史 | 有 | 28 (25.5) | 93 (19.8) | 1.734 | 0.188 |
| 无 | 82 (74.5) | 377 (80.2) | |||
| 糖尿病史 | 有 | 6 (5.5) | 15 (3.2) | 1.308 | 0.253 |
| 无 | 104 (94.5) | 455 (96.8) | |||
| 心电图诊断 | 异常 | 19 (17.3) | 93 (19.8) | 0.362 | 0.548 |
| 正常 | 91 (82.7) | 377 (80.2) | |||
| 心脏疾病史 | 有 | 7 (6.4) | 29 (6.2) | 0.006 | 0.940 |
| 无 | 103 (93.6) | 441 (93.8) | |||
| 呼吸系统疾病史 | 有 | 11 (10.0) | 49 (10.4) | 0.017 | 0.895 |
| 无 | 99 (90.0) | 421 (89.6) | |||
| 过敏史 | 有 | 19 (17.3) | 96 (20.4) | 0.557 | 0.455 |
| 无 | 91 (82.7) | 374 (79.6) | |||
| 手术史 | 有 | 51 (46.4) | 236 (50.2) | 0.528 | 0.467 |
| 无 | 59 (53.6) | 234 (49.8) | |||
| 既往普通胃镜史 | 有 | 54 (49.1) | 235 (50.0) | 0.029 | 0.864 |
| 无 | 56 (50.9) | 235 (50.0) | |||
| 既往无痛胃镜史 | 有 | 42 (38.2) | 202 (43.0) | 0.842 | 0.359 |
| 无 | 68 (61.8) | 268 (57.0) | |||
| 活检 | 有 | 61 (55.5) | 204 (43.4) | 5.216 | 0.022 |
| 无 | 49 (44.5) | 266 (56.6) | |||
计量资料及等级资料的单因素分析: 使用Kolmogorov-Smirnov检验对计量资料的正态性进行检验, 分析结果显示本研究中的计量资料均不服从正态分布, 均为偏态, 因此选择Mann-Whitney U非参数检验分析. 按照分级规定, 将计量资料转换为等级资料. 结果显示: 年龄、BMI、腹围、内镜操作时间、丙泊酚的量、患者ASA分级、内镜医师分级, 差异有统计学意义(P<0.05), 详见表2.
| 变量 | 低氧血症 (n = 110) | 非低氧血症 (n = 470) | Z | P值 |
| 年龄 (岁) | -3.392 | 0.001 | ||
| <45 | 28 (25.5) | 194 (41.3) | ||
| 45-60 | 48 (43.6) | 171 (36.4) | ||
| 61-75 | 30 (27.3) | 101 (21.5) | ||
| >75 | 4 (3.6) | 4 (0.9) | ||
| BMI (kg/m2) | -3.351 | 0.001 | ||
| <18.5 | 5 (4.5) | 30 (6.4) | ||
| 18.5-25 | 63 (57.3) | 326 (69.4) | ||
| 25.1-30 | 38 (34.5) | 104 (22.1) | ||
| >30 | 4 (3.6) | 10 (2.1) | ||
| 内镜操作时间 (min) | -2.618 | 0.009 | ||
| <5 | 15 (13.6) | 104 (22.1) | ||
| 5-7 | 28 (25.5) | 131 (27.9) | ||
| 7.1-10 | 37 (33.6) | 140 (29.8) | ||
| >10 | 30 (27.3) | 95 (20.2) | ||
| 丙泊酚的量 (mg) | -3.103 | 0.002 | ||
| <140 | 22 (20.0) | 122 (26.0) | ||
| 140-162 | 22 (20.0) | 146 (31.1) | ||
| 163-197 | 20 (18.2) | 80 (17.0) | ||
| >197 | 46 (41.8) | 122 (26.0) | ||
| ASA分级 | -2.282 | 0.022 | ||
| 1 | 52 (47.3) | 279 (59.4) | ||
| 2 | 56 (50.9) | 184 (39.1) | ||
| 3 | 2 (1.8) | 7 (1.5) | ||
| 4 | 0 | 0 | ||
| 腹围 (男, cm) | -4.958 | 0.000 | ||
| <94 | 29 (58.0) | 130 (62.8) | ||
| 94-101.9 | 16 (32.0) | 44 (21.3) | ||
| ≥102 | 5 (10.0) | 33 (15.9) | ||
| 腹围 (女, cm) | ||||
| <80 | 35 (58.3) | 156 (59.3) | ||
| 80-87.9 | 11 (18.3) | 72 (27.4) | ||
| ≥88 | 14 (23.3) | 35 (13.3) | ||
| 内镜医师分级 | -1.987 | 0.047 | ||
| 1 | 6 (5.5) | 25 (5.3) | ||
| 2 | 3 (2.7) | 8 (1.7) | ||
| 3 | 7 (6.4) | 15 (3.2) | ||
| 4 | 35 (31.8) | 122 (26.0) | ||
| 5 | 59 (53.6) | 300 (63.8) | ||
| 麻醉医师分级 | -0.352 | 0.725 | ||
| 1 | 59 (53.6) | 253 (53.8) | ||
| 2 | 7 (6.4) | 20 (4.3) | ||
| 3 | 38 (34.5) | 156 (33.2) | ||
| 4 | 2 (1.8) | 17 (3.6) | ||
| 5 | 4 (3.6) | 24 (5.1) |
因此, 经单因素分析得到低氧血症的9项危险因素, 包括: 打鼾史、活检、年龄、BMI、腹围、内镜操作时间、丙泊酚的量、患者ASA分级、内镜医师分级.
为排除混杂因素影响, 采用Logistic回归分析, 结果显示打鼾史、活检、BMI、腹围、内镜操作时间、患者ASA分级、内镜医师分级均不是低氧血症的独立危险因素, 而年龄和丙泊酚用量为麻醉胃镜检查中出现低氧血症的独立危险因素. 分析显示年龄(45-60岁, OR值2.031, 95%CI: 1.211-3.404); (61-75岁, OR值2.231, 95%CI: 1.249-3.986); (>75岁, OR值8.955, 95%CI: 2.070-38.746)和丙泊酚用量(140-162 mg, OR值0.874, 95%CI: 1.249-3.986); (163-197 mg, OR值1.467, 95%CI: 0.740-2.909); (>197 mg, OR值2.360, 95%CI: 1.320-4.219)(表3)是低氧血症的独立危险因素.
| 因素 | 偏回归系数 | 标准误 | Wald检验统计量 | P值 | OR值 | 95%置信区间 | |
| 下限 | 上限 | ||||||
| 年龄 | 14.623 | 0.002 | |||||
| 年龄45-60岁 | 0.708 | 0.264 | 7.223 | 0.007 | 2.031 | 1.211 | 3.404 |
| 年龄61-75岁 | 0.803 | 0.296 | 7.354 | 0.007 | 2.231 | 1.249 | 3.986 |
| 年龄>75岁 | 2.192 | 0.747 | 8.603 | 0.003 | 8.955 | 2.070 | 38.746 |
| 丙泊酚 | 14.757 | 0.002 | |||||
| 丙泊酚140-162 mg | -0.135 | 0.331 | 0.166 | 0.684 | 0.874 | 0.457 | 1.672 |
| 丙泊酚163-197 mg | 0.383 | 0.349 | 1.203 | 0.273 | 1.467 | 0.740 | 2.909 |
| 丙泊酚>197 mg | 0.858 | 0.297 | 8.382 | 0.004 | 2.360 | 1.320 | 4.219 |
| 常量 | -2.302 | 0.302 | 58.065 | 0.000 | 0.100 | ||
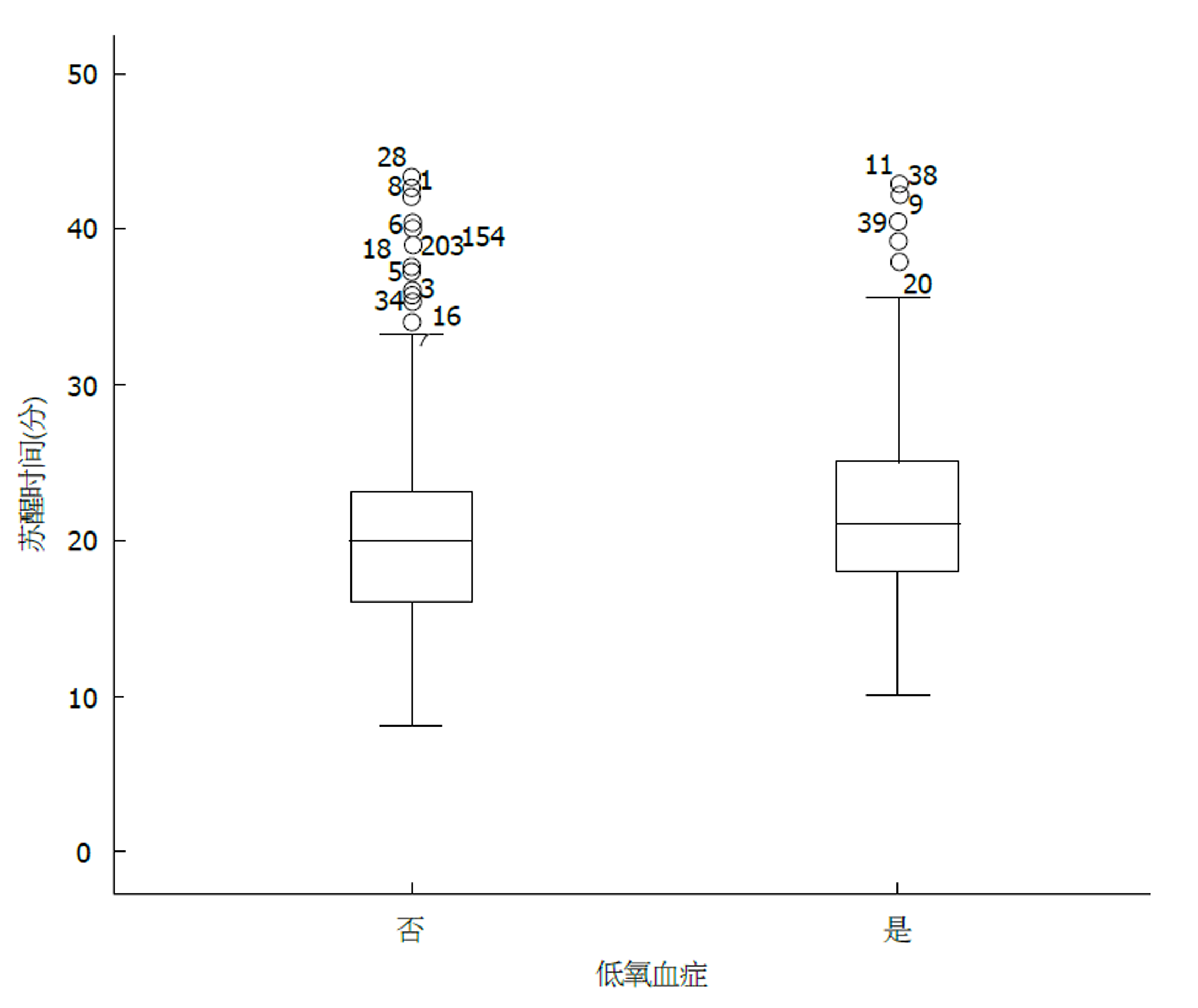
发生低氧血症的患者中, 苏醒时间为21.0 min±6.85 min, 最短苏醒时间10 min, 最长苏醒时间42.75 min, 平均时间21 min; 未发生低氧血症的患者中, 苏醒时间为20.0 min±5.9 min, 最短苏醒时间8 min, 最长苏醒时间43.3 min. 具体分布情况详见图1.
我们共纳入580例麻醉胃镜检查患者, 其中110例患者发生低氧血症. 单因素分析发现打鼾史、活检、年龄、BMI、腹围、内镜操作时间、丙泊酚的量、患者ASA分级、内镜医师分级在两组间存在差异(P<0.05); 多因素Logistic回归分析发现年龄(>75岁, OR = 8.955, 95%CI: 2.070-38.746)和丙泊酚用量(>197 mg, OR = 2.360, 95%CI: 1.320-4.219)是低氧血症的独立危险因素. 因此, 对高龄患者(特别是>75岁患者)和需要较大量丙泊酚(特别是>197 mg)镇静的患者需要加以主动干预, 以预防低氧血症的发生.
内窥镜诊疗中使用镇静已经是临床常规实践内容. 在美国, 近98%的上消化道内窥镜检查是在镇静状态下进行的, 以消除疼痛和改善患者舒适[12,13]. 内窥镜诊疗期间的镇静有两方面益处: 第一, 通过减少手术过程中的疼痛, 从而使患者更加舒适; 第二, 通过减少任何不必要的患者运动, 从而减少内镜检查时的并发症[14,15]. 本研究中未出现因不良事件而需要院内留滞、住院观察、死亡的情况.
在研究中我们发现, 随着患者年龄增长, 麻醉胃镜检查中发生低氧血症的风险增加, 特别是年龄>75岁的患者(OR = 8.955, 95%CI: 2.070-38.746), 该研究结果和国外研究相符合. 美国的一项麻醉胃镜风险评估项目中, 年龄被认为主要和ASA分级相关, 随着年龄增加, ASA等级越高, 而麻醉风险也相应增高[16]. 而在澳大利亚, 共纳入墨尔本大学附属九家医院的2132位患者, 该研究发现, 年龄是预测麻醉内镜检查中和检查后不良事件的独立危险因素, 年龄>80岁的患者不仅在诊疗期间发生不良事件的风险明显升高(OR = 3.39, 95%CI: 1.65-6.97), 诊疗后30 d死亡率也明显升高(HR = 3.54, 95%CI: 1.40-8.96)[17].
丙泊酚是内镜诊疗中常用的镇静剂. 其药代动力学和短半衰期使其成为内镜诊疗中理想的麻醉药物[14,15]. 丙泊酚用于胃肠内镜手术的数量在过去十年中有所增加, 但普遍认为它会导致较高的心肺不良事件. 一项系统回顾研究比较在内窥镜诊疗中使用丙泊酚和非丙泊酚药物发生的镇静相关不良事件, 其中共有26项研究报告了低氧血症事件, 13项研究支持使用丙泊酚, 因为与非丙泊酚药物相比, 基本内镜(胃、肠镜)诊疗中使用丙泊酚出现低氧血症的OR为0.77(95%CI: 0.49-1.19), 而在相对复杂内镜(ERCP、小肠镜等)诊疗中使用丙泊酚出现低氧血症的OR为0.85(95%CI: 0.61-1.20). 该研究指出, 在麻醉胃肠镜检查中, 与接受非丙泊酚药物麻醉的患者相比, 使用丙泊酚麻醉的患者出现不良事件的概率降低了39%[18].
我们纳入580例门诊麻醉胃镜检查患者, 检查中均使用丙泊酚镇静, 低氧血症发生率为19%. 通过数据整理分析, 我们发现低氧血症的发生与患者年龄和检查中丙泊酚的使用量有关, 即患者年龄越大, 丙泊酚使用量越高, 患者在麻醉胃镜检查中出现低氧血症的可能性越高, 低氧血症的发生延长了患者的平均苏醒时间. 该研究结论提示我们: 在门诊患者中, 对高龄患者(特别是>75岁患者)以及需要较大量丙泊酚(特别时>197 mg)镇静的患者需要关注并主动干预, 比如持续辅助托患者下颌, 提高患者吸入氧流量, 经声门给氧等.
麻醉胃镜检查已经作为一种常规胃镜检查方式在国内开展. 低氧血症仍然是麻醉胃镜检查中发生率较高的不良事件, 但国外就其发生率的报道情况相差较大(<1%至85%), 国内缺乏相关高质量报道. 丙泊酚作为用于门诊患者麻醉胃镜检查的镇静药物, 其安全、有效性已经得到认可, 《中国消化内镜诊疗镇静/麻醉的专家共识意见》(2014年)推荐使用,但国外仍然有一些质疑其安全的争论, 本研究中, 我们将其作为门诊患者胃镜检查的镇静药物使用, 观察其对低氧血症发生率的影响.
麻醉胃镜对于提高胃镜检查患者的舒适度及满意度有很大帮助. 低氧血症是发生率较高的不良事件, 持续的低氧血症容易引发心脏疾病. 我们设计此课题是为了观察上海长海医院消化内镜中心低氧血症的发生率及其危险因素. 从而帮助我们制定防止低氧血症发生的预防措施, 以保障麻醉胃镜顺利实施, 即在保障患者安全的前提下, 让患者体验无痛医疗.
本研究比较了发生低氧血症和未发生低氧血症两组患者的基本信息、麻醉信息和胃镜操作相关信息, 分析两组间信息的差异, 从而发现低氧血症的独立危险因素, 具有临床实用性和可操作性.
本研究选取了2018-9/2018-9-11长海医院门诊麻醉胃镜检查的患者, 根据纳入排除标准共计580例进入研究, 详细记录了患者低氧血症的发生情况, 患者的基本信息和检查中的麻醉、内镜操作信息, 采用统计分析的方法, 对两组患者的各种信息进行对比分析.
低氧血症的发生率和患者的年龄及检查中丙泊酚使用量有关, 它们是麻醉胃镜检查发生低氧血症的独立危险因素(P<0.05).
麻醉胃镜总体安全、舒适, 伴有低氧血症的发生. 患者的年龄及检查中丙泊酚使用量是麻醉胃镜检查发生低氧血症的独立危险因素. 对高龄患者(特别是>75岁患者)以及需要较大量丙泊酚(特别是>197 mg)镇静的患者需要加以关注, 比如持续辅助托患者下颌, 提高患者吸入氧流量, 经声门给氧等.
尽管通过本研究我们看到麻醉胃镜和丙泊酚的应用能使患者舒适而且基本安全, 但低氧血症等不良事件依然存在. 麻醉监护任重道远. 本研究存在病例数较少的不足之处, 未来的研究应当采取增加研究中心、扩大样本量等措施, 以反映国内麻醉胃镜检查的安全现状、不良事件发生率及其危险因素, 以期制定预防策略, 保障患者安全.
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C,C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Scott BB. Gastroenterology in the Trent Region in 1992 and a review of changes since 1975. Gut. 1995;36:468-472. [PubMed] [DOI] |
| 2. | Cohen LB, Wecsler JS, Gaetano JN, Benson AA, Miller KM, Durkalski V, Aisenberg J. Endoscopic sedation in the United States: results from a nationwide survey. Am J Gastroenterol. 2006;101:967-974. [PubMed] [DOI] |
| 3. | Vargo JJ, Cohen LB, Rex DK, Kwo PY; American Association for the Study of Liver Diseases; American College of Gasteroenterology; American Gastroenterological Association; American Society for Gastrointestinal Endoscopy. Position statement: Nonanesthesiologist administration of propofol for GI endoscopy. Gastroenterology. 2009;137:2161-2167. [PubMed] [DOI] |
| 4. | Dumonceau JM, Riphaus A, Aparicio JR, Beilenhoff U, Knape JT, Ortmann M, Paspatis G, Ponsioen CY, Racz I, Schreiber F, Vilmann P, Wehrmann T, Wientjes C, Walder B; NAAP Task Force Members. European Society of Gastrointestinal Endoscopy, European Society of Gastroenterology and Endoscopy Nurses and Associates, and the European Society of Anaesthesiology Guideline: Non-anaesthesiologist administration of propofol for GI endoscopy. Eur J Anaesthesiol. 2010;27:1016-1030. [PubMed] [DOI] |
| 5. | Beitz A, Riphaus A, Meining A, Kronshage T, Geist C, Wagenpfeil S, Weber A, Jung A, Bajbouj M, Pox C, Schneider G, Schmid RM, Wehrmann T, von Delius S. Capnographic monitoring reduces the incidence of arterial oxygen desaturation and hypoxemia during propofol sedation for colonoscopy: a randomized, controlled study (ColoCap Study). Am J Gastroenterol. 2012;107:1205-1212. [PubMed] [DOI] |
| 6. | Bell GD, Bown S, Morden A, Coady T, Logan RF. Prevention of hypoxaemia during upper-gastrointestinal endoscopy by means of oxygen via nasal cannulae. Lancet. 1987;1:1022-1024. [PubMed] [DOI] |
| 7. | Hart R, Classen M. Complications of diagnostic gastrointestinal endoscopy. Endoscopy. 1990;22:229-233. [PubMed] [DOI] |
| 8. | Jurell KR, O'Connor KW, Slack J, Fraiz J, Shaar CJ, Kent L, Callon R. Effect of supplemental oxygen on cardiopulmonary changes during gastrointestinal endoscopy. Gastrointest Endosc. 1994;40:665-670. [PubMed] [DOI] |
| 9. | Vaessen H, Bruens E, Knape J. Clinical analysis of moderate-to-deep-sedation by nonmedical sedation practitioners in 597 patients undergoing gastrointestinal endoscopy: a retrospective study. Endosc Int Open. 2016;4:E564-E571. [PubMed] [DOI] |
| 10. | Sieg A, bng-Study-Group, Beck S, Scholl SG, Heil FJ, Gotthardt DN, Stremmel W, Rex DK, Friedrich K. Safety analysis of endoscopist-directed propofol sedation: a prospective, national multicenter study of 24 441 patients in German outpatient practices. J Gastroenterol Hepatol. 2014;29:517-523. [PubMed] [DOI] |
| 11. | Qadeer MA, Lopez AR, Dumot JA, Vargo JJ. Hypoxemia during moderate sedation for gastrointestinal endoscopy: causes and associations. Digestion. 2011;84:37-45. [PubMed] [DOI] |
| 13. | Keeffe EB, O'Connor KW. 1989 A/S/G/E survey of endoscopic sedation and monitoring practices. Gastrointest Endosc. 1990;36:S13-S18. [PubMed] [DOI] |
| 14. | Vargo JJ, Zuccaro G, Dumot JA, Shermock KM, Morrow JB, Conwell DL, Trolli PA, Maurer WG. Gastroenterologist-administered propofol versus meperidine and midazolam for advanced upper endoscopy: a prospective, randomized trial. Gastroenterology. 2002;123:8-16. [PubMed] [DOI] |
| 15. | Vargo JJ. Propofol: a gastroenterologist's perspective. Gastrointest Endosc Clin N Am. 2004;14:313-323. [PubMed] [DOI] |
| 16. | Nie X, Mattke S, Predmore Z, Liu H. Upcoding and Anesthesia Risk in Outpatient Gastrointestinal Endoscopy Procedures. JAMA Intern Med. 2016;176:855-856. [PubMed] [DOI] |
| 17. | Leslie K, Allen ML, Hessian EC, Peyton PJ, Kasza J, Courtney A, Dhar PA, Briedis J, Lee S, Beeton AR, Sayakkarage D, Palanivel S, Taylor JK, Haughton AJ, O'Kane CX. Safety of sedation for gastrointestinal endoscopy in a group of university-affiliated hospitals: a prospective cohort study. Br J Anaesth. 2017;118:90-99. [PubMed] [DOI] |
| 18. | Wadhwa V, Issa D, Garg S, Lopez R, Sanaka MR, Vargo JJ. Similar Risk of Cardiopulmonary Adverse Events Between Propofol and Traditional Anesthesia for Gastrointestinal Endoscopy: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2017;15:194-206. [PubMed] [DOI] |