修回日期: 2019-02-02
接受日期: 2019-03-07
在线出版日期: 2019-03-28
临床工作中, 常加用益生菌来治疗溃疡性结肠炎(ulcerative colitis, UC), 但其在UC的治疗中到底发挥多大的作用、在哪一阶段起作用, 目前尚无定论.
采用Meta分析的方法比较益生菌与安慰剂在成人UC中的疗效及安全性.
检索PubMed, EMBASE, Cochrane Library, 万方数据库, 中国知网数据库中有关益生菌与安慰剂在UC治疗中的随机对照试验研究(randomized controlled trials, RCTs).
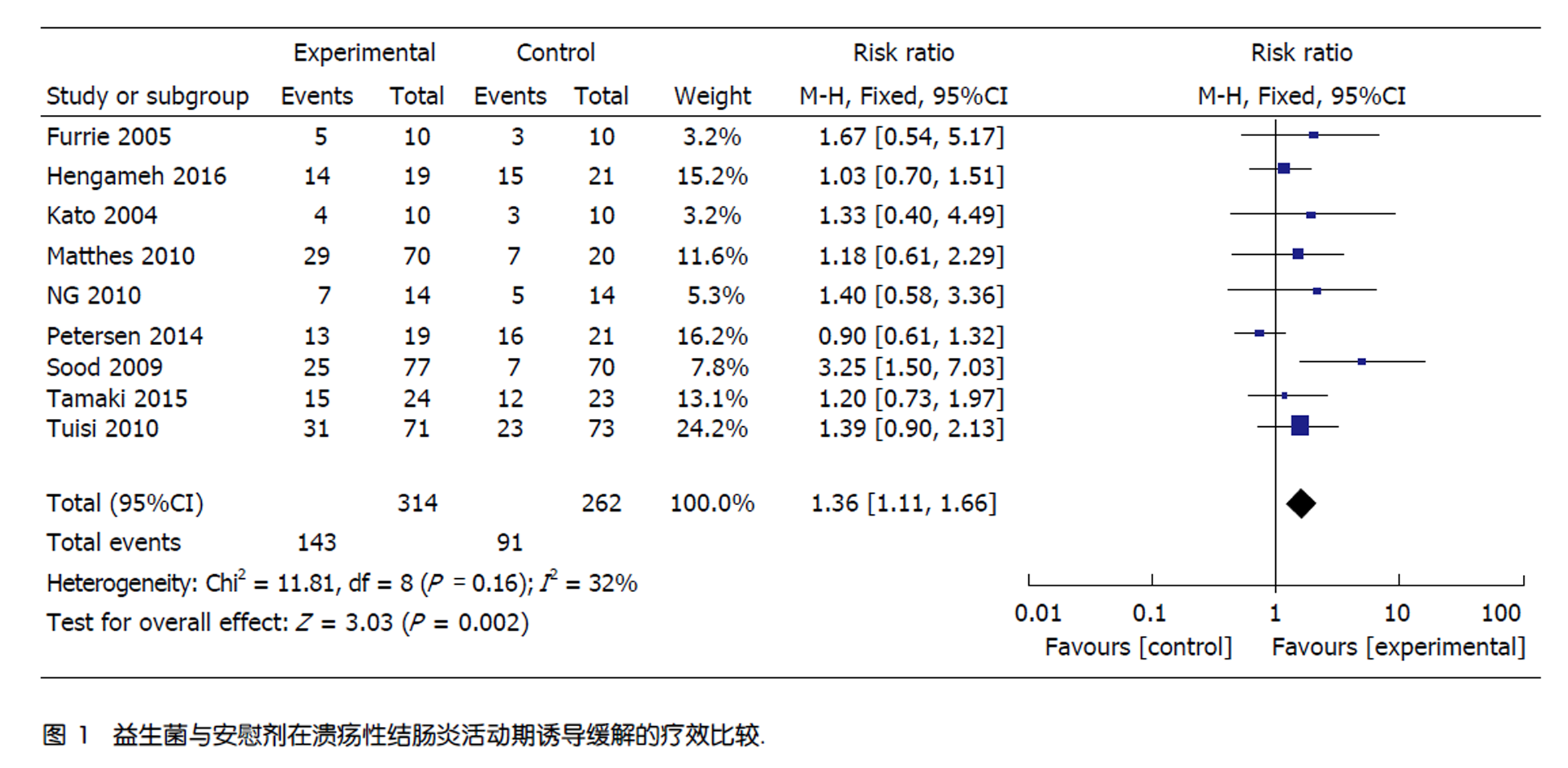
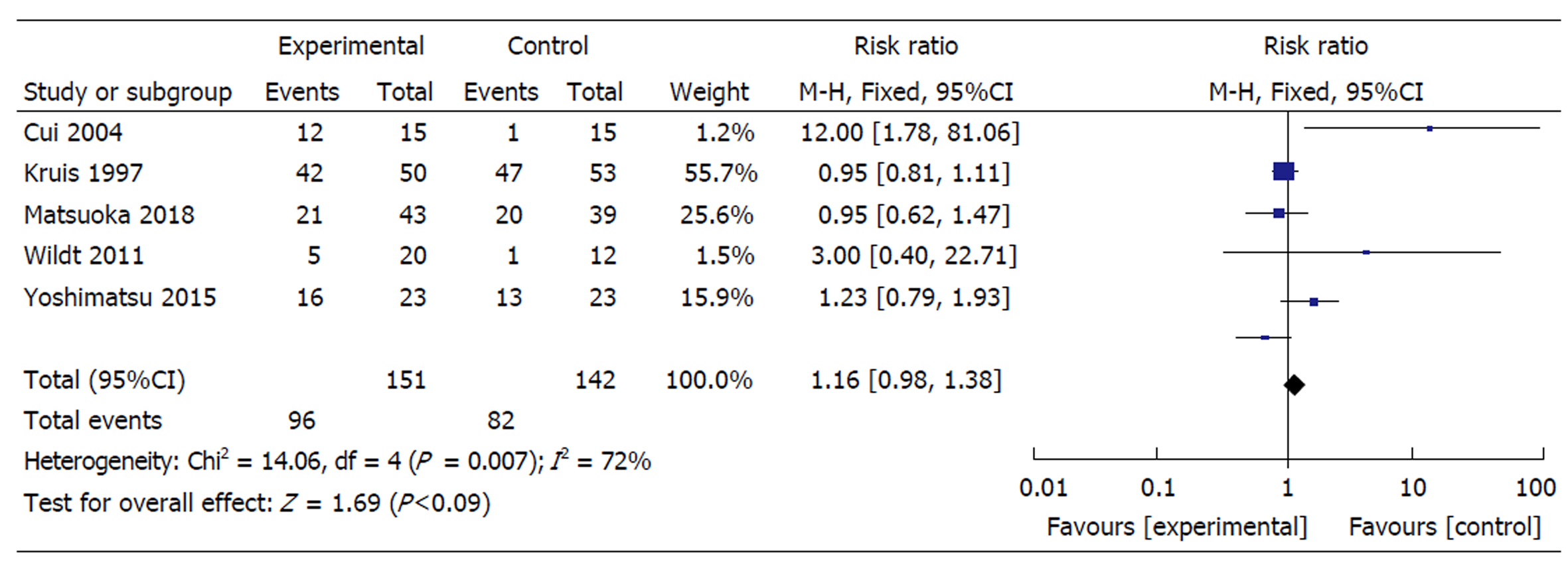
14项RCTs共计869例患者纳入本研究. 其中, 关于UC诱导缓解的研究有9项RCTs, 关于维持治疗的有5项RCTs.比较其在UC诱导缓解中的作用, 发现益生菌对比安慰剂的缓解率分别为45.5%、34.7%, RR = 1.36, 95%CI: 1.11-1.66), 二者有统计学意义(P = 0.002), 各研究之间不存在异质性(χ2 = 11.81, P = 0.16, I2= 32%); 比较其在UC维持治疗中的作用, 发现各研究间存在异质性(P = 0.09, I2 = 72%), 进一步亚组分析发现, 单独应用益生菌较单独应用安慰剂有效(P = 0.004), 而益生菌联合应用其他药物(5-ASA、美沙拉嗪、激素和硫唑嘌呤)与安慰剂联合其他药物相比, 无统计学意义(P = 0.95); 比较益生菌与安慰剂在UC治疗中的安全性, 发现二者副作用相近, 分别为23.1%、15.3%, 二者比较无统计学意义(P = 0.86).
在UC诱导缓解中, 无论单独应用益生菌还是益生菌联合其他药物的作用比安慰剂效果好; 在UC维持治疗中, 单用益生菌的作用比安慰剂效果好, 但合用其他药物时, 益生菌无明显优势; 二者在UC治疗中的安全性相近.
核心提要: 临床工作中, 常加用益生菌来治疗溃疡性结肠炎(ulcerative colitis, UC), 但其在UC的治疗中到底发挥多大的作用、在哪一阶段起作用, 目前尚无定论. 本Meta分析通过比较益生菌与安慰剂在UC缓解诱导与维持治疗的疗效及安全性, 以期为益生菌在UC临床中的合理应用提供依据.
引文著录: 冯丽伟, 赵岳. 益生菌单独用药和联合用药对比安慰剂治疗溃疡性结肠炎的疗效分析. 世界华人消化杂志 2019; 27(6): 367-375
Revised: February 2, 2019
Accepted: March 7, 2019
Published online: March 28, 2019
In clinical work, probiotics are often used to treat ulcerative colitis (UC). However, it is unclear how and at which stage probiotics play a role in the treatment of UC.
To evaluate the efficacy and safety of probiotics vs placebo in the treatment of UC.
PubMed, EMBASE, Cochrane Library, WanFang Database, and the Chinese Biomedical Database were searched. Data were extracted and selected using strict criteria.
Fourteen randomized controlled trials (RCTs) involving a total of 869 participants to investigate the effects of probiotics (n = 465) vs placebo (n = 404) on UC were included, of which nine evaluated the remission rate, and five estimated the recurrence rate. Compared with the placebo group, the remission rate of UC patients who received probiotics was significantly better (relative risk = 1.36; 95%CI: 1.11-1.66, P = 0.002). When comparing the recurrence rate of UC between the probiotics and placebo groups, it was found that there was a significant heterogeneity (P = 0.09, I2 = 72%). Subgroup analysis showed that probiotics alone were better than placebo (P = 0.004), while combined with others drugs, there was no significant between the probiotics and placebo groups (P = 0.95). Four RCTs compared the safety, which showed that there was no significant difference between the two groups (P = 0.86).
Probiotics have better effects in UC maintenance therapy than placebo. However, with regard to the recurrence rate of UC, probiotics alone have benefits in UC than placebo, while combined with other drugs, probiotics are not better than placebo.
- Citation: Feng LW, Zhao Y. Efficacy and safety of probiotics in adults with ulcerative colitis: A meta-analysis of placebo-controlled trials. Shijie Huaren Xiaohua Zazhi 2019; 27(6): 367-375
- URL: https://www.wjgnet.com/1009-3079/full/v27/i6/367.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i6.367
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性的免疫介导的肠道疾病, 主要累及大肠, 其病因不清, 目前认为其发病主要与环境、遗传、肠道内环境紊乱、自身免疫有关[1]. 常规的治疗药物主要包括: 氨基水杨酸制剂、免疫抑制剂、生物制剂及糖皮质激素等. 临床工作中, 常加用益生菌来治疗UC[2-8], 但其在UC的治疗中到底发挥多大的作用、在哪一阶段起作用, 目前尚无定论. 本Meta分析通过比较益生菌与安慰剂在UC缓解诱导与维持治疗的疗效及安全性, 以期为益生菌在UC临床中的合理应用提供依据.
检索外文数据库: PubMed, EMBASE, Cochrane library, 万方数据库和中国知网数据库(检索年限截止至2018-08). 联合使用主题词或关键词: ulcerative colitis、probiotic、Lactobacillus、Bifidobacterium、Escherichia coli、VERSUSL#3、placebo、UC、益生菌、微生态制剂、乳杆菌、双歧杆菌、大肠杆菌.
纳入标准: (1)益生菌用于UC活动期诱导缓解和(或)维持缓解的随机对照试验研究(controlled trials, RCTs); (2)成年人; (3)试验包括益生菌组和安慰剂组; (4)对重复研究纳入最新发表者; (5)有统一且明确的诊断标准; (6)能查阅全文的文献; (7)提供患者结局和测量方法; (8)语种为英语或汉语.
排除标准: (1)非RCTs研究; (2)文献综述、会议简报、仅有摘要的文章; (3)研究对象为妊娠哺乳期妇女或儿童; (4)益生菌对UC术后储袋炎作用的研究; (5)未提供患者结局和测量方法.
主要结局指标对于UC活动期是诱导缓解率; 对于UC缓解期是临床复发率; 次要结局指标为临床不良反应的对比.
缓解的定义是指患者无便血症状, 内镜下黏膜无明显溃疡、糜烂、颗粒样增粗等改变. 临床缓解主要依据: CAI(Clinical activity index scores)评分及内镜下表现.
文献资料提取和质量评价: 文献纳入、数据提取和试验质量评价均由2名作者根据文献纳入和排除标准独立完成并交叉核对, 如有异议向第三方咨询, 讨论并取得最终一致. 文献的质量评价使用Cochrane Handbook5.10[9]中的偏倚风险评估(assessing risk of bias)工具. 同时采用Jadad评分进行文献质量评价: (1)随机分配方法是否正确; (2)双盲法的应用是否恰当; (3)退出与失访的记录, 共5分, ≥3分的文献纳入本研究中.
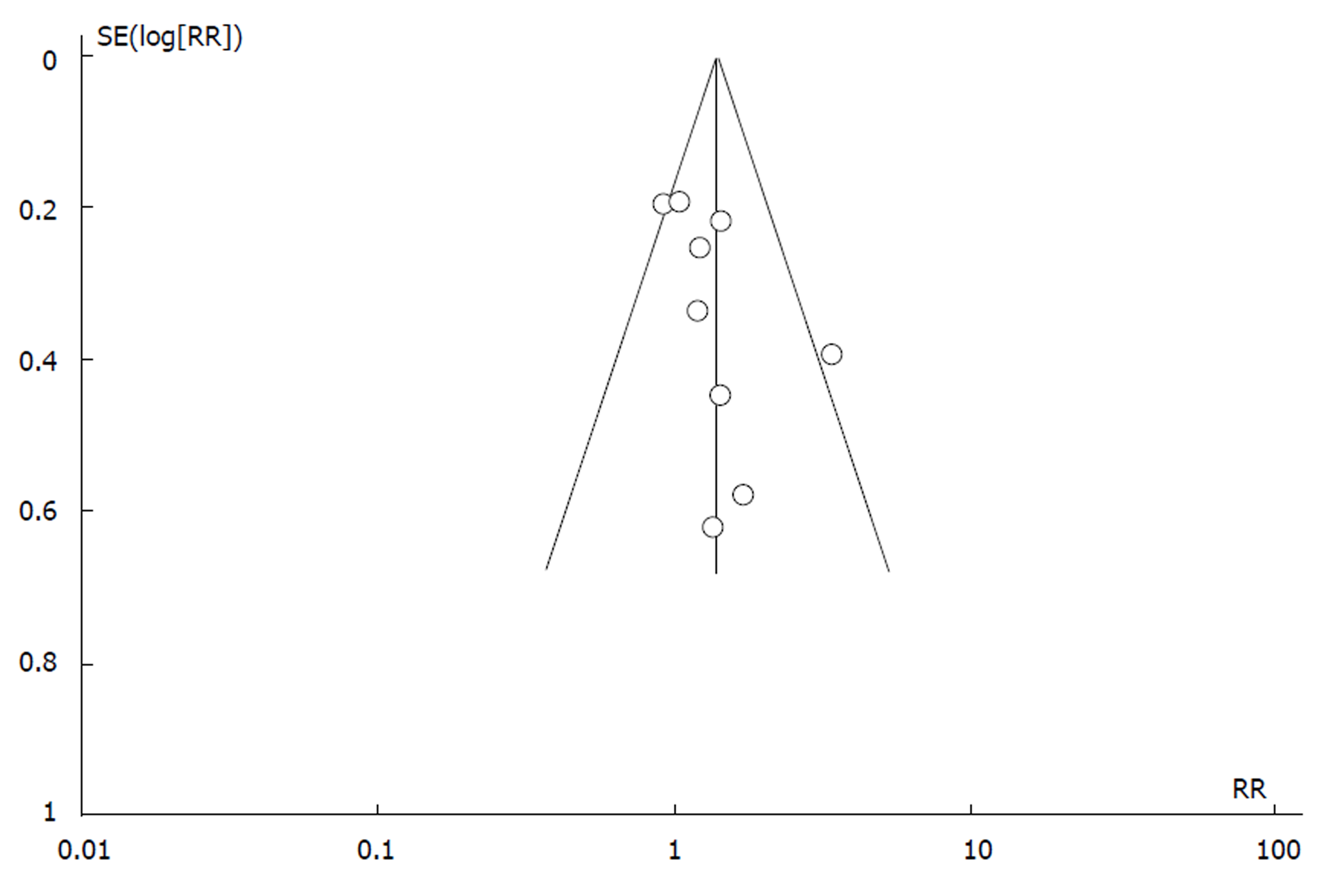
统计学处理 应用Cochrane协作网提供的RevMan 5.30软件进行Meta分析, 计数资料计算RR值及其95%CI, P<0.05为差异有统计学意义. 纳入研究间异质性的分析采用χ2检验, P>0.10且I2<50%时, 认为各研究间无异质性, 采用固定效应模型进行合并; 二者中任一不符合条件, 则采用随机效应模型进行合并. 对存在异质性的研究行亚组分析. 绘制漏斗图监测发表偏倚.
初步检索共获得国内外文献1657篇, 其中中文348篇, 英文1309篇. 通过阅读文题及摘要, 排除综述、评论、重复研究、动物实验、会议报告、病案报道、仅有摘要及非RCTs后得到20篇文献; 阅读全文, 根据纳入和排除标准进行筛选并剔除不符合要求的文献[10-15], 最终得到14篇RCTs[16-29](表1), 包括9篇为UC活动期诱导缓解治疗, 5篇为UC缓解期维持缓解治疗. 所有入选文献均有明确的诊断、纳入和排除标准, 9篇采用随机数字表法产生随机序列, 8篇实施中心隐藏, 8篇采用双盲法, 14篇文献随访均描述完整; 根据Jadad评分, 5分5篇, 4分6篇, 3分3篇.
| 参考文献 | 病例数(益生菌/安慰剂) | 益生菌组 | 安慰剂组 | 结果 (益生菌/安慰剂) | 疗程 (wk) | Jadad评分 |
| Kato等[16]2004 日本 | 20 (10/10) | 双歧杆菌发酵乳+ SASP或5-ASA | 安慰剂 + SASP 或5-ASA | 缓解(4/3) | 12 | 4 |
| Furrie等[17]2005 英国 | 18 (9/9) | 长双歧杆菌+激素, 免疫抑制剂或5-ASA | 安慰剂+激素, 免疫抑制剂或5-ASA | 缓解(5/3) | 4 | 5 |
| Sood等[18]2009 印度 | 147 (77/70) | VSL#3 | 安慰剂 | 缓解(25/7) | 12 | 5 |
| Matthe等[19]2010德国 | 57 (46/11) | 大肠杆菌1917 | 安慰剂 | 缓解(20/3) | 8 | 4 |
| Ng等[20]2010 英国 | 28 (14/14) | VSL#3 | 安慰剂 | 缓解(7/5) | 8 | 3 |
| Tursi等[21]2010 意大利 | 144 (71/73) | VSL#3 | 安慰剂 | 缓解 (31/23) | 8 | 4 |
| Tamaki等[22]2015 日本 | 47 (24/23) | 长双歧杆菌536 | 安慰剂 | 缓解(15/12) | 8 | 5 |
| Petersen等[23] 2014 丹麦 | 40 (19/21) | 环丙沙星(1 wk)+大肠杆菌Nissle1917+常规治疗 | 环丙沙星(1周)+安慰剂+常规治疗 | 缓解(13/16) | 8 | 4 |
| Hengameh等[24] 2016 丹麦 | 40 (19/21) | 环丙沙星(1 wk)+大肠杆菌Nissle1917 | 环丙沙星(1 wk)+安慰剂 | 缓解(14/15) | 8 | 5 |
| Kruis等[25]1997 德国 | 103 (50/53) | 大肠杆菌1917+ 5-ASA | 安慰剂 + 5-ASA | 复发(8/6) | 12 | 3 |
| Cui等[26]2004 中国 | 30 (15/15) | 双歧杆菌二联活菌 | 安慰剂 (淀粉) | 复发(3/14) | 8 | 3 |
| Wildt等[27]2011 丹麦 | 32 (20/12) | 双歧杆菌 | 安慰剂 | 复发 (15/11) | 52 | 5 |
| Yoshimatsu等[28] 2015 日本 | 46 (23/23) | 乳酶生、酪酸梭菌、马铃薯杆菌(三联菌)+美沙拉嗪或氢化波尼松或硫唑嘌呤 | 安慰剂+美沙拉嗪 或氢化波尼松 或硫唑嘌呤 | 复发(7/10) | 48 | 4 |
| Matsuoka等[29] | 82 (43/39) | 短双歧杆菌+5-ASA | 安慰剂+5-ASA | 复发(22/19) | 48 | 4 |
总诱导缓解率共9项研究[16-24]评价了益生菌与安慰剂在UC活动期诱导缓解的疗效, 均以诱导缓解率作为结局指标. 有4项研究[16,17,23,24]联合了其他药物(包括联合5-ASA、SASP、激素、免疫抑制剂和环丙沙星), 5项研究[18-22]单用益生菌与安慰剂进行比较. 研究中益生菌制剂包括: 长双歧杆菌[16,17,22]、VSL#3[18,20,21]和大肠杆菌[19]. 异质性检验显示, 各研究之间不存在异质性(χ2 = 11.81, P = 0.16, I2 = 32%). 采用固定效应模型显示: 益生菌组诱导缓解率为45.5%, 安慰剂组诱导缓解率为34.7%, 益生菌对UC活动期诱导缓解的疗效高于安慰剂对照组(RR = 1.36, 95%CI: 1.11-1.66, P = 0.002)(图1).
2.3.1 总维持缓解率: 共有5项研究[23-29]评价了益生菌与安慰剂在UC缓解期维持缓解的疗效, 均以疾病复发率作为结局指标. 3项研究[23,28,29]联合了其他药物(包括联合5-ASA、美沙拉嗪、激素和硫唑嘌啉), 2项研究[26,27]为单独用药. 研究中益生菌制剂包括: 大肠杆菌[23]、双歧杆菌[26,27]、乳酶生+酪酸梭菌+马铃薯杆菌(三联)[28], 短双歧杆菌[29]. 异质性检验显示, 各研究之间存在异质性(χ2 = 14.06, P = 0.007, I2 = 72%)(图2), 采用随机效应模型显示: 益生菌对UC缓解期维持缓解的疗效与安慰剂对照组相似(RR = 1.16, 95% CI: 0.98-1.38, P = 0.09).
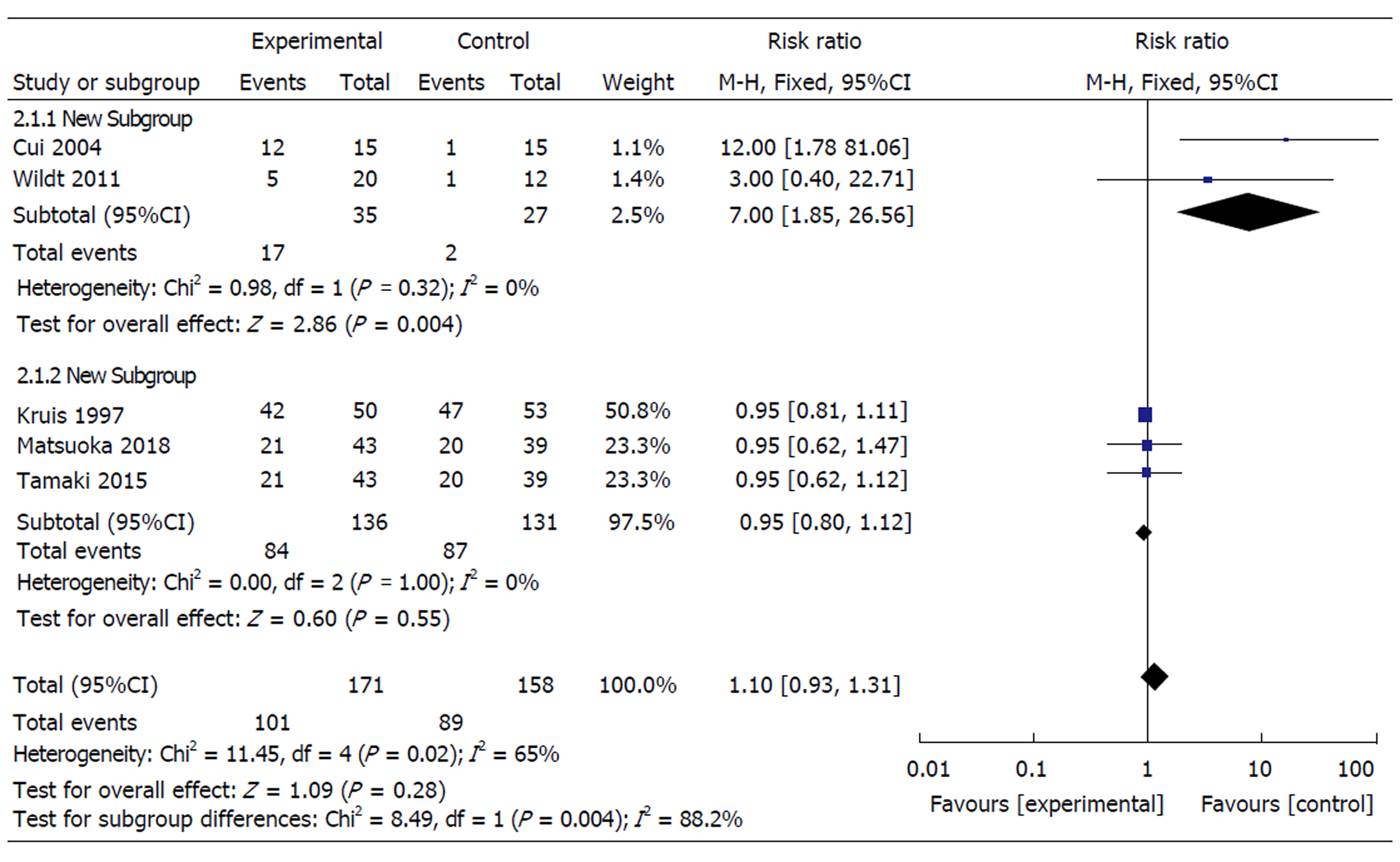
2.3.2 亚组分析: 按是否联合用药进行亚组分析: 联合用药组比较发现, 各研究间不存在异质性(χ2 = 0.00, P = 1.00, I2 = 0%), 采用固定效应模型显示: 益生菌对UC维持缓解的疗效与安慰剂对照组相似(61.8%:66.4%, RR = 0.95, 95%CI: 0.80-1.12, P = 0.55; 单独用药组中, 各研究之间不存在异质性(χ2 = 0.98, P = 0.32, I2 = 0), 采用固定效应模型显示: 益生菌对UC活动期诱导缓解的疗效显著高于安慰剂对照组(48.6%比7.4%, RR = 7.00, 95%CI: 1.85-26.56, P = 0.004)(图3).
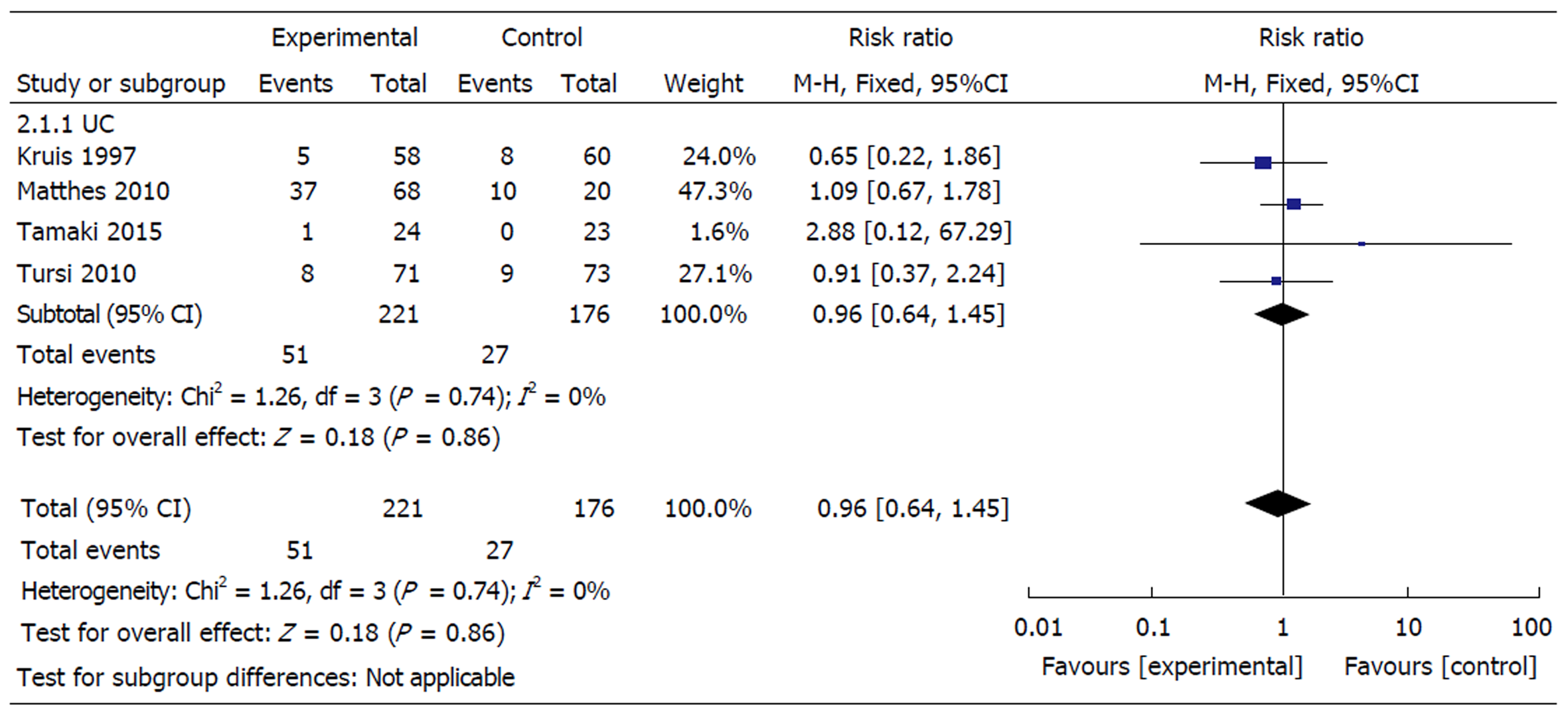
共有4项研究[19,21,27,28]报告了治疗期间的不良反应情况.常见不良反应包括腹胀、腹部不适、腹泻、恶心、呕吐、头晕、头痛、干咳等 ,未见严重不良反应, 大部分患者用药数日后不适症状可自行消失. 异质性检验显示, 各研究之间不存在异质性(χ2 = 1.26, P = 0.74, I2 = 0). 采用随机效应模型分析.分析显示益生菌组不良反应发生率为23.1%, 安慰剂对照组为15.3%, 两组间无明显差异(RR = 0.96, 95%CI: 0.64-1.45, P = 0.86)(图4).
对益生菌与安慰剂在UC活动期诱导缓解的疗效作漏斗图分析(图5), 图示左右基本对称, 提示发表性偏倚较小.对益生菌与安慰剂在UC缓解期维持缓解的疗效分析纳入文献较少(≤5个), 故未作发表偏倚分析.
UC是一种慢性非特异炎症的肠道疾病, 病程迁延、易反复, 给患者和社会造成沉重的负担[30]. 理想的治疗方案应该是尽快的诱导疾病缓解、减少复发, 且副作用低. 目前常规的治疗药物主要包括: 氨基水杨酸制剂、免疫抑制剂、生物制剂及糖皮质激素类. 近期的一些研究结果显示, 益生菌在UC的治疗中作用显著[10-13,31-33], 值得临床推广. 益生菌可能在以下几个方面发挥作用: (1)调节Th1/Th2细胞平衡促进机体的免疫功能[2,3,33]; (2)改善肠道的内环境, 抑制致病菌的过度生长[4,5,34]; (3)抑制NF-κB通路, 下调细胞中炎性介质的分泌, 减少炎症反应[21]; (4)改善肠道黏膜屏障[6,7]等. 但各研究中存在益生菌应用的种类、剂量、疗程不一样, 选择病人的病变程度各异, 故很难得出令人信服的结论. 为了说明益生菌在UC治疗中是否真正发挥作用, 有必要将益生菌与安慰剂在UC治疗各阶段的疗效进行比较, 以期为益生菌在UC临床治疗中的合理应用提供依据.
关于益生菌治疗UC的Meta分析并不少见, 但他们大部分主要是比较益生菌与其他药物, 如水杨酸制剂在UC治疗中的作用[34,35], 实际操作中无论是UC的诱导缓解治疗还是维持治疗很少单用益生菌而不用其他药物, 而临床医生往往习惯性的加用益生菌来治疗UC. 本Meta分析发现: 在UC的活动期诱导缓解治疗中, 共9项结果纳入本研究中, 各研究间不存在异质性(χ2 = 11.81, P = 0.16, I2 = 32%), 采用固定效应模型显示, 益生菌组诱导缓解率为45.5%, 安慰剂组诱导缓解率为34.7%, 益生菌对UC活动期诱导缓解的疗效高于安慰剂对照组(P = 0.002); 在UC的缓解期维持缓解治疗中, 各研究间异质性明显(χ2 = 14.06, P = 0.007, I2 = 72%), 考虑与单独用益生菌和益生菌联合其他药物后的效果差异明显有关. 进一步亚组分析发现, 单独应用益生菌较单独应用安慰剂有效(P = 0.004), 而益生菌联合应用其他药物与安慰剂联合其他药物相比无统计学意义(P = 0.95).由上述结果可以得出以下结论: 在UC诱导缓解治疗中, 应用益生菌的作用比安慰剂效果好; 在UC维持治疗中, 单用益生菌的作用比安慰剂效果好, 但合用其他药物时, 益生菌联合其他药物无明显优势. 本Meta分析为益生菌用于UC的治疗提供了循证学依据.
临床应用中普遍认为益生菌的副作用较小, 本研究的结果也充分证明了这一观点. 共有4项研究报告了治疗期间的不良反应情况, 报告的不良反应主要为胃肠道反应, 占总不良反应的85.7%(其中腹胀占50%、腹泻28.6%、恶心呕吐7.1%), 神经精神症状, 占总不良反应的21.3%(其中头晕占14.2%、头痛7.1%), 及呼吸道症状(干咳7.1%). 但4项纳入的研究中有1项[23]为益生菌联合其他药物(5-ASA)治疗, 所引起的副作用不能单纯归因于益生菌所致. 且研究发现: 绝大多数患者都能耐受, 不需停药, 用药数日后症状可自行缓解.结果分析显示: 益生菌组与安慰剂组的不良反应分别为23.1%和15.3%, 两组间无明显差异(P = 0.86).
此外, Palumbo等[36]的一项研究发现: 长疗程(2年)的美沙拉嗪联合乳酸杆菌、嗜酸乳杆菌、双歧杆菌, 用于治疗活动期UC诱导缓解, 效果显著. 因此, 长疗程的益生菌治疗UC的效果值得进一步研究. 另一项研究结果提示[37]: 益生菌可以调节UC小鼠模型的脑-肠轴, 改变小鼠的行为, 从而起到治疗UC的作用. 这些均提示益生菌在UC的治疗中发挥了积极的作用, 值得进一步研究.
总之, 本Meta分析表明: 益生菌在UC急性诱导缓解期时应用作用明显; 在缓解维持期时, 在不同时应用其他药物时, 作用较安慰剂效果好, 如果联合应用其他常用的治疗UC药物时, 则无明显益处. 但目前仍存在诸多问题, 期待更多多中心、大样本的临床RCT研究的出现来进一步证实此结论.
临床工作中, 常加用益生菌来治疗溃疡性结肠炎(ulcerative colitis, UC), 但其在UC的治疗中到底发挥多大的作用、在哪一阶段起作用, 目前尚无定论.
揭示益生菌在成人UC中的疗效及不良反应.
揭示益生菌在成人UC中到底发挥多大的作用、在哪一阶段起作用.
采用Meta分析的方法比较益生菌与安慰剂在成人UC中的疗效及安全性.
14项RCTs共计869例患者纳入本研究. 其中, 关于UC诱导缓解的研究有9项RCTs, 关于维持治疗的有5项RCTs. 比较其在UC诱导缓解中的作用, 发现益生菌对比安慰剂的缓解率分别为45.5%、34.7%, 二者有统计学意义; 比较其在UC维持治疗中的作用, 发现各研究间存在异质性(P = 0.09, I2 = 72%), 进一步亚组分析发现, 单独应用益生菌较单独应用安慰剂有效(P = 0.004), 而益生菌联合应用其他药物(5-ASA、美沙拉嗪、激素和硫唑嘌呤)与安慰剂联合其他药物相比, 无统计学意义(P = 0.95); 比较益生菌与安慰剂在UC治疗中的安全性, 发现二者副作用相近, 分别为23.1%、15.3%, 二者比较无统计学意义.
本研究发现, 在UC诱导缓解中, 无论单独应用益生菌还是益生菌联合其他药物的作用比安慰剂效果好; 在UC维持治疗中, 单用益生菌的作用比安慰剂效果好, 但合用其他药物时, 益生菌无明显优势; 二者在UC治疗中的安全性相近.
本研究为UC的治疗过程中, 合理应用益生菌提供了一定的循证学依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Manichanh C, Borruel N, Casellas F, Guarner F. The gut microbiota in IBD. Nat Rev Gastroenterol Hepatol. 2012;9:599-608. [PubMed] [DOI] |
| 2. | Kawashima T, Hayashi K, Kosaka A, Kawashima M, Igarashi T, Tsutsui H, Tsuji NM, Nishimura I, Hayashi T, Obata A. Lactobacillus plantarum strain YU from fermented foods activates Th1 and protective immune responses. Int Immunopharmacol. 2011;11:2017-2024. [PubMed] [DOI] |
| 3. | Pontier-Bres R, Munro P, Boyer L, Anty R, Imbert V, Terciolo C, André F, Rampal P, Lemichez E, Peyron JF, Czerucka D. Saccharomyces boulardii modifies Salmonella typhimurium traffic and host immune responses along the intestinal tract. PLoS One. 2014;9:e103069. [PubMed] [DOI] |
| 4. | Lawton EM, Ross RP, Hill C, Cotter PD. Two-peptide lantibiotics: a medical perspective. Mini Rev Med Chem. 2007;7:1236-1247. [PubMed] |
| 5. | Makras L, Triantafyllou V, Fayol-Messaoudi D, Adriany T, Zoumpopoulou G, Tsakalidou E, Servin A, De Vuyst L. Kinetic analysis of the antibacterial activity of probiotic lactobacilli towards Salmonella enterica serovar Typhimurium reveals a role for lactic acid and other inhibitory compounds. Res Microbiol. 2006;157:241-247. [PubMed] [DOI] |
| 6. | Tanaka K, Fujiya M, Konishi H, Ueno N, Kashima S, Sasajima J, Moriichi K, Ikuta K, Tanabe H, Kohgo Y. Probiotic-derived polyphosphate improves the intestinal barrier function through the caveolin-dependent endocytic pathway. Biochem Biophys Res Commun. 2015;467:541-548. [PubMed] [DOI] |
| 7. | Persborn M, Gerritsen J, Wallon C, Carlsson A, Akkermans LM, Söderholm JD. The effects of probiotics on barrier function and mucosal pouch microbiota during maintenance treatment for severe pouchitis in patients with ulcerative colitis. Aliment Pharmacol Ther. 2013;38:772-783. [PubMed] [DOI] |
| 8. | Boudeau J, Rich C, France CF. Escherichia coli strain Nissle 1917 inhibits adhesion to and invasion of intestinal epithelial cells by adherent-invasive E. coli isolated from a Crohn's disease patient. Gastroenterology. 2001;120:A190. |
| 9. | Higgins JP, Green S eds. Cochrane Handbook for Systernati Reviews of Interventions version 5.1.0[updated March 2011][S/OL]. The Cochrane Collaboration. 2011;. |
| 10. | Rembacken BJ, Snelling AM, Hawkey PM, Chalmers DM, Axon AT. Non-pathogenic Escherichia coli versus mesalazine for the treatment of ulcerative colitis: a randomised trial. Lancet. 1999;354:635-639. [PubMed] |
| 11. | Kruis W, Fric P, Pokrotnieks J, Lukás M, Fixa B, Kascák M, Kamm MA, Weismueller J, Beglinger C, Stolte M, Wolff C, Schulze J. Maintaining remission of ulcerative colitis with the probiotic Escherichia coli Nissle 1917 is as effective as with standard mesalazine. Gut. 2004;53:1617-1623. [PubMed] [DOI] |
| 12. | Tursi A, Brandimarte G, Giorgetti GM, Forti G, Modeo ME, Gigliobianco A. Low-dose balsalazide plus a high-potency probiotic preparation is more effective than balsalazide alone or mesalazine in the treatment of acute mild-to-moderate ulcerative colitis. Med Sci Monit. 2004;10:PI126-PI131. [PubMed] |
| 13. | Zocco MA, dal Verme LZ, Cremonini F, Piscaglia AC, Nista EC, Candelli M, Novi M, Rigante D, Cazzato IA, Ojetti V, Armuzzi A, Gasbarrini G, Gasbarrini A. Efficacy of Lactobacillus GG in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther. 2006;23:1567-1574. [PubMed] [DOI] |
| 14. | Miele E, Pascarella F, Giannetti E, Quaglietta L, Baldassano RN, Staiano A. Effect of a probiotic preparation (VSL#3) on induction and maintenance of remission in children with ulcerative colitis. Am J Gastroenterol. 2009;104:437-443. [PubMed] [DOI] |
| 15. | Oliva S, Di Nardo G, Ferrari F, Mallardo S, Rossi P, Patrizi G, Cucchiara S, Stronati L. Randomised clinical trial: the effectiveness of Lactobacillus reuteri ATCC 55730 rectal enema in children with active distal ulcerative colitis. Aliment Pharmacol Ther. 2012;35:327-334. [PubMed] [DOI] |
| 16. | Kato K, Mizuno S, Umesaki Y, Ishii Y, Sugitani M, Imaoka A, Otsuka M, Hasunuma O, Kurihara R, Iwasaki A, Arakawa Y. Randomized placebo-controlled trial assessing the effect of bifidobacteria-fermented milk on active ulcerative colitis. Aliment Pharmacol Ther. 2004;20:1133-1141. [PubMed] [DOI] |
| 17. | Furrie E, Macfarlane S, Kennedy A, Cummings JH, Walsh SV, O'neil DA, Macfarlane GT. Synbiotic therapy (Bifidobacterium longum/Synergy 1) initiates resolution of inflammation in patients with active ulcerative colitis: a randomised controlled pilot trial. Gut. 2005;54:242-249. [PubMed] |
| 18. | Sood A, Midha V, Makharia GK, Ahuja V, Singal D, Goswami P, Tandon RK. The probiotic preparation, VSL#3 induces remission in patients with mild-to-moderately active ulcerative colitis. Clin Gastroenterol Hepatol. 2009;7:1202-1209, 1209.e1. [PubMed] [DOI] |
| 19. | Matthes H, Krummenerl T, Giensch M, Wolff C, Schulze J. Clinical trial: probiotic treatment of acute distal ulcerative colitis with rectally administered Escherichia coli Nissle 1917 (EcN). BMC Complement Altern Med. 2010;10:13. [PubMed] [DOI] |
| 20. | Ng SC, Plamondon S, Kamm MA, Hart AL, Al-Hassi HO, Guenther T, Stagg AJ, Knight SC. Immunosuppressive effects via human intestinal dendritic cells of probiotic bacteria and steroids in the treatment of acute ulcerative colitis. Inflamm Bowel Dis. 2010;16:1286-1298. [PubMed] |
| 21. | Tursi A, Brandimarte G, Papa A, Giglio A, Elisei W, Giorgetti GM, Forti G, Morini S, Hassan C, Pistoia MA, Modeo ME, Rodino' S, D'Amico T, Sebkova L, Sacca' N, Di Giulio E, Luzza F, Imeneo M, Larussa T, Di Rosa S, Annese V, Danese S, Gasbarrini A. Treatment of relapsing mild-to-moderate ulcerative colitis with the probiotic VSL#3 as adjunctive to a standard pharmaceutical treatment: a double-blind, randomized, placebo-controlled study. Am J Gastroenterol. 2010;105:2218-2227. [PubMed] [DOI] |
| 22. | Yoshimatsu Y, Yamada A, Furukawa R, Sono K, Osamura A, Nakamura K, Aoki H, Tsuda Y, Hosoe N, Takada N, Suzuki Y. Effectiveness of probiotic therapy for the prevention of relapse in patients with inactive ulcerative colitis. World J Gastroenterol. 2015;21:5985-5994. [PubMed] [DOI] |
| 23. | Petersen AM, Mirsepasi H, Halkjær SI, Mortensen EM, Nordgaard-Lassen I, Krogfelt KA. Ciprofloxacin and probiotic Escherichia coli Nissle add-on treatment in active ulcerative colitis: a double-blind randomized placebo controlled clinical trial. J Crohns Colitis. 2014;8:1498-1505. [PubMed] [DOI] |
| 24. | Mirsepasi-Lauridsen HC, Halkjaer SI, Mortensen EM, Lydolph MC, Nordgaard-Lassen I, Krogfelt KA, Petersen AM. Extraintestinal pathogenic Escherichia coli are associated with intestinal inflammation in patients with ulcerative colitis. Sci Rep. 2016;6:31152. [PubMed] [DOI] |
| 25. | Kruis W, Schütz E, Fric P, Fixa B, Judmaier G, Stolte M. Double-blind comparison of an oral Escherichia coli preparation and mesalazine in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther. 1997;11:853-858. [PubMed] |
| 26. | Matsuoka K, Uemura Y, Kanai T, Kunisaki R, Suzuki Y, Yokoyama K, Yoshimura N, Hibi T. Efficacy of Bifidobacterium breve Fermented Milk in Maintaining Remission of Ulcerative Colitis. Dig Dis Sci. 2018;63:1910-1919. [PubMed] [DOI] |
| 27. | Cui HH, Chen CL, Wang JD, Yang YJ, Cun Y, Wu JB, Liu YH, Dan HL, Jian YT, Chen XQ. Effects of probiotic on intestinal mucosa of patients with ulcerative colitis. World J Gastroenterol. 2004;10:1521-1525. [PubMed] |
| 28. | Wildt S, Nordgaard I, Hansen U, Brockmann E, Rumessen JJ. A randomised double-blind placebo-controlled trial with Lactobacillus acidophilus La-5 and Bifidobacterium animalis subsp. lactis BB-12 for maintenance of remission in ulcerative colitis. J Crohns Colitis. 2011;5:115-121. [PubMed] [DOI] |
| 29. | Tamaki H, Nakase H, Inoue S, Kawanami C, Itani T, Ohana M, Kusaka T, Uose S, Hisatsune H, Tojo M, Noda T, Arasawa S, Izuta M, Kubo A, Ogawa C, Matsunaka T, Shibatouge M. Efficacy of probiotic treatment with Bifidobacterium longum 536 for induction of remission in active ulcerative colitis: A randomized, double-blinded, placebo-controlled multicenter trial. Dig Endosc. 2016;28:67-74. [PubMed] [DOI] |
| 30. | 郑 香云, 蒋 平, 吴 昊, 邵 晓晓, 胡 定元, 姜 立佳, 林 秀清, 李 士林, 蒋 益. 诱骗受体及护骨素基因多态性与溃疡性结肠炎的关系. 中华内科杂志. 2014;53:521-526. [DOI] |
| 31. | Naidoo K, Gordon M, Fagbemi AO, Thomas AG, Akobeng AK. Probiotics for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev. 2011;12:1-22. [PubMed] [DOI] |
| 32. | Sang LX, Chang B, Zhang WL, Wu XM, Li XH, Jiang M. Remission induction and maintenance effect of probiotics on ulcerative colitis: a meta-analysis. World J Gastroenterol. 2010;16:1908-1915. [PubMed] |
| 33. | Shen J, Zuo ZX, Mao AP. Effect of probiotics on inducing remission and maintaining therapy in ulcerative colitis, Crohn's disease, and pouchitis: meta-analysis of randomized controlled trials. Inflamm Bowel Dis. 2014;20:21-35. [PubMed] [DOI] |
| 34. | Jiang Y, Zhang ZG, Qi FX, Zhang Y, Han T. Comparison of maintenance effect of probiotics and aminosalicylates on ulcerative colitis: A meta-analysis of randomized controlled trials. Chronic Dis Transl Med. 2016;2:34-41. [PubMed] [DOI] |
| 36. | Palumbo VD, Romeo M, Marino Gammazza A, Carini F, Damiani P, Damiano G, Buscemi S, Lo Monte AI, Gerges-Geagea A, Jurjus A, Tomasello G. The long-term effects of probiotics in the therapy of ulcerative colitis: A clinical study. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2016;160:372-377. [PubMed] [DOI] |
| 37. | Emge JR, Huynh K, Miller EN, Kaur M, Reardon C, Barrett KE, Gareau MG. Modulation of the microbiota-gut-brain axis by probiotics in a murine model of inflammatory bowel disease. Am J Physiol Gastrointest Liver Physiol. 2016;310:G989-G998. [PubMed] [DOI] |