修回日期: 2018-12-24
接受日期: 2019-01-10
在线出版日期: 2019-02-08
研究七氟醚对人结直肠癌HCT116细胞迁移和侵袭能力的影响, 并探讨其分子机制.
以细胞计数法(CCK-8)检测七氟醚对HCT116细胞增殖能力的影响; 采用实时荧光定量PCR(qRT-PCR)检测细胞中miR-34a表达水平, Transwell实验检测细胞迁移和侵袭能力, 蛋白免疫吸附法(Western blot)检测细胞中基质金属蛋白酶-2(matrix metalloprotease, MMP-2)和基质金属蛋白酶-9(MMP-9)蛋白表达水平.
通过CCK-8实验筛选出七氟醚的作用浓度为4%. 以4%七氟醚处理HCT116细胞4 h后miR-34a表达水平升高了79%. 转染miR-34a inhibitor后, 细胞中miR-34a的表达水平下降了81%. 七氟醚干预后迁移细胞数由(97.75±16.10)降低到(36.60±8.58), 侵袭细胞数由(64.22±6.25)降低到(26.48±3.10), MMP-2蛋白表达水平由(0.68±0.11)下调到(0.24±0.04), MMP-9蛋白表达水平由(0.48±0.07)下调到(0.13±0.02); 而抑制miR-34a的表达后, 迁移细胞数由(40.15±9.02)提高到(88.65±12.74), 侵袭细胞数由(26.12±3.02)提高到(59.24±4.68), MMP-2蛋白表达水平由(0.22±0.03)上调到(0.61±0.09), MMP-9蛋白表达水平由(0.14±0.03)上调到(0.43±0.06).
七氟醚通过上调miR-34a的表达抑制人结直肠癌HCT116细胞的迁移和侵袭, 可能与下调MMP-2和MMP-9蛋白表达有关.
核心提要: 七氟醚通过上调miR-34a的表达抑制人结直肠癌HCT116细胞增殖、侵袭和迁移, 而转染miR-34a inhibitor后逆转了七氟醚对HCT116细胞增殖、侵袭和迁移的抑制作用, 该过程可能与调控MMP-2和MMP-9蛋白表达水平有关.
引文著录: 单晓山, 刘宇, 楼群兵, 周振峰. 七氟醚通过上调miR-34a抑制结直肠癌细胞的迁移和侵袭的机制研究. 世界华人消化杂志 2019; 27(3): 146-153
Revised: December 24, 2018
Accepted: January 10, 2019
Published online: February 8, 2019
To investigate the effect of sevoflurane on the migration and invasion of human colorectal cancer HCT116 cells, and to explore the underlying molecular mechanism.
The effect of sevoflurane on the proliferation of HCT116 cells was examined by CCK-8 assay. Real-time quantitative PCR was used to detect the expression of miR-34a in cells. Transwell assay was used to detect cell migration and invasion. Western blot was used to detect the expression levels of MMP-2 and MMP-9 in cells.
The concentration of action of sevoflurane was determined to be 4% by CCK-8 assay. The expression of miR-34a increased by 79% after treatment of HCT116 cells with 4% sevoflurane for 4 h. After transfection with miR-34a inhibitor, the expression level of miR-34a in cells decreased by 81%. After sevoflurane intervention, the number of migrated cells decreased from 97.75 ± 16.10 to 36.60 ± 8.58, the number of invasive cells decreased from 64.22 ± 6.25 to 26.48 ± 3.10, the expression level of MMP-2 protein was down-regulated from 0.68 ± 0.11 to 0.24 ± 0.04, and the expression level of MMP-9 protein was down-regulated from 0.48 ± 0.07 to 0.13 ± 0.02. After inhibiting the expression of miR-34a, the number of migrated cells was increased from 40.15 ± 9.02 to 88.65 ± 12.74, the number of invasive cells increased from 26.12 ± 3.02 to 59.24 ± 4.68, the expression level of MMP-2 protein was up-regulated from 0.22 ± 0.03 to 0.61 ± 0.09, and the expression level of MMP-9 protein was up-regulated from 0.14 ± 0.03 to 0.43 ± 0.06.
Sevoflurane inhibits the migration and invasion of human colorectal cancer HCT116 cells by up-regulating the expression of miR-34a, which may be related to the inhibition of MMP-2 and MMP-9 protein expression.
- Citation: Shan XS, Liu Y, Lou QB, Zhou ZF. Sevoflurane regulates migration and invasion of colorectal cancer cells by up-regulating miR-34a. Shijie Huaren Xiaohua Zazhi 2019; 27(3): 146-153
- URL: https://www.wjgnet.com/1009-3079/full/v27/i3/146.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i3.146
结直肠癌是常见的消化道恶性肿瘤, 在西方国家其发病率较高, 是第三大常见癌症[1]. 随着社会环境、饮食习惯和生活方式的改变, 我国结直肠癌的发病率亦呈逐年上升的趋势[2]. 结直肠癌的复发、浸润和转移是导致患者死亡的主要原因[3], 因此深入探究其发病和发展机制对结直肠癌的诊断、治疗和预后具有重要意义. 基质金属蛋白酶2(matrix metalloproteinase 2, MMP-2)和MMP-9(matrix metalloproteinase 9, MMP-9)均属于基质金属蛋白酶家族, 可通过降解细胞外基质(extracellular matrix, ECM)成分参与肿瘤的浸润与转移. 七氟醚是临床上常用的吸入性麻醉药, 广泛应用于多种肿瘤切除手术的麻醉诱导和维持[4]. 近期研究显示, 七氟醚对胶质瘤、肺癌、骨肉瘤等肿瘤细胞的生长、凋亡、迁移和侵袭具有抑制作用[5-7]. 目前关于七氟醚对结直肠癌细胞生物学特性影响的研究尚无报道. 微小RNA(microRNA, miRNA)是一类长度约为20 nt的非编码RNA, 在细胞增殖、分化、凋亡、侵袭和迁移等过程中扮演重要角色. 研究显示, miR-34a在食管鳞状细胞癌、乳腺癌等多种肿瘤细胞中发挥抑制细胞迁移和侵袭的作用[8,9]. 有报道称, 过表达miR-34a能够抑制结直肠癌细胞的迁移和侵袭能力[10]. 本研究以人结直肠癌HCT116细胞为研究对象, 观察七氟醚对HCT116细胞迁移和侵袭的影响, 及对miR-34a表达量的调控作用, 并探讨其作用的分子机制, 以期为七氟醚应用于结直肠癌的诊治提供实验依据.
人结直肠癌细胞株HCT116(中国科学院上海生命科学学院细胞库); 七氟醚(美国Baxter公司); DMEM培养基、胎牛血清(美国Gibco公司); 胰蛋白酶、青霉素和链霉素(杭州四季青生物工程材料有限公司); Trizol试剂、逆转录试剂盒(北京康为试剂有限公司); SYBR Green PCR Master Mix试剂盒(日本TaKaRa公司); miR-34a inhibitor和阴性对照inhibitor control(广州锐博生物科技有限公司); 引物合成及测序均由上海生工生物工程有限公司完成; Lipofectamine 2000转染试剂(美国Invitrogen公司); CCK-8试剂(碧云天生物技术研究所); PVDF膜(美国Abcam公司); 孔径8 μm的Transwell小室(美国Corning公司); Matrigel基质胶(美国BD公司); ECL化学发光检测试剂盒(美国Thermo Fisher公司); MMP-2抗体、MMP-9抗体、GAPDH抗体及二抗(美国CST公司).
1.2.1 细胞培养: 人结直肠癌HCT116细胞培养在含10%胎牛血清的DMEM培养基(含100 U/L青霉素、100 U/L链霉素)中, 放置在体积分数为5%CO2、37 ℃培养箱内培养, 每天观察细胞生长状态, 每隔1 d更换1次新鲜培养基. 待细胞生长汇合度达80%以上时, 用胰蛋白酶消化细胞, 进行传代培养, 取对数增殖期的细胞进行后续实验.
1.2.2 CCK-8检测七氟醚对细胞增殖能力的影响: 将处于对数生长期的HCT116细胞接种到96孔板中, 接种密度为1×104个/孔, 将细胞随机分为5组: 0%七氟醚组、1%七氟醚组、2%七氟醚组、4%七氟醚组、8%七氟醚组. 将各组细胞培养板分批次放入无菌密闭的玻璃箱中, 玻璃箱两侧壁分别安装进气口和出气口, 进气口连接麻醉机, 出气口连接麻醉气体监测仪. 0%七氟醚组细胞通入95% O2-2.5% CO2混合气体, 其余各组在此基础上分别通入1%、2%、4%、8%七氟醚, 5组细胞处理2、4、6 h时采用CCK-8检测细胞增殖能力, 即在各个时间点分别加入10 μL CCK-8溶液, 于37℃培养箱内孵育4 h, 使用酶标仪测定每孔细胞在450 nm处光密度值(OD值). 计算各组细胞增殖率, (实验组OD值-空白孔OD)/(对照组OD值-空白孔OD)×100%. 实验重复3次, 取均值.
1.2.3 细胞转染和分组: 转染前1 d将HCT116细胞接种到6孔板中, 接种密度为2×105个/孔, 放置于37 ℃培养箱内继续培养, 待细胞生长密度达40%-50%时, 分别将miR-34a inhibitor和inhibitor control转染至HCT116细胞, 将转染miR-34a inhibitor的细胞记为anti-miR-34a组, 将转染inhibitor control的细胞记为anti-NC组, 未转染的细胞记为Control组. 转染操作步骤严格参照Lipofectamine 2000转染试剂说明书进行, 转染后的细胞继续放置于37 ℃培养箱中培养.
各组细胞转染24 h后, 给予4%七氟醚处理4 h(根据七氟醚对细胞增殖影响及qRT-PCR检测实验, 筛选出的七氟醚作用浓度和时间), 分别记为Sevoflurane组、Sevoflurane+anti-NC组和Sevoflurane+anti-miR-34a组.
1.2.4 qRT-PCR检测miR-34a表达水平: 分别收集Control组、anti-NC组和anti-miR-34a组转染24 h的HCT116细胞, 以及4%七氟醚处理2、4、6 h的HCT116细胞, 采用Trizol试剂提取各组细胞中总RNA, 使用Nanodrop超微量核酸蛋白检测仪测定所提RNA的浓度和纯度. 参照逆转录试剂盒说明书合成cDNA, 以cDNA为模板, 使用SYBR Green PCR Master Mix试剂盒, 以U6为内参, 进行实时荧光定量PCR扩增, 采用20 μL反应体系, 其中模板0.8 μL, 上下游引物各1 μL, 2×SYBR Green qPCR Mix 10 μL, 剩余以ddH2O补足20 μL. 反应条件为: 94 ℃ 预变性5 min, 94 ℃ 变性30 s, 58 ℃退火30 s, 72 ℃延伸30 s, 采用40个循环. 反应结束后分析U6和miR-34a阈值(Ct值), 以2-ΔΔCt法计算各组HCT116细胞miR-34a相对表达水平. 实验重复3次, 取均值. miR-34a引物: F-5'-CCCACTCACCGTACTAA-3'; R-5'-GTGGTTTCAAGGCCAGATGT-3'; U6引物: F-5'-AAACCGTTACCATTACTGAGTT-3'; R-5'-CGCT TCGGCAGCACATATAC-3'.
1.2.5 Transwell实验检测细胞迁移和侵袭能力: 取50 μL稀释后的Matrigel基质胶铺于Transwell小室的上室, 于37 ℃培养箱中静置30 min备用. 收集Control组、Sevoflurane组、Sevoflurane+anti-NC组和Sevoflurane+anti-miR-34a组HCT116细胞, 用不含血清的培养基重悬细胞, 调整细胞密度为2×105个/mL. 取200 μL细胞悬液加入到Transwell小室的上室, 下室加入600 μL含10%胎牛血清的完全培养液, 放置37 ℃培养箱培养24 h. 取出小室, 除去上室培养液, 以无水甲醇固定30 min. 使用棉签轻轻拭去上室残留细胞, 以0.1%结晶紫染色20 min, 吸去染色液, 在倒置显微镜下随机选取6个视野, 观察计数穿膜细胞数. 实验重复3次, 取均值, 以穿膜细胞数表示细胞侵袭能力. 同样的方法检测细胞迁移能力, 除Transwell小室的上室未用Matrigel基质胶包被外, 其余步骤均与侵袭实验相同. 实验重复3次, 取均值.
1.2.6 Western blot检测各组细胞蛋白表达水平: 收集各组待测HCT116细胞, 使用蛋白提取试剂盒提取各组细胞中总蛋白, 采用BCA蛋白浓度检测试剂盒对蛋白进行定量测定. 使用上样缓冲液与蛋白样品混合, 在沸水浴中加热变性. 采用十二烷基硫酸钠-聚丙烯酰胺凝胶(10%分离胶和5%浓缩胶)进行电泳, 取50 μg蛋白样品加到上样孔, 电泳分离蛋白. 电泳结束后将凝胶上的蛋白转移至PVDF膜上, 在5%脱脂奶粉中封闭2 h. 分别加入1:500稀释的MMP-2一抗、1:500稀释的MMP-9一抗, 4 ℃过夜孵育. 再加入1:2000稀释的二抗, 室温孵育2 h. 加入ECL显色液, 显影、定影, 以凝胶成像仪拍照, 以GAPDH为内参, 采用Image J图像分析软件分析条带灰度值, 以目的蛋白条带灰度值与GAPDH条带灰度值的比值表示目的蛋白表达水平. 实验重复3次, 取均值.
统计学处理 采用SPSS 21.0统计学软件进行数据统计分析, 实验计量数据均采用mean±SD表示, 多组间差异比较采用单因素方差分析, 组间差异比较采用SNK-q检验分析, 其中以P<0.05表示差异具有统计学意义.
分别以0%、1%、2%、4%、8%的七氟醚处理结直肠癌HCT116细胞2、4、6 h, 以CCK-8检测细胞增殖能力, 结果如表1所示, 随着七氟醚浓度的升高HCT116细胞的增殖率逐渐降低. 4%和8%七氟醚组细胞在各个时间点增殖能力均受到明显抑制(P<0.05); 2%七氟醚组细胞从4 h开始增殖能力受到明显抑制(P<0.05); 1%七氟醚组细胞增殖能力无统计学意义(P>0.05). 结果说明七氟醚能够抑制直肠癌HCT116细胞增殖. 根据CCK-8实验, 后续选择4%七氟醚进行后续实验.
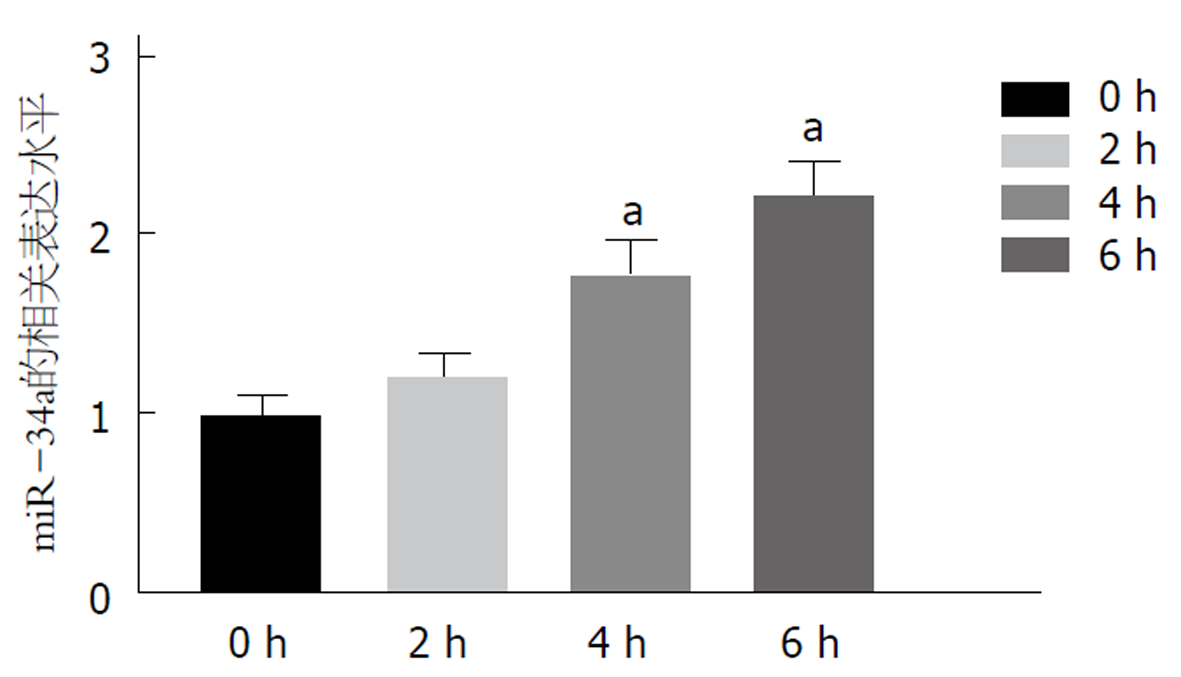
以4%七氟醚处理直肠癌HCT116细胞, 采用qRT-PCR检测细胞中miR-34a表达水平, 结果如图1所示, 与0 h组比, 处理4、6 h时HCT116细胞中miR-34a表达水平显著升高(P<0.05), 而处理2 h时HCT116细胞中miR-34a表达水平变化无统计学意义(P>0.05). 提示七氟醚能够促进HCT116细胞中miR-34a的表达. 根据qRT-PCR实验结果, 采用4%七氟醚处理4 h进行后续实验.
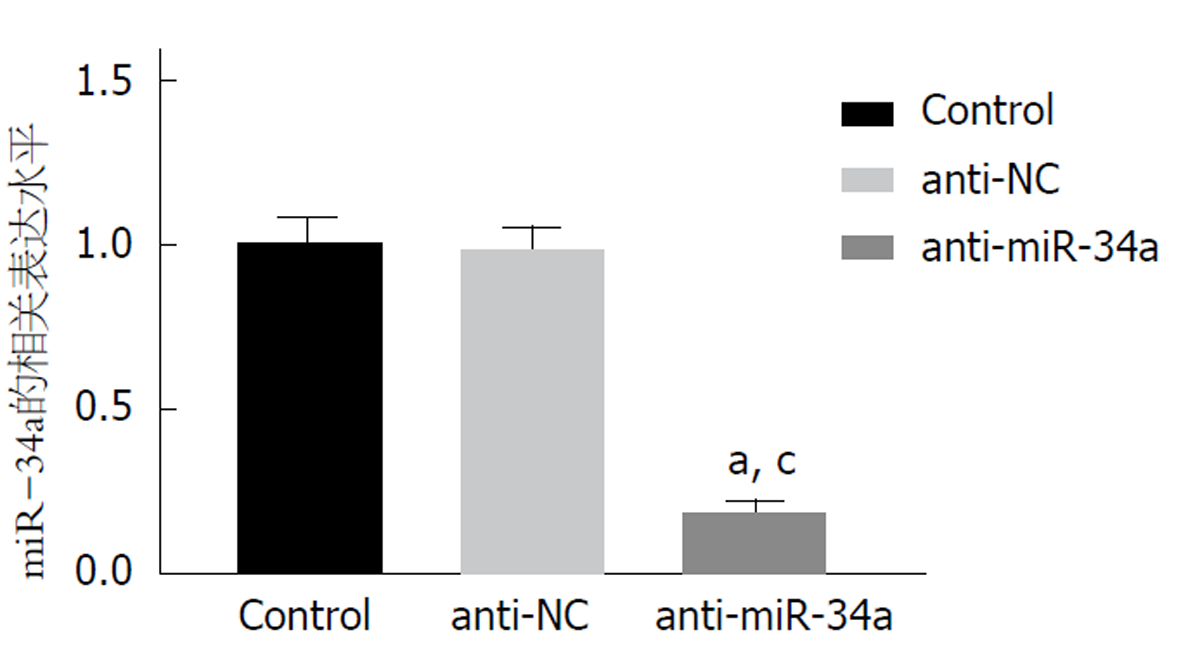
与Control组比, anti-NC组HCT116细胞中miR-34a的表达水平无明显变化(P>0.05), anti-miR-34a组HCT116细胞中miR-34a的表达水平显著降低(P<0.05). 见图2. 说明在HCT116细胞中转染miR-34a inhibitor成功下调了miR-34a的表达.
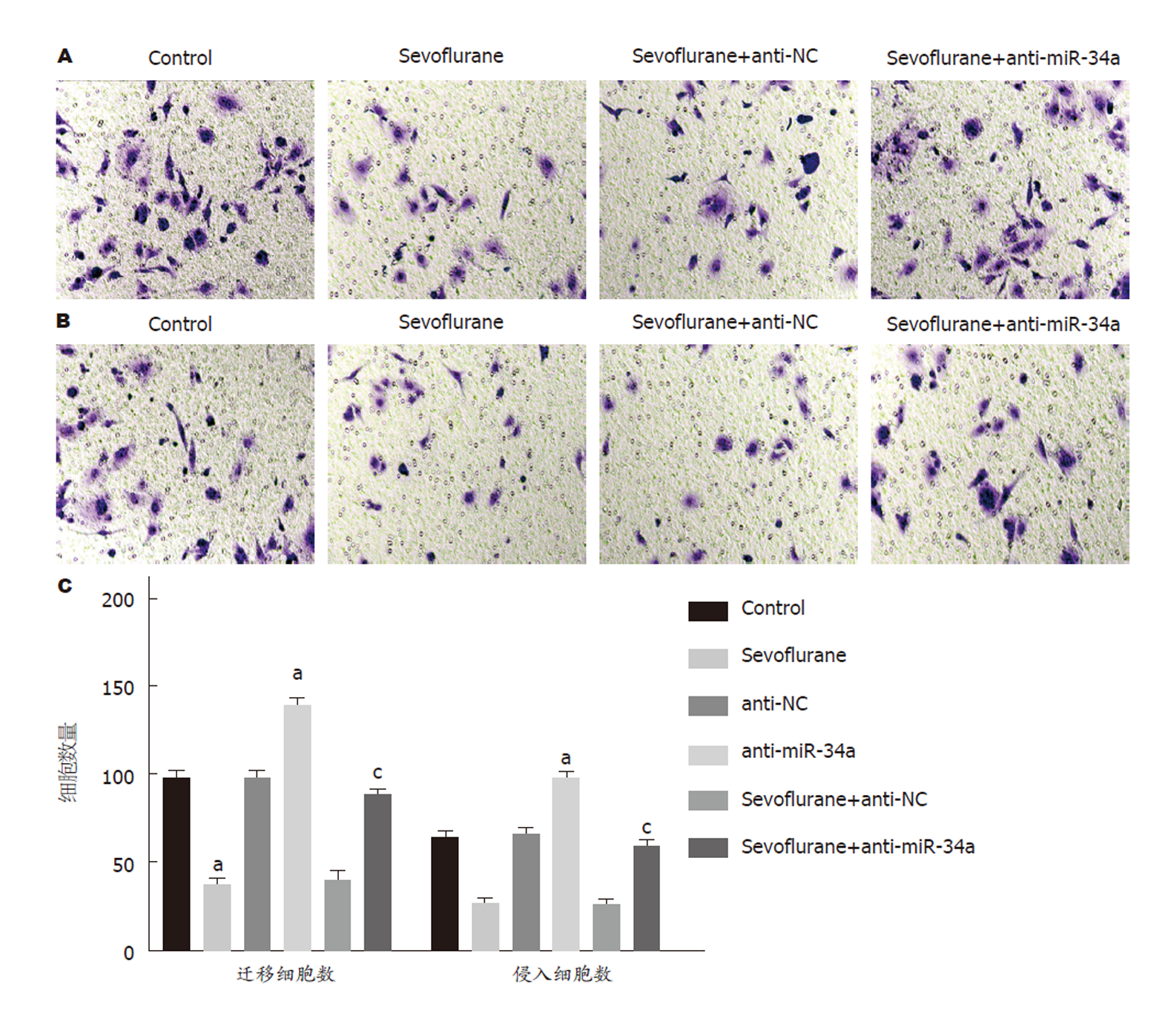
成功下调HCT116细胞中miR-34a的表达后, 给予4%七氟醚处理4 h, Transwell实验检测结果显示(图3), 与Control组比, Sevoflurane组迁移和侵袭细胞数显著减少(P<0.05). 与Sevoflurane组比, Sevoflurane+anti-NC组迁移和侵袭细胞数无明显改变(P>0.05); 而Sevoflurane+anti-miR-34a组迁移和侵袭细胞数明显增多(P<0.05). 以上实验结果表明七氟醚能够抑制HCT116细胞迁移和侵袭, 而anti-miR-34a能够逆转七氟醚抑制HCT116细胞迁移和侵袭的作用.
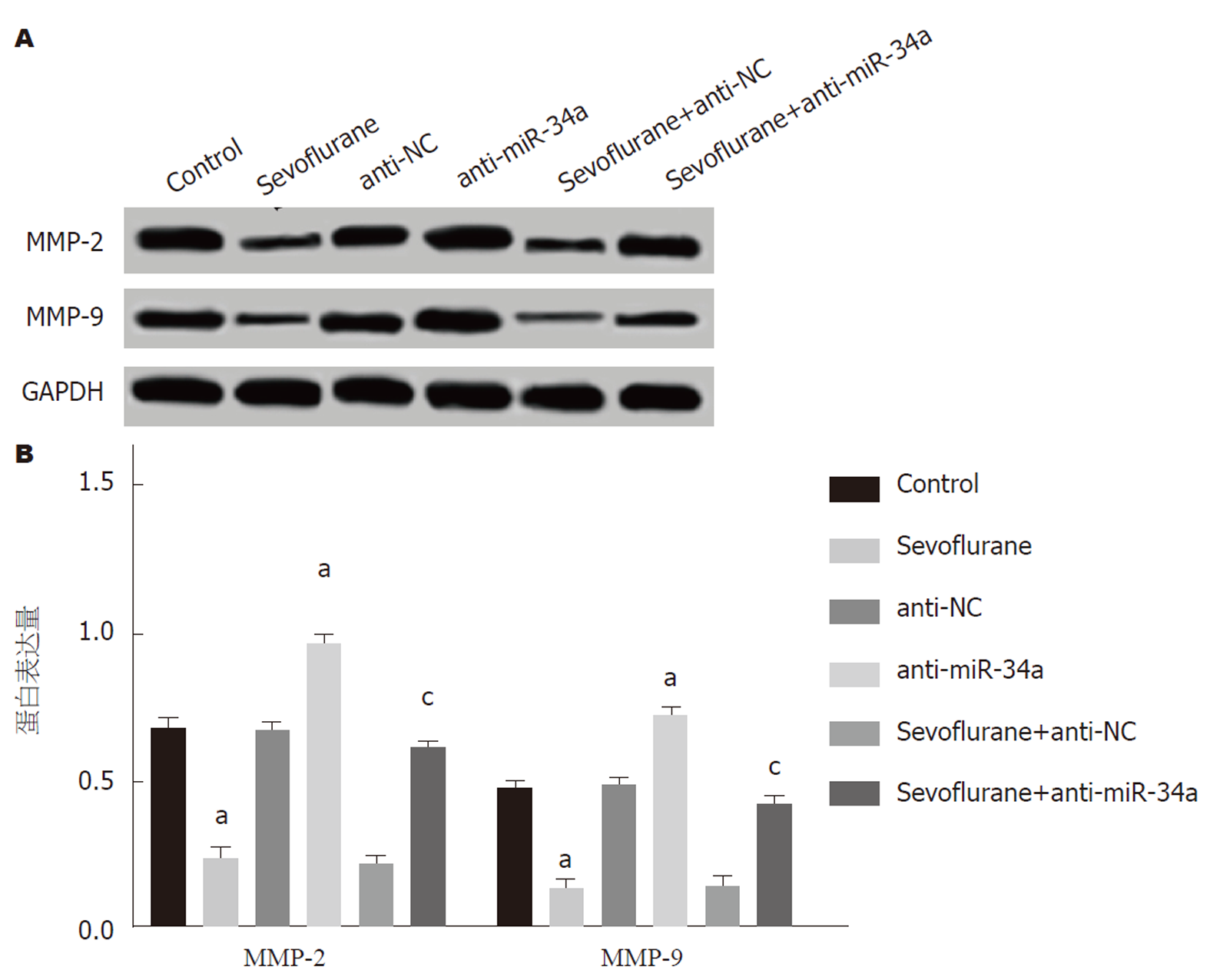
Western blot检测结果如图4, 与Control组比, Sevoflurane组HCT116细胞中MMP-2和MMP-9蛋白表达水平显著下调(P<0.05). 与Sevoflurane组比, Sevoflurane+anti-NC组细胞中MMP-2和MMP-9蛋白表达水平无明显改变(P>0.05), 而Sevoflurane+anti-miR-34a组细胞中MMP-2和MMP-9蛋白表达水平明显上调(P<0.05). 表明七氟醚能够抑制HCT116细胞中MMP-2和MMP-9蛋白表达, 而anti-miR-34a可回调七氟醚对MMP-2和MMP-9蛋白表达抑制的作用.
结直肠癌是全球范围内常见的消化系统恶性肿瘤之一, 具有较高的发病率和致死率, 目前已成为世界公共卫生问题之一[11]. 近年来结直肠癌的诊治水平得到一定的改善, 但结直肠癌患者术后多出现复发, 总体预后仍不能达到理想水平. 多项研究发现, 肿瘤发生转移是导致该情况的主要原因. 近期研究发现, 术中使用的麻醉药对多数肿瘤患者的生存率产生一定的影响[12]. 七氟醚是肿瘤切除手术中常用的吸入性麻醉药, 临床及基础研究发现, 七氟醚对肿瘤的生长及转移均具有一定程度的影响[13,14]. Liang等[15]人研究发现, 七氟醚能够通过抑制缺氧诱导因子-1α抑制缺氧诱导的肺癌细胞生长和转移. 黎真真等人以1%的七氟醚干预卵巢癌SKOV3细胞, 结果发现SKOV3细胞增殖、侵袭和迁移能力均明显受到抑制, 该过程与阻碍上皮间质转化过程及减轻干细胞特性有关[16]. 目前关于七氟醚对结直肠癌细胞转移和侵袭的研究鲜有报道. 因此本实验以不同浓度的七氟醚干预人结直肠癌HCT116细胞不同时间, 观察其对HCT116细胞增殖的影响, 筛选出其作用浓度为4%, 用于后续探究对HCT116细胞迁移和侵袭能力的影响.
目前关于miRNA参与肿瘤的发病和进展引起众多学者的广泛关注[17,18]. 据报道, miR-34a在调控皮肤鳞状细胞癌、食管癌、肝癌等多种肿瘤细胞迁移和侵袭中扮演重要角色[19-21]. Luo等[22]研究发现长链非编码RNA GAPLINC通过调节miR-34a/c-MET信号通路促进结直肠癌细胞的细胞迁移和侵袭. Chandrasekaran等[23]发现miR-34a通过下调高迁移率族蛋白盒1(HMGB1)的表达抑制人宫颈癌和结直肠癌细胞的增殖、迁移和侵袭. 说明miR-34a能够调控结直肠癌细胞的迁移和侵袭能力. 本实验发现, 4%的七氟醚处理HCT116细胞4 h后, miR-34a的表达水平显著升高. 提示七氟醚可能通过上调miR-34a的表达调控结直肠癌的迁移和侵袭. 为进一步验证该猜想, 本实验通过转染miR-34a inhibitor下调HCT116细胞中miR-34a的表达, 并以4%的七氟醚处理HCT116细胞4 h, 经Transwell实验检测发现, 七氟醚能够抑制HCT116细胞迁移和侵袭能力, 而下调miR-34a的表达联合七氟醚处理的细胞能够逆转七氟醚对HCT116细胞迁移和侵袭能力的抑制作用. 以上结果提示miR-34a参与了七氟醚抑制结直肠癌细胞迁移和侵袭的过程. 此外, 本实验检测了基质金属蛋白酶MMP-2和MMP-9表达水平, 发现七氟醚能够抑制MMP-2和MMP-9的表达, 而下调miR-34a可恢复七氟醚对MMP-2和MMP-9表达下调的作用. MMP-2和MMP-9是基质金属蛋白水解酶家族中重要成员, 它们能够通过降解细胞外基质和基底膜等物质促进肿瘤细胞发生转移, 在肿瘤浸润、侵袭和转移中发挥至关重要的作用[24,25]. 本实验结果提示, 七氟醚通过上调miR-34a的表达, 抑制结直肠癌细胞的迁移和侵袭能力, 且该过程与下调MMP-2和MMP-9的表达有关.
结直肠癌是常见的消化系统恶性肿瘤, 其发病率和致死率均处较高水平. 结直肠癌发生转移是导致预后不良的主要原因. 七氟醚是肿瘤切除手术中常用麻醉药, 多项研究发现, 七氟醚能够抑制肿瘤的生长和转移. 然而其具体作用机制目前尚不十分明确.
本实验探究七氟醚对结直肠癌细胞侵袭和迁移能力的影响, 并初步探讨其作用机制, 以期为临床上使用七氟醚治疗结直肠提供一定的实验基础.
本实验探讨七氟醚对结直肠癌HCT116细胞侵袭和迁移能力的影响主要通过调控miR-34a的表达实现的, 且该过程与MMP-2和MMP-9的表达水平的变化有关. 本研究为进一步探究七氟醚对肿瘤侵袭和迁移的机制研究奠定一定的理论基础.
本实验主要通过qRT-PCR实验检测七氟醚对HCT116细胞中miR-34a表达的影响, CCK-8法检测七氟醚对细胞增殖能力的影响; 通过脂质体转染实验抑制细胞中miR-34a的表达; 通过Transwell实验检测对细胞侵袭和迁移能力的影响; Western blot检测对细胞中MMP-2和MMP-9蛋白表达的影响.
本实验结果显示, 七氟醚能够抑制结直肠癌HCT116细胞的增殖、侵袭和迁移, 且上调miR-34a的表达. 在此基础上转染miR-34a inhibitor抑制miR-34a的表达后, 七氟醚对细胞侵袭和迁移能力的抑制作用部分被逆转, 此外发现MMP-2和MMP-9蛋白表达水平发生变化.
七氟醚能够抑制结直肠癌HCT116细胞侵袭和迁移, 其作用机制与上调miR-34a的表达, 抑制MMP-2和MMP-9蛋白表达有关, 为七氟醚对肿瘤侵袭和迁移的影响的分子机制探究奠定实验基础.
本实验以不同浓度的七氟醚干预人结直肠癌HCT116细胞不同时间, 观察其对HCT116细胞增殖的影响, 筛选出其作用浓度为4%, 用于后续探究对HCT116细胞迁移和侵袭能力的影响.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Siegel RL, Miller KD, Fedewa SA, Ahnen DJ, Meester RGS, Barzi A, Jemal A. Colorectal cancer statistics, 2017. CA Cancer J Clin. 2017;67:177-193. [PubMed] [DOI] |
| 2. | Zhu J, Tan Z, Hollis-Hansen K, Zhang Y, Yu C, Li Y. Epidemiological Trends in Colorectal Cancer in China: An Ecological Study. Dig Dis Sci. 2017;62:235-243. [PubMed] [DOI] |
| 3. | Zabijak L, Attencourt C, Guignant C, Chatelain D, Marcelo P, Marolleau JP, Treiner E. Increased tumor infiltration by mucosal-associated invariant T cells correlates with poor survival in colorectal cancer patients. Cancer Immunol Immunother. 2015;64:1601-1608. [PubMed] [DOI] |
| 4. | Tokushige H, Kushiro A, Okano A, Maeda T, Ito H, Wakuno A, Nagata SI, Ohta M. Clinical evaluation of constant rate infusion of alfaxalone-medetomidine combined with sevoflurane anesthesia in Thoroughbred racehorses undergoing arthroscopic surgery. Acta Vet Scand. 2018;60:50. [PubMed] [DOI] |
| 5. | Yi W, Li D, Guo Y, Zhang Y, Huang B, Li X. Sevoflurane inhibits the migration and invasion of glioma cells by upregulating microRNA-637. Int J Mol Med. 2016;38:1857-1863. [PubMed] [DOI] |
| 6. | Liang H, Gu M, Yang C, Wang H, Wen X, Zhou Q. Sevoflurane inhibits invasion and migration of lung cancer cells by inactivating the p38 MAPK signaling pathway. J Anesth. 2012;26:381-392. [PubMed] [DOI] |
| 8. | Yang L, Song X, Zhu J, Li M, Ji Y, Wu F, Chen Y, Cui X, Hu J, Wang L, Cao Y, Wei Y, Zhang W, Li F. Tumor suppressor microRNA-34a inhibits cell migration and invasion by targeting MMP-2/MMP-9/FNDC3B in esophageal squamous cell carcinoma. Int J Oncol. 2017;51:378-388. [PubMed] [DOI] |
| 9. | Li G, Yao L, Zhang J, Li X, Dang S, Zeng K, Zhou Y, Gao F. Tumor-suppressive microRNA-34a inhibits breast cancer cell migration and invasion via targeting oncogenic TPD52. Tumour Biol. 2016;37:7481-7491. [PubMed] [DOI] |
| 11. | Arnold M, Sierra MS, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global patterns and trends in colorectal cancer incidence and mortality. Gut. 2017;66:683-691. [PubMed] [DOI] |
| 13. | Lim JA, Oh CS, Yoon TG, Lee JY, Lee SH, Yoo YB, Yang JH, Kim SH. The effect of propofol and sevoflurane on cancer cell, natural killer cell, and cytotoxic T lymphocyte function in patients undergoing breast cancer surgery: an in vitro analysis. BMC Cancer. 2018;18:159. [PubMed] [DOI] |
| 15. | Liang H, Yang CX, Zhang B, Wang HB, Liu HZ, Lai XH, Liao MJ, Zhang T. Sevoflurane suppresses hypoxia-induced growth and metastasis of lung cancer cells via inhibiting hypoxia-inducible factor-1α. J Anesth. 2015;29:821-830. [PubMed] [DOI] |
| 18. | Ganju A, Khan S, Hafeez BB, Behrman SW, Yallapu MM, Chauhan SC, Jaggi M. miRNA nanotherapeutics for cancer. Drug Discov Today. 2017;22:424-432. [PubMed] [DOI] |
| 19. | Li S, Luo C, Zhou J, Zhang Y. MicroRNA-34a directly targets high-mobility group box 1 and inhibits the cancer cell proliferation, migration and invasion in cutaneous squamous cell carcinoma. Exp Ther Med. 2017;14:5611-5618. [PubMed] [DOI] |
| 20. | Shi H, Zhou S, Liu J, Zhu J, Xue J, Gu L, Chen Y. miR-34a inhibits the in vitro cell proliferation and migration in human esophageal cancer. Pathol Res Pract. 2016;212:444-449. [PubMed] [DOI] |
| 21. | Zhou J, Zhou W, Kong F, Xiao X, Kuang H, Zhu Y. microRNA-34a overexpression inhibits cell migration and invasion via regulating SIRT1 in hepatocellular carcinoma. Oncol Lett. 2017;14:6950-6954. [PubMed] [DOI] |
| 22. | Luo Y, Ouyang J, Zhou D, Zhong S, Wen M, Ou W, Yu H, Jia L, Huang Y. Long Noncoding RNA GAPLINC Promotes Cells Migration and Invasion in Colorectal Cancer Cell by Regulating miR-34a/c-MET Signal Pathway. Dig Dis Sci. 2018;63:890-899. [PubMed] [DOI] |
| 23. | Chandrasekaran KS, Sathyanarayanan A, Karunagaran D. Downregulation of HMGB1 by miR-34a is sufficient to suppress proliferation, migration and invasion of human cervical and colorectal cancer cells. Tumour Biol. 2016;37:13155-13166. [PubMed] [DOI] |
| 24. | Webb AH, Gao BT, Goldsmith ZK, Irvine AS, Saleh N, Lee RP, Lendermon JB, Bheemreddy R, Zhang Q, Brennan RC, Johnson D, Steinle JJ, Wilson MW, Morales-Tirado VM. Inhibition of MMP-2 and MMP-9 decreases cellular migration, and angiogenesis in in vitro models of retinoblastoma. BMC Cancer. 2017;17:434. [PubMed] [DOI] |
| 25. | Li H, Qiu Z, Li F, Wang C. The relationship between MMP-2 and MMP-9 expression levels with breast cancer incidence and prognosis. Oncol Lett. 2017;14:5865-5870. [PubMed] [DOI] |