修回日期: 2019-12-10
接受日期: 2019-12-20
在线出版日期: 2019-12-28
麦冬皂苷D(ophiopogonin D, OPD)是中药麦冬提取物中重要的单体成分且具有抗癌作用, 但是否具有抗肝细胞癌(hepatocellular carcinoma, HCC)作用还未知. 本研究假设OPD能够通过上调miR-519d-3p表达进而下调真核细胞翻译起始因子4E(eukaryotic translation initiation factor 4E, EIF4E)表达发挥抗HCC作用.
探讨OPD对HCC细胞增殖、迁移和侵袭的影响及可能的作用机制.
培养HCC细胞HepG2和MHCC97, 不同浓度(2.5 μmol/L、5 μmol/L、10 μmol/L)的OPD作用48 h后, 四甲基噻唑蓝染色法(methylthiazoletrazolium, MTT)检测细胞增殖, Transwell检测细胞迁移和侵袭, 实时荧光定量PCR(real-time quantitative PCR, RT-qPCR)检测细胞中miR-519d-3p和EIF4E mRNA表达, Western blot检测细胞周期蛋白D1(CyclinD1)、p21、基质金属蛋白酶2(matrix metalloproteinase-2, MMP-2)、MMP-9和EIF4E蛋白表达. 双荧光素酶报告基因实验验证miR-519d-3p和EIF4E 之间关系. 转染miR-519d-3p mimics、si-EIF4E构建miR-519d-3p 过表达或EIF4E表达抑制的HepG2和MHCC97细胞, RT-qPCR检测细胞中miR-519d-3p表达或Western blot检测EIF4E蛋白表达验证转染效率. MTT、Transwell、Western blot分别检测过表达miR-519d-3p或抑制EIF4E表达对HepG2和MHCC97细胞增殖、迁移和侵袭, 及CyclinD1、p21、MMP-2和MMP-9蛋白表达的影响.
与对照组比, OPD组HepG2细胞抑制率显著升高(P<0.05), 迁移和侵袭数显著降低(P<0.05), HepG2细胞中CyclinD1、MMP-2和MMP-9蛋白表达显著降低(P<0.05), p21蛋白表达显著升高(P<0.05), miR-519d-3p表达显著升高(P<0.05), EIF4E mRNA和蛋白表达显著降低(P<0.05), 且呈浓度依赖性. miR-519d-3p在HepG2细胞中靶向负调控EIF4E表达. miR-519d-3p过表达或抑制EIF4E表达均可抑制HepG2细胞增殖、迁移和侵袭. 抑制miR-519d-3p表达部分逆转了OPD对HepG2细胞增殖、迁移和侵袭的抑制作用.
OPD可能通过调控miR-519d-3p/EIF4E表达抑制HCC细胞的增殖、迁移和侵袭.
核心提要: 麦冬皂苷D可抑制HCC细胞增殖、迁移和侵袭, 其作用机制与调控miR-519d-3p/EIF4E表达有关.
引文著录: 申鹏, 汪正飞. 麦冬皂苷D通过调控miR-519d-3p/EIF4E表达对肝癌细胞增殖、迁移、侵袭的实验研究. 世界华人消化杂志 2019; 27(24): 1473-1482
Revised: December 10, 2019
Accepted: December 20, 2019
Published online: December 28, 2019
Ophiopogonin D (OPD) is an important monomer component in Chinese traditional medicine. Ophiopogon extract has anti-cancer effects, but it is unknown whether it has anti-liver cancer effects. We hypothesized that OPD could have anti-liver cancer activity by up-regulating the expression of miR-519d-3p and then down-regulating the expression of eukaryotic translation initiation factor 4E (EIF4E).
To investigate the effects of OPD on proliferation, migration, and invasion of hepatocellular carcinoma cells and the possible mechanism involved.
HepG2 and MHCC97 cells were cultured for 48 h after treatment with different concentrations (2.5, 5, and 10 μmol/L) of OPD. Methylthiazoletrazolium (MTT) assay was used to detect cell proliferation, Transwell assay was used to detect cell migration and invasion, real-time quantitative PCR (RT-qPCR) was used to detect the levels of miR-519d-3p and EIF4E mRNA in HepG2 cells, and Western blot was used to detect the expression levels of CyclinD1, p21, matrix metalloproteinase (MMP)-2, MMP-9, and EIF4E proteins. Dual luciferase reporter gene assay was used to validate the relationship between miR-519d-3p and EIF4E. To obtain HepG2 or MHCC97 cells with miR-519d-3p overexpression or EIF4E knockdown, miR-519d-3p mimic or si-EIF4E was transfected into HepG2 or MHCC97 cells. Then, RT-qPCR was used to detect the level of miR-519d-3p expression in HepG2 or MHCC97 cells and Western blot was performed to detect the level of EIF4E protein to verify the transfection efficiency. MTT assay, Transwell assay, and Western blot were used to detect the effects of overexpression of miR-519d-3p or inhibition of EIF4E on cell proliferation, migration, and invasion as well as the expression of CyclinD1, p21, MMP-2, and MMP-9 proteins.
Compared with control cells, the rates of reduced growth of HepG2 cells in the OPD groups were significantly increased (P < 0.05), cell migration and invasion were significantly decreased (P < 0.05), the levels of CyclinD1, MMP-2, and MMP-9 proteins were significantly decreased (P < 0.05), p21 protein expression was significantly increased (P < 0.05), miR-519d-3p expression was significantly increased (P < 0.05), and the levels of EIF4E mRNA and protein were significantly decreased (P < 0.05). MiR-519d-3p negatively regulated EIF4E expression in HepG2 cells. Overexpression of miR-519d-3p or inhibition of EIF4E inhibited the proliferation, migration, and invasion of HepG2 cells. Inhibition of miR-519d-3p expression partially reversed the inhibitory effect of OPD on the proliferation, migration, and invasion of HepG2 cells.
OPD inhibits the proliferation, migration, and invasion of hepatoma cells possibly by regulating the expression of miR-519d-3p/EIF4E.
- Citation: Shen P, Wang ZF. Ophiopogonin D inhibits proliferation, migration, and invasion of hepatocellular carcinoma cells by regulating miR-519d-3p/EIF4E expression. Shijie Huaren Xiaohua Zazhi 2019; 27(24): 1473-1482
- URL: https://www.wjgnet.com/1009-3079/full/v27/i24/1473.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i24.1473
肝细胞癌(hepatocellular carcinoma, HCC), 是常见的恶性肿瘤之一, 严重威胁人类的生命健康. HCC治疗以常规手术切除为主, 辅助放疗和化疗. 但目前, HCC的治疗效果不佳, 患者预后较差, 易发生早期侵袭和转移[1,2]. 因此, 寻找能够抑制HCC转移和侵袭的药物具有重要意义. 麦冬是百合科沿阶草属植物麦冬的肉质块根, 具有保护血管、抗心肌缺血、降血糖等功效, 在中医临床中广泛使用[3,4]. 常用的中药材. 麦冬皂苷D(ophiopogonin D, OPD)是麦冬提取物中重要的单体成分, 同样具有多种生物学效应[5]. 研究显示, OPD可能通过受体相互作用蛋白1/混合谱系激酶结构区域样蛋白通路诱导前列腺癌细胞程序性坏死抑制其生长[6]. OPD可能通过下调细胞周期相关蛋白B1表达, 阻滞细胞周期进展, 抑制人乳腺癌细胞生长[7]. 但目前, OPD影响HCC细胞的生物学行为的相关研究还未见报道. miRNA是一类内源性的小分子非编码RNA, 可在转录后水平调控靶基因的表达, 进而影响肿瘤细胞的增殖、凋亡、迁移和侵袭等生物学行为, 在肿瘤的发生和发展中发挥重要作用[8]. 研究显示, miR-519d-3p在胃癌[9]、乳腺癌[10]等肿瘤中异常表达, 上调其表达可抑制肿瘤的增殖、迁移和侵袭, 是肿瘤治疗的潜在靶点. 但目前, miR-519d-3p在HCC中的作用还未知. 生物信息学软件预测显示, 真核细胞翻译起始因子4E(eukaryotic translation initiation factor 4E, EIF4E)是miR-519d-3p的靶基因. EIF4E是真核细胞翻译起始因子家族的一员, 也参与多种肿瘤的发生和发展过程. 研究显示, HCC组织中EIF4E表达升高, 其高表达的患者5年生存率降低, 可作为HCC的预后生物标记物[11]. Ding等[12]研究显示, EIF4E参与HCC细胞的增殖和集落形成. 本研究以HCC细胞HepG2和MHCC97为研究对象, 主要探讨了OPD对HCC细胞增殖、迁移和侵袭的影响, 并以miR-519d-3p/EIF4E轴为切入点, 分析OPD影响HCC细胞增殖、迁移和侵袭的可能机制, 以期为HCC治疗药物的研发提供新思路.
HCC细胞株HepG2和MHCC97, ATCC细胞库; OPD, 上海一飞生物科技有限公司, 纯度>98%; 胎牛血清, 杭州四季青; DMEM培养基, 北京索莱宝公司; Trizol试剂和LipofectamineTM2000试剂盒, 美国Invitrogen公司; miR-519d-3p mimics、阴性对照等, 上海吉玛制药技术有限公司; 四甲基噻唑蓝(methylthiazoletrazolium, MTT)和二甲基亚砜(dimethyl sulfoxide, DMSO), 美国Sigma公司; 逆转录试剂盒, 北京诺博莱德科技有限公司; PCR试剂盒, 日本TOYOBO公司; 引物序列由上海生工生物技术公司提供; 放射免疫沉淀法(radioimmunoprecipitation assay, RIPA)裂解液、二喹啉甲酸(bicinchoninicacid, BCA)蛋白测定试剂盒和双荧光素酶活性检测试剂盒, 上海碧云天公司; 鼠抗人单克隆抗体细胞周期蛋白D1(CyclinD1)和p21抗体, 美国Santa Cruz公司; 鼠抗人单克隆抗体基质金属蛋白酶2(matrix metalloproteinase 2, MMP-2)和MMP-9, 福州迈新技术开发有限公司.
1.2.1 细胞培养和转染: HepG2和MHCC97细胞, 均用含10%胎牛血清的DMEM培养基置于37 ℃、5%CO2、97%湿度的培养箱中培养. 待细胞生长密度达到80%时, 胰酶消化, 传代培养. 分别取对数生长期的HepG2、MHCC97细胞, 接种于6孔板中, 待细胞融合至60%时, 参照LipofectamineTM2000说明书. 分别转染转染miR-519d-3p模拟物(mimics)及阴性对照(miR-NC)、miR-519d-3p抑制剂(anti-miR-519d-3p)及阴性对照(anti-miR-NC).、EIF4E小干扰RNA(si-EIF4E)及乱序无意义序列(si-NC). 转染24 h后, 更换新鲜培养基, 继续培养至48 h, 收集各组细胞进行后续实验.
1.2.2 细胞分组处理: 未转染的HepG2、MHCC97细胞均分为对照组: 细胞正常培养, 不做任何处理; OPD组: 含不同浓度[6](2.5 μmol/L、5 μmol/L、10 μmol/L) OPD的培养基作用48 h. 转染miR-519d-3p mimics、miR-NC、si-EIF4E、si-NC的HepG2和MHCC97细胞均培养48 h, 分别记为miR-519d-3p 组、miR-NC组、si-EIF4E组和si-NC组. 转染anti-miR-519d-3p、anti-miR-NC的HepG2和MHCC97细胞均用含10 μmol/L OPD的培养基作用48 h, 分别记为OPD+anti-miR-519d-3p组、OPD+anti-miR-NC组.
1.2.3 MTT检测细胞增殖: 未转染或转染后的HepG2、MHCC97细胞, 调整细胞浓度为2.5×104个/mL, 接种于96孔板中, 每孔200 μL, 置于常规培养箱中培养. 细胞贴壁后按照1.2.2分组处理. 培养结束后, 每孔加入20 μL MTT溶液(5 g/L), 继续培养4 h. 然后吸弃培养基, 加入150 μL DMSO溶液, 反应5 min, 混匀后于全自动酶标仪490 nm处测定吸光度值.
1.2.3 Transwell检测细胞迁移和侵袭: 未转染或转染后的HepG2、MHCC97细胞, 用不含胎牛血清的DMEM培养基重悬, 调整细胞浓度为2×105个/mL. 细胞迁移实验: 取100 μL细胞悬液加入至Transwell小室的上室, 下室加入500 μL含10%胎牛血清的DMEM培养基, 上室细胞按照1.2.2处理后, 吸弃培养基. 取出小室, PBS清洗细胞, 经甲醛固定、结晶紫染色后, 倒置显微镜下观察、拍照, 计算迁移细胞数目. 细胞侵袭实验: 不含胎牛血清的DMEM培养基稀释Matrigel胶, 加入到Transwell小室的上室. 然后取100 μL细胞悬液加入至铺有Matrigel胶的上室, 剩余操作与细胞迁移实验相同.
1.2.4 实时荧光定量PCR检测miR-519d-3p和EIF4E mRNA: Trizol试剂提取各组处理后细胞中总RNA. 紫外分光光度计检测RNA的纯度和浓度, 选取A260 nm/A280 nm值在1.8-2.0的范围内的RNA, 使用逆转录试剂盒将其逆转录为cDNA, -20 ℃保存. 然后以cDNA为模板行PCR扩增. PCR反应条件: 95 ℃ 5 min, 95 ℃ 10 s, 60 ℃ 30 s, 72 ℃ 30 s, 共45个循环. miR-519d-3p以U6为内参, EIF4E以GAPDH为内参, 采用2-△△Ct法计算miR-519d-3p和EIF4E mRNA的相对表达水平.
1.2.5 Western blot蛋白表达: RIPA裂解液, 提取各组细胞中总蛋白, 于冰上充分裂解30 min, 4 ℃、12000 g离心10 min, 收集上清液, BCA法测定蛋白含量. 取适量的蛋白, 加入上样缓冲液, 煮沸5 min使蛋白变性. 取15 μg变性蛋白上样进行SDS-聚丙烯酰胺凝胶电泳. 电泳结束后, 将蛋白转至PVDF膜, 使用5%脱脂牛奶室温条件封闭, 封闭时间2 h. 加入一抗, 4 ℃孵育过夜. TBST洗膜3次, 每次5 min. 然后加入辣根过氧化酶标记的二抗, 室温孵育1 h. TBST洗膜3次, 每次5 min. 加入ECL显影液避光条件下进行显影, 凝胶成像系统曝光拍照.
1.2.6 双荧光素酶报告基因实验: 生物信息学软件预测显示, EIF4E的3'UTR中存在与miR-519d-3p互补的核苷酸序列. 将对数生长的HepG2细胞接种于6孔板中, 细胞融合至60%时, 使用LipofectamineTM2000将pmiRGLO-WT-EIF4E、pmiRGLO-MUT-EIF4E质粒分别与miR-519d-3p mimics和其阴性对照共转染至HepG2、MHCC97细胞. 转染后6 h, 更换新鲜的培养基. 继续培养至48 h, 收集各组细胞, 参照双荧光素酶活性检测试剂盒说明书操作, 对各组细胞的荧光素酶活性进行测定.
统计学处理 利用SPSS 22.0软件分析实验数据. 计量资料以(Mean±SD)表示, 两组间比较采用独立样本t检验, 多组间比较采用单因素方差分析. 以P<0.05表示差异有统计学意义.
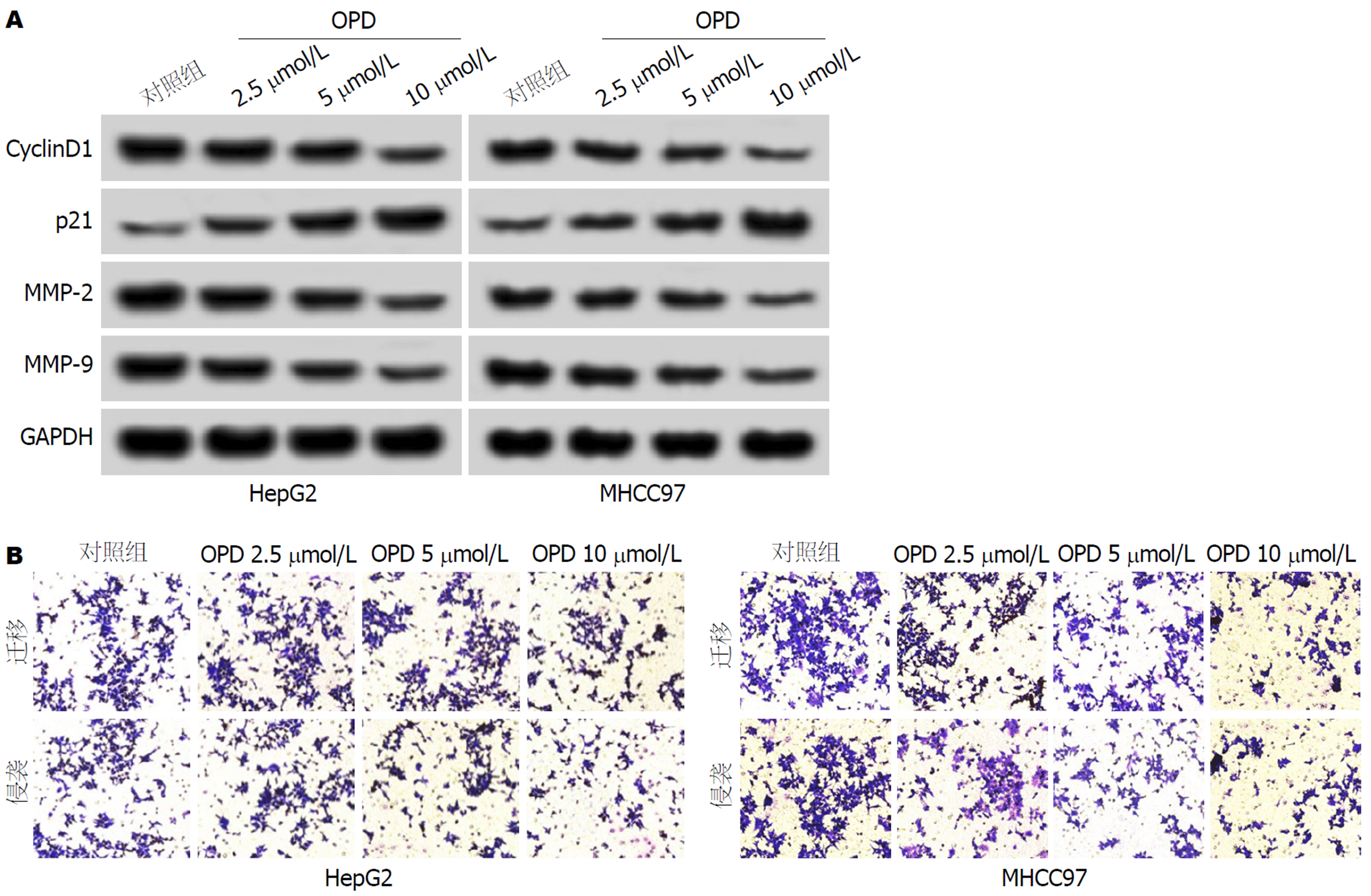
与对照组比较, OPD组HepG2、MHCC97细胞的抑制率、p21蛋白表达显著升高(P<0.05), 迁移和侵袭数、CyclinD1、MMP-2和MMP-9蛋白表达显著降低(P<0.05), 且不同浓度OPD组间比较差异具有统计学意义(P<0.05). 表明OPD可剂量依赖性抑制HepG2、MHCC97细胞增殖、迁移和侵袭(图1、表1和表2).
| 分组 | 抑制率(%) | 迁移细胞数(个) | 侵袭细胞数(个) | CyclinD1蛋白 | p21蛋白 | MMP-2蛋白 | MMP-9蛋白 |
| 对照组 | 0.00±0.00 | 126.34±10.48 | 109.23±9.24 | 0.73±0.07 | 0.24±0.03 | 0.77±0.06 | 0.75±0.07 |
| OPD 2.5 μmol/L组 | 17.28±1.75a | 92.41±9.14a | 81.42±8.01a | 0.61±0.06a | 0.39±0.04a | 0.64±0.05a | 0.59±0.05a |
| OPD 5 μmol/L组 | 39.46±3.57ac | 71.26±7.24ac | 59.37±5.44ac | 0.48±0.05ac | 0.52±0.05ac | 0.52±0.04ac | 0.48±0.04ac |
| OPD 10 μmol/L组 | 61.14±6.28ace | 53.41±5.22ace | 41.69±4.83ace | 0.27±0.03ace | 0.68±0.06ace | 0.37±0.03ace | 0.32±0.03ace |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 分组 | 抑制率(%) | 迁移细胞数(个) | 侵袭细胞数(个) | CyclinD1蛋白 | p21蛋白 | MMP-2蛋白 | MMP-9蛋白 |
| 对照组 | 0.00±0.01 | 105.32±11.22 | 89.65±8.33 | 0.68±0.06 | 0.29±0.03 | 0.65±0.06 | 0.78±0.07 |
| OPD 2.5 μmol/L组 | 19.65±1.84a | 81.65±8.43a | 71.61±7.42a | 0.56±0.05a | 0.44±0.04a | 0.54±0.05a | 0.65±0.05a |
| OPD 5 μmol/L组 | 31.26±3.45ac | 62.98±6.33ac | 56.44±5.31ac | 0.44±0.04ac | 0.58±0.05ac | 0.41±0.04ac | 0.53±0.05ac |
| OPD 10 μmol/L组 | 48.61±4.33ace | 42.87±4.39ace | 34.29±4.63ace | 0.29±0.03ace | 0.73±0.07ace | 0.26±0.03ace | 0.34±0.03ace |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
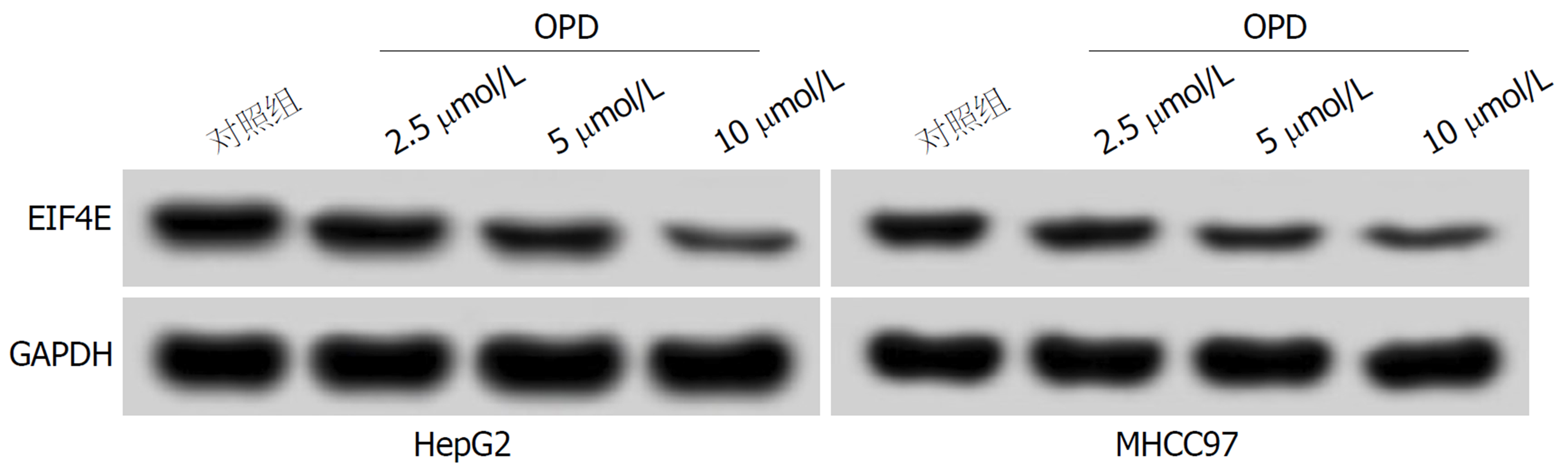
与对照组比, OPD组HepG2、MHCC97细胞中miR-519d-3p表达显著升高(P<0.05), EIF4E mRNA和蛋白表达显著降低(P<0.05), 且不同浓度OPD组间比较差异具有统计学意义(P<0.05), 表明OPD可剂量依赖性促进HepG2、MHCC97细胞中miR-519d-3p表达, 抑制EIF4E表达(图2和表3).
| 分组 | HepG2 | MHCC97 | ||||
| miR-519d-3p | EIF4E mRNA | EIF4E蛋白 | miR-519d-3p | EIF4E mRNA | EIF4E蛋白 | |
| 对照组 | 1.00±0.09 | 1.02±0.09 | 0.62±0.06 | 1.00±0.08 | 1.01±0.07 | 0.57±0.05 |
| OPD 2.5 μmol/L组 | 2.11±0.21a | 0.81±0.08a | 0.49±0.04a | 1.62±0.16a | 0.87±0.07a | 0.46±0.04a |
| OPD 5 μmol/L组 | 3.02±0.29ac | 0.63±0.06ac | 0.33±0.03ac | 2.51±0.22ac | 0.75±0.06ac | 0.35±0.03ac |
| OPD 10 μmol/L组 | 4.27±0.38ace | 0.42±0.04ace | 0.21±0.03ace | 3.12±0.31ace | 0.57±0.05ace | 0.24±0.03ace |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
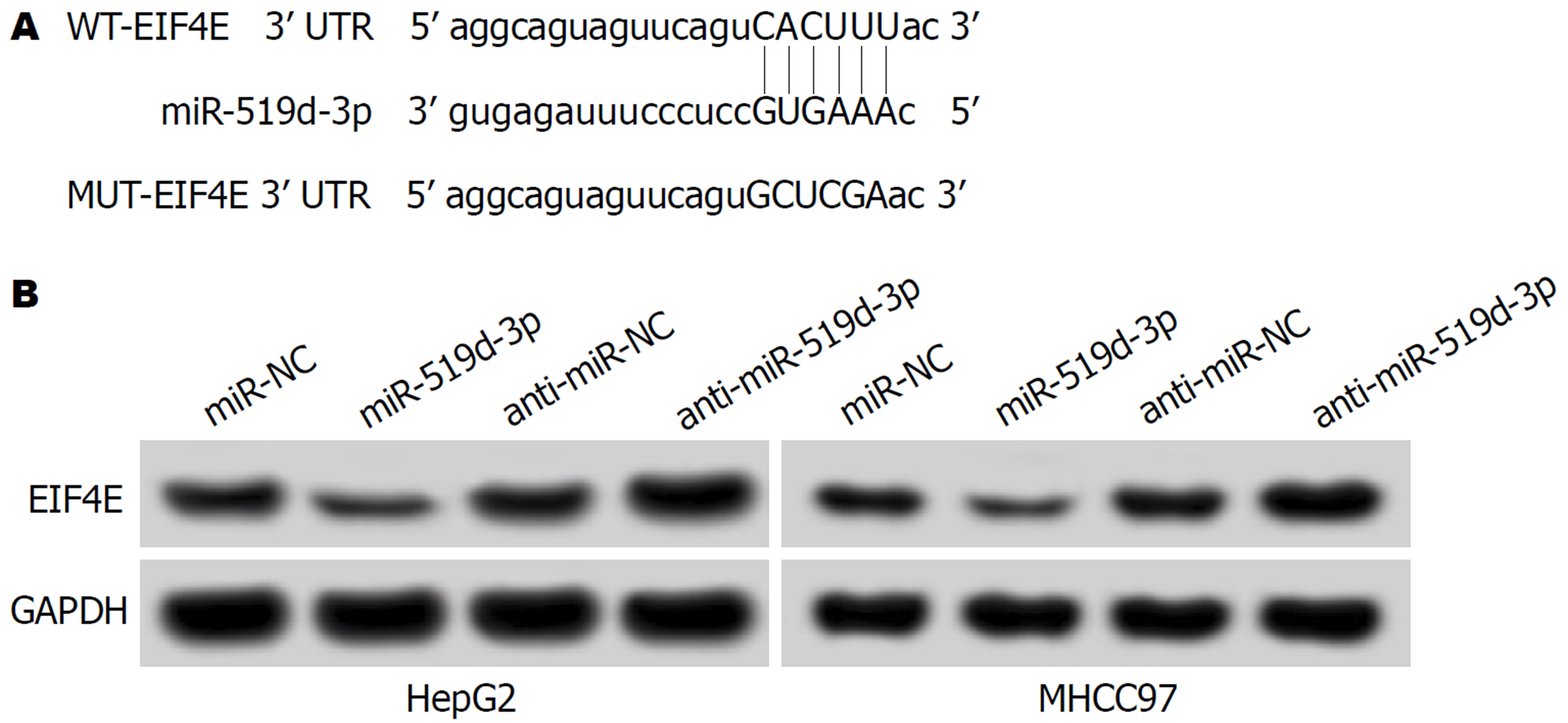
TargetScan等生物信息学软件预测显示, EIF4E的3'UTR中含有与miR-519d-3p互补的核苷酸序列(图3A)., 与共转染WT-EIF4E的miR-NC组比较, miR-519d-3p 组HepG2、MHCC97细胞荧光素酶活性显著降低(P<0.05), 而与共转染MUT-EIF4E的miR-NC组比较, miR-519d-3p组HepG2、MHCC97细胞荧光素酶活性比较差异无统计学意义(P>0.05)(表4), 说明miR-519d-3p可与EIF4E的3'UTR序列上的结合位点靶向结合. miR-519d-3p组HepG2、MHCC97细胞中EIF4E蛋白表达显著低于miR-NC(P<0.05), anti-miR-519d-3p组HepG2、MHCC97细胞中EIF4E蛋白表达显著高于miR-NC(P<0.05)(表5). 表明miR-519d-3p在HepG2、MHCC97细胞中靶向负调控EIF4E表达.
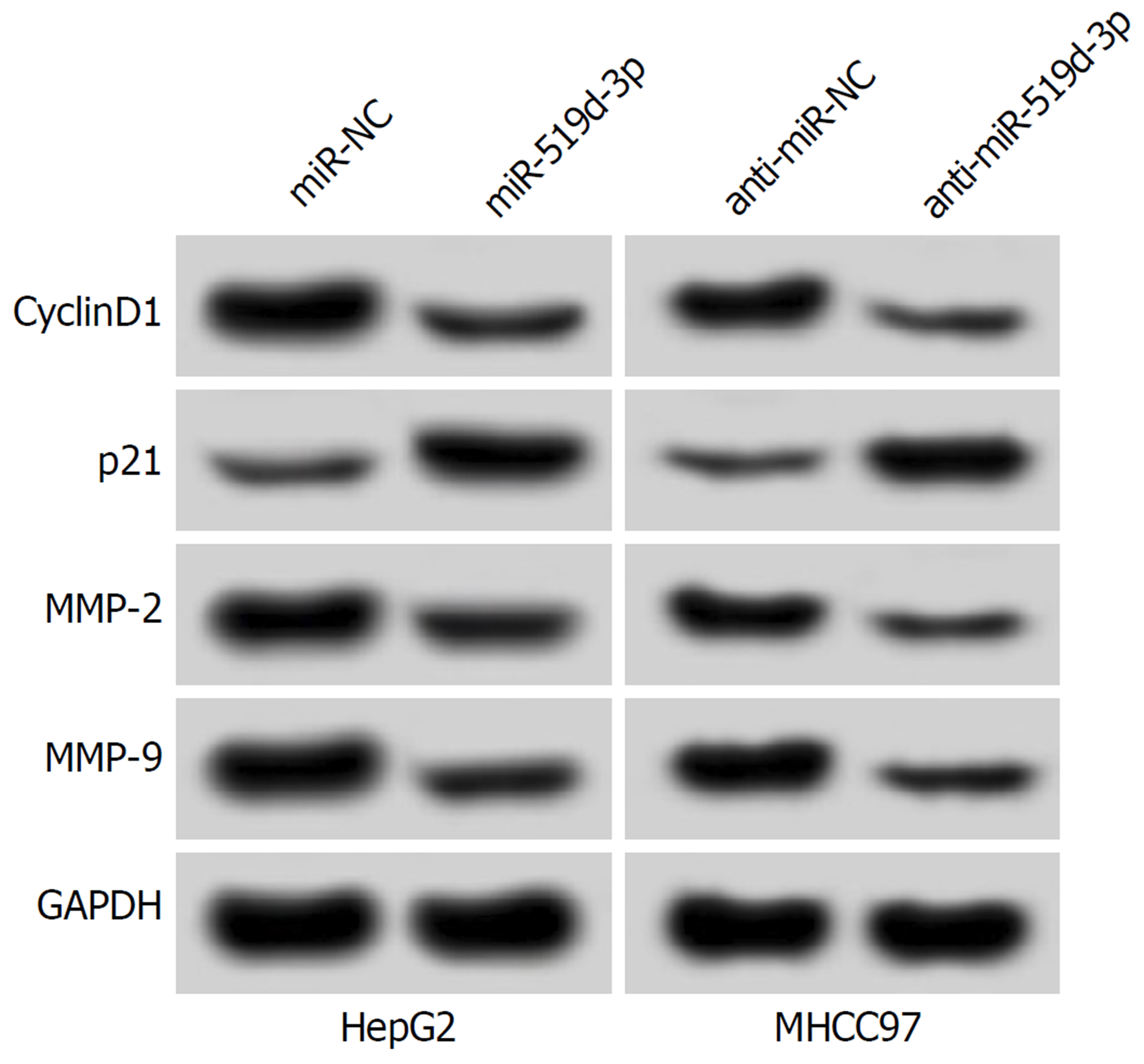
miR-519d-3p组HepG2、MHCC97细胞中miR-519d-3p表达水平显著高于miR-NC组(P<0.05), 表明miR-519d-3p mimics转染成功, 细胞中miR-519d-3p过表达. 与miR-NC组比较, miR-519d-3p组HepG2、MHCC97细胞抑制率、p21蛋白表达显著升高(P<0.05), 迁移和侵袭数, 及CyclinD1、MMP-2和MMP-9蛋白表达显著降低(P<0.05), 表明miR-519d-3p过表达可抑制HepG2、MHCC97细胞增殖、迁移和侵袭(图4、表6和表7).
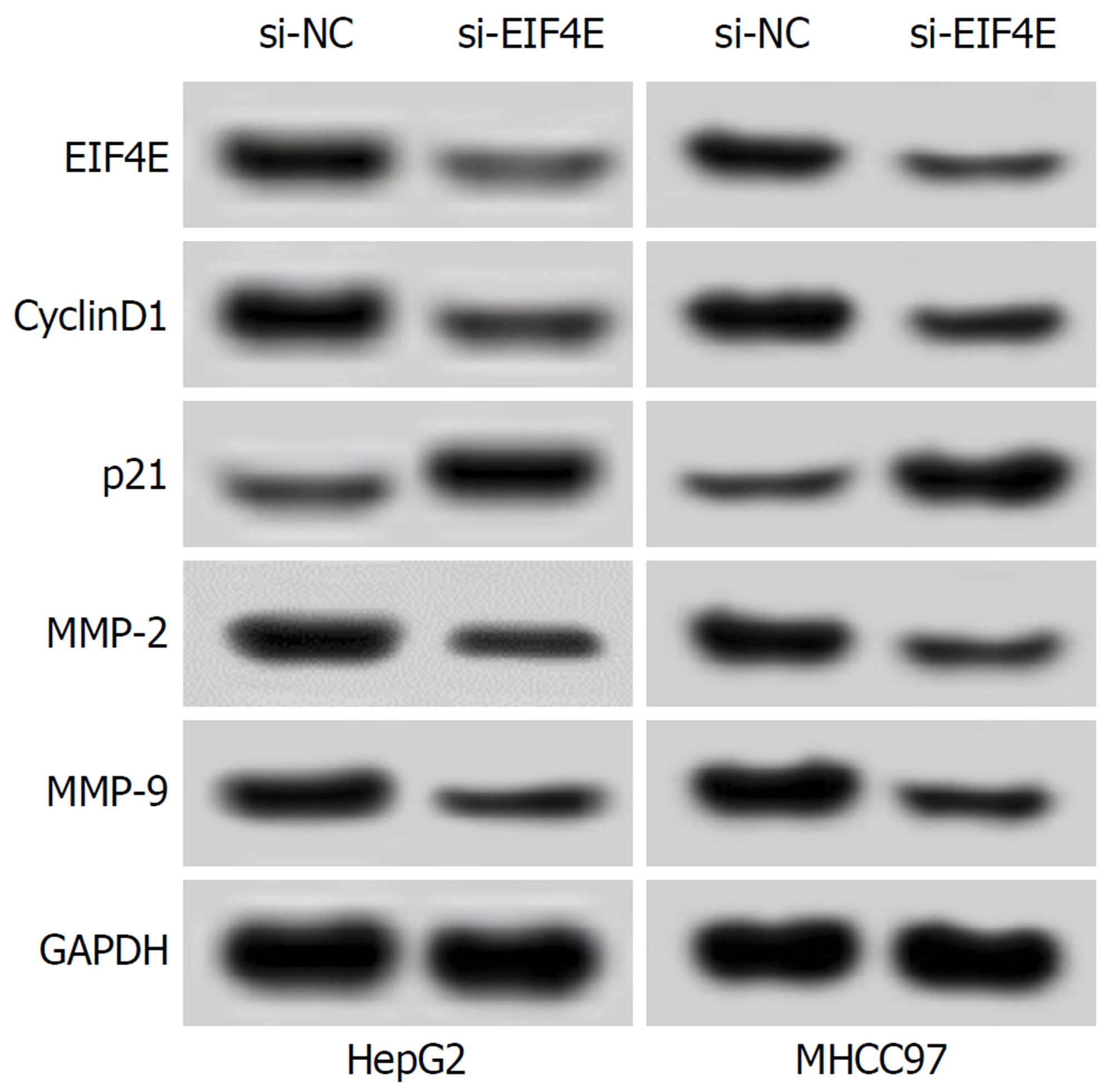
si-EIF4E组HepG2、MHCC97细胞中EIF4E蛋白表达显著低于si-NC组(P<0.05), 表明EIF4E小干扰RNA转染成功, 细胞中EIF4E表达受到抑制. 与miR-NC组比较, miR-519d-3p组HepG2、MHCC97细胞抑制率、p21蛋白表达显著升高(P<0.05), 迁移和侵袭数, 及CyclinD1、MMP-2和MMP-9蛋白表达显著降低(P<0.05), 表明抑制EIF4E表达可抑制HepG2、MHCC97细胞的增殖、迁移和侵袭(图5、表8和表9).
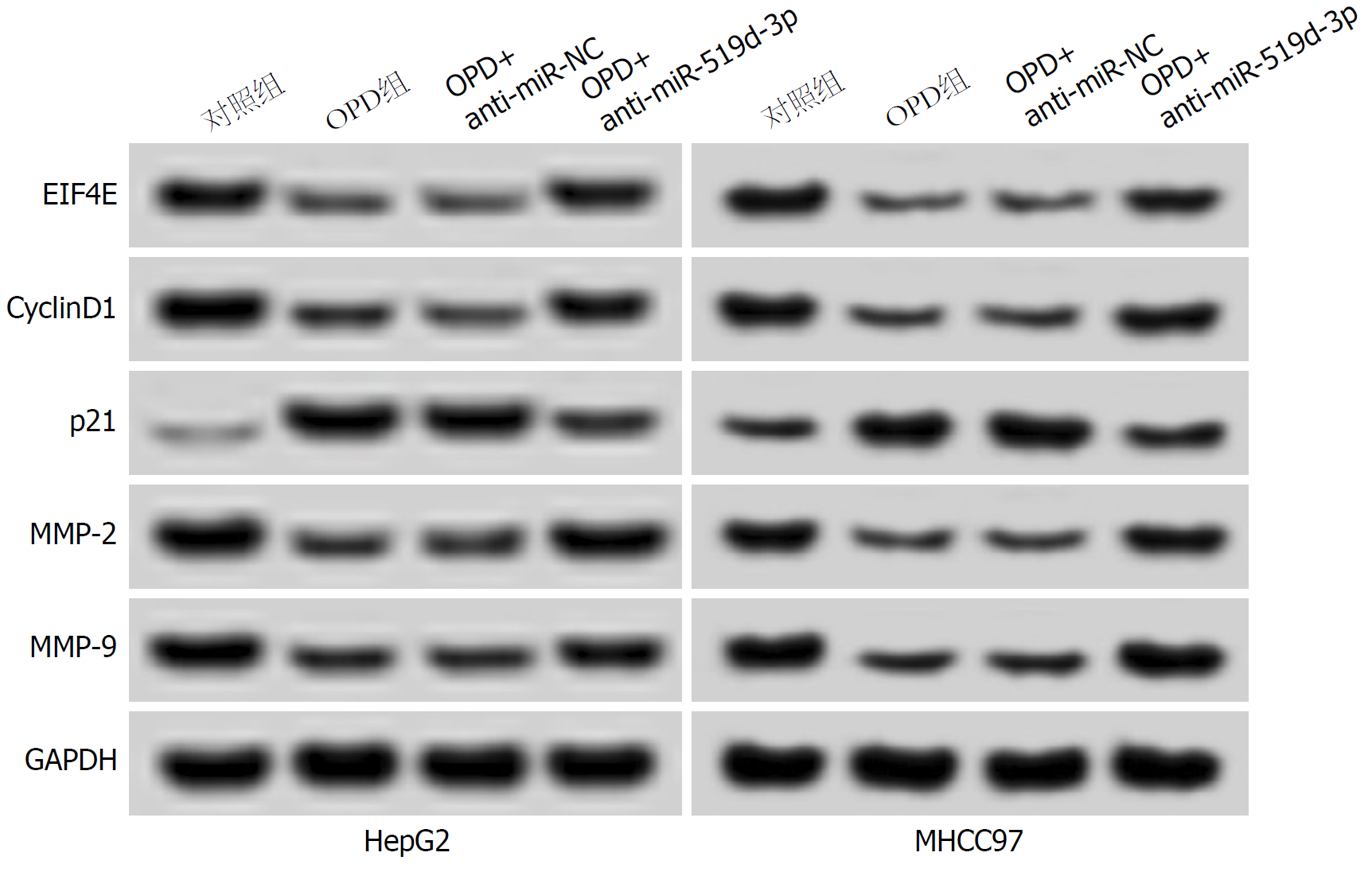
与OPD+anti-miR-NC组比, OPD+anti-miR-519d-3p组HepG2、MHCC97细胞抑制率、miR-519d-3p、p21蛋白表达均显著降低(P<0.05), 迁移和侵袭数, 及EIF4E、CyclinD1、MMP-2和MMP-9蛋白表达显著升高(P<0.05), 表明抑制miR-519d-3p表达部分逆转了OPD对HepG2、MHCC97细胞增殖、迁移和侵袭的抑制作用(图6、表10和表11).
| 分组 | miR-519d-3p | EIF4E蛋白 | 抑制率(%) | 迁移细胞数(个) | 侵袭细胞数(个) | CyclinD1蛋白 | p21蛋白 | MMP-2蛋白 | MMP-9蛋白 |
| 对照组 | 1.00±0.08 | 0.64±0.06 | 0.00±0.00 | 116.37±10.54 | 103.65±9.14 | 0.74±0.07 | 0.23±0.03 | 0.76±0.06 | 0.73±0.06 |
| OPD组 | 4.02±0.39a | 0.25±0.03a | 58.14±5.22a | 52.41±5.28a | 43.66±4.28 | 0.29±0.03a | 0.66±0.06a | 0.35±0.03a | 0.31±0.03a |
| OPD+anti-miR-NC | 4.11±0.41 | 0.22±0.03 | 60.35±6.17 | 50.29±5.27 | 41.58±4.27 | 0.25±0.03 | 0.69±0.07 | 0.33±0.03 | 0.28±0.03 |
| OPD+anti-miR-519d-3p | 1.96±0.19c | 0.51±0.05c | 19.68±1.92c | 82.62±8.04c | 71.36±7.24c | 0.61±0.06c | 0.37±0.04c | 0.59±0.05c | 0.56±0.05c |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 分组 | miR-519d-3p | EIF4E蛋白 | 抑制率(%) | 迁移细胞数(个) | 侵袭细胞数(个) | CyclinD1蛋白 | p21蛋白 | MMP-2蛋白 | MMP-9蛋白 |
| 对照组 | 1.01±0.09 | 0.57±0.05 | 0.00±0.01 | 109.32±9.47 | 89.32±8.47 | 0.66±0.06 | 0.30±0.03 | 0.64±0.06 | 0.79±0.07 |
| OPD组 | 2.79±0.28a | 0.21±0.01a | 41.65±4.22a | 46.35±4.47a | 36.29±3.58 | 0.27±0.03a | 0.75±0.07a | 0.25±0.03a | 0.35±0.03a |
| OPD+anti-miR-NC | 2.84±0.27 | 0.20±0.03 | 43.18±4.27 | 44.25±4.42 | 34.17±3.44 | 0.26±0.03 | 0.76±0.07 | 0.24±0.03 | 0.33±0.03 |
| OPD+anti-miR-519d-3p | 1.53±0.15c | 0.46±0.04c | 15.98±1.89c | 79.28±7.36c | 68.21±6.22c | 0.54±0.05c | 0.39±0.04c | 0.52±0.05c | 0.68±0.06c |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
天然产物具有抗肿瘤效果, 多数从植物中提取的天然化合物是抗肿瘤药物的先导化合物[13]. OPD是传统中草药麦冬的主要活性单体, 在心血管、心肌损伤等方面发挥保护作用[14,15]. 研究显示, OPD通过抑制核转录因子kappa B、磷脂酰肌醇3-激酶/蛋白激酶B和转录激活蛋白-1途径抑制肺癌细胞增殖, 增强紫杉醇诱导的肺癌死亡[16]. OPD可通过抑制p38的磷酸化以及MMP-9的表达抑制黑素瘤MDA-MB-435细胞的增殖和侵袭, 是黑素瘤治疗的候选药物[17]. 目前, OPD对HCC细胞生物学行为的影响还未知. 本研究结果显示, OPD可抑制HCCHepG2细胞的增殖、迁移和侵袭, 下调HepG2细胞中CyclinD1、MMP-2和MMP-9蛋白表达, 上调p21蛋白表达, 提示OPD在一定程度上发挥抗HCC的作用, 是HCC治疗的潜在药物.
miRNA参与肿瘤的发生和发展. miR-519d-3p是近年来新发现的一种miRNA. 有报道称, miR-519d-3p在结直肠癌组织和细胞系中表达下调, 过表达miR-519d-3p通过直接靶向肌钙蛋白相关蛋白表达显著抑制结直肠癌细胞的增殖、迁移和侵袭, 并阻滞细胞周期G0/G1期, 诱导结直肠癌细胞凋亡[18]. 过表达miR-519d-3p可抑制乳腺癌细胞的增殖和迁移, 是乳腺癌治疗的潜在靶标[10]. 但是, miR-519d-3p对HCC细胞生物学行为的影响还未知. 本研究显示, 过表达miR-519d-3p可抑制HCC细胞增殖、迁移和侵袭, 提示miR-519d-3p可能是HCC细胞治疗的分子靶点. 此外, OPD可促进HCC细胞中miR-519d-3p的表达, 而抑制miR-519d-3p表达逆转了OPD对HCC细胞增殖、迁移和侵袭的影响, 提示OPD通过上调细胞中miR-519d-3p表达HCC细胞的增殖、迁移和侵袭.
miRNA通常与靶mRNA的3'端UTR区结合, 抑制mRNA翻译或裂解mRNA, 通过调控基因的表达发挥作用[19,20]. 本研究首先通过生物信息学软件发现, EIF4E的3'UTR中含有与miR-519d-3p互补的核苷酸序列, 提示miR-519d-3p可能调控EIF4E表达. 然后通过双荧光素酶报告基因实验证实了miR-519d-3p在HCC细胞中负调控EIF4E表达. 这也与OPD促进HCC细胞miR-519d-3p表达, 而抑制EIF4E表达的结果一致. 此外, 抑制EIF4E表达可抑制HCC细胞的增殖、迁移和侵袭, 并下调细胞中CyclinD1、MMP-2和MMP-9蛋白表达, 上调p21蛋白表达进一步提示OPD可能通过上调HCC细胞中miR-519d-3p进而下调EIF4E表达抑制HCC细胞的增殖、迁移和侵袭.
综上所述, OPD可抑制HCC细胞增殖、迁移和侵袭, 其作用机制可能与促进细胞miR-519d-3p表达进而下调EIF4E表达有关, 是潜在的HCC治疗药物. 但本研究还存在不足之处, 仅在细胞层面进行了初步探讨, 接下来将通过动物实验进一步验证OPD抑制HCC发生发展的作用及其他可能的作用机制.
肝细胞癌(hepatocellular carcinoma, HCC)易复发和转移, 缺乏有效的治疗药物. 麦冬皂苷D(ophiopogonin D, OPD)是中药麦冬提取物中重要的单体成分, 在乳腺癌、肺癌、黑素瘤等肿瘤中发挥抗癌作用, 但是对HCC的影响还未知. 本研究探讨OPD对HCC细胞增殖、迁移和侵袭的影响及作用机制, 以期为HCC治疗药物的研发提供新思路.
本研究的主题是OPD是否抑制HCC细胞的增殖、迁移和侵袭及其是否通过调控miR-519d-3p/真核细胞翻译起始因子4E(eukaryotic translation initiation factor 4E, EIF4E)轴表达发挥作用, 目的是为了探究OPD是否发挥抗HCC作用及其可能的作用机制.
本研究的主要目标是探讨OPD是否具有抗HCC作用及作用机制, 通过实验明确了OPD可可能通过调控miR-519d-3p/EIF4E抑制HCC细胞的增殖、迁移和侵袭, 接下来进一步通过动物模型实验进一步验证OPD的抗HCC作用, 可能为临床HCC治疗药物的研发提供新途径.
本研究采用四甲基噻唑蓝染色法检测了细胞增殖, Transwell检测了细胞迁移和侵袭, 实时荧光定量PCR检测了细胞中miR-519d-3p和EIF4E mRNA表达, Western blot检测了细胞周期蛋白D1、p21、基质金属蛋白酶2(matrix metalloproteinase-2, MMP-2)、MMP-9和EIF4E蛋白表达, 双荧光素酶报告基因实验验证了miR-519d-3p与EIF4E的3'端UTR能否靶向结合.
本研究达到实验目标. 实验结果表明OPD可抑制HCC细胞增殖、迁移和侵袭, 在一定程度上发挥抗HCC作用, 同时, OPD通过调控上调miR-519d-3p表达, 进而抑制EIF4E表达来抑制HCC细胞的增殖、迁移和侵袭.
本研究首次发现OPD可抑制HCC细胞的增殖、迁移和侵袭, 且其作用机制与调控miR-519d-3p/EIF4E轴表达有关. OPD可能具有开发为治疗HCC药物的潜在价值.
本研究不足之处是还未进行动物相关实验, 仅在细胞层面进行了探讨, 接下来将通过动物实验探讨OPD对HCC小鼠肿瘤生长的影响及其他可能的作用机制. 方法是通过二乙基亚硝胺腹腔注射和CCl4灌胃方法构建小鼠HCC模型, 灌胃OPD, 探究OPD对肿瘤生长的影响, 以及建立接种miR-519d-3p过表达等HCC细胞建立移植瘤裸鼠, 探讨miR-519d-3p过表达对移植瘤裸鼠肿瘤生长的影响.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 5. | Tong YN, Yang LY, Yang Y, Song Z, Peng LS, Gao JN, Zeng H, Zou QM, Sun HW, Mao XH. An immunopotentiator, ophiopogonin D, encapsulated in a nanoemulsion as a robust adjuvant to improve vaccine efficacy. Acta Biomater. 2018;77:255-267. [PubMed] [DOI] |
| 6. | 王 佳佳, 卢 宗亮, 孔 亚, 宋 伟, 王 贺, 许 红霞. 麦冬皂苷D"通过RIP1/MLKL诱导前列腺癌PC3细胞程序性坏死. 第三军医大学学报. 2017;39:201-207. [DOI] |
| 7. | Zang QQ, Zhang L, Gao N, Huang C. Ophiopogonin D inhibits cell proliferation, causes cell cycle arrest at G2/M, and induces apoptosis in human breast carcinoma MCF-7 cells. J Integr Med. 2016;14:51-59. [PubMed] [DOI] |
| 9. | Li YY, Shao JP, Zhang SP, Xing GQ, Liu HJ. miR-519d-3p Inhibits Cell Proliferation and Invasion of Gastric Cancer by Downregulating B-Cell Lymphoma 6. Cytogenet Genome Res. 2018;154:12-19. [PubMed] [DOI] |
| 10. | Li D, Song H, Wu T, Xie D, Hu J, Zhao J, Shen Q, Fang L. MiR-519d-3p suppresses breast cancer cell growth and motility via targeting LIM domain kinase 1. Mol Cell Biochem. 2018;444:169-178. [PubMed] [DOI] |
| 11. | Jiang XM, Yu XN, Huang RZ, Zhu HR, Chen XP, Xiong J, Chen ZY, Huang XX, Shen XZ, Zhu JM. Prognostic significance of eukaryotic initiation factor 4E in hepatocellular carcinoma. J Cancer Res Clin Oncol. 2016;142:2309-2317. [PubMed] [DOI] |
| 12. | Ding J, Li Y, Fan H, Xu W, Gao R, Bai S, Zhu Z, Yang W, Gong Y, Yang J, Zhou J. Knockdown of PSMC3IP suppresses the proliferation and xenografted tumorigenesis of hepatocellular carcinoma cell. J Cell Biochem. 2019;120:5449-5458. [PubMed] [DOI] |
| 14. | 王 远, 王 宇光, 马 增春, 汤 响林, 梁 乾德, 谭 洪玲, 肖 成荣, 赵 永红, 高 月. 麦冬皂苷D通过降低自噬抑制血管紧张素Ⅱ诱导的心肌肥大. 中国药理学通报. 2016;32:1370-1376. [DOI] |
| 15. | 任 思嘉, 徐 焕华, 李 明, 郝 斐然, 马 增春, 汤 响林, 梁 乾德, 谭 洪玲, 肖 成荣, 王 宇光, 高 月. 麦冬皂苷D对大鼠心肌细胞H9c2的细胞毒性. 中国药理学与毒理学杂志. 2017;31:325-331. [DOI] |
| 16. | Lee JH, Kim C, Lee SG, Yang WM, Um JY, Sethi G, Ahn KS. Ophiopogonin D modulates multiple oncogenic signaling pathways, leading to suppression of proliferation and chemosensitization of human lung cancer cells. Phytomedicine. 2018;40:165-175. [PubMed] [DOI] |
| 17. | Zhang YY, Meng C, Zhang XM, Yuan CH, Wen MD, Chen Z, Dong DC, Gao YH, Liu C, Zhang Z. Ophiopogonin D attenuates doxorubicin-induced autophagic cell death by relieving mitochondrial damage in vitro and in vivo. J Pharmacol Exp Ther. 2015;352:166-174. [PubMed] [DOI] |
| 18. | Ye X, Lv H. MicroRNA-519d-3p inhibits cell proliferation and migration by targeting TROAP in colorectal cancer. Biomed Pharmacother. 2018;105:879-886. [PubMed] [DOI] |
| 19. | 朱 斌路, 姜 红堃. 竞争性内源RNA与心血管疾病发病机制的研究进展. 中华实用儿科临床杂志. 2018;33:1033-1036. [DOI] |
| 20. | 孙 雪梅, 郑 书贤, 王 瑞鸽, 王 照岩, 李 洪利, 尹 崇高, 张 宝刚. miR-424通过结合ARK5 mRNA 3'-UTR抑制胶质瘤细胞侵袭. 中国生物化学与分子生物学报. 2017;5:104-109. |