修回日期: 2019-10-17
接受日期: 2019-11-12
在线出版日期: 2019-11-28
乙型肝炎病毒(hepatitis B virus, HBV)感染是全球病毒性肝炎、肝纤维化及肝硬化(liver cirrhosis, LC)的主要病因. 肝纤维化最初是可逆的, 但如果缺乏早期诊断和及时治疗, 它将进展至终末期肝病, 如LC、肝衰竭, 甚至肝癌. 因此, 肝纤维化的准确分期在慢性乙肝(chronic hepatitis B, CHB)患者的管理和治疗起着决定性的作用. 然而, 目前尚缺乏被认可并广泛应用于临床的诊断标记物.
采用荟萃分析的方法评价循环miRNAs对CHB相关肝纤维化的诊断价值.
以"serum/plasma/circulating/blood"和"microRNA/miRNA/miR*"和"Hepatitis B/CHB/viral hepatitis*/chronic hepatitis"和"liver fibrosis/liver cirrhosis/hepatic fibrosis*"为关键词, 系统检索PubMed、Cochrane图书馆和Embase数据库的相关临床研究文献. 并对纳入文献进行归纳和统计学分析, 评估循环miRNAs诊断早期肝纤维化、进展期肝纤维化以及LC的敏感性、特异性、阳性似然比、阴性似然比、诊断比值比、以及受试者工作特征曲线下面积(the area under the receiver operating characteristic curves, AUROC).
最终15项研究共计1623例CHB患者被纳入. 其中9项研究评估了循环miRNAs对早期肝纤维化的诊断效能, 结果显示合并的敏感度、特异度及AUROC值分别为0.76(95%CI: 0.69-0.82)、0.64(95%CI: 0.47-0.78)和0.78(95%CI: 0.74-0.81). 4项研究评估了循环miRNAs对进展期肝纤维化的诊断效能, 结果显示合并的敏感度、特异度及AUROC值分别为0.79 (95%CI: 0.72-0.85)、0.81(95%CI: 0.63-0.91)和0.82 (95%CI: 0.79-0.85). 2项研究评估了循环miRNAs对LC患者的诊断效能, 结果显示AUROC = 0.882, 诊断准确性高达93.7%.
循环miRNAs对CHB患者的肝纤维化具有良好的诊断效能, 尤其对于进展期肝纤维化及LC, 可用作CHB患者肝纤维化诊断的潜在血清生物标记物.
核心提要: 本研究通过荟萃分析, 证实了循环miRNAs尤其联合miRNAs或miRNAs模型, 可作为一种稳定、优良的生物标志物, 用于诊断慢性乙肝相关肝纤维化, 其中对LC的诊断准确率高达93.7%. 同时, 也为其他病因所致肝纤维化的诊断提供了有前景的新手段.
引文著录: 路晴晴, 陈敏, 王晓林, 曹仕琼. 循环miRNAs对乙肝患者肝纤维化诊断价值的荟萃分析. 世界华人消化杂志 2019; 27(22): 1365-1374
Revised: October 17, 2019
Accepted: November 12, 2019
Published online: November 28, 2019
Hepatitis B virus (HBV) infection is a major cause of viral hepatitis, liver fibrosis, and liver cirrhosis worldwide. Liver fibrosis is initially reversible, but without early diagnosis and timely treatment, it can progress to end-stage liver diseases such as cirrhosis, liver failure, and even liver cancer. Therefore, the accurate diagnosis of hepatic fibrosis plays a decisive role in the management and treatment of chronic hepatitis B (CHB) patients. However, accurate diagnostic markers are still lacking.
To systemically evaluate the diagnostic accuracy of circulating microRNAs (miRNAs) in hepatitis B-related fibrosis.
The PubMed, Cochrane Library, and Embase databases were searched for all eligible studies using the following search terms: ("serum" or "plasma" or "circulating" or "blood") and ("microRNA" or "miRNA" or "miR*") and ("hepatitis B" or "CHB" or "viral hepatitis*" or "chronic hepatitis") and ("liver fibrosis" or "liver cirrhosis" or "hepatic fibrosis*"). The sensitivity, specificity, positive likelihood ratio, negative likelihood ratio, diagnostic odds ratio, and area under the summary receiver operating characteristics curve (AUROC) were pooled to assess the accuracy of circulating miRNAs for the diagnosis of early fibrosis, advanced fibrosis, and cirrhosis.
A total of 15 studies with 1623 CHB patients were enrolled in this meta-analysis. The pooled sensitivity, specificity, and AUROC of using circulating miRNAs for the diagnosis of hepatitis B-related early fibrosis were 0.76 (95%CI: 0.69-0.82), 0.64 (95%CI: 0.47-0.78), and 0.78 (95%CI: 0.74-0.81), respectively. The pooled sensitivity, specificity, and AUROC of using circulating miRNAs for the diagnosis of hepatitis B-related advanced fibrosis were 0.79 (95%CI: 0.72-0.85), 0.81(95%CI: 0.63-0.91), and 0.82 (95%CI: 0.79-0.85), respectively. Only two studies assessed the diagnostic accuracy of circulating miRNAs for predicting cirrhosis, and the results suggested that circulating miRNAs provided a high diagnostic accuracy for CHB-related cirrhosis (AUROC = 0.882; accuracy, 93.7%).
Circulating miRNAs show pretty good diagnostic accuracy for hepatitis B-related fibrosis, especially for advanced fibrosis and cirrhosis, and can be used as potential circulating biomarkers for the diagnosis of liver fibrosis in CHB patients.
- Citation: Lu QQ, Chen M, Wang XL, Cao SQ. Meta-analysis of diagnostic value of circulating microRNAs in hepatitis B-related fibrosis. Shijie Huaren Xiaohua Zazhi 2019; 27(22): 1365-1374
- URL: https://www.wjgnet.com/1009-3079/full/v27/i22/1365.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i22.1365
慢性乙肝(chronic hepatitis B, CHB)病毒感染是全球病毒性肝炎及肝硬化(liver cirrhosis, LC)的主要原因. 据估计, CHB患者总数超过3.5亿, 每年死亡人数高达100多万[1]. 大多数CHB患者存在肝纤维化. 肝纤维化最初是可逆的, 但如果缺乏早期诊断、及时治疗, 将会进展至终末期肝病, 如LC、肝衰竭, 甚至肝癌[2]. 因此, 肝纤维化的准确诊断在CHB患者的管理和治疗中发挥着至关重要的作用. miRNAs是一种短的, 包含18-25个核苷酸的非编码RNA, 在转录后水平调控基因表达. 近年来, 由于其在分化、发育、代谢、增殖、凋亡、病毒感染、肿瘤发生等众多生物学过程中所发挥的重要作用而备受关注[3-5]. 既往研究表明, 部分miRNAs的表达呈阶段性依赖性, 不同程度肝纤维化患者的miRNAs表达谱存在差异[6-8]. 近年来, 越来越多的学者尝试探索循环miRNAs对CHB相关肝纤维化的诊断效能, 但结果并不一致, 受试者工作特征曲线下面积(the area under the receiver operating characteristic curves, AUROC)从0.635至0.99不等[6-13]. 循环miRNAs是否可作为CHB相关肝纤维化的潜在诊断标记物一直存在争议. 为了解决这一争议, 我们进行了此项meta分析, 首次全面评估了循环miRNAs对CHB相关肝纤维化的诊断效能.
以"serum/plasma/circulating/blood"和"microRNA/miRNA/miR*"和"Hepatitis B/CHB/viral hepatitis*/chronic hepatitis"和"liver fibrosis/liver cirrhosis/hepatic fibrosis*"为关键词, 同时结合对应的主题词, 检索建库至2019年PubMed, Cochrane Library以及Embase数据库的所有相关研究文献, 并对相关文献的参考文献列表进行二次扩大范围检索以防遗漏. 文献检索对语言和地域不做限制. 纳入标准: (1)研究评价了循环miRNAs对乙肝相关肝纤维化的诊断性能; (2)以组织病理学检查为金标准; (3)根据METAVIR评分系统或Scheuer评分系统或者其他可比较的分期系统对肝纤维化程度进行分级; (4)研究包括足够的数据(包括真阳性、假阳性、真阴性、假阴性)来构建四格表用于评价诊断性能. 排除标准: (1)主题不相关; (2)研究对象为儿童; (3)动物或细胞实验; (4)综述性文献; (5)读者来信或会议摘要; (6)患者同时合并感染其他肝炎病毒; (7)重复发表和报道.
由两位研究者(路和王)严格依据纳入和排除标准独立地对研究进行选择, 并从符合条件的研究中提取信息, 这些信息包括第一作者姓名、发表年份、地区、样本量、纤维化评分系统、对照组的组成、miRNAs的类型、纤维化的分期、真阳性数(true-positive, TP)、真阴性数(true-negative, TN)、假阳性数(false-positive, FP)、假阴性数(false-negative, FN). 纳入研究的方法学质量根据诊断准确性实验质量评价量表(quality assessment of diagnostic accuracy studies, QUADAS)进行评估[14]. 研究人员之间的分歧通过讨论达成共识, 如果共识不能达成, 则由第三名调查人员(曹)介入作出最终决定.
统计学处理 统计分析采用Stata 14.0, Meta-Disc 1.4软件完成. 计算合并的敏感度(sensitivity, SE)、特异度(specificity, SP)、阳性似然比(positive likelihood ratios, PLR)、阴性似然比(negative likelihood ratios, NLR)、诊断比值比(diagnostic odds ratios, DOR)及AUROC作为血清miRNAs诊断CHB相关肝纤维化的效能评价指标. 诊断效能的评价标准: AUROC = 1.00时为完美, AUROC>0.90时为优秀, AUROC>0.80时为良好, AUROC<0.80时为中等[15]. 纳入研究的方法学质量评估则是通过Review Manager 5.3软件完成. 应用χ2检验对各研究间的异质性进行检验, 用不一致性指数I2评价异质性的程度. I2>50%或I2>25%, P<0.01, 表明异质性显著, 应采用随机效应模型进行数据合并, 否则应选择固定效应模型. 采用meta回归分析和亚组分析探索研究间异质性的潜在来源. 此外, 利用斯皮尔曼相关系数验证阈值效应的存在. Deeks漏斗图被用来检测发表偏倚. P<0.05为差异有统计学意义.
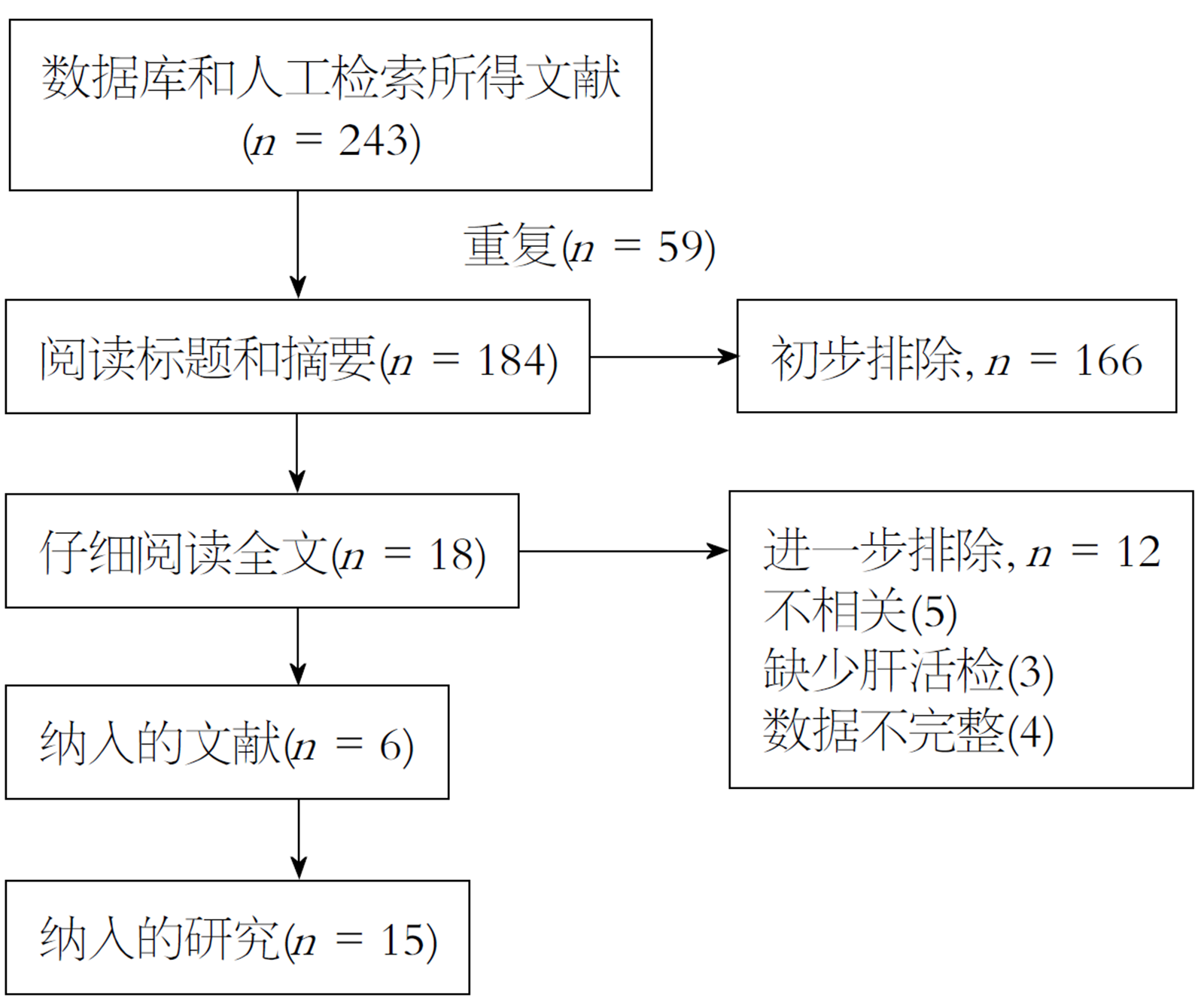
共检索到243篇文献, 其中PubMed 64篇、Cochrane 14篇、Embase 163篇, 手工检索2篇. 去除59篇重复文献后, 通过浏览标题和摘要去除166篇主题不相关文献. 对余下18篇文献仔细阅读全文, 最终, 6篇文献共包括15项研究符合要求被纳入(图1). 纳入研究的基本特征见表1[6-11], 所有研究均发表于2013-2017年, 共包含1623例乙肝患者. 除了1项研究来自日本外, 其余研究均来自中国. 研究间使用的组织学评分系统不完全相同, 其中3项研究使用METAVIR评分系统[7,11], 11项研究使用Scheuer评分系统[6,8,10]. 早期纤维化被定义为METAVIR评分≤F2, 或Scheuer评分≤S2; 进展期纤维化被定义为METAVIR评分≥F3或Scheuer评分S3≥F3; LC被定义为METAVIR评分 = F4或Scheuer评分 = S4.
| 作者 | 出版年份 | 地区 | n | 评分系统 | 病例组 | 对照组 | miRNAs | TP | FP | FN | TN |
| Bao等[6] | 2017 | 中国 | 123 | Scheuer | 早期纤维化 | 进展期纤维化 | miR-29a | 50 | 41 | 19 | 13 |
| Bao等[6] | 2017 | 中国 | 123 | Scheuer | 早期纤维化 | 进展期纤维化 | miR-29b | 40 | 15 | 29 | 39 |
| Bao等[6] | 2017 | 中国 | 123 | Scheuer | 早期纤维化 | 进展期纤维化 | miR-29c | 42 | 6 | 27 | 48 |
| Bao等[6] | 2017 | 中国 | 123 | Scheuer | 早期纤维化 | 进展期纤维化 | miR-143 | 53 | 16 | 16 | 38 |
| Bao等[6] | 2017 | 中国 | 123 | Scheuer | 早期纤维化 | 进展期纤维化 | miR-223 | 59 | 22 | 10 | 32 |
| Bao等[6] | 2017 | 中国 | 123 | Scheuer | 早期纤维化 | 进展期纤维化 | miR-21 | 59 | 24 | 10 | 30 |
| Bao等[6] | 2017 | 中国 | 123 | Scheuer | 早期纤维化 | 进展期纤维化 | miR-374 | 55 | 26 | 14 | 28 |
| Li等[7] | 2016 | 中国 | 20 | METAVIR | 早期纤维化 | 健康人 | miR-185 | 15 | 1 | 5 | 20 |
| Li等[7] | 2016 | 中国 | 24 | METAVIR | 进展期纤维化 | 健康人 | miR-185 | 21 | 1 | 3 | 20 |
| Chen等[8] | 2013 | 中国 | 182 | Scheuer | 肝硬化 | 健康人 | miR106b+181b | 77 | 23 | 13 | 69 |
| Long等[9] | 2017 | 中国 | 63 | unclear | 肝硬化 | 其他肝脏疾病 | miRNA 模型 | 14 | 3 | 1 | 45 |
| Xie等[10] | 2014 | 中国 | 140 | Scheuer | 进展期纤维化 | 早期纤维化 | miR-101 | 46 | 13 | 15 | 66 |
| Xie等[10] | 2014 | 中国 | 91 | Scheuer | 进展期纤维化 | 健康人 | miR-101 | 49 | 6 | 12 | 24 |
| Xie等[10] | 2014 | 中国 | 109 | Scheuer | 早期纤维化 | 健康人 | miR-101 | 67 | 18 | 12 | 12 |
| Nakamura[11] | 2017 | 日本 | 91 | METAVIR | 进展期纤维化 | 早期纤维化 | miR-122 | 23 | 26 | 7 | 35 |
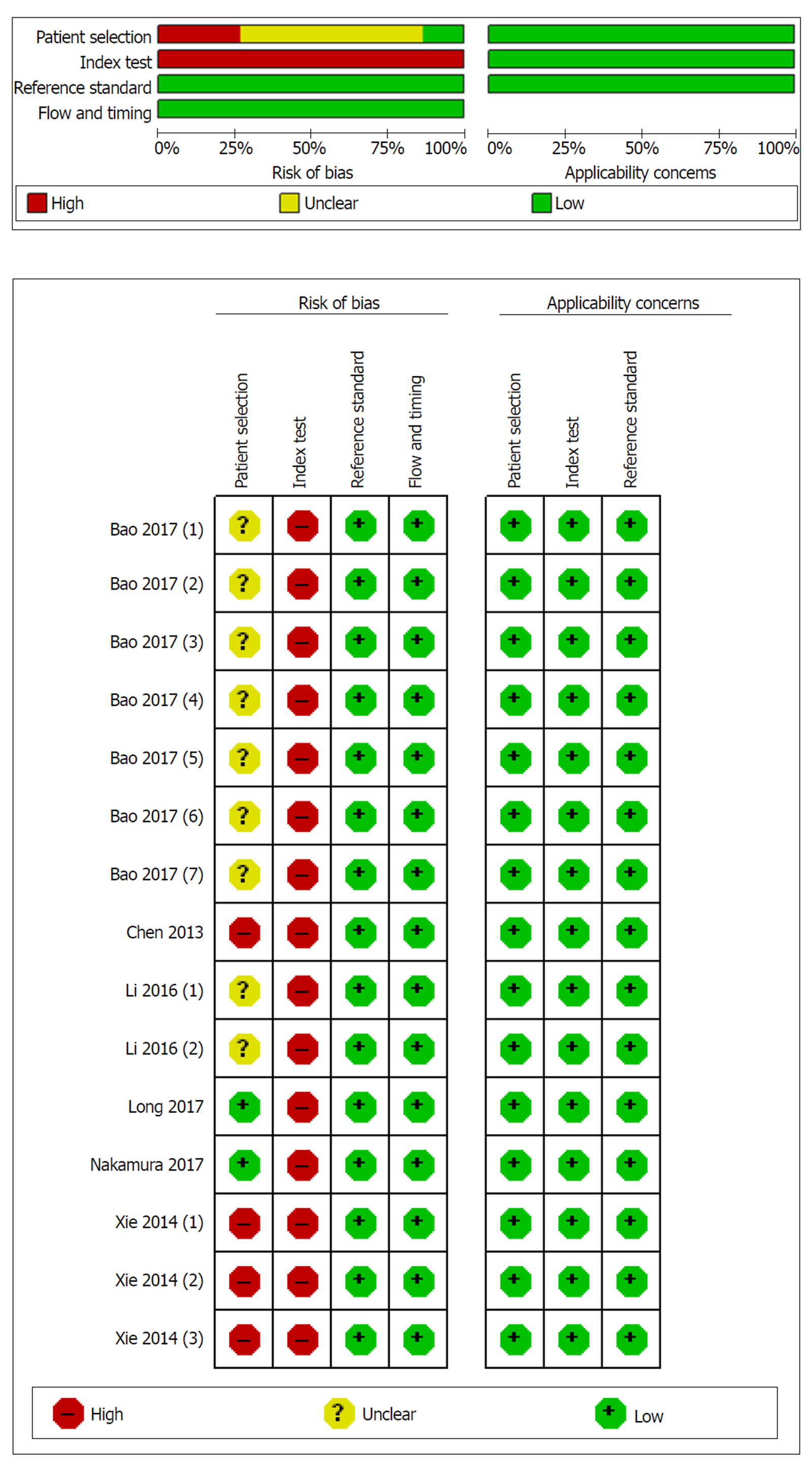
使用QUADAS-2量表从"病例选择、指标测试、参考标准、流程与进展"四个方面对纳入研究的方法学进行评估, 结果如图2. 大部分研究是回顾性的, 尽管部分研究明确了纳入病例的具体时段, 但没有一项研究表明病例的选择是随机的或连续的, 因此, 病例选择的偏倚风险被列为"不清楚". 没有一项研究事先设立诊断阈值, 因此, 在这些研究中, 检验指标的实施和解释都被标记为具有"高"的偏倚风险. 在参考标准、流程与进展方面, 纳入荟萃分析的研究均符合所有项目, 因此偏倚风险被标注为"低".
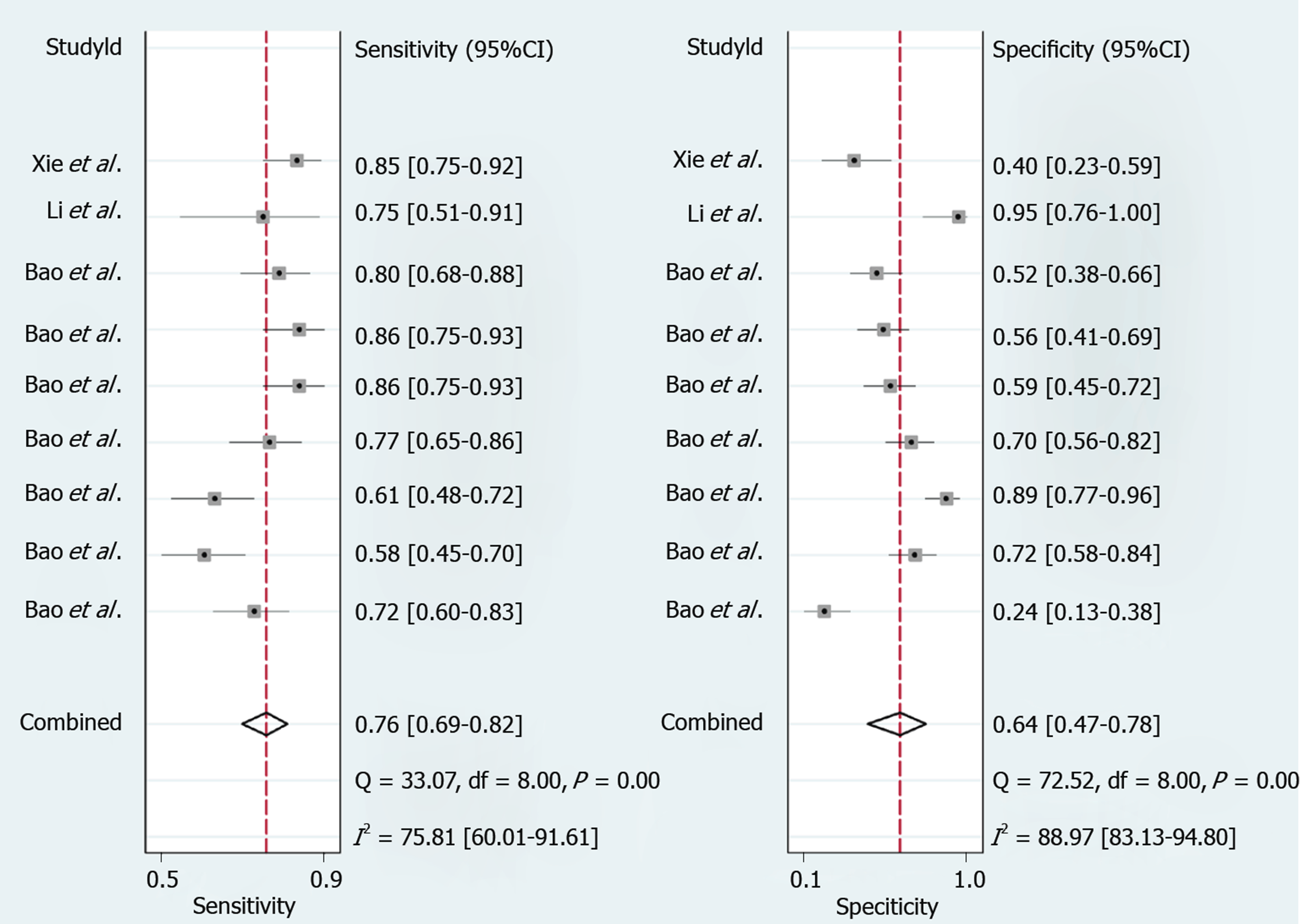
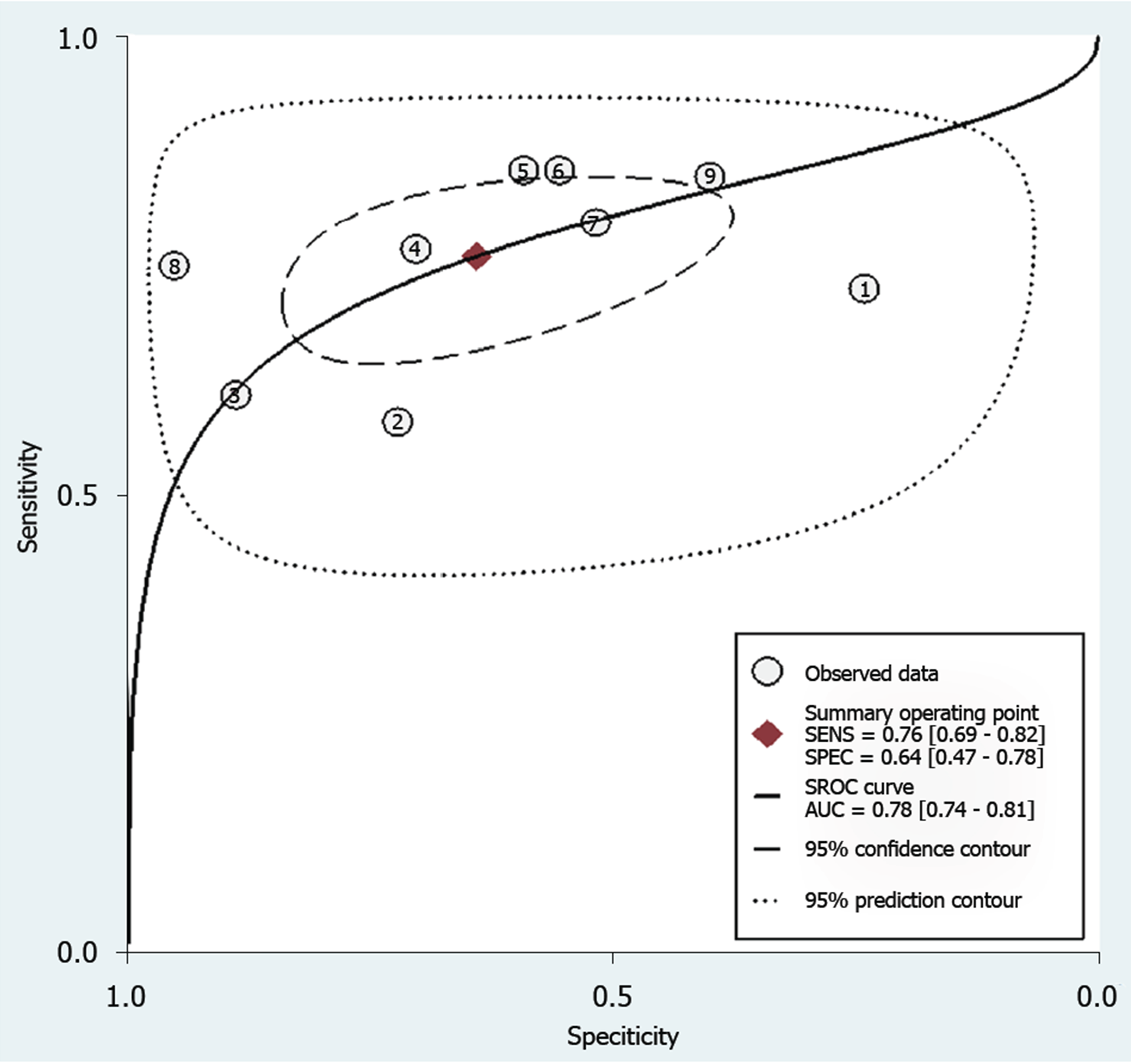
总共9项研究评估了循环miRNAs对乙肝患者早期肝纤维化的诊断效能. 如图3和表2所示, 合并的敏感度和特异度分别为76%和64%. 接下来, 我们绘制了受试者工作特征曲线, 如图4, AUROC为0.78, 说明循环miRNAs具有中等程度的准确性, 可以作为一种有前景的非侵入性的工具用于早期肝纤维化的识别.
| n | r | P值 | Se%[95%CI] | Sp%[95%CI] | PLR[95%CI] | NLR[95%CI] | DOR[95%CI] | AUROC | |
| 早期纤维化 | 9 | 0.410 | 0.273 | 0.76[0.69, 0.82] | 0.64[0.47, 0.78] | 2.1[1.4, 3.2] | 0.37[0.29, 0.49] | 6[3, 10] | 0.78 |
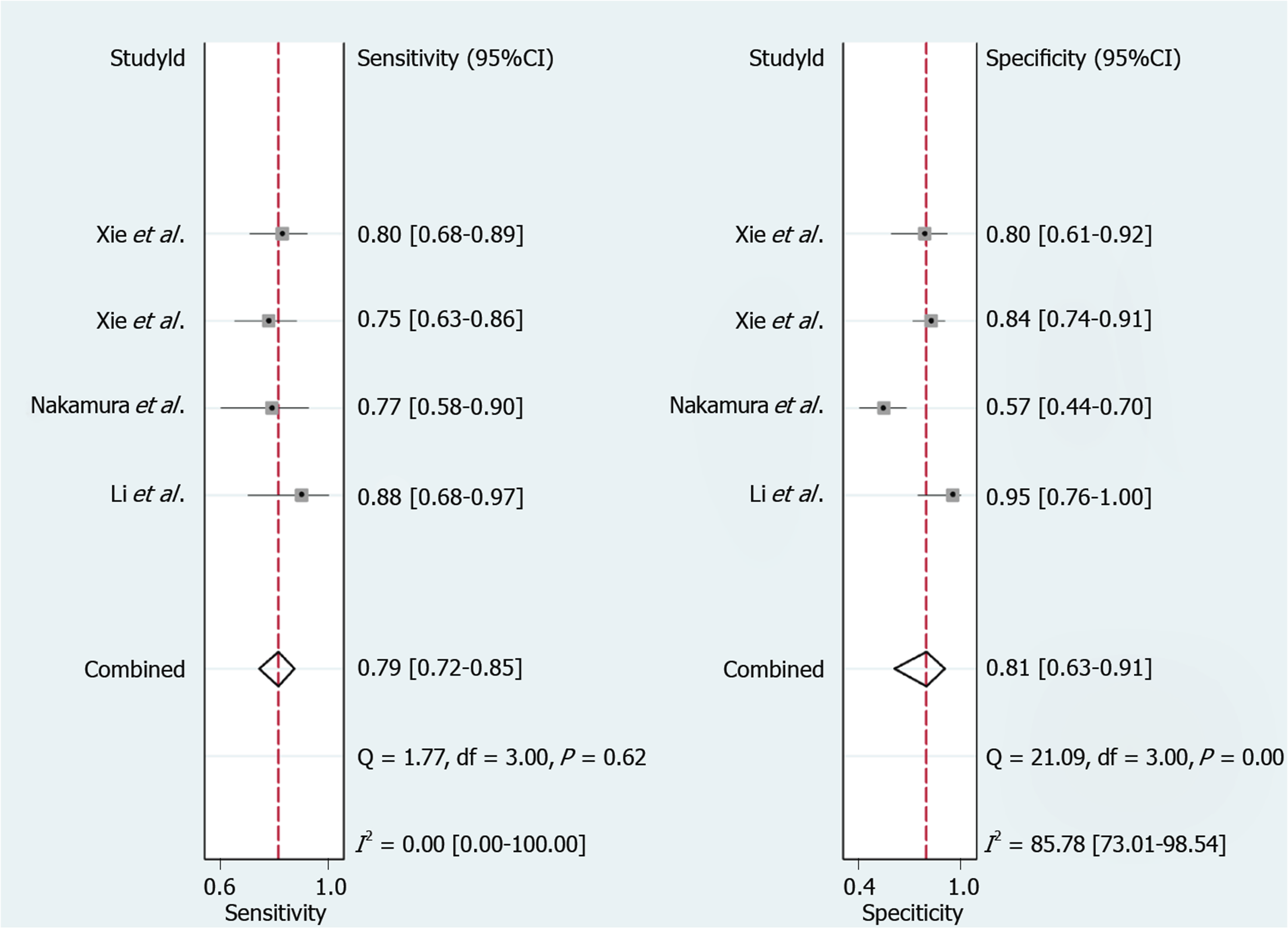
| 进展期纤维化 | 4 | -0.400 | 0.600 | 0.79[0.72, 0.85] | 0.81[0.63, 0.91] | 4.1[1.9, 8.6] | 0.26[0.18, 0.39] | 16[5, 46] | 0.82 |
| 亚组1 | 8 | 0.419 | 0.301 | 0.76[0.69, 0.83] | 0.59[0.44, 0.73] | 1.9[1.3, 2.6] | 0.40[0.30, 0.52] | 5[3, 8] | 0.76 |
| 亚组2 | 7 | 0.487 | 0.268 | 0.75[0.67, 0.82] | 0.62[0.45, 0.76] | 2.0[1.3, 2.9] | 0.40[0.30, 0.54] | 5[3, 9] | 0.76 |
| 亚组3 | 8 | 0.419 | 0.301 | 0.76[0.69, 0.83] | 0.59[0.44, 0.73] | 1.9[1.3, 2.6] | 0.40[0.30, 0.52] | 5[3, 8] | 0.76 |
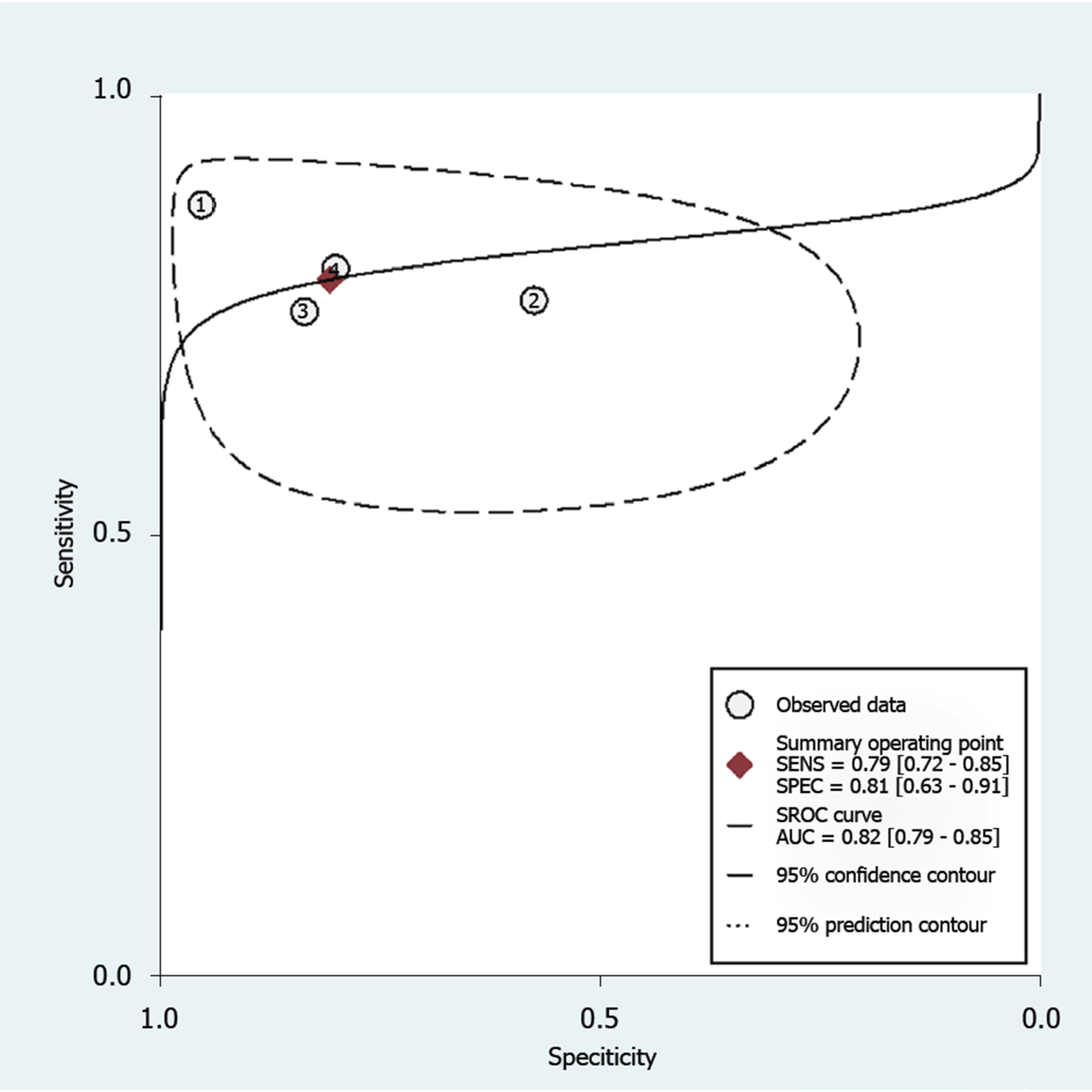
总共4项研究评估了循环miRNAs对CHB进展期肝纤维化的诊断效能. 如图5和表2, 合并的敏感度和特异度分别为79%和81%. SROC曲线如图6, 使用循环miRNAs诊断进展期肝纤维化的AUROC值高达0.82, 表明循环miRNAs对进展期肝纤维化具有良好的诊断性能.
2项研究评估了循环miRNAs对CHB患者LC的诊断价值. Chen等[8]构建了一个包含两个miRNAs (miR-106b and miR-181b)的诊断工具, 它对CHB相关的LC具有较高的诊断准确性, AUROC高达0.882. 在另一项研究中, 一个包含88个miRNAs的诊断模型被用来诊断LC, 在发现集中, 诊断准确性为100%, 在验证集中, 其诊断准确性仍高达93.7%[9]. 这些结果表明循环miRNAs, 尤其是联合miRNAs或miRNAs模型, 是诊断CHB相关性LC的有前景的标志物. 然而, 由于研究数量有限, 且均来自中国人群, 循环miRNAs对乙肝LC的诊断效能还需要更多大规模的、精心设计的、多国家、多中心的临床研究来进一步证实.
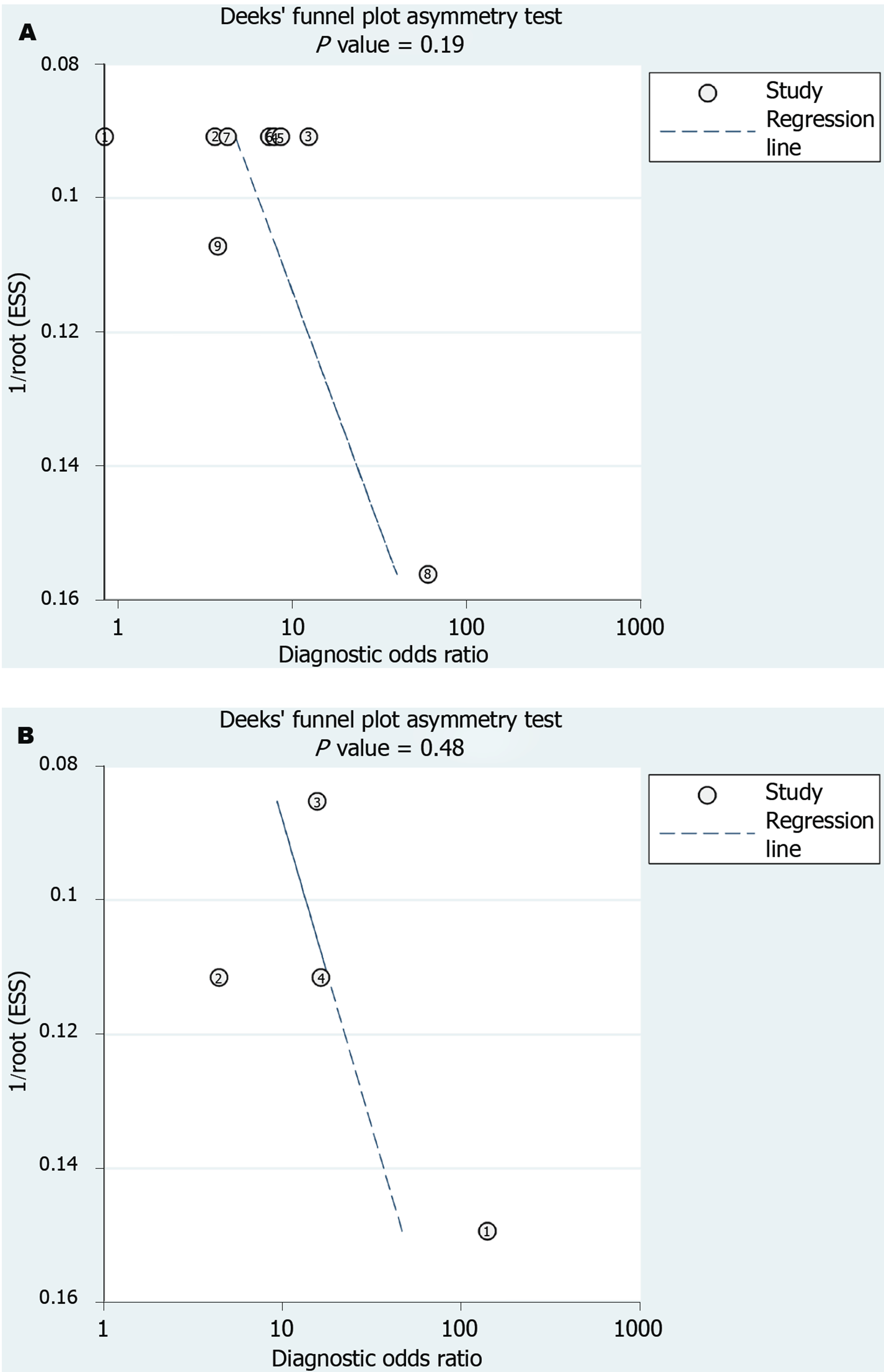
共15项研究被纳入, 异质性检验结果显示: I2>50%, 这表明纳入的研究间存在显著的异质性. 因此随机效应模型被选择用于数据的合并分析. 一般来说, 阈值效应是诊断性试验中最常见的异质性来源之一. 我们通过斯皮尔曼相关分析确定阈值效应. 如表2所示, P>0.05, 无统计学意义, 说明不存在阈值效应. 随后, 我们根据组织学评分系统、对照组的组成及样本量的大小进行了亚组分析, 如表2, 与总体研究结果相似, 三个亚组的结果显示循环miRNAs对CHB患者的早期肝纤维化均表现出良好的诊断性能, 而不受组织学评分系统、对照组的组成及样本量大小的影响. 漏斗图不对称线性回归检验显示漏斗图对称性, 表明不存在发表偏倚(P = 0.19和0.48; 图7A、7B). 考虑到纳入的研究数量有限, 本研究没有进行meta回归分析.
由于缺乏准确的诊断方法, CHB相关肝纤维化已成为导致全球肝功能衰竭甚至肝癌的主要原因之一. 肝脏活检一直被认为是肝纤维化诊断和分级的金标准. 然而, 肝活检的一系列缺陷如样本误差大, 出血风险高, 医疗负担重, 以及观察者间的不一致性等限制了其在临床实践中的广泛应用[16]. 此外, 由于无法避免的有创性, 重复的组织病理学检查是不切实际的. 因此, 越来越多的研究者致力于探索可靠的, 无创的手段以取代肝活检. 这些无创诊断方式包括基于血清学指标的评分模型, 以及基于肝脏硬度的影像学成像技术. 其中一些血清学评分模型如天冬氨酸转氨酶-血小板计数比值(aspartate aminotransferase to platelet ratio index, APRI)[17]及纤维化指数(fibrosis-four index,FIB-4)[18]是基于慢性丙型肝炎患者的数据构建的, 他们对于CHB患者肝纤维化诊断的适用性仍存在争议[19]. 另外一些模型, 包括增强的肝纤维化评分及Fibro Test, 则很难将肝纤维化患者与慢性肝炎患者进行准确区分. 过去十年间, 涌现了许多新兴的有前景的影像学技术, 包括瞬时弹性成像(transient electrograph, TE), 剪切波弹性成像(shear wave elastography, SWE), 声辐射脉冲弹性成像(acoustic radiation pulse imaging, ARFI), 以及磁共振弹性成像(magnetic resonance elastography, MRE)等. 既往研究表明这些影像学技术对肝纤维化诊断效能良好, 且优于实验室指标[20-23]. 因此, 已被广泛应用于肝纤维化的临床诊断. 然而, 他们价格不菲, 且诊断准确性易受到诸如肥胖、腹水、急性炎症、肝淤血、门脉高压等一系列因素的影响[24,25], 降低了诊断结果的可信度. 因此, 迫切需要一种无创、高效、可重复的工具用于肝纤维化的准确诊断和长期监测. 作为一种非侵袭性的生物标志物, 循环miRNAs在诊断肝纤维化方面具有巨大潜力[26]. 近年来, 越来越多的学者尝试探索循环miRNAs对CHB相关肝纤维化的诊断性能, 但结果不一. 因此, 我们进行了此项荟萃分析, 首次全面评估循环miRNAs对CHB相关肝纤维化的诊断价值.
此项荟萃分析纳入了来自6篇文献的15项研究, 共包括1623例CHB患者. 大部分研究来自我国人群, 而我国长期以来一直是一个乙型肝炎高发国家. 由于研究间存在异质性(I2>50%), 我们选择随机效应模型进行数据合并和分析. 其中9项研究评估了循环miRNAs对早期肝纤维化的诊断效能, 结果显示合并的敏感度、特异度及AUROC分别为0.76(95%CI: 0.69-0.82)、0.64(95%CI: 0.47-0.78)和0.78(95%CI: 0.74-0.81). 4项研究评价了循环miRNAs对进展期肝纤维化的诊断效能, 结果显示合并的敏感度、特异度及AUROC分别为0.79(95%CI: 0.72-0.85)、0.81(95%CI: 0.63-0.91)和0.82(95%CI: 0.79-0.85). 这些结果表明, 循环miRNAs可作为一种稳定、优良的分子生物标志物, 用于诊断CHB相关肝纤维化, 尤其是晚期纤维化. 仅有两项研究评估了循环miRNAs对LC的诊断效能, 结果表明, 循环miRNAs对CHB相关LC具有较高的诊断准确率, AUROC = 0.882, 准确率高达93.7%. 这些数据表明, 循环miRNAs, 尤其是联合miRNAs或miRNAs模型, 是诊断CHB相关LC的有前景的标志物. 上述研究结果也使得通过无创方法监测肝纤维化进展成为可能.
此项荟萃分析有几项优点. 首先, 这是首个全面评估循环miRNAs对CHB相关肝纤维化诊断效能的荟萃分析, 并解决了循环miRNAs是否可以作为CHB相关肝纤维化的潜在诊断标志物的争议. 其次, 研究设计是根据PRISMA声明(系统回顾和荟萃分析的规范报告条目)完成的[27]. 此外, 纳入的研究的是由两名研究者根据严格的纳入和排除标准独立进行选择的. 然而, 必须指出的是, 我们的研究仍存在一些局限性. 首先, 在本荟萃分析中, 纳入的研究之间存在显著的异质性. 尽管我们实施了各种探索异质性的统计分析方法, 遗憾的是, 仍未能确定异质性的潜在来源. 由于各研究间所检测的miRNAs不完全相同, 我们推测, 异质性可能来源于miRNAs类型的差别. 其次, 虽然进行了系统全面的文献检索, 但最终纳入荟萃分析的相关研究数量仍然不足. 他们仅来自两个国家, 中国和日本. 循环miRNAs在其他国家和地区诊断CHB相关肝纤维化的适用性仍未可知. 因此, 在循环miRNAs被作为CHB相关肝纤维化的诊断工具之前, 需要进行一系列大规模、前瞻性、多中心、多国家的临床研究以提供高质量的循证医学证据.
综上所述, 本荟萃分析证实了循环miRNAs可以作为CHB相关肝纤维化诊断的潜在生物标记物, 尤其对于晚期肝纤维化和LC. 未来需要更多的研究探索循环miRNAs的联合应用及基于miRNAs的诊断模型的构建, 使其在临床应用中更加准确和可行.
乙肝相关肝纤维化是导致肝功能衰竭及终末期肝病的主要病因, 其早期诊断对慢性肝病的预后至关重要. 传统诊断采用组织病理学检查, 因其有创性, 不可重复性, 难以普及, 且无法动态评估治疗效果. 因此, 临床上迫切需要一种灵敏、特异、可重复的无创检测指标. 近年来, 越来越多的学者尝试探索循环miRNAs对慢性乙肝(chronic hepatitis B, CHB)相关肝纤维化的诊断价值, 但结论不一, 循环miRNAs是否可作为CHB相关肝纤维化的潜在诊断标记物尚存争议.
通过对包含1623例CHB患者的15项研究进行荟萃分析, 全面评估循环miRNAs对 CHB相关肝纤维化的诊断价值, 旨在为CHB相关肝纤维化及其他病因所致肝纤维化的诊断提供有前景的、无创的、可重复的新手段.
通过分别评价循环miRNAs对CHB相关早期肝纤维化、进展期肝纤维化以及肝硬化(liver cirrhosis, LC)等三种不同程度肝纤维化的诊断价值, 为循环miRNAs在临床中用于CHB相关肝纤维化的诊断及分期提供客观依据.
本研究采用荟萃分析的方法, 严格依据纳入和排除标准对研究进行选择, 并根据QUADAS量表对研究的方法学进行评估, 以保证纳入研究的高质量. 全面评价了循环miRNAs对 CHB相关肝纤维化的诊断价值. 在此基础上, 为增加结论的稳定性, 可靠性, 我们进行了亚组分析寻找研究间异质性的潜在来源, 利用斯皮尔曼相关系数否定了阈值效应的存在, 使用Deeks漏斗图证实不存在发表偏倚.
本研究共纳入1623例CHB患者, 证实了循环miRNAs对CHB相关肝纤维化具有良好的诊断效能. 其中循环miRNAs诊断早期肝纤维化的敏感度、特异度及AUROC值分别为0.76、0.64和0.78; 诊断进展期肝纤维化的敏感度、特异度及AUROC值分别为0.79、0.81和0.82; 诊断LC的AUROC = 0.882, 诊断准确性高达93.7%.
本研究证实循环microRNAs对CHB相关肝纤维化具有良好的诊断效能, 尤其对于进展期肝纤维化及LC, 可作为CHB患者肝纤维化诊断的血清标记物.
循环microRNAs对CHB相关肝纤维化诊断效能优良, 有望作为肝纤维化的血清标记物被广泛应用于临床.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): E
编辑: 王禹乔 电编:刘继红
| 1. | Custer B, Sullivan SD, Hazlet TK, Iloeje U, Veenstra DL, Kowdley KV. Global epidemiology of hepatitis B virus. J Clin Gastroenterol. 2004;38:S158-S168. [PubMed] [DOI] |
| 2. | Manning DS, Afdhal NH. Diagnosis and quantitation of fibrosis. Gastroenterology. 2008;134:1670-1681. [PubMed] [DOI] |
| 3. | Bushati N, Cohen SM. microRNA functions. Annu Rev Cell Dev Biol. 2007;23:175-205. [PubMed] [DOI] |
| 4. | Miska EA. How microRNAs control cell division, differentiation and death. Curr Opin Genet Dev. 2005;15:563-568. [PubMed] [DOI] |
| 5. | Giordano S, Columbano A. MicroRNAs: new tools for diagnosis, prognosis, and therapy in hepatocellular carcinoma? Hepatology. 2013;57:840-847. [PubMed] [DOI] |
| 6. | Bao S, Zheng J, Li N, Huang C, Chen M, Cheng Q, Yu K, Chen S, Zhu M, Shi G. Serum MicroRNA Levels as a Noninvasive Diagnostic Biomarker for the Early Diagnosis of Hepatitis B Virus-Related Liver Fibrosis. Gut Liver. 2017;11:860-869. [PubMed] [DOI] |
| 7. | Li BB, Li DL, Chen C, Liu BH, Xia CY, Wu HJ, Wu CQ, Ji GQ, Liu S, Ni W, Yao DK, Zeng ZY, Chen DG, Qin BD, Xin X, Yan GL, Dan Tang, Liu HM, He J, Yan H, Zhu WJ, Yu HY, Zhu L. Potentials of the elevated circulating miR-185 level as a biomarker for early diagnosis of HBV-related liver fibrosis. Sci Rep. 2016;6:34157. [PubMed] [DOI] |
| 8. | Chen YJ, Zhu JM, Wu H, Fan J, Zhou J, Hu J, Yu Q, Liu TT, Yang L, Wu CL, Guo XL, Huang XW, Shen XZ. Circulating microRNAs as a Fingerprint for Liver Cirrhosis. PLoS One. 2013;8:e66577. [PubMed] [DOI] |
| 9. | Long XR, Zhang YJ, Zhang MY, Chen K, Zheng XFS, Wang HY. Identification of an 88-microRNA signature in whole blood for diagnosis of hepatocellular carcinoma and other chronic liver diseases. Aging (Albany NY). 2017;9:1565-1584. [PubMed] [DOI] |
| 10. | Xie Y, Yao Q, Butt AM, Guo J, Tian Z, Bao X, Li H, Meng Q, Lu J. Expression profiling of serum microRNA-101 in HBV-associated chronic hepatitis, liver cirrhosis, and hepatocellular carcinoma. Cancer Biol Ther. 2014;15:1248-1255. [PubMed] [DOI] |
| 11. | Nakamura M, Kanda T, Jiang X, Haga Y, Takahashi K, Wu S, Yasui S, Nakamoto S, Yokosuka O. Serum microRNA-122 and Wisteria floribunda agglutinin-positive Mac-2 binding protein are useful tools for liquid biopsy of the patients with hepatitis B virus and advanced liver fibrosis. PLoS One. 2017;12:e0177302. [PubMed] [DOI] |
| 12. | Jin BX, Zhang YH, Jin WJ, Sun XY, Qiao GF, Wei YY, Sun LB, Zhang WH, Li N. MicroRNA panels as disease biomarkers distinguishing hepatitis B virus infection caused hepatitis and liver cirrhosis. Sci Rep. 2015;5:15026. [PubMed] [DOI] |
| 13. | Hou T, Wang Z, Jin W, Liu C, Sun X, Li N, Zhang Y, Chen Y, Zhang W, Li Y. A Two-layer Model to Identify Hepatitis B Virus Related Chronic Hepatitis and Liver Cirrhosis Based on Plasma microRNA Biomarkers. Comb Chem High Throughput Screen. 2017;20:123-132. [PubMed] [DOI] |
| 14. | Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, Leeflang MM, Sterne JA, Bossuyt PM; QUADAS-2 Group. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011;155:529-536. [PubMed] [DOI] |
| 15. | Swets JA. Measuring the accuracy of diagnostic systems. Science. 1988;240:1285-1293. [PubMed] [DOI] |
| 16. | Venkatesh SK, Yin M, Ehman RL. Magnetic resonance elastography of liver: technique, analysis, and clinical applications. J Magn Reson Imaging. 2013;37:544-555. [PubMed] [DOI] |
| 17. | Wai CT, Greenson JK, Fontana RJ, Kalbfleisch JD, Marrero JA, Conjeevaram HS, Lok AS. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology. 2003;38:518-526. [PubMed] [DOI] |
| 18. | Sterling RK, Lissen E, Clumeck N, Sola R, Correa MC, Montaner J, S Sulkowski M, Torriani FJ, Dieterich DT, Thomas DL, Messinger D, Nelson M; APRICOT Clinical Investigators. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology. 2006;43:1317-1325. [PubMed] [DOI] |
| 19. | Kim WR, Berg T, Asselah T, Flisiak R, Fung S, Gordon SC, Janssen HL, Lampertico P, Lau D, Bornstein JD, Schall RE, Dinh P, Yee LJ, Martins EB, Lim SG, Loomba R, Petersen J, Buti M, Marcellin P. Evaluation of APRI and FIB-4 scoring systems for non-invasive assessment of hepatic fibrosis in chronic hepatitis B patients. J Hepatol. 2016;64:773-780. [PubMed] [DOI] |
| 20. | Xiao G, Zhu S, Xiao X, Yan L, Yang J, Wu G. Comparison of laboratory tests, ultrasound, or magnetic resonance elastography to detect fibrosis in patients with nonalcoholic fatty liver disease: A meta-analysis. Hepatology. 2017;66:1486-1501. [PubMed] [DOI] |
| 21. | Ragazzo TG, Paranagua-Vezozzo D, Lima FR, de Campos Mazo DF, Pessoa MG, Oliveira CP, Alves VAF, Carrilho FJ. Accuracy of transient elastography-FibroScan®, acoustic radiation force impulse (ARFI) imaging, the enhanced liver fibrosis (ELF) test, APRI, and the FIB-4 index compared with liver biopsy in patients with chronic hepatitis C. Clinics (Sao Paulo). 2017;72:516-525. [PubMed] [DOI] |
| 22. | Herrmann E, de Lédinghen V, Cassinotto C, Chu WC, Leung VY, Ferraioli G, Filice C, Castera L, Vilgrain V, Ronot M, Dumortier J, Guibal A, Pol S, Trebicka J, Jansen C, Strassburg C, Zheng R, Zheng J, Francque S, Vanwolleghem T, Vonghia L, Manesis EK, Zoumpoulis P, Sporea I, Thiele M, Krag A, Cohen-Bacrie C, Criton A, Gay J, Deffieux T, Friedrich-Rust M. Assessment of biopsy-proven liver fibrosis by two-dimensional shear wave elastography: An individual patient data-based meta-analysis. Hepatology. 2018;67:260-272. [PubMed] [DOI] |
| 23. | Pfeifer L, Zopf S, Siebler J, Schwitulla J, Wildner D, Wachter D, Neurath MF, Strobel D. Prospective Evaluation of Acoustic Radiation Force Impulse (ARFI) Elastography and High-Frequency B-Mode Ultrasound in Compensated Patients for the Diagnosis of Liver Fibrosis/Cirrhosis in Comparison to Mini-Laparoscopic Biopsy. Ultraschall Med. 2015;36:581-589. [PubMed] [DOI] |
| 24. | Tsochatzis EA, Gurusamy KS, Ntaoula S, Cholongitas E, Davidson BR, Burroughs AK. Elastography for the diagnosis of severity of fibrosis in chronic liver disease: a meta-analysis of diagnostic accuracy. J Hepatol. 2011;54:650-659. [PubMed] [DOI] |
| 25. | Yin M, Talwalkar JA, Glaser KJ, Venkatesh SK, Chen J, Manduca A, Ehman RL. Dynamic postprandial hepatic stiffness augmentation assessed with MR elastography in patients with chronic liver disease. AJR Am J Roentgenol. 2011;197:64-70. [PubMed] [DOI] |
| 26. | Chang CC, Lin CC, Hsieh WL, Lai HW, Tsai CH, Cheng YW. MicroRNA expression profiling in PBMCs: a potential diagnostic biomarker of chronic hepatitis C. Dis Markers. 2014;2014:367157. [PubMed] [DOI] |