修回日期: 2019-09-25
接受日期: 2019-10-25
在线出版日期: 2019-11-08
内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)可一次性完整切除整块病变, 目前已被广泛用于表浅食管癌的治疗, 但当切除黏膜范围超过3/4 wk时, 极易并发顽固性食管狭窄, 严重影响患者的生活质量.
评价创面局部单次注射曲安奈德预防大范围表浅食管癌ESD后狭窄的有效性及安全性.
回顾性分析2013-01/2017-12在浙江省肿瘤医院内镜中心行ESD治疗的49例大范围表浅食管癌患者的病例资料, 前期27例仅行ESD治疗, 设为对照组, 后期22例ESD术后创面局部注射曲安奈德预防狭窄, 设为治疗组. 两组均系统内镜随访, 并发食管狭窄时予以内镜下球囊扩张(endoscopic balloon dilation, EBD)治疗, 直至成功解除梗阻. 统计比较两组食管狭窄的发生率及所需的EBD次数.
治疗组食管狭窄发生率为22.7%(5/22), 明显低于对照组74.1%(20/27)(P = 0.001); 狭窄发生后所需EBD次数, 治疗组平均为4.4±2.1次(范围2-7次), 亦明显少于对照组, 平均8.7±4.2次(范围1-17次)(P = 0.037). 无局部注射相关的出血、穿孔、纵膈脓肿等严重并发症发生.
大范围食管ESD术后创面单次注射曲安奈德可以有效预防食管狭窄的发生, 并可显著减少EBD治疗次数.
核心提要: 本研究通过对49例行内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)治疗的切除黏膜范围超过3/4 wk的表浅食管癌患者的病例资料进行回顾性研究分析, 结果表明大范围食管ESD术后创面单次注射曲安奈德可以有效预防食管狭窄的发生, 并可显著减少狭窄发生后内镜下球囊扩张治疗次数.
引文著录: 阮荣蔚, 俞江平, 陶亚利, 刘永军, 朱舒文, 王实. 表浅食管癌内镜黏膜下剥离术后局部单次注射曲安奈德预防狭窄疗效观察. 世界华人消化杂志 2019; 27(21): 1313-1319
Revised: September 25, 2019
Accepted: October 25, 2019
Published online: November 8, 2019
Endoscopic submucosal dissection (ESD) enables en bloc resection and has now been widely used in the resection of superficial esophageal carcinomas. However, refractory postoperative stenosis develops frequently when the mucosal defect involves more than three-quarters of the circumference, which decreases the patient's quality of life seriously.
To evaluate the efficacy and safety of single local triamcinolone injection for the prevention of stenosis after ESD for superficial esophageal carcinoma.
The clinical data of 49 patients with superficial esophageal carcinomas treated by ESD at the Endoscopy Center of Zhejiang Cancer Hospital from January 2013 to December 2017 were retrospectively analyzed. Among them, 27 patients were only treated with ESD, which were used as a control group, and the other 22 patients who underwent triamcinolone acetonide injection into the residual submucosal layer of the resected region immediately after ESD for prevention of stenosis were used as a study group. Systematic endoscopic follow-ups were performed in both groups, and if esophageal stenoses were detected, repeated endoscopic balloon dilations (EBD) were performed until dysphagia symptoms were successfully relieved. The rate of esophageal stenosis and the frequency of EBD were compared between the two groups.
The rate of esophageal stenosis in the study group was 22.7% (5/22), which was significantly lower than that in the control group [74.1% (20/27), P = 0.001]. The mean number of EBD procedures was 4.4 ± 2.1 (range 2-7) in the study group, which was also significantly lower than that in the control group [8.7 ± 4.2 (range, 1-17), P = 0.037]. No bleeding, perforation, mediastinal abscess, or other serious complications occurred with local triamcinolone injection in our study.
Single local triamcinolone injection after esophageal ESD can effectively prevent the occurrence of esophageal stenosis and significantly reduce the number of EBD treatments.
- Citation: Ruan RW, Yu JP, Tao YL, Liu YJ, Zhu SW, Wang S. Efficacy of single local triamcinolone injection for prevention of stenosis after endoscopic submucosal dissection for superficial esophageal carcinoma. Shijie Huaren Xiaohua Zazhi 2019; 27(21): 1313-1319
- URL: https://www.wjgnet.com/1009-3079/full/v27/i21/1313.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i21.1313
内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)可以一次性完整切除大块病变, 同时为组织病理学提供完整的评估资料, 目前已成为表浅型食管癌标准治疗手段[1,2]. 但当ESD切除范围超过3/4 wk时, 极易并发食管狭窄[3,4], 需反复内镜下扩张治疗来解除梗阻, 严重影响患者的生活质量, 对于此类患者, 如何有效预防狭窄是改善预后的关键. 本研究通过对49例行ESD治疗的大范围表浅食管癌患者的病例资料进行回顾性分析, 探讨ESD术后创面局部单次注射曲安奈德对食管狭窄的预防作用.
本研究纳入2013-01/2017-12在浙江省肿瘤医院内镜中心行ESD治疗的大范围表浅食管癌患者49例, 所有病变通过胃镜检查发现, ESD前未行其它任何治疗. ESD术前充分告知患者及家属相关病情、治疗方案、ESD治疗相关并发症及预后等情况, 同时签署知情同意书. 纳入标准: (1)病理证实为鳞状细胞癌, 且浸润深度不超过黏膜下层上1/3(sm1); (2)ESD切除黏膜范围>3/4 wk; (3)无淋巴结及远处转移. 排除标准: (1)ESD切除黏膜范围≤3/4 wk; (2)术后病理提示浸润深度超过sm1; (3)存在淋巴结及远处转移; (4)术后病理提示切缘阳性者. 前期27例患者仅行ESD治疗, 设为对照组; 后期22例患者ESD术后创面局部单次注射曲安奈德预防狭窄, 设为治疗组.
主要器械及试剂: Olympus GIF-H260Z放大胃镜, GIF-Q260J电子胃镜, Dual刀(KD-650L), D-201-10704透明帽, NM-200U-0423注射针, FD-410LR 高频治疗钳, ERBE高频电切割器(200S), 威尔逊WF型软性喷洒管, 球囊扩张导管(Gudu Medical 15/16/18 mm×60 mm), 医用透明质酸钠凝胶, 亚甲蓝注射液, 肾上腺素, 复方碘溶液(浓度1.2%), 曲安奈德注射液(昆明积大制药有限公司, 规格: 1 mL:40 mg)等.
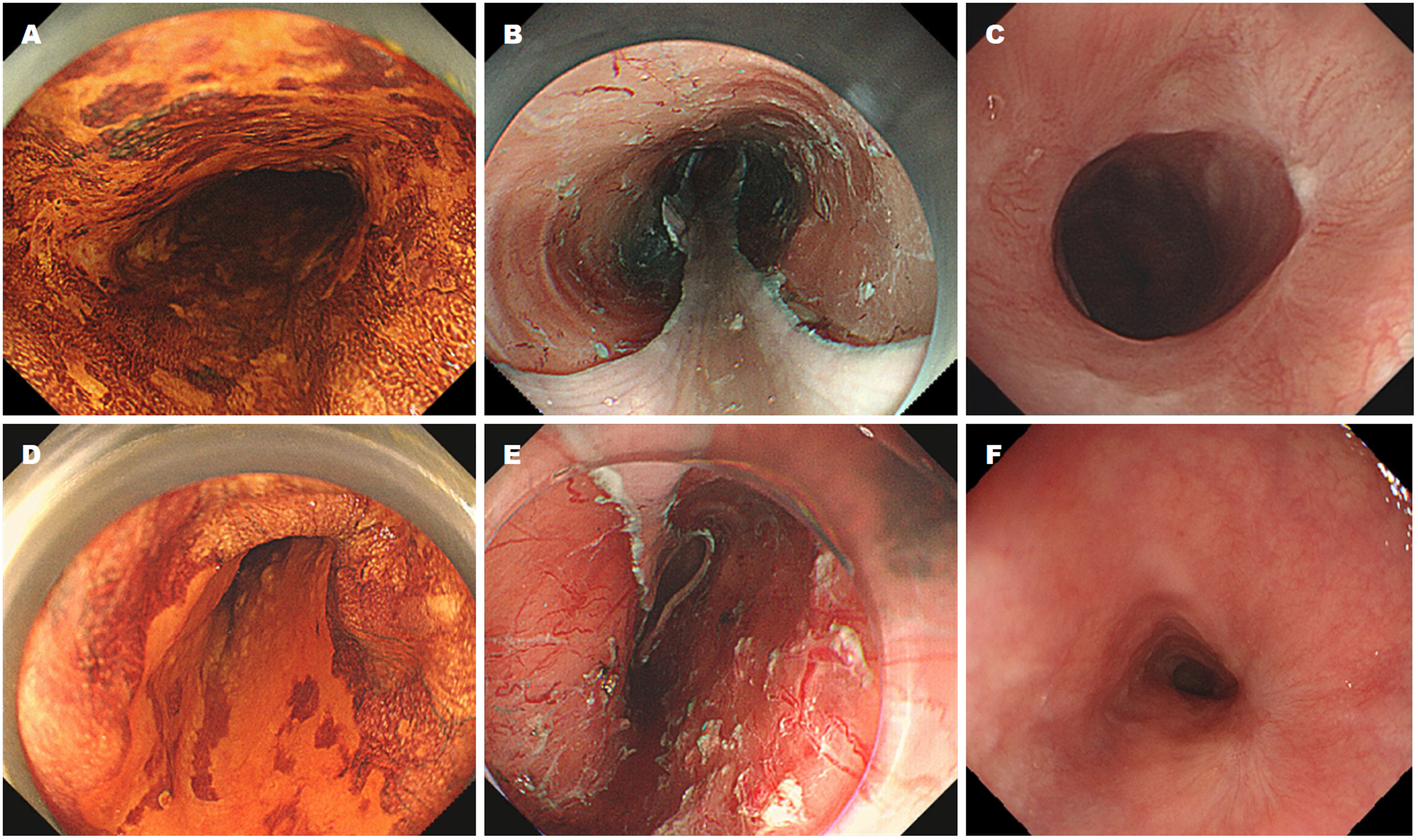
1.2.1 ESD治疗方法: ESD操作均在气管插管麻醉下进行. 治疗过程: (1)染色: 行卢戈氏液染色, 明确病变范围; (2)标记: 根据染色显示范围, 距离病变边缘外侧约2-5 mm处行环周标记; (3)黏膜下注射: 沿标记点外侧缘分多点注射透明质酸钠及亚甲蓝混合液, 使病变明显隆起; (4)黏膜切开及剥离: 沿标记点外侧行环周切开, 并沿固有肌层完整剥离病变.
1.2.2 激素注射方法: ESD术后将2瓶曲安奈德注射液按照1:3稀释成浓度为10 mg/mL的液体, 分多点均匀注射于创面边缘及残存黏膜下层, 每点注射0.2-0.4 mL, 总剂量控制在80 mg. 注射由肛侧向口侧进行, 避免损伤固有肌层, 对固有肌层直接暴露的部位不作注射.
1.2.3 随访及疗效评价: 术后1 mo、3 mo、6 mo、12 mo复查胃镜, 后每年随访1次, 对出现吞咽困难的患者, 即时行胃镜检查, 观察创面愈合及食管狭窄情况. 食管狭窄诊断标准: 进食固体食物受阻, 标准胃镜(镜身直径9.8 mm)无法通过. 吞咽困难分级采用Stooler分级法: 0级: 能进各种饮食; Ⅰ级: 能进软食; Ⅱ级: 能进半流质; Ⅲ级: 流质饮食; Ⅳ级: 进食流质困难. 狭窄处置: 对吞咽困难在Stooler Ⅱ级及以下、标准胃镜无法通过的患者采用内镜下球囊扩张(endoscopic balloon dilation, EBD)治疗, 起初1次/wk, 连续3次, 分别予以直径15 mm、16 mm及18 mm的球囊扩张, 后改用直径18 mm的球囊每2周扩张1次, 直至解除梗阻. 狭窄缓解标准: 吞咽困难恢复至Stooler Ⅱ级以上, 标准胃镜通过顺利, 连续6 mo无再狭窄发生. 疗效评价指标为两组食管狭窄发生率及所需的EBD次数.
统计学处理 使用SPSS 19.0软件包对数据进行统计学分析. 计量资料以mean±SD的形式表示, 根据资料的性质, 各组间数据比较采用t检验或者方差分析. 以P<0.05为差异具有统计学意义.
所有患者均一次性完整切除病变, 整块切除率为100%. 治疗组与对照组在平均年龄、性别、病变位置、肉眼分型、侵犯层次、固有肌层损伤、ESD切除范围、ESD剥离纵径、ESD治疗时间等方面比较, P值均大于0.05, 差异无统计学意义, 两组具有可比性(表1).
| 治疗组(n = 22) | 对照组(n = 27) | P值 | |
| 平均年龄(岁) | 66.0±6.7 | 66.1±8.5 | 0.957 |
| 性别(男/女) | 15/7 | 21/6 | 0.666 |
| 病变位置(上中段/下段) | 18/4 | 25/2 | 0.480 |
| 肉眼分型(I、IIa/IIb、IIa+IIc) | 4/18 | 7/20 | 0.763 |
| 侵犯层次(m1、m2/m3、sm1) | 12/10 | 16/11 | 0.967 |
| 固有肌层损伤(例) | 5 | 11 | 0.302 |
| ESD切除范围(非全周/全周) | 20/2 | 26/1 | 0.855 |
| ESD切除纵径(cm) | 5.2±1.2 | 5.7±1.7 | 0.211 |
| ESD治疗时间(min) | 93.6±35.5 | 113.3±53.5 | 0.145 |
| 总体并发症发生率 | 59.1%(13/22) | 66.7%(18/27) | 0.803 |
| 狭窄发生率 | 22.7%(5/22) | 74.1%(20/27) | 0.001b |
| EBD次数 | 4.4±2.1(2-7) | 8.7±4.2(1-17) | 0.037a |
所有患者按要求参加随访, 治疗组有5例发生食管狭窄, 包括2例全周型及3例非全周型病变, 狭窄发生率为22.7%(5/22), 对照组有20例发生食管狭窄, 包括1例全周型及19例非全型病变, 狭窄发生率为74.1%(20/27), 两者比较, 差异具有统计学意义(P = 0.001). 狭窄患者经EBD治疗后均成功解除梗阻, 其中治疗组5例患者行2-7次, 平均4.4±2.1次EBD治疗, 对照组20例患者行1-17次, 平均8.7±4.2次EBD治疗, 两组比较差异具有统计学意义(P = 0.037)(图1).
本研究ESD术中发生小穿孔1例, 纵膈气肿4例, 明显胸痛26例, 均经内科保守治疗后痊愈, 无迟发性出血、穿孔、纵膈脓肿等严重并发症发生. 其中治疗组并发纵膈气肿2例, 明显胸痛11例, 总体并发症发生率为59.1%(13/22); 对照组并发小穿孔1例, 纵膈气胸2例, 明显胸痛15例, 总体并发症发生率为66.7%(18/27), 两组比较, 差异无统计学意义(P = 0.803).
食管狭窄是大范围食管ESD术后最常见的并发症, 当切除黏膜范围超过3/4 wk时, 狭窄发生率可达83.3%-94.1%[3,4]. 目前, 临床上用于食管ESD术后狭窄治疗最常用的方法是EBD治疗, 通过EBD治疗可显著改善患者吞咽困难症状, 但因食管ESD术后引起的多为难治性狭窄, 需反复EBD处理, 患者经济负担重, 生活质量低下, 同时也增加了并发出血、穿孔的风险[5,6]. 对于反复EBD治疗无效的患者, 可尝试暂时性置入可回收食管支架来解除梗阻, 但存在支架移位、再狭窄、支架回收困难等风险[7,8]. 因此, 对于大范围食管ESD治疗患者, 如何有效预防术后狭窄成为关键.
糖皮质激素具有抑制炎性细胞的渗出, 阻止纤维母细胞及炎症细胞活化和迁移, 并可以降低脯氨酰羟化酶的活性, 增加胶原酶活性, 从而减少胶原沉积, 加速分解, 减少瘢痕的形成,被广泛用于大范围ESD术后食管狭窄的预防, 主要有口服及局部注射两种途径. 口服激素简单易行, 可显著减少大范围ESD术后食管狭窄发生率, 并减少狭窄发生后所需EBD治疗次数[9,10], 但存在免疫抑制、感染、骨质疏松、精神障碍、糖尿病病情恶化、消化道溃疡等系统性不良反应, 并可影响创面愈合, 推迟ESD术后需追加手术及同步放化疗的时间[11-13]. 相比口服激素, 局部注射可显著减少激素用量, 减轻全身性不良反应, 多项研究均表明, 食管大范围ESD术后创面局部注射激素可有效预防狭窄形成, 但注射方法不尽相同[11,12,14-17]. Hashimoto等[15]研究最早采用ESD术后第3 d、7 d、10 d创面局部多次注射曲安奈德来预防食管狭窄, 虽取得良好治疗效果, 但该法需反复内镜下操作, 过程较为繁琐, 同时也增加了并发出血、穿孔、纵膈脓肿等风险. 本研究对照组27例患者食管ESD术后未行狭窄预防, 治疗组22例患者ESD术后创面局部注射曲安奈德来预防狭窄, 随访发现治疗组仅5例发生食管狭窄, 狭窄发生率为22.7%, 而对照组有20例发生食管狭窄, 其狭窄发生率高达74.1%(P = 0.001); 狭窄后所需EBD次数, 治疗组平均为4.4±2.1次(范围2-7次), 而对照组平均为8.7±4.2次(范围1-17次)(P = 0.037), 取得良好治疗效果, 与相关文献报道基本一致[11,12,14,16-17]. 由此可见, 食管ESD术后创面单次激素注射即可达到预防狭窄的目的, 与多次注射相比, 单次注射更容易识别残存黏膜下层, 实现有效注射, 并可减少对固有肌层的损伤, 避免穿孔、纵膈脓肿等不良事件发生; 此外, 单次注射可避免重复内镜操作, 减轻患者痛苦, 缩短治疗周期, 并减少医疗费用.
单次激素注射对大范围食管ESD术后狭窄显示出了良好的预防作用, 但也存在一定的局限性, 有研究认为[17-19], 对于ESD术后全周黏膜缺损的患者, 即使创面局部注射激素也很难预防狭窄形成. 而Nagami等[11]研究则表明, 当食管ESD术后黏膜缺损超过5/6 wk时, 单一创面激素注射对狭窄预防作用有限. 本研究中2例全周黏膜缺损及1例黏膜缺损达11/12 wk的患者局部注射曲安奈德后仍未能阻止食管狭窄形成. 因此, 对于ESD术后全周或近全周黏膜缺损的患者, 应采取更有效的措施来预防食管狭窄的形成. 有研究表明[20,21], 局部激素注射联合聚羟基乙酸膜覆盖创面可能对预防此类狭窄有效. Ye等[22]研究显示, 暂时性置入全覆膜金属可回收支架可有效预防全周型食管ESD术后狭窄的形成, 但容易并发支架移位. Kato等[23]报道了2例全周食管ESD术后创面单次注射曲安奈德联合激素灌注来预防狭窄, 取得良好效果, 但有待于更大样本量的研究观察. 近来, 我们采用创面局部注射曲安奈德联合小剂量口服泼尼松(每周剂量依次为30 mg/d、20 mg/d、10 mg/d、5 mg/d, 连用4 wk)的方法来预防全周ESD术后食管狭窄, 共治疗6例患者, 虽均并发狭窄, 但经2-4次不等的EBD治疗后成功解除梗阻, 疗效显著, 但现有样本量偏少, 确切疗效有待于今后大样本的研究论证.
食管ESD术后创面局部注射激素的主要并发症为出血、穿孔及纵膈脓肿, 与注射不当引起固有肌层损伤等因素有关[12,24], 因此对操作者的技术要求比较高. 本研究治疗组22例患者无一例发生激素注射相关并发症, 一方面与术者ESD操作娴熟有关; 另一方面, 在ESD治疗时, 在确保病变完整剥离的同时, 我们会尽可能多的保留黏膜下层组织, 既可减少对固有肌层的损伤, 又为ESD术后创面局部注射激素创造了条件.
总体而言, 大范围食管ESD术后创面单次注射曲安奈德可以有效预防食管狭窄的发生, 并可显著减少EBD治疗次数. 但因本研究属于单中心回顾性非随机对照研究, 且病例数相对偏少, 可能会对结果产生一定的影响, 有待于今后进行前瞻性、大样本、多中心的随机对照研究来进一步论证本研究的结论.
随着消化内镜诊治技术的发展, 内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)已成为表浅食管癌标准治疗方法, 但因食管管腔结构相对狭小, 当ESD切除黏膜范围超过3/4 wk时, 容易并发顽固性食管狭窄, 虽可通过内镜下球囊扩张(endoscopic balloon dilation, EBD)、可回收支架放置、口服激素等手段来治疗及预防狭窄, 但存在过程反复、支架及口服激素相关副作用, 严重影响患者生活质量, 也限制了ESD技术在大范围表浅食管癌中的应用. 本研究通过对49例大范围表浅食管癌患者的病例资料进行回顾性分析, 探讨ESD术后创面局部注射曲安奈德对食管狭窄的预防作用.
本研究的目的在于观察ESD术后创面单次注射曲安奈德对大范围表浅食管癌ESD术后狭窄的预防作用, 为大范围食管ESD术后狭窄预防积累相关临床经验.
通过对大范围食管ESD术后创面局部注射曲安奈德, 以达到预防术后食管狭窄的目的. 本研究表明ESD术后创面局部注射曲安奈德可有效预防食管狭窄的形成, 并可减少EBD治疗次数, 为大范围食管ESD术后狭窄预防提供了一种更为简单有效的方法.
本研究采用回顾性分析的方法, 设置治疗组及对照组, 并严格按照纳入标准及排除标准收集病例资料及数据, 采用SPSS 19.0软件包对数据进行统计学分析, 根据资料的性质, 各组间数据比较采用t检验或者方差分析. 以P<0.05为差异具有统计学意义.
本研究达到预期目标, 治疗组中有2例全周型及3例非全周型病变术后并发狭窄, 狭窄发生率为22.7%(5/22), 对照组中有1例全周型及19例非全型病变术后发生狭窄, 狭窄发生率为74.1%(20/27), 两者比较, P = 0.001, 具有统计学差异. 狭窄发生后, 治疗组5例患者行2-7次, 平均4.4±2.1次EBD治疗后解除梗阻, 对照组20例患者行1-17次, 平均8.7±4.2次EBD治疗后解除梗阻, 两组比较P = 0.037, 差异有统计学意义.
研究表明对于大范围食管ESD术后创面单次注射曲安奈德可以有效预防食管狭窄的形成, 并可显著减少狭窄发生后所需的EBD治疗次数, 对今后临床上ESD术后食管狭窄的预防具有参考价值. 但对于全周型及接近全周型的病变, ESD术后创面单次注射曲安奈德预防狭窄作用有限, 有待于我们进一步研究更为有效的方法来预防术后狭窄.
本研究属于单中心回顾性非随机对照研究,病例数偏少, 可能会使结果产生偏倚, 有待于进行前瞻性、大样本、多中心的随机对照研究来进一步论证本研究结论的准确性.对于大范围食管ESD术后狭窄的预防, 特别是全周型狭窄的预防, 今后可采用创面局部注射曲安奈德联合口服激素的方法, 以期待取得更为有效的作用.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Nakagawa K, Koike T, Iijima K, Shinkai H, Hatta W, Endo H, Ara N, Uno K, Asano N, Imatani A, Shimosegawa T. Comparison of the long-term outcomes of endoscopic resection for superficial squamous cell carcinoma and adenocarcinoma of the esophagus in Japan. Am J Gastroenterol. 2014;109:348-356. [PubMed] [DOI] |
| 2. | Kuwano H, Nishimura Y, Oyama T, Kato H, Kitagawa Y, Kusano M, Shimada H, Takiuchi H, Toh Y, Doki Y, Naomoto Y, Matsubara H, Miyazaki T, Muto M, Yanagisawa A. Guidelines for Diagnosis and Treatment of Carcinoma of the Esophagus April 2012 edited by the Japan Esophageal Society. Esophagus. 2015;12:1-30. [PubMed] [DOI] |
| 3. | Ono S, Fujishiro M, Niimi K, Goto O, Kodashima S, Yamamichi N, Omata M. Predictors of postoperative stricture after esophageal endoscopic submucosal dissection for superficial squamous cell neoplasms. Endoscopy. 2009;41:661-665. [PubMed] [DOI] |
| 4. | Shi Q, Ju H, Yao LQ, Zhou PH, Xu MD, Chen T, Zhou JM, Chen TY, Zhong YS. Risk factors for postoperative stricture after endoscopic submucosal dissection for superficial esophageal carcinoma. Endoscopy. 2014;46:640-644. [PubMed] [DOI] |
| 5. | Takahashi H, Arimura Y, Okahara S, Uchida S, Ishigaki S, Tsukagoshi H, Shinomura Y, Hosokawa M. Risk of perforation during dilation for esophageal strictures after endoscopic resection in patients with early squamous cell carcinoma. Endoscopy. 2011;43:184-189. [PubMed] [DOI] |
| 6. | Kishida Y, Kakushima N, Kawata N, Tanaka M, Takizawa K, Imai K, Hotta K, Matsubayashi H, Ono H. Complications of endoscopic dilation for esophageal stenosis after endoscopic submucosal dissection of superficial esophageal cancer. Surg Endosc. 2015;29:2953-2959. [PubMed] [DOI] |
| 7. | Gangloff A, Lecleire S, Di Fiore A, Huet E, Iwanicki-Caron I, Antonietti M, Michel P. Fully versus partially covered self-expandable metal stents in benign esophageal strictures. Dis Esophagus. 2015;28:678-683. [PubMed] [DOI] |
| 8. | Liu J, Hu Y, Cui C, Li Y, Lin X, Fu J. Removable, fully covered, self-expandable metal stents for the treatment of refractory benign esophagogastric anastomotic strictures. Dysphagia. 2012;27:260-264. [PubMed] [DOI] |
| 9. | Yamaguchi N, Isomoto H, Nakayama T, Hayashi T, Nishiyama H, Ohnita K, Takeshima F, Shikuwa S, Kohno S, Nakao K. Usefulness of oral prednisolone in the treatment of esophageal stricture after endoscopic submucosal dissection for superficial esophageal squamous cell carcinoma. Gastrointest Endosc. 2011;73:1115-1121. [PubMed] [DOI] |
| 10. | Sato H, Inoue H, Kobayashi Y, Maselli R, Santi EG, Hayee B, Igarashi K, Yoshida A, Ikeda H, Onimaru M, Aoyagi Y, Kudo SE. Control of severe strictures after circumferential endoscopic submucosal dissection for esophageal carcinoma: oral steroid therapy with balloon dilation or balloon dilation alone. Gastrointest Endosc. 2013;78:250-257. [PubMed] [DOI] |
| 11. | Nagami Y, Ominami M, Shiba M, Sakai T, Fukunaga S, Sugimori S, Otani K, Hosomi S, Tanaka F, Taira K, Kamata N, Yamagami H, Tanigawa T, Watanabe T, Ishihara T, Yamamoto K, Fujiwara Y. Prediction of esophageal stricture in patients given locoregional triamcinolone injections immediately after endoscopic submucosal dissection. Dig Endosc. 2018;30:198-205. [PubMed] [DOI] |
| 12. | Nagami Y, Shiba M, Ominami M, Sakai T, Minamino H, Fukunaga S, Sugimori S, Tanaka F, Kamata N, Tanigawa T, Yamagami H, Watanabe T, Tominaga K, Fujiwara Y, Arakawa T. Single Locoregional Triamcinolone Injection Immediately After Esophageal Endoscopic Submucosal Dissection Prevents Stricture Formation. Clin Transl Gastroenterol. 2017;8:e75. [PubMed] [DOI] |
| 13. | Mizutani T, Tanaka M, Eba J, Mizusawa J, Fukuda H, Hanaoka N, Takeuchi M, Aoyama I, Kojima T, Takizawa K, Ono H, Muto M; Gastrointestinal Endoscopy Study Group of the Japan Clinical Oncology Group (JCOG). A Phase III study of oral steroid administration versus local steroid injection therapy for the prevention of esophageal stricture after endoscopic submucosal dissection (JCOG1217, Steroid EESD P3). Jpn J Clin Oncol. 2015;45:1087-1090. [PubMed] [DOI] |
| 14. | Hanaoka N, Ishihara R, Takeuchi Y, Uedo N, Higashino K, Ohta T, Kanzaki H, Hanafusa M, Nagai K, Matsui F, Iishi H, Tatsuta M, Ito Y. Intralesional steroid injection to prevent stricture after endoscopic submucosal dissection for esophageal cancer: a controlled prospective study. Endoscopy. 2012;44:1007-1011. [PubMed] [DOI] |
| 15. | Hashimoto S, Kobayashi M, Takeuchi M, Sato Y, Narisawa R, Aoyagi Y. The efficacy of endoscopic triamcinolone injection for the prevention of esophageal stricture after endoscopic submucosal dissection. Gastrointest Endosc. 2011;74:1389-1393. [PubMed] [DOI] |
| 16. | Nagami Y, Shiba M, Tominaga K, Minamino H, Ominami M, Fukunaga S, Sugimori S, Tanigawa T, Yamagami H, Watanabe K, Watanabe T, Fujiwara Y, Arakawa T. Locoregional steroid injection prevents stricture formation after endoscopic submucosal dissection for esophageal cancer: a propensity score matching analysis. Surg Endosc. 2016;30:1441-1449. [PubMed] [DOI] |
| 17. | Takahashi H, Arimura Y, Okahara S, Kodaira J, Hokari K, Tsukagoshi H, Shinomura Y, Hosokawa M. A randomized controlled trial of endoscopic steroid injection for prophylaxis of esophageal stenoses after extensive endoscopic submucosal dissection. BMC Gastroenterol. 2015;15:1. [PubMed] [DOI] |
| 18. | Hanaoka N, Ishihara R, Uedo N, Takeuchi Y, Higashino K, Akasaka T, Kanesaka T, Matsuura N, Yamasaki Y, Hamada K, Iishi H. Refractory strictures despite steroid injection after esophageal endoscopic resection. Endosc Int Open. 2016;4:E354-E359. [PubMed] [DOI] |
| 19. | Miwata T, Oka S, Tanaka S, Kagemoto K, Sanomura Y, Urabe Y, Hiyama T, Chayama K. Risk factors for esophageal stenosis after entire circumferential endoscopic submucosal dissection for superficial esophageal squamous cell carcinoma. Surg Endosc. 2016;30:4049-4056. [PubMed] [DOI] |
| 20. | Nagami Y, Shiba M, Tominaga K, Ominami M, Fukunaga S, Sugimori S, Tanaka F, Kamata N, Tanigawa T, Yamagami H, Watanabe T, Fujiwara Y, Arakawa T. Hybrid therapy with locoregional steroid injection and polyglycolic acid sheets to prevent stricture after esophageal endoscopic submucosal dissection. Endosc Int Open. 2016;4:E1017-E1022. [PubMed] [DOI] |
| 21. | Sakaguchi Y, Tsuji Y, Fujishiro M, Kataoka Y, Takeuchi C, Yakabi S, Saito I, Shichijo S, Minatsuki C, Asada-Hirayama I, Yamaguchi D, Niimi K, Ono S, Kodashima S, Yamamichi N, Koike K. Triamcinolone Injection and Shielding with Polyglycolic Acid Sheets and Fibrin Glue for Postoperative Stricture Prevention after Esophageal Endoscopic Resection: A Pilot Study. Am J Gastroenterol. 2016;111:581-583. [PubMed] [DOI] |
| 22. | Ye LP, Zheng HH, Mao XL, Zhang Y, Zhou XB, Zhu LH. Complete circular endoscopic resection using submucosal tunnel technique combined with esophageal stent placement for circumferential superficial esophageal lesions. Surg Endosc. 2016;30:1078-1085. [PubMed] [DOI] |
| 23. | Kato R, Yamasaki Y, Tanaka S. Triamcinolone injection and filling method to prevent stricture after esophageal endoscopic submucosal dissection. Dig Endosc. 2018;30:795-796. [PubMed] [DOI] |
| 24. | Chu Y, Chen T, Li H, Zhou P, Zhang Y, Chen W, Zhong Y, Yao L, Xu M. Long-term efficacy and safety of intralesional steroid injection plus oral steroid administration in preventing stricture after endoscopic submucosal dissection for esophageal epithelial neoplasms. Surg Endosc. 2019;33:1244-1251. [PubMed] [DOI] |