修回日期: 2019-09-19
接受日期: 2019-09-24
在线出版日期: 2019-10-28
急性胰腺炎(acute pancreatitis, AP)是急性腹痛的主要原因. 虽然AP的病理生理学尚不完全清楚. 目前人们普遍认为, 酶原颗粒(zymogen granules, ZGs)中的酶原激活在AP的进展中起着重要作用. 在AP动物模型中, 血清ZGs的糖蛋白2(glycoprotein 2, GP2)水平的上调可作为AP的一个潜在的生物标识物.
研究血清GP2是否能够作为AP严重程度的早期生物标识物.
在一项前瞻性单中心队列研究中, 纳入9例健康受试者和发病24 h内的59例AP患者, 收集血浆样本和临床病例基线资料. 采用酶联免疫吸附实验法检测血清GP2水平, 并将血清GP2水平与AP的严重程度进行关联分析.
59例AP患者中包含30例轻度AP, 16例中度AP, 13例重度AP. 血清GP2水平在AP患者中显著升高, 且与AP严重程度呈现正相关关系. 用2.3 ng/mL作为截止点, GP2区分中度AP的灵敏度和特异性分别为96.6%和90.0%, 阳性和阴性预测值分别为90.3%和96.4%. 用5.1 ng/mL作为截止点, 重度AP的灵敏度, 特异性, 阳性及阴性预测值均为100%. 且血清GP2在对AP预后方面较急性胰腺炎严重程度床边指数评分、红细胞压积、入院时或持续性全身炎症综合征评分和C反应蛋白优越.
AP的血清GP2的浓度升高, 且血清GP2与胰腺炎的严重程度呈正相关, 提示其具有预测AP严重程度的潜力.
核心提要: GP2在AP患者血清中明显升高, 且与AP的严重程度呈正相关. 血清GP2的敏感性、特异性或预后准确性高于其他常用指标, 包括C反应蛋白、全身炎症综合征评分、红细胞压积和急性胰腺炎严重程度床边指数评分.
引文著录: 马柏强, 王理富, 吴文元, 邢永俊. 血清糖蛋白2作为预测急性胰腺炎严重程度标识物的研究. 世界华人消化杂志 2019; 27(20): 1271-1277
Revised: September 19, 2019
Accepted: September 24, 2019
Published online: October 28, 2019
Acute pancreatitis (AP) is a main cause of acute abdominal pain. Although the pathophysiology of AP is not fully understood, it is now widely acknowledged that the activation of enzymes in zymogen granules (ZGs) plays an important role in the progression of AP. In AP animal models, the up-regulation of serum ZG glycoprotein 2 (GP2) can be used as a potential biological marker for AP.
To investigate whether serum GP2 can be used as an early biomarker of AP severity.
In a prospective single-center cohort study, plasma samples and baseline clinical data were collected from 9 healthy subjects and 59 patients with AP within 24 h of onset. Serum GP2 levels were detected by enzyme-linked immunosorbent assay, and their correlation with the severity of AP was analyzed.
Of the 59 AP patients, 30 had mild AP, 16 had moderate AP, and 13 had severe AP. Serum GP2 levels were significantly increased in AP patients and positively correlated with AP severity. Using 2.3 ng/mL as the cut-off point, the sensitivity and specificity of serum GP2 to distinguish moderate AP were 96.6% and 90.0%, respectively, and the positive and negative predictive values were 90.3% and 96.4%, respectively. Using 5.1 ng/mL as the cut-off point, the sensitivity, specificity, positive predictive value, and negative predictive value to distinguish severe AP were all 100%. Serum GP2 was found to be a better prognostic marker than bedside index for severity in acute pancreatitis score, hematocrit, admission or persistent systemic inflammatory response score, and C-reactive protein.
Serum GP2 increases in AP patients, and it positively correlates with the severity of AP, suggesting its potential to predict the severity of AP.
- Citation: Ma BQ, Wang LF, Wu WY, Xing YJ. Serum glycoprotein 2 as a biomarker of severity of acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2019; 27(20): 1271-1277
- URL: https://www.wjgnet.com/1009-3079/full/v27/i20/1271.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i20.1271
急性胰腺炎(acute pancreatitis, AP)是胰腺的突发炎症导致胰腺自身消化的过程, 通常涉及胰周组织及周围器官, 是胃肠道疾病导致入院的最常见原因之一[1,2]. 该疾病的严重程度变化很大, 包括轻度胰腺炎、局限性胰腺炎到可能导致多器官衰竭和死亡的重症胰腺炎[3,4].
AP的严重程度早期预测成为AP治疗中的一个关键问题[5]. 当预测准确时, 可以对患者进行适当的患者分级, 对患者预后具有重要理意义[6]. 当患有严重AP风险时, 可通过血液动力学支持及密切监测, 对识别胰腺炎及可能需要的特定治疗方法进行评估[7]. 但目前准确地识别疾病早期AP的方法仍在探究之中. 目前, 对于AP严重程度的预测主要是基于多因素的得分, 包括Ranson、APACHE-Ⅱ、全身炎症综合征(systemic inflammatory response syndrome, SIRS)评分急性胰腺炎床旁严重指数(bedside index of severity in acute pancreatits, BISAP)等[8-10]. 然而, 其中的一些预测方式的计算复杂(APACHE-II, Ranson), 更重要的是, 这些评分系统对死亡率或持续器官衰竭(>48 h)的敏感性有限[11]. 此外, 一些报告表明, 这些评分系统并不优于易于确定的生物标志物, 如血尿素氮, C反应蛋白(C-reactive protein, CRP), 血细胞压积(hematocrit, HCT)或肌酐(creatinine, Cr)[12-14]. 因此, 需要一种新的血液生物标志物来对AP的严重程度作出较准确的预测, 以对AP的早期管理提供指导.
有研究[15]表明, 酶原颗粒的糖蛋白(glycoprotein 2, GP2)在AP动物模型的血清中有较明显的差异性, 可作为动物AP模型中的生物标识物. 而在患者的血清中, AP患者的GP2水平较对照组有明显的升高[16]. 在发病1 d以上的患者血清中, GP2的水平与AP的血清学检测有一定的联系[14]. 而GP2水平的上升也可以在慢性胰腺炎及胰腺癌患者血清中观察到[17], 因此, GP2作为AP严重程度的生物标志物尚待进一步研究.
本研究拟利用酶联免疫吸附实验(enzyme-linked immunosorbent assay, ELISA)对患者血清GP2进行检测, 且对AP患者的严重程度及预后进行分析, 以此来确定GP2在预测AP严重程度中的意义.
1.1.1 病例纳入: 纳入发病24 h内急性胰腺炎患者(>18岁)进行前瞻性研究. 根据亚特兰大分型对急性胰腺炎患者进行严重程度分类. 患者需符合以下三个条件中的任何两种及以上: (1)持续性腹痛; (2)血清淀粉酶活性是正常值的3倍以上; (3)CT增强扫描、MRI扫描或超声扫描明确AP. 排除标准: 复发性胰腺炎; 慢性胰腺炎; 胰腺肿大性胰腺炎; 孕期患者; 从发病至入院超过24 h. 研究已经过伦理委员会批准, 患者已签署知情同意.
1.1.2 收集患者一般资料: 收集患者入院及住院期间血清学检测资料. SIRS依据患者症状及血清学检测明确. 患者的结局变量依据亚特兰大分型进行分类.
1.2.1 血清GP2 ELISA检测: 抽取患者5 mL肘静脉血, 常规分离血清, 采用人酶原颗粒GP2 ELISA检测试剂盒( LMAI Bio, 中国)检测血清GP2. 抗GP2单抗包被于酶标板上, 标准品与样品中GP2单抗结合, 加入生物素化GP2抗体, 形成免疫复合物, 辣根过氧化物酶与生物素结合, 加入酶底物TMB, 出现蓝色, 在450 nm处测OD值, 制作标准曲线. 待标准曲线作出后, 将血清样品100 μL加入孔中, 37 ℃静置120 min, 洗板4-6次, 每孔中加入第一抗体工作液50 μL, 混匀后静置60 min, 洗板后每孔加酶标工作液100 μL, 反37 ℃静置60 min, 洗板后加入底物反液压液100 μL, 暗处静置5 min, 最后加入50 μL终止液混匀, 在450 nm处测吸光值, 根据标准曲线计算血清GP2浓度.
统计学处理 连续性变量采用中位数(M)及四分位间距(IQR)来表示, 比较患者的基线水平特征. 连续型变量采用方差分析, 非参数变量Mann-Whitney U检验和χ2检测分类变量. 二元多变量逻辑回归评估GP2水平与急性胰腺炎严重程度关系. 采用Cochran-Mantel-Haenszel检验来揭示GP2及其它指标水平与患者血清学结局指标的影响. 所有数据均经SPSS 17.0版统计软件. P<0.05被认为有统计学意义.
根据修订后的亚特兰大分类, 59名患者和9名健康受试者进入该研究, 30例患者有轻度AP, 16例患有中度AP, 13例患有重度AP. 患者的基础临床特征以及根据严重程度的分类结果(表1)表明, 胆结石是主要的病因, 其次是酒精滥用和内镜逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP). 8例严重AP患者死亡(其中5例感染胰腺坏死). 患者年龄, 性别或身体质量指数(body mass index, BMI)>30 kg/m2均无显着差异.
| 病理特征 | 总数(n = 59) | 轻度(n = 30) | 中等(n = 16) | 重度(n = 13) | P值 |
| 年龄(岁) | 64.0 (52.5-77.0) | 62.5(49.5-72.3) | 66.5(53.5-77.8) | 77.0(42.0-81.5) | 0.571 |
| 性别(男/女) | 26/33 | 11/19 | 7/9 | 8/5 | 0.324 |
| 病因 | 0.065 | ||||
| 胆源性 | 24 (40.7%) | 13 (43.3%) | 7 (43.8%) | 4 (30.8%) | |
| 酒精性 | 8 (13.6%) | 1 (3.3%) | 4 (25.0%) | 3 (23.1%) | |
| ERCP术后 | 7 (11.9%) | 3 (10.0%) | 2 (12.5%) | 2 (15.4%) | |
| BMI>30 kg/m2 | 14 (23.7%) | 7 (23.3%) | 3 (18.8%) | 4 (30.8%) | 0.749 |
| BISAP评分 | 1 (1-2) | 1 (0-2) | 2 (1-3) | 2 (1-3) | 0.005 |
| Charlson指数 | 0 | 0 | 1 (0-2) | 1 (0-2) | 0.035 |
| CRP(mg/dL) | 10.9 (3.0-24.2) | 4.3(1.8-12.7) | 19.8 (9.6-28.4) | 30.4(23.2-39.3) | <0.001 |
| SIRS发生率 | 29 (49.2%) | 9 (30%) | 11 (68.8%) | 9 (75%) | 0.007 |
| SIRS>48 h | 14 (23.7%) | 0 | 3 (18.8%) | 11 (84.6%) | <0.001 |
| 胰腺坏死 | 9 (15.3%) | 0 | 3 (18.8%) | 6 (46.2%) | 0.001 |
| 胰周组织坏死 | 9 (15.3%) | 0 | 3 (18.8%) | 6 (46.2%) | <0.001 |
| 败血症 | 5 (8.5%) | 0 | 0 | 5 (38.5%) | <0.001 |
| 器官衰竭 | 13 (22.0%) | 0 | 0 | 13 (100%) | <0.001 |
| 住院天数 | 12 (7.0-18.5) | 8.5 (6.0-12.3) | 14 (11.0-20.0) | 32.5 (3.8-52.3) | 0.014 |
| 死亡率 | 8(13.6%) | 0 | 0 | 8 (61.5%) | <0.001 |
治疗前所有AP患者血清GP2水平均高于健康受试者(均P<0.05); 且随着AP严重程度的增加, 血清GP2水平升高, 且差异具有统计学意义(均P<0.05)(表2). 以AP患者治疗后的临床结局分为痊愈/好转出院或死亡, 根据临床结局前最后一次血清GP2水平结果统计, 治疗后痊愈/好转出院的AP患者血清GP2水平均显著低于治疗前(均P<0.05); 而治疗后死亡的重度AP患者血清GP2水平显著高于治疗前重度AP患者血清GP2水平(P<0.05)(表2).
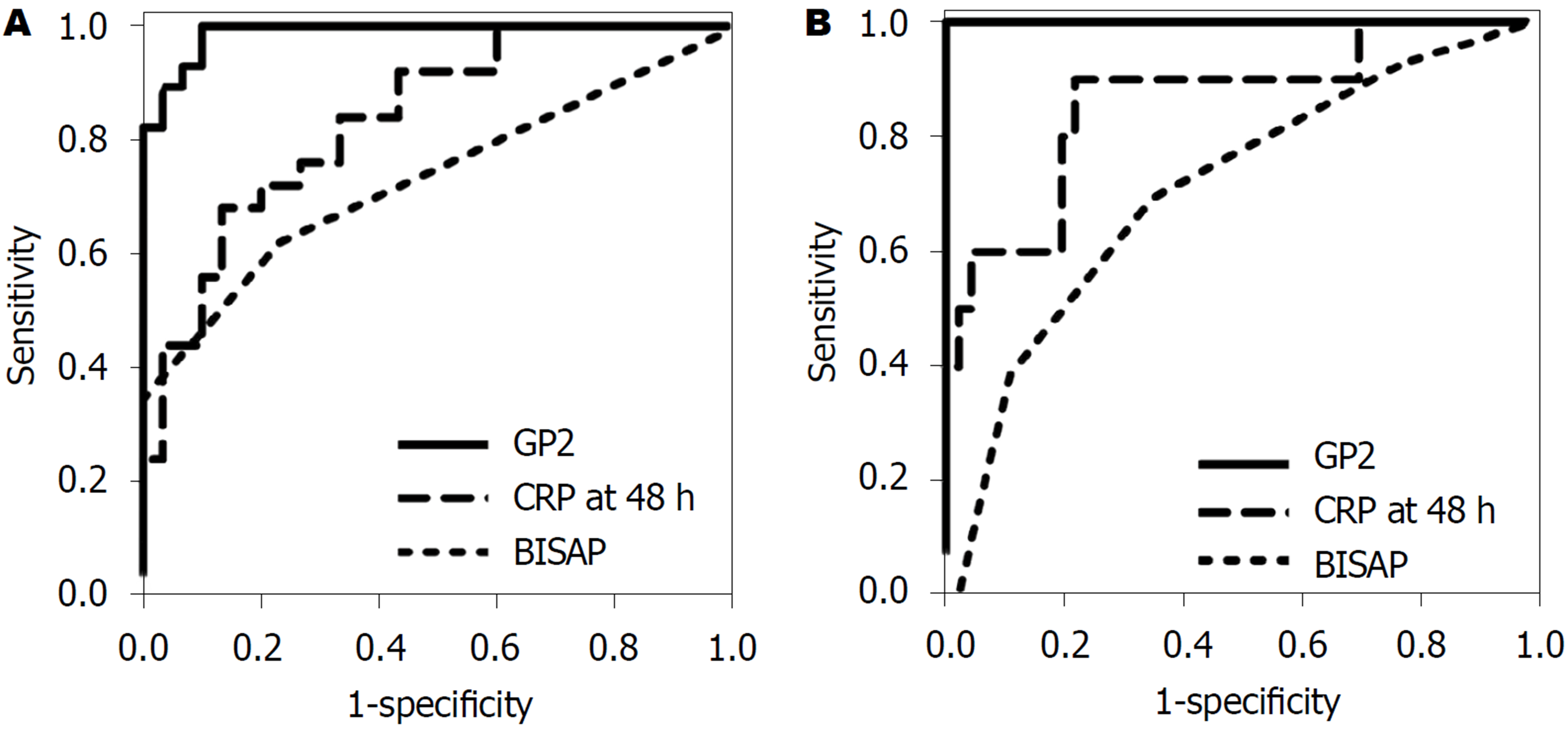
对于中度至重度AP的预测, GP2, BISAP评分和CRP的受试者工作曲线(receiver operating characteristic, ROC)如图1. GP2水平的ROC、ROC曲线下面积(area under curve, AUC)高于BISAP评分和CRP(表3). 以2.3 ng/mL为截止点, 入院时血清GP2可轻易地预测为中度或重度AP, 敏感性为96.6%, 特异性为90.0%, 阳性预测值(positive predictive value, PPV)为90.3%, 阴性预测值(negative predictive value, NPV)为96.4%. GP2的敏感性和NPV高于其他常用预测因子(表4).
| 结局预测 | 指标 | AUC (95%CI) |
| 中度胰腺炎 | GP2 | 0.954 (0.886-1) |
| BISAP评分 | 0.732 (0.601-0.863) | |
| CRP | 0.837 (0.734-0.941) | |
| 重症胰腺炎 | GP2 | 1 |
| BISAP评分 | 0.709 (0.547-0.871) | |
| CRP | 0.860 (0.720-1) | |
| 死亡 | GP2 | 0.931 (0.866-0.997) |
| BISAP评分 | 0.808 (0.668-0.948) | |
| CRP | 0.772 (0.529-1) |
| 指标 | 敏感性(%) | 特异性(%) | 阳性预测率(%) | 阴性预测率(%) |
| GP2>2.3 ng/mL | 96.6 | 90 | 90.3 | 96.4 |
| SIRS | 71.4 | 70 | 69 | 72.4 |
| 持续性SIRS | 48.3 | 100 | 100 | 65.9 |
| HTC>44% | 44.8 | 66.7 | 56.5 | 55.6 |
| BISAP | 34.5 | 100 | 100 | 61.2 |
| CRP>15 mg/dL | 68 | 80 | 73.9 | 75 |
GP2是严重疾病的预测因子, 与BISAP评分和CRP相比, AUC更高(表3, 图1). 使用5.1 nmol/L作为临界值, 血清GP2的预测重度AP的敏感性, 特异性, PPV值和NPV值均为100%. 该准确度高于本研究中评估的任何其他预测因子(表5).
| 变量 | 结局预测 | 敏感性(%) | 特异性(%) | 阳性预测率(%) | 阴性预测率(%) |
| GP2>5.1 ng/mL | 重症胰腺炎 | 100 | 100 | 100 | 100 |
| 死亡 | 100 | 90.2 | 61.5 | 100 | |
| SIRS | 重症胰腺炎 | 72 | 56.5 | 31 | 89.7 |
| 死亡 | 85.7 | 54.9 | 20.7 | 96.6 | |
| 持续性SIRS | 重症胰腺炎 | 84.6 | 93.3 | 78.6 | 95.5 |
| 死亡 | 75 | 84 | 42.9 | 95.5 | |
| HTC>44% | 重症胰腺炎 | 38.5 | 60.9 | 21.7 | 77.8 |
| 死亡 | 25 | 58.8 | 8.7 | 83.3 | |
| BISAP | 重症胰腺炎 | 38.5 | 89.1 | 50 | 83.7 |
| 死亡 | 50 | 88.2 | 40 | 91.8 | |
| CRP>15 mg/dL | 重症胰腺炎 | 90 | 68.9 | 39.1 | 96.9 |
| 死亡 | 80 | 62 | 17.4 | 96.9 |
准确地评估AP的严重程度, 对患者的治疗及预后均有重要意义[18]. 因此,目前, 研究者们一直在寻找敏感性及特异性较高的AP的血清学标识物. AP主要是由于多种因素的共同作用导致的胰腺的坏死及及肿胀, 导致炎症因子及其它细胞因子释放,这些因子为寻找AP的生物标识物提供了思路, 但多数适用于动物模型的生物标识物在应用于患者时则无意义[19]. 因此急需寻找一种适用于人的特异性及敏感性较高的生物标识物.
GP2作为一种可自身聚集及非消化性自身抗原, 可伴随消化酶原一起分泌[20]. GP2在分泌过程中不起主要作用, 但是分泌后的抗菌及免疫调节方面起着重要作用, 包括腺泡的内吞及酶原颗粒功能的调节[21]. AP的自身消化会致使腺泡的损害并导致消化酶及包括GP2和其它酶原颗粒的释放[22]. 在本研究中, GP2在AP患者血清中明显升高, 且与不同严重程度AP呈正相关, 表明GP2对诊断AP及预测AP有一定的临床意义.
为了探究GP2的敏感性与其它常用的的AP预测因子的优越性, 本研究对GP2与AP进行了关联性分析. 结果表明, GP2对中度及重度胰腺炎的预测准确性较CRP及BISAP评分高. 有研究[23]报道, GP2对AP预测的准确性较淀粉酶高. 这一结果与本研究相同, 表明GP2可作为AP的新型预测因子.
本研究中, 以2.3 ng/mL为截止点[24], GP2预测AP的敏感性为0.97, 特异性为0.9, 明显高于包括持续性的炎症反应综合率发生率、CRP指标、BISAP评分等. 以5.1 ng/mL为截止点[25], GP2对于重度AP的敏感性及特异性为100%. 进一步证明了GP2对AP的严重程度的预测有重要的指导意义.
与其它的生物标识物的研究类似, 本研究也有方法和技术的限制, 首先, 本研究, 59例AP患者中只有13例重度AP, 16例中度. 虽然本研究的统计结果可以区分这三个亚组, 但仍需更多的患者来支持这一结论. 但无论如何, GP2的敏感性及特异性均高于其它因子, 包括CRP及BISAP评分. 其次, 其他标识物有采用气相色谱/质谱联用的方法, 其可能比ELISA方法有更高的准确性, 但ELISA较色相色谱/质谱法有其明显的优越性, 包括应用快速简洁等. 为了能在临床运用过程中能将较大量的样本进行检测, ELISA是较好的选择.
本研究中虽然取得了较好的结果, 但仍需多中心, 多样本的队列研究支持GP2这一生物标识物在AP严重程度的预测中的准确性.
急性胰腺炎(acute pancreatitis, AP)发病机制复杂, 并发症较多, 且AP的严重程度变化较大, 其治疗方案往往相差甚远. 而早期AP严重程度的准确预测对于治疗方案的设定和预后均有重大意义, 且在AP动物模型中血清酶原颗粒的糖蛋白(glycoprotein 2, GP2)水平特异性上调.
本研究的主题为找到一种敏感性与特异性的血清学标识物用来预测AP的严重程度. 并与其它经典的血清学标志物及评分标准进行比较.
研究GP2是否能够作AP严重程度的早期生物标识物. 并且对其敏感性与特异性进行分析.
纳入丽水市人民医院普外科收入的AP患者, 收集其血浆样品,并纳入一定数量的健康受试者. 采用酶联免疫吸附实验方法检测患者血清中GP2水平, 并将GP2水平与AP患者严重程度进行关联分析.
血清GP2水平在AP患者中明显升高, 且与AP严重程度呈现正相关. 另外, GP2对于中度和重度AP的敏感性、特异性或预后的准确性较急性胰腺炎床旁严重指数评分、全身炎症综合征评分、C反应蛋白和红细胞压积T优越.
血清GP2具有作为预测AP严重程度和预后的生物标识物的潜力. 因此, 在AP的临床诊断与预测过程中, 可对其血清GP2浓度进行检测, 以早期诊断其严重程度, 利于合理化的治疗.
血清GP2有望作为预测AP严重程度和预后的生物标识物. 但, 本研究中纳入患者和健康受试者的样本量偏少, 仍需大数据的结果来支持GP2这一生物标识物在AP严重程度的预测中的准确性.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | 中华医学会消化病学分会胰腺疾病学组. 《中华胰腺病杂志》编辑委员会, 《中华消化杂志》编辑委员会, 王兴鹏, 李兆申, 袁耀宗, 杜奕奇, 曾悦. 中国急性胰腺炎诊治指南(2013, 上海). 中华胰腺病杂志. 2013;13:73-78. [DOI] |
| 4. | Leppäniemi A, Tolonen M, Tarasconi A, Segovia-Lohse H, Gamberini E, Kirkpatrick AW, Ball CG, Parry N, Sartelli M, Wolbrink D, van Goor H, Baiocchi G, Ansaloni L, Biffl W, Coccolini F, Di Saverio S, Kluger Y, Moore E, Catena F. 2019 WSES guidelines for the management of severe acute pancreatitis. World J Emerg Surg. 2019;14:27. [PubMed] [DOI] |
| 5. | Singh RG, Pendharkar SA, Cervantes A, Cho J, Miranda-Soberanis V, Petrov MS. Abdominal obesity and insulin resistance after an episode of acute pancreatitis. Dig Liver Dis. 2018;50:1081-1087. [PubMed] [DOI] |
| 6. | Vege SS, DiMagno MJ, Forsmark CE, Martel M, Barkun AN. Initial Medical Treatment of Acute Pancreatitis: American Gastroenterological Association Institute Technical Review. Gastroenterology. 2018;154:1103-1139. [PubMed] [DOI] |
| 7. | Crockett SD, Wani S, Gardner TB, Falck-Ytter Y, Barkun AN; American Gastroenterological Association Institute Clinical Guidelines Committee. American Gastroenterological Association Institute Guideline on Initial Management of Acute Pancreatitis. Gastroenterology. 2018;154:1096-1101. [PubMed] [DOI] |
| 8. | Abaylı B, Gençdal G, Değirmencioğlu Ş. Correlation between neutrophil/lymphocyte ratio and Ranson score in acute pancreatitis. J Clin Lab Anal. 2018;e22437. [PubMed] [DOI] |
| 9. | Hagjer S, Kumar N. Evaluation of the BISAP scoring system in prognostication of acute pancreatitis - A prospective observational study. Int J Surg. 2018;54:76-81. [PubMed] [DOI] |
| 10. | Rathnakar SK, Vishnu VH, Muniyappa S, Prasath A. Accuracy and Predictability of PANC-3 Scoring System over APACHE II in Acute Pancreatitis: A Prospective Study. J Clin Diagn Res. 2017;11:PC10-PC13. [PubMed] [DOI] |
| 11. | Shi Y, Liu Y, Liu YQ, Gao F, Li JH, Li QJ, Guo QY. Early diagnosis and severity assessment of acute pancreatitis (AP) using MR elastography (MRE) with spin-echo echo-planar imaging. J Magn Reson Imaging. 2017;46:1311-1319. [PubMed] [DOI] |
| 12. | Sternby H, Hartman H, Johansen D, Thorlacius H, Regnér S. IL-6 and CRP are superior in early differentiation between mild and non-mild acute pancreatitis. Pancreatology. 2017;17:550-554. [PubMed] [DOI] |
| 13. | Fei Y, Hu J, Gao K, Tu J, Li WQ, Wang W. Predicting risk for portal vein thrombosis in acute pancreatitis patients: A comparison of radical basis function artificial neural network and logistic regression models. J Crit Care. 2017;39:115-123. [PubMed] [DOI] |
| 14. | Hong W, Lin S, Zippi M, Geng W, Stock S, Zimmer V, Xu C, Zhou M. High-Density Lipoprotein Cholesterol, Blood Urea Nitrogen, and Serum Creatinine Can Predict Severe Acute Pancreatitis. Biomed Res Int. 2017;2017:1648385. [PubMed] [DOI] |
| 15. | Roggenbuck D, Goihl A, Hanack K, Holzlöhner P, Hentschel C, Veiczi M, Schierack P, Reinhold D, Schulz HU. Serological diagnosis and prognosis of severe acute pancreatitis by analysis of serum glycoprotein 2. Clin Chem Lab Med. 2017;55:854-864. [PubMed] [DOI] |
| 16. | Fétaud-Lapierre V, Pastor CM, Jorge-Costa M, Hochstrasser DF, Morel DR, Frossard JL, Lescuyer P. Time-course proteomic analysis of taurocholate-induced necrotizing acute pancreatitis. J Proteomics. 2013;85:12-27. [PubMed] [DOI] |
| 17. | DiMagno MJ, Forsmark CE. Chronic pancreatitis and small intestinal bacterial overgrowth. Pancreatology. 2018;18:360-362. [PubMed] [DOI] |
| 18. | Smeets XJNM, Knoester I, Grooteman KV, Singh VK, Banks PA, Papachristou GI, Duarte-Rojo A, Robles-Diaz G, Kievit W, Besselink MGH, Verdonk RC, Van Santvoort HC, Drenth JPH, Belias M, Van Geenen EJM; Dutch Pancreatitis Study Group. The association between obesity and outcomes in acute pancreatitis: an individual patient data meta-analysis. Eur J Gastroenterol Hepatol. 2019;31:316-322. [PubMed] [DOI] |
| 19. | Zhu Y, He C, Li X, Cai Y, Hu J, Liao Y, Zhao J, Xia L, He W, Liu L, Luo C, Shu X, Cai Q, Chen Y, Lu N. Gut microbiota dysbiosis worsens the severity of acute pancreatitis in patients and mice. J Gastroenterol. 2019;54:347-358. [PubMed] [DOI] |
| 20. | Maheshwari R, Subramanian RM. Severe Acute Pancreatitis and Necrotizing Pancreatitis. Crit Care Clin. 2016;32:279-290. [PubMed] [DOI] |
| 21. | Zhang C, Guo L, Qin Y, Li G. [Interaction between polymorphisms of TLR4 gene G11367C in 3' untranslated region and IκB-α Hae III in acute pancreatitis and the degree of severity]. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2016;41:272-281. [PubMed] [DOI] |
| 22. | Branquinho D, Ramos-Andrade D, Elvas L, Amaro P, Ferreira M, Sofia C. Drug-Induced Acute Pancreatitis and Pseudoaneurysms: An Ominous Combination. GE Port J Gastroenterol. 2016;23:309-313. [PubMed] [DOI] |
| 23. | Polonikov AV, Samgina TA, Nazarenko PM, Bushueva OY, Ivanov VP. Alcohol Consumption and Cigarette Smoking are Important Modifiers of the Association Between Acute Pancreatitis and the PRSS1-PRSS2 Locus in Men. Pancreas. 2017;46:230-236. [PubMed] [DOI] |
| 24. | Dumnicka P, Kuśnierz-Cabala B, Sporek M, Mazur-Laskowska M, Gil K, Kuźniewski M, Ceranowicz P, Warzecha Z, Dembiński A, Bonior J, Drożdż R. Serum Concentrations of Angiopoietin-2 and Soluble fms-Like Tyrosine Kinase 1 (sFlt-1) Are Associated with Coagulopathy among Patients with Acute Pancreatitis. Int J Mol Sci. 2017;18:E753. [PubMed] [DOI] |