修回日期: 2019-08-23
接受日期: 2019-09-13
在线出版日期: 2019-09-28
既往研究表明前白蛋白(prealbumin, PA)与纤维蛋白原(fibrinogen, Fib)可用于判断多种恶性肿瘤的临床病理特征及预后. 因此本研究推测前白蛋白/纤维蛋白原比值(prealbumin-to-fibrinogen, PA/F)可预测胃癌(gastric cancer, GC)患者临床病理特征, 术前辅助判断肿瘤进展程度.
探讨术前PA与Fib比值PA/F和GC临床病理特征的关系.
回顾性分析2017-01/2019-03浙江大学附属第一医院肿瘤外科收治的210例GC患者术前临床病理资料并分为低PA/F组和高PA/F组. 比较两组临床资料及病理学特征的差异并分析PA/F值与其他预后相关免疫营养指标的相关性.
PA/F值与年龄、肿瘤大小、分化程度、浸润深度、淋巴结转移、TNM分期和神经血管侵犯相关(P<0.05), 低PA/F值组表现出患者年龄更大、肿瘤最大径更大、分化程度更差、浸润深度更深、TNM分期更晚和更易神经脉管侵犯(P<0.05). PA/F值与中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)、血小板与淋巴细胞比值(platelet-to-lymphocyte ratio, PLR)、C反应蛋白与白蛋白比值(C-reactive protein-to-albumin ratio, CAR)和系统性免疫炎症指数(systemic immune-inflammation index, SII)呈负相关性, 与预后营养指数(prognostic nutritional index, PNI)呈正相关性.
PA/F值可作为GC患者术前临床病理特征的判断指标, 其值≤9.07提示肿瘤处于进展期, TNM分期相对较差, PA/F值与NLR、PLR、CAR、SII和PNI多种GC预后指数具有相关性.
核心提要: 分析胃癌患者外周血前白蛋白与纤维蛋白原比值(prealbumin-to-fibrinogen ratio, PA/F)与临床病理特征的关系, 结果表明PA/F值与肿瘤大小、分化程度、浸润深度、淋巴结转移和TNM分期等相关, 并且与其他多种免疫预后指标呈负相关性.
引文著录: 张俊斌, 王浩浩, 王伟斌, 王海勇, 陆轶民, 俞雄飞, 滕理送. 前白蛋白/纤维蛋白原比值与胃癌临床病理特征的关系. 世界华人消化杂志 2019; 27(18): 1133-1141
Revised: August 23, 2019
Accepted: September 13, 2019
Published online: September 28, 2019
Previous studies have shown that prealbumin (PA) and fibrinogen (Fib) can be used to predict the clinicopathological features and prognosis of a variety of malignant tumors. Therefore, we speculated that the prealbumin-to-fibrinogen ratio (PA/F) can predict the clinicopathological features of patients with gastric cancer (GC) and tumor progression preoperatively.
To explore the relationship between the PA/F ratio and clinicopathological features of patients with GC.
The preoperative clinical and pathological data of 210 patients with GC admitted to the First Affiliated Hospital of Zhejiang University from January 2017 to March 2019 were retrospectively analyzed. The patients were divided into either a low PA/F group or high PA/F group. The differences in clinical data and pathological features were compared between the two groups, and the correlation between PA/F values and other prognosis-related immunonutrient indicators was also analyzed.
The PA/F ratio was significantly associated with age, tumor size, degree of differentiation, depth of invasion, lymph node metastasis, TNM stage, and neurovascular invasion (P < 0.05). The low PA/F value group showed greater age, larger tumor diameter, lower degree of differentiation, deeper infiltration, advanced TNM stage, and more frequent neurovascular invasion (P < 0.05). PA/F values were negatively correlated with multiple immune nutrition indicators, such as neutrophil-to-lymphocyte ratio (NLR), platelet-to-lymphocyte ratio (PLR), C-reactive protein-to-albumin ratio (CAR), and systemic immune-inflammation index (SII), but positively correlated with prognostic nutritional index (PNI).
The PA/F ratio can be used as a predictor of preclinical clinicopathological features in patients with GC, and patients with a PA/F ratio ≤ 9.07 have a relatively poor prognosis. The PA/F value is associated with NLR, PLR, CAR, SII, and PNI.
- Citation: Zhang JB, Wang HH, Wang WB, Wang HY, Lu YM, Yu XF, Teng LS. Association of prealbumin/fibrinogen ratio with clinicopathologic characteristics of gastric cancer. Shijie Huaren Xiaohua Zazhi 2019; 27(18): 1133-1141
- URL: https://www.wjgnet.com/1009-3079/full/v27/i18/1133.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i18.1133
胃癌(gastric cancer, GC)是我国常见的消化系统恶性肿瘤, 每年全球GC新增病例中约41%发生在中国, 据最新中国恶性肿瘤流行情况分析表明, GC目前已成为我国发病率第二和死亡率第三的恶性肿瘤[1]. 随着外科的发展及肿瘤化疗、放疗、靶向治疗等多学科诊疗技术的进步、早诊早治率的提高, GC的临床预后较之前已有明显改善. 但目前GC患者的分期仍主要依赖于术后病理, 亟需发展一套可术前评估GC患者肿瘤进展程度的体系, 从而指导多学科治疗方案的制定.
恶性肿瘤的发生发展及侵袭转移程度不仅与肿瘤细胞本身特性有关, 而且还受到机体对肿瘤反应的影响, 这其中就包括了宿主本身的营养状况. 血清前白蛋白(prealbumin, PA)是由肝脏合成的、能较敏感反映机体蛋白更新程度的一种蛋白质, 能够比白蛋白更好的反应机体的营养状况[2]. 之前研究报道了PA在判断结直肠癌、肝内胆管细胞癌、食管癌、GC等消化系统恶性肿瘤诊断和预后方面具有重要作用[3-6].
研究发现肿瘤患者常表现出一项或多项凝血功能指标的异常, 其中也包括血浆纤维蛋白原. 纤维蛋白原(fibrinogen, Fib)是由肝脏产生的一类糖蛋白, 在临床上尤其是外科术前常规检测的凝血指标. Fib参与了恶性肿瘤的发生发展和侵袭转移. 在GC中, 血浆Fib水平与GC进展程度及预后不佳呈正相关[7].
基于以上研究发现, 我们推测由PA和Fib组合构建的PA与Fib比值(prealbumin-to-fibrinogen ratio, PA/F)能够较好的预测GC患者临床病理特征.
回顾性统计分析2017-01/2019-03浙江大学附属第一医院收治的210例GC患者临床及病理资料,术后病理分期以美国国立综合癌症网络发表的GC第2018. 2版指南为依据, 术后病理诊断胃腺癌,根据术后病理确定肿瘤分化程度, 分为高分化组、中分化组、低差分化组(未分化癌、粘液腺癌、印戒细胞癌、肝样腺癌).
210例接受手术治疗的GC患者平均年龄为61.2岁±0.71岁, 其中≤60岁者共94例, 占44.8%; >60岁者共116例, 占55.2%. 男性共143例, 占68.1%; 女性共67例, 占31.9%. 根据肿瘤中心所在的部位分类, 绝大部分GC位于远端胃, 高位、中位、低位肿瘤的比例分别为11.4%(24例)、29.5%(62例)和59.1%(124例). 48.6%(102例)的GC最大径≤3 cm, 51.4%(108例)的GC最大径>3 cm. 仅16.7%(35例)的GC病人伴有血清癌胚抗原(carcino-embryonic antigen, CEA)水平增高. 大部分(78.1%, 164例)GC患者的术后病理组织学类型为低差分化腺癌, 而高分化和中分化腺癌分别占5.7%(12例)和16.2%(34例). GC累犯神经和脉管的比例基本相同, 分别为24.3%(51例)和23.8%(50例). 根据第八版GC TNM分期, Ⅰ、Ⅱ、Ⅲ、Ⅳ期GC患者分别占GC手术患者总数的36.7%(77例)、28.1%(59例)、30.9%(65例)和4.3%(9例). 所有患者中53.8%(113例)的GC病人伴有淋巴结转移(N>0), 4.3%(9例)的GC病人伴有远处转移(M = 1)(表1).
| 因素 | 例数 | PA/F值 | t值/F值 | P值 |
| 性别 | 1.336 | 0.183 | ||
| 男 | 143 | 9.288±0.302 | ||
| 女 | 67 | 8.598±0.387 | ||
| 年龄(岁) | 2.956 | 0.004 | ||
| ≤60 | 94 | 9.842±0.358 | ||
| >60 | 116 | 8.439±0.314 | ||
| 肿瘤部位 | 1.368 | 0.257 | ||
| 高位 | 24 | 7.978±0.643 | ||
| 中位 | 62 | 9.295±0.429 | ||
| 低位 | 124 | 9.171±0.322 | ||
| 肿瘤大小(cm) | 4.271 | <0.001 | ||
| ≤3 | 102 | 10.09±0.321 | ||
| >3 | 108 | 8.115±0.332 | ||
| 分化程度 | 6.02 | 0.003 | ||
| 高分化 | 12 | 11.85±0.606 | ||
| 中分化 | 34 | 9.897±0.691 | ||
| 低分化 | 164 | 8.693±0.261 | ||
| 脉管浸润 | 3.484 | <0.001 | ||
| 有 | 50 | 7.614±0.511 | ||
| 无 | 160 | 9.528±0.263 | ||
| 神经侵犯 | 2.72 | 0.007 | ||
| 有 | 51 | 7.921±0.411 | ||
| 无 | 159 | 9.432±0.283 | ||
| 浸润深度 | 19.56 | <0.001 | ||
| TIS, T1 | 68 | 11.04±0.371 | ||
| T2 | 31 | 10.15±0.618 | ||
| T3 | 87 | 7.647±0.317 | ||
| T4 | 24 | 7.169±0.658 | ||
| 淋巴结转移 | 8.019 | <0.001 | ||
| N0 | 97 | 10.11±0.336 | ||
| N1 | 35 | 9.119±0.614 | ||
| N2 | 34 | 8.430±0.593 | ||
| N3 | 44 | 7.250±0.440 | ||
| 远处转移 | 3.047 | 0.003 | ||
| M0 | 201 | 9.223±0.244 | ||
| M1 | 9 | 5.682±0.722 | ||
| TNM分期 | 16.19 | <0.001 | ||
| 0-Ⅰ期 | 77 | 10.88±0.365 | ||
| Ⅱ期 | 59 | 8.717±0.444 | ||
| Ⅲ期 | 65 | 7.713±0.369 | ||
| Ⅳ期 | 9 | 5.682±0.722 | ||
| CEA水平 | 0.116 | 0.908 | ||
| ≤5 | 175 | 9.083±0.263 | ||
| >5 | 35 | 9.010±0.597 |
1.2.1 纳入与排除标准: 纳入标准: (1)患者术前经胃镜活检及术后行病理常规检测证实为胃腺癌的手术病人; (2)血液学标本在手术前1 wk内获得. 排除标准: (1)术前进行过放疗或者化疗的患者; (2)合并同时或异时的其他恶性肿瘤的患者; (3)伴随其他可能影响血常规及肝肾功能疾病, 比如自身免疫性疾病、感染性疾病及肝炎肝硬化等; (4)术前出现过严重消化道梗阻、穿孔或大出血等并发症的患者; (5)术前影像学检查已发现肝、肺等远处转移的患者; (6)临床及病理资料缺失或随访失访的患者.
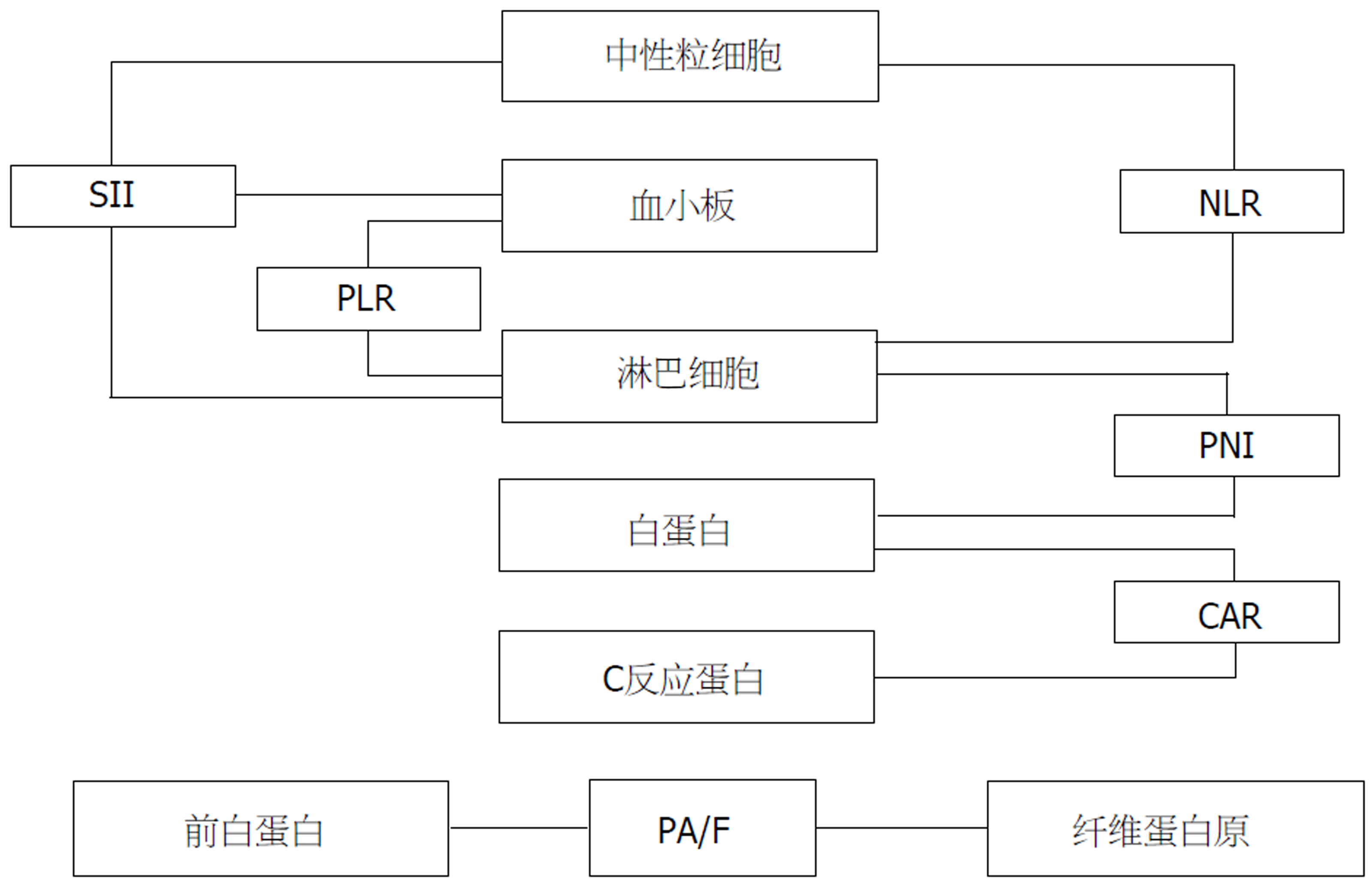
1.2.2 数据计算方式: 术前一周进行血常规、凝血功能及生化检查, 根据结果计算PA/F值、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)、血小板与淋巴细胞比值(platelet-to-lymphocyte ratio, PLR)、C反应蛋白与白蛋白比值(C-reactive protein-to-albumin ratio, CAR)、预后营养指数(prognostic nutritional index, PNI), PNI = 血清白蛋白值(g/L)+5×外周淋巴细胞总数(×109/L)、系统性免疫炎症指数(systemic immune-inflammation index, SII), SII = 外周血小板总数(×109/L)×外周中性粒细胞总数(×109/L)/外周淋巴细胞总数(×109/L). 与之前研究报道相似[8], 我们选取PA/F值平均值为截断值, 对全部210例GC患者进行统计分析, 得出PA/F值的均值为9.07, 将PA/F值≥9.07定义为高PA/F值组, 将PA/F值<9.07定义为低PA/F值组. 各比值之间关系(图1).
统计学处理 采用SPSS 16.0统计学软件进行数据的统计分析. 符合正态分布的计量资料以mean±SD表示, 两组之间的均数比较采用独立样本t检验, 多组均数比较采用单因素方差分析; 不符合正态分布的计量资料以中位数和四分位数[M(P25, P75)]表示, 比较采用秩和检验. 计数资料以例数和百分数表示, 计数资料比较采用χ2检验或者Fisher确切概率法分析. 通过计算PA/F值绘制PA/F受试者工作特征(receiver operating characteristic, ROC)曲线并测定PA/F值敏感性和特异性. P<0.05为差异具有统计学意义.
进一步分析显示, 术前PA/F值与年龄、肿瘤部位及术前肿瘤标志物CEA水平无密切关系(P>0.05). 但在年龄大于60岁的老年GC患者中PA/F值更低(t = 2.956, P = 0.004). 此外, PA/F值与肿瘤大小及分化程度密切相关, 肿瘤最大径>3 cm的GC患者PA/F值更低(t = 4.271, P<0.001); 低分化GC患者的PA/F值明显低于高分化GC患者, 但高分化GC患者与中分化GC患者, 中分化GC与低分化GC患者PA/F值无统计学差异(F = 2.056, P = 0.003; 组间比较P高分化-低分化 = 0.006). 肿瘤浸润程度越重, PA/F值越低(F = 19.56, P<0.001; 组间比较P1-3<0.001, P1-4<0.001, P2-3 = 0.001, P2-4 = 0.003). 有淋巴结转移组PA/F值明显低于无淋巴结转移组GC患者(F = 8.019, P<0.001; 组间比较P0-3<0.001). 在肿瘤侵犯神经脉管的GC患者中, 其PA/F值低于未侵犯GC患者(t神经 = 2.72, P = 0.007; t脉管 = 3.484, P<0.001). 临床TNM分期越晚, PA/F值越低, 呈逐步降低趋势(F = 16.19, P<0.001; 组间比较P1-2 = 0.001, P1-3<0.001, P1-4<0.001, P2-4 = 0.039)(表1).
经计数得出PA/F值的均值为9.07±0.24, 因此, 我们根据此值将GC患者分为高PA/F值组和低PA/F值组. 结果显示, 高PA/F值组共有患者100例, 其中男性69例(69%), 女性31例(31%); 年龄≤60岁者共53例(53%), 年龄>60岁者共47例(47%). 低PA/F值组共有患者110例, 其中男性74例(67%), 女性36例(33%); 年龄≤60岁者共41例(37.3%), 年龄>60岁者共69例(63.7%). 此外, 低PA/F值组与高PA/F值组相比, 有更大的肿瘤最大径(χ2 = 18.19, P<0.001)、更深的浸润深度(χ2 = 24.08, P<0.001)、更多的淋巴结转移(χ2 = 16.85, P<0.001)、更多神经脉管侵犯(χ2 = 4.1, P神经 = 0.04和χ2 = 8.17, P脉管 = 0.004)、分化程度更差(χ2 = 11, P = 0.004)和较晚的TNM分期(χ2 = 36.18, P<0.001); 而两组患者性别、肿瘤部位和术前CEA水平的差异均无统计学差异(P>0.05)(表2).
| 因素 | 低PA/F组(n = 110) | 高PA/F组(n = 100) | χ2值 | P值 |
| 性别 | 0.072 | 0.789 | ||
| 男 | 74 (67.27%) | 69 (69.00%) | ||
| 女 | 36 (32.73%) | 31 (31.00%) | ||
| 年龄(岁) | 5.24 | 0.022 | ||
| ≤60 | 41 (37.27%) | 53 (53.00%) | ||
| >60 | 69 (62.73%) | 47 (47.00%) | ||
| 肿瘤部位 | 2.745 | 0.254 | ||
| 高位 | 16 (14.55%) | 8 (8.00%) | ||
| 中位 | 29 (26.36%) | 33 (33.00%) | ||
| 低位 | 65 (59.09%) | 59 (59.00%) | ||
| 肿瘤大小(cm) | 18.19 | <0.001 | ||
| ≤3 | 38 (34.55%) | 64 (64.00%) | ||
| >3 | 72 (65.45%) | 36 (36.00%) | ||
| 分化程度 | 11 | 0.004 | ||
| 高分化 | 1 (0.90%) | 11 (11.00%) | ||
| 中分化 | 16 (14.55%) | 18 (18.00%) | ||
| 低分化 | 93 (84.55%) | 71 (71.00%) | ||
| 脉管浸润 | 8.167 | 0.004 | ||
| 有 | 35 (31.82%) | 15 (15.00%) | ||
| 无 | 75 (68.18%) | 85 (85.00%) | ||
| 神经侵犯 | 4.102 | 0.043 | ||
| 有 | 33 (30.00%) | 18 (18.00%) | ||
| 无 | 77 (70.00%) | 82 (82.00%) | ||
| 浸润深度 | 24.08 | <0.001 | ||
| 早期(TIS, T1) | 19 (17.27%) | 49 (49.00%) | ||
| 进展期(T2-T4) | 91 (82.73%) | 51 (51.00%) | ||
| 淋巴结转移 | 16.85 | <0.001 | ||
| 无(N0) | 36 (32.73%) | 61 (61.00%) | ||
| 有(N1、N2、N3) | 74 (67.27%) | 39 (39.00%) | ||
| 远处转移 | 8.548 | 0.004 | ||
| M0 | 101 (91.82%) | 100 (100.00%) | ||
| M1 | 9 (8.18%) | 0 (0.00%) | ||
| TNM分期 | 36.18 | <0.001 | ||
| 0-Ⅰ期 | 21 (19.09%) | 56 (56.00%) | ||
| Ⅱ期 | 35 (31.82%) | 24 (24.00%) | ||
| Ⅲ期 | 45 (40.91%) | 20 (20.00%) | ||
| Ⅳ期 | 9 (8.18%) | 0 (0.00%) | ||
| CEA水平 | 0.061 | 0.805 | ||
| ≤5 | 91 (82.73%) | 84 (84.00%) | ||
| >5 | 19 (17.27%) | 16 (16.00%) |
进一步分析淋巴结转移率看到, 低PA/F值组的淋巴结转移率(67.3%)明显高于高PA/F值组(39%)(χ2 = 21.28, P<0.001). 对GC患者的T1/T2期和T3/T4期进行ROC曲线统计分析, 取所有患者PA/F值的平均数9.07作为分界值, 其敏感度为72.9%, 特异度为58.5%, ROC曲线下面积(area under the curve, AUC)值为0.71; 而在判断淋巴结是否转移上, 其敏感度为65.5%, 特异度为62.5%, AUC值为0.67(表3).
| 组别 | 例数 | N0 | N1 | N2 | N3 | 转移率 |
| 低PA/F值组 | 110 | 36 | 18 | 23 | 33 | 67.27% |
| 高PA/F值组 | 100 | 61 | 17 | 11 | 11 | 39.00% |
| 合计 | 210 | 97 | 35 | 34 | 44 | 53.81% |
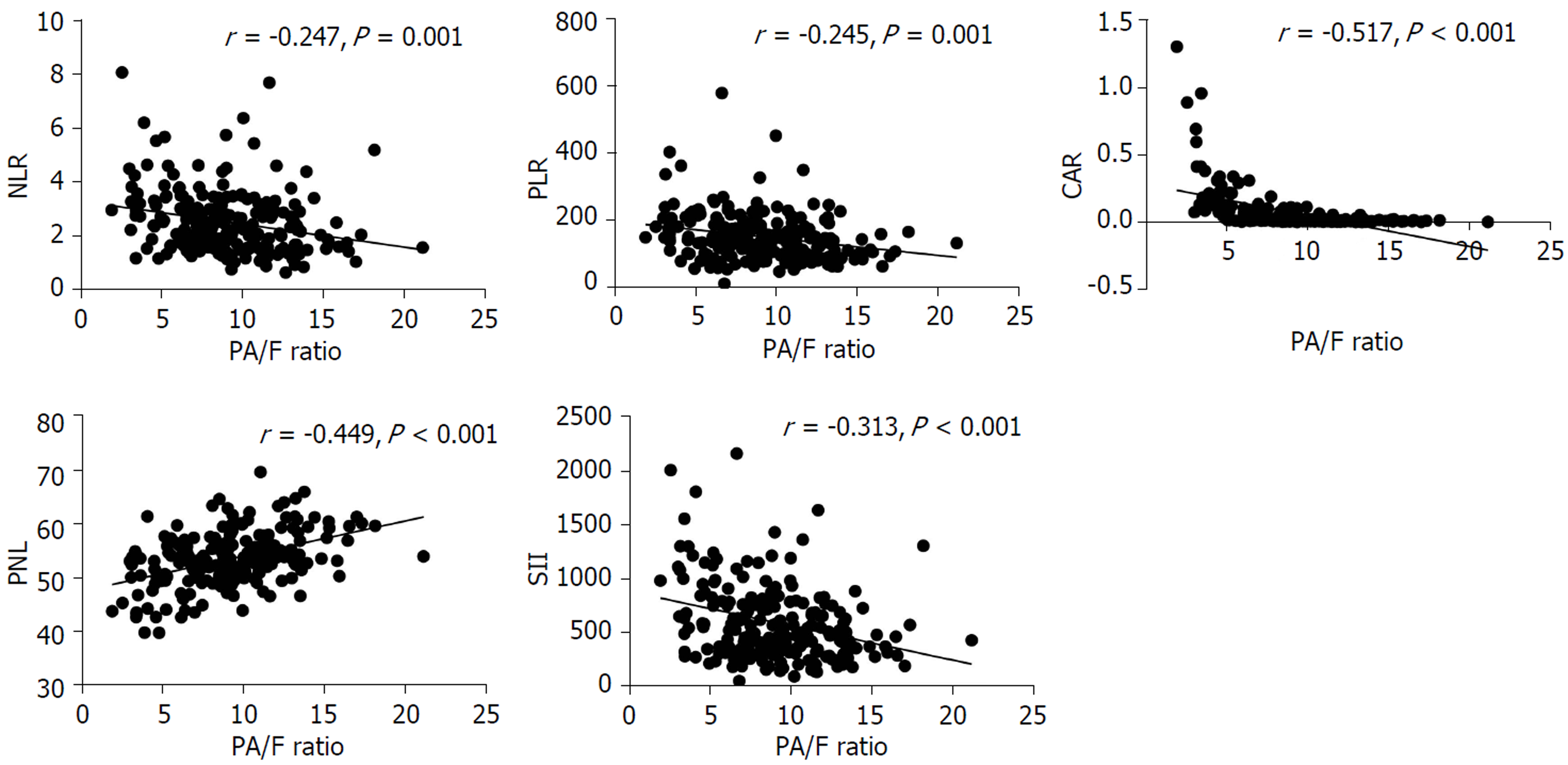
此外, 本研究进一步统计分析了PA/F值与其他免疫营养指标的相关性, 发现早期GC的NLR、PLR、CAR和SII明显小于进展期GC, PNI明显大于进展期GC(P<0.05)(表4). 经过Pearson相关性分析显示, PA/F值与NLR(r = -0.247, P = 0.001)、PLR(r = -0.245, P = 0.001)、CAR(r = -0.517, P<0.001)和SII(r = -0.313, P<0.001)呈负相关, 与PNI(r = -0.449, P<0.001)呈正相关; 其中PA/F值与CAR的相关性最高(图2).
| 变量 | 0-Ⅰ期(n = 77) | Ⅱ-Ⅳ期(n = 133) | P值 |
| NLR | 1.865 (1.915-2.423) | 2.55 (2.481-2.896) | <0.001 |
| PLR | 125.6 (126.3-150.7) | 156.3 (155.0-181.9) | 0.002 |
| CAR | 0.009 (0.013-0.041) | 0.029 (0.063-0.128) | <0.001 |
| PNI | 54.83±0.533 | 52.21±0.439 | <0.001 |
| SII | 414.4 (396.5-511.6) | 617.4 (605.8-734.9) | <0.001 |
据统计2015年我国GC总发病例数约67.9万, 总死亡例数约49.8万, 总体预后仍然较差[9]. 虽然对GC的诊断及治疗方法众多, 然而, 由于其症状缺乏特异性和晚期GC患者治疗的有限性, 较难在初诊时对GC进展程度进行快速有效评估. 目前TNM分期仍是判断GC患者预后的主要指标, 但由于其依赖于术后病理, 具有一定的局限性. 因此, 研究GC发生发展及转移相关的预测指标对评估患者病情从而制定治疗方案具有重要意义.
既往研究表明, 肿瘤患者的营养状况与患者的年龄、疾病进展程度和预后相关. PA与白蛋白功能相似, 但半衰期更短, 能够较敏感的评估机体营养状况和免疫功能, 而这与肿瘤的复发和预后密切相关[10]. 前白蛋白降低会增加GC患者术后并发症的发生率, 包括组织修复功能下降、吻合口瘘、营养支持获益差等. 而且还会促进全身炎症反应, 从而引发促进肿瘤的发展, 导致患者预后较差. 改善患者的营养状况可缩短住院时间、降低术后并发症的发生率, 从而影响患者预后. 纤维蛋白原又称为凝血因子Ⅰ, 是由肝脏产生的血液中含量最高的凝血因子, 在手术、感染、炎症、外伤及肿瘤等多种病理生理情况下均出现不同程度的升高[11]. 在恶性肿瘤中往往伴随一项或多项凝血功能的异常, 凝血系统的激活及凝血相关分子的释放在肿瘤进展过程中发挥了重要作用[12], 其中便包括纤维蛋白原含量的改变. 研究表明, 大约50%未转移和90%已转移的肿瘤患者存在一定的凝血功能异常[13], 而无明显诱因情况出现血栓性疾病的患者可能存在隐匿性恶性肿瘤[14]. 越来越多的研究发现Fib与恶性肿瘤之间存在密切关系, 其与多种肿瘤的进展、化疗反应不佳及临床预后不良相关[15,16]. 其机制可能是纤维蛋白原可在肿瘤细胞外基质中起到骨架作用, 从而促进肿瘤血管的生成, 增强肿瘤细胞的粘附、迁移和侵袭[17].
综上所述, 我们推测以前白蛋白和纤维蛋白原为基础的指标PA/F值可预测GC患者的临床病理特征. 但对于PA/F值与GC患者TNM分期及预后的关系及其内在机制目前仍不清楚, 仍需进一步基础机制研究加以论证. 本研究回顾性分析了GC患者术前的PA/F值与临床病理特征的关系, 并首次报道了肿瘤直径越大、分化程度越差、浸润深度越深、淋巴结转移率越高、TNM分期越晚的GC患者往往伴随较低的PA/F值, 此类患者也更易伴发神经脉管侵犯. 以上都提示了低PA/F值GC患者术后复发率更高、预后更差, 需要较强的术后化疗方案及更频繁的随访周期. 同样临床上可以看到, 肿瘤越大、浸润深度越深、淋巴结转移数目越多的GC患者往往更容易出现营养消耗、恶病质、体内凝血系统的激活等情况, 这也反应了肿瘤引发的患者免疫、营养状态的下降, 从而引起PA/F值降低.
过去几十年中, 大量的研究发现由血常规结果得出的炎症指数, 比如NLR、PLR和SII可用于判断恶性肿瘤的疾病进展程度和预后[18]. 与之前研究报道一致, 我们同样发现, NLR、PLR、CAR及SII随着TNM分期的进展, 呈上升趋势, 而PNI呈下降趋势, 差异具有统计学意义. 进一步分析发现PA/F值与呈PNI正相关, 与NLR、PLR、CAR及SII呈负相关.
但本研究仍有不足之处, 首先, 本研究术后单中心回顾性研究, 存在选择偏倚, 后期仍需多中心、大样本、前瞻性研究加以证实; 其次, 由于大多医院尚未将前白蛋白列为术前常规检测项目, 浙江大学医学院附属第一医院近两年才开始对恶性肿瘤病人进行术前检测前白蛋白等营养指标, 因此缺乏随访及预后数据.
综上所述, 低PA/F值组GC患者的肿瘤较大、分化程度更差、浸润深度更深、淋巴结转移更多、更容易侵犯神经脉管, 从而表现出TNM分期更晚, 提示此类患者预后较差, 需加强随访. PA/F值可作为术前评估GC患者TNM分期的重要工具, 据此判断患者术后并发症的发生和预后, 指导临床医生制定更好的治疗方案.
胃癌(gastric cancer, GC)是我国常见的消化道恶性肿瘤之一, 具有较高的发病率和死亡率. 因此, 术前对GC患者疾病状态的判断并选择合理的治疗方案有助于改善患者生存时间, 具有重要的临床意义. 既往研究表明前白蛋白(prealbumin, PA)和纤维蛋白原(fibrinogen, Fib)对包括GC在内的多种恶性肿瘤的进展和预后具有判断作用. 然而, 我国尚无PA与Fib比值(prealbumin-to-fibrinogen, PA/F)在GC患者中作用的报道. 本研究旨在探讨PA/F值对GC患者临床病理特征的判断作用, 并分析其与多种免疫预后指标的关系.
本研究旨在研究PA/F值对GC临床病理特征的预测判断价值, 并进一步探讨其与多种免疫预后指标的相关性, 以期为临床提供更多术前决策手段, 从而提高GC患者的术后生存时间.
本研究分析了术前PA/F值与GC各临床病理特征的关系, 进一步比较了PA/F值与多种免疫预后指标的相关性.
本研究采用回顾性分析的研究方法, 记录其术前实验室检查数据并计算相应预测指标, 得出PA/F值的平均值为9.07, 根据此将所有GC患者分为高PA/F值组和低PA/F值组. 比较两组GC患者临床病理特征差异及分析PA/F值与其他免疫预后指标的相关性.
随着GC进展程度的增加, PA/F值逐渐降低. 低PA/F组患者的肿瘤最大径更大、浸润深度更深、淋巴结转移更多、神经脉管侵犯更多、分化程度更差和TNM分期更晚. 低PA/F值组的淋巴结转移率(67.3%)明显高于高PA/F值组(39%). PA/F值与中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)、血小板与淋巴细胞比值、C反应蛋白与白蛋白比值(C-reactive protein-to-albumin ratio, CAR)和系统性免疫炎症指数呈负相关性, 与预后营养指数呈正相关性, 其中PA/F值与CAR的相关性最大(r = -0.517).
PA/F值与GC患者的临床病理特征密切相关, 低PA/F值患者表现出肿瘤明显进展, 并且PA/F值与NLR等多种免疫预后指标相关.
本研究对PA/F值与GC患者的临床病理特征进行分析研究, 但仍需长期随访明确其在预后判断中的作用, 依据后续依靠大样本多中心随机对照实验予以验证其对GC进展判断的有效性.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Zhu Z. [2017 hotspots review and outlook on gastric cancer surgery in China]. Zhonghua Wei Chang Wai Ke Za Zhi. 2018;21:7-14. [PubMed] |
| 2. | Lu J, Xu BB, Zheng ZF, Xie JW, Wang JB, Lin JX, Chen QY, Cao LL, Lin M, Tu RH, Huang ZN, Zheng CH, Huang CM, Li P. CRP/prealbumin, a novel inflammatory index for predicting recurrence after radical resection in gastric cancer patients: post hoc analysis of a randomized phase III trial. Gastric Cancer. 2019;22:536-545. [PubMed] [DOI] |
| 3. | Zhou H, Jiang X, Li Q, Hu J, Zhong Z, Wang H, Wang H, Yang B, Hu H. A simple and effective prognostic staging system based on clinicopathologic features of intrahepatic cholangiocarcinoma. Am J Cancer Res. 2015;5:1831-1843. [PubMed] |
| 4. | Han WX, Chen ZM, Wei ZJ, Xu AM. Preoperative pre-albumin predicts prognosis of patients after gastrectomy for adenocarcinoma of esophagogastric junction. World J Surg Oncol. 2016;14:279. [PubMed] [DOI] |
| 5. | Chiang JM, Chang CJ, Jiang SF, Yeh CY, You JF, Hsieh PS, Huang HY. Pre-operative serum albumin level substantially predicts post-operative morbidity and mortality among patients with colorectal cancer who undergo elective colectomy. Eur J Cancer Care (Engl). 2017;26. [PubMed] [DOI] |
| 6. | Shen Q, Liu W, Quan H, Pan S, Li S, Zhou T, Ouyang Y, Xiao H. Prealbumin and lymphocyte-based prognostic score, a new tool for predicting long-term survival after curative resection of stage II/III gastric cancer. Br J Nutr. 2018;120:1359-1369. [PubMed] [DOI] |
| 7. | Song S, Cong X, Li F, Xue Y. The Fibrinogen to Mean Platelet Volume Ratio Can Predict Overall Survival of Patients with Non-Metastatic Gastric Cancer. J Gastric Cancer. 2018;18:368-378. [PubMed] [DOI] |
| 8. | Li S, Xu X, Liang D, Tian G, Song S, He Y. [Prognostic value of blood neutrophil-to-lymphocyte ratio (NLR) and platelet-to-lymphocyte ratio (PLR) in patients with gastric cancer]. Zhonghua Zhong Liu Za Zhi. 2014;36:910-915. [PubMed] |
| 9. | Ni XC, Xu J, Yi Y, Fu YP, Cai XY, Liu G, Huang JL, Gan W, Qiu SJ. Inflammation-nutrition score predicts prognosis of patients with resectable hepatocellular carcinoma. Int J Clin Oncol. 2019;24:825-835. [PubMed] [DOI] |
| 10. | Jia RR, Zhong JH, Huo RR, Su QB, Xiang X, Zhao FL, Qin ZB, Chen JH, Liao YY, Ma L, Xiang BD, Zhang CY, Li LQ. Correlation between serum prealbumin and prognosis of patients with hepatocellular carcinoma after hepatectomy. J Surg Oncol. 2019;119:794-800. [PubMed] [DOI] |
| 11. | Tilley RE, Holscher T, Belani R, Nieva J, Mackman N. Tissue factor activity is increased in a combined platelet and microparticle sample from cancer patients. Thromb Res. 2008;122:604-609. [PubMed] [DOI] |
| 12. | Marco P, Marco A. [Biomolecular markers in cancer-associated thromboembolism]. Med Clin (Barc). 2015;144 Suppl 1:21-25. [PubMed] [DOI] |
| 13. | Zhang D, Zhou X, Bao W, Chen Y, Cheng L, Qiu G, Sheng L, Ji Y, Du X. Plasma fibrinogen levels are correlated with postoperative distant metastasis and prognosis in esophageal squamous cell carcinoma. Oncotarget. 2015;6:38410-38420. [PubMed] [DOI] |
| 14. | Tang L, Liu K, Wang J, Wang C, Zhao P, Liu J. High preoperative plasma fibrinogen levels are associated with distant metastases and impaired prognosis after curative resection in patients with colorectal cancer. J Surg Oncol. 2010;102:428-432. [PubMed] [DOI] |
| 15. | Fan N, Chen D, Zheng J, Wen Z, Lin P. A novel preoperative plasma indicator to predict prognoses for patients with esophageal squamous cell carcinoma after radical esophagectomy: fibrinogen-to-lymphocyte ratio. Cancer Manag Res. 2019;11:4719-4728. [PubMed] [DOI] |
| 16. | Xu H, Ai JZ, Tan P, Lin TH, Jin X, Gong LN, Lei HR, Yang L, Wei Q. Pretreatment elevated fibrinogen level predicts worse oncologic outcomes in upper tract urothelial carcinoma. Asian J Androl. 2019;. [PubMed] [DOI] |
| 17. | Zhang Y, Xiao G. Prognostic significance of the ratio of fibrinogen and albumin in human malignancies: a meta-analysis. Cancer Manag Res. 2019;11:3381-3393. [PubMed] [DOI] |
| 18. | Kumarasamy C, Sabarimurugan S, Madurantakam RM, Lakhotiya K, Samiappan S, Baxi S, Nachimuthu R, Gothandam KM, Jayaraj R. Prognostic significance of blood inflammatory biomarkers NLR, PLR, and LMR in cancer-A protocol for systematic review and meta-analysis. Medicine (Baltimore). 2019;98:e14834. [PubMed] [DOI] |