修回日期: 2019-06-25
接受日期: 2019-09-13
在线出版日期: 2019-09-28
胃黏膜受到外界刺激出现破损时会形成胃溃疡(gastric mucosa, GM). GM发病因素多样, 包括胃酸分泌合成过多、胃黏膜受损、幽门螺旋杆菌感染等因素. GM临床治愈率可达到85%-95%, 然而GM的复发仍然是临床治疗的挑战之一.
探讨二甲基砜(methylsulfonylmethane, MSM)对乙醇诱导小鼠GM的保护作用.
将小鼠随机分为空白对照组、GM模型组、乙醇联合MSM低、中、高剂量处理组, 每组10只小鼠. 观察各组小鼠胃黏膜组织和溃疡指数、组织病理学改变, 血清中谷胱甘肽(glutathione, GSH)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)、炎症因子白介素-6(Interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)含量及胃组织中结缔组织生长因子(connective tissue growth factor, CTGF)蛋白表达.
MSM可有效减轻小鼠乙醇所致GM病理学变化, 能显著降低GM小鼠胃组织中MDA、GSH、SOD及血清中炎症因子IL-6、TNF-α水平, 增加CTGF蛋白表达水平.
MSM可减轻乙醇所致小鼠急性GM, 对乙醇诱导的急性GM具有保护作用, 其机制可能是通过清除氧自由基, 抑制脂质过氧化, 抑制炎症因子释放, 增加CTGF蛋白的表达, 从而起到对小鼠乙醇型GM的保护作用.
核心提要: 本研究发现二甲基砜(methylsulfonylmethane, MSM)在乙醇所致急性胃溃疡(gastric mucosa, GM)小鼠模型中, 能显著降低胃组织中谷胱甘肽、超氧化物歧化酶、丙二醛含量及血清中炎症因子白介素-6、肿瘤坏死因子-α水平, 并降低胃组织中结缔组织生长因子(connective tissue growth factor, CTGF)蛋白表达. MSM对乙醇所致小鼠急性GM具有保护作用, 其机制可能是通过清除氧自由基, 抑制脂质过氧化, 抑制炎症因子释放, 增加CTGF蛋白的表达.
引文著录: 王婷, 林佳. 二甲基砜对乙醇诱导的小鼠胃溃疡作用的评价. 世界华人消化杂志 2019; 27(18): 1118-1124
Revised: June 25, 2019
Accepted: September 13, 2019
Published online: September 28, 2019
When the gastric mucosa (GM) is damaged by external stimulation, gastric ulcer forms. The pathogenic factors for gastric ulcer are various, including excessive gastric acid secretion, GM damage, Helicobacter pylori infection, and other factors. The clinical cure rate for gastric ulcer can reach 85%-95%. However, the recurrence of gastric ulcer is still one of the challenges in clinical treatment.
To investigate the protective effect of methylsulfonyl-methane (MSM) against ethanol-induced gastric ulcer in mice.
Mice were randomly divided into a blank control group, a gastric ulcer model group, and low-, medium, and high-dose MSM groups, with 10 rats in each group. GM tissue changes and ulcer index, histopathological changes, serum glutathione (GSH), superoxide dismutase (SOD), malondialdehyde (MDA), inflammatory factors [interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α)], and the expression of connective tissue growth factor (CTGF) were observed.
MSM alleviated the pathological changes of ethanol-induced gastric ulcer in mice. MSM reduced the levels of MDA, GSH, and SOD in gastric tissue, decreased the levels of IL-6 and TNF-α in serum of mice with gastric ulcer, and increased the expression of CTGF protein.
MSM can alleviate ethanol-induced acute gastric ulcer in mice via mechanisms possibly related to scavenging oxygen free radicals, inhibiting lipid peroxidation, inhibiting the release of inflammatory factors, and increasing the expression of CTGF protein.
- Citation: Wang T, Lin J. Protective effects of methylsulfonylmethane against ethanol-induced gastric ulcer in mice. Shijie Huaren Xiaohua Zazhi 2019; 27(18): 1118-1124
- URL: https://www.wjgnet.com/1009-3079/full/v27/i18/1118.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i18.1118
胃溃疡(gastric mucosa, GM)是全球范围内发病率和患病率不断上升的主要胃肠道疾病之一. 过度饮酒、饮食不当、压力、吸烟和长期摄入非甾体抗炎药等外源性损害因素都与GM的形成有关. GM是由侵略性因素和防御性因素失衡引起的, 这些因素反过来又能调节涉及中性粒细胞、嗜酸性粒细胞和肥大细胞作用的炎症过程. 过量饮酒可导致胃黏膜损伤. 乙醇破坏胃黏膜血管内皮细胞, 损伤微循环, 引起活性氧自由基和炎性细胞因子的增加, 最终加重胃黏膜缺氧. 因此, 有能力有效保护胃黏膜形成GM的药物应具有减少氧化和炎症应激的能力[1-3].
二甲基砜(methylsulfonylmethane, MSM)是二甲基亚砜(Dimethyl sulfoxide, DMSO)的氧化代谢产物, 也称作二甲砜或者DMSO2, 它是一种广泛存在于水果、蔬菜、谷物、动物和人体内的硫化合物. 已有试验证明, MSM有抗氧化和抗炎的作用, 对于消除人体内产生的氧自由基有非常重要的作用, 同时也有很好的临床治疗前景[4-7]. 然而前国内外尚未报道有关MSM用于GM的研究, 故本试验着眼于MSM在GM中的抗炎、抗氧化机制的研究, 为临床治疗提供一条新的线索.
乙醇购自于东莞万信公司; MSM试剂(货号: A506832)、组织蛋白提取试剂盒(货号: C510003)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)ELISA检测试剂盒(货号: ESK5001-96T)和白介素-6(Interleukin-6, IL-6)ELISA检测试剂盒(货号: C507044)购买自购买自上海生工生物有限公司; 丙二醛(malondialdehyde, MDA)检测试剂盒(货号: SK039)、谷胱甘肽(glutathione, GSH)检测试剂盒(货号: YT297)和超氧化物歧化酶(superoxide dismutase, SOD)检测试剂盒(货号: YT311)购买自北京百奥莱博科技有限公司; GAPDH抗体、结缔组织生长因子(connective tissue growth factor, CTGF)抗体(货号: sc-101586)和HRP标记的Ig-G二抗(货号: sc-2789)购买自美国Santa Cruz公司.
1.2.1 实验动物及分组: 50只ICR雄性小鼠(20-25 g)购买于浙江维通利华实验动物技术有限公司[SCXK(浙)2019-0001], 饲养于台州市食品药品检验所实验动物房[SYXK(浙)2015-0003], 小鼠适应性饲养一周后, 随机分成5组: 空白对照组、GM模型组、乙醇联合MSM低、中、高剂量处理组, 每组10只小鼠. 其中空白对照组每只小鼠进行灌胃0.2 ml生理盐水; GM模型组每只小鼠进行灌胃0.2 ml无水乙醇; 乙醇联合MSM低、中、高剂量处理组每只小鼠进行灌胃乙醇前1.5 h分别2 mg/kg、20 mg/kg和100 mg/kg MSM[6]. 乙醇灌胃4 h后, 麻醉后, 通过小鼠尾静脉每只小鼠取0.5 ml血, 然后处死小鼠, 打开腹腔, 摘除整个胃.
1.2.2 观察计算溃疡指数: 沿胃大弯从幽门处剪开, 同时用生理盐水冲洗, 最后展平, 置于手术台上, 观察溃疡. 按点状溃疡个数或溃疡面积给予计分: (1)点状溃疡(黏膜缺损最大径小于1 mm或者出血性小点, 称为点状溃疡): 每3个点状溃疡计1分; (2)条状出血: 测量条状溃疡的最大长径以及垂直于其的最大短径, 二者的乘积即为溃疡指数. 宽为1 mm者每1 mm计1分; 2 mm宽者每1 mm计2分; 3 mm宽者每1 mm 计3分, 若宽度超过4 mm, 则分段记数, 即黏膜损伤长度的总计分作为溃疡指数(若长度非整数, 小数部分按四舍五入的方法取舍)[8].
1.2.3 小鼠胃病理学检查: 胃组织以5%的多聚甲醛固定, 然后进行石蜡包埋组织. 切成5 μm厚的石蜡切片. 将石蜡切片干燥后, 进行常规脱蜡至水化. 此后, 将切片用苏木精染色5 min, 在自来水中洗涤, 在1%酸性醇中分化, 在1%氨水中变蓝, 再用用伊红复染1 min. 然后将载玻片在流动的自来水中冲洗, 通过浓度逐渐下降的乙醇中脱水, 在二甲苯中处理后, 用中性胶固定. 用Olympus BX51光学显微镜观察载玻片并拍照, 以评估小鼠胃黏膜病理改变.
1.2.4 小鼠胃组织中MDA、GSH、SOD检测: 取小鼠胃组织称质量, 按质量(g): 体积(mL) = 1:9加入冰冻生理盐水, 冰水浴下机械匀浆, 2500 r/min, 离心10 min, 取上清液, 制成10%组织匀浆. 根据试剂盒说明测定均浆中MDA含量、GSH、SOD活力. 通过酶标仪分别测量532 nm、412 nm、560 nm处的吸光度. 按照预制的标准曲线计算MDA含量和GSH、SOD活性. MDA含量表示为nmol/mg. GSH、SOD活性表示为UI/mg.
1.2.5 小鼠血清中IL-6、TNF-α检测: 通过ELISA试剂盒检测IL-6和TNF-α水平. 取小鼠尾静脉取0.5 ml血, 以2000 rpm离心15 min, 分离血清, 根据制造商的说明, 使用ELISA试剂盒测定血清中IL-6和TNF-α. 每个反应孔中加入抗体缓冲液, 4 ℃过夜, 次日加入血清样品100 μL, 37 ℃孵育1 h. 洗涤后加入酶标抗体, 37 ℃孵育1 h. 加入底物溶液, 37 ℃反应30 min, 最后于加入硫酸终止反应. 酶标仪中450 nm检测OD值. 按照预制的标准曲线计算IL-6和TNF-α水平. IL-6和TNF-α水平表示为pg/ml.
1.2.6 Western blot: 利用组织蛋白提取试剂盒萃取胃组织蛋白, 利用BCA法将各组蛋白样品定量至相同浓度后, 取30 μg蛋白进行10%的SDS-聚丙烯酰胺凝胶电泳并转移至甲醇预活化的PVDF膜上. 然后用5%脱脂奶粉在室温下封闭样品2 h, 并在4 ℃用CTGF抗体一抗(1:500)孵育过夜. 用TBST冲洗膜3次/5 min, 再与辣根过氧化物酶偶联的二抗反应, 增强化学发光法(ECL)发光试剂显影, 以GAPDH为内部参照, 利用灰度成像软件(UVP, UK)测定主带的光密度值以计算CTGF蛋白表达水平.
统计学处理 采用SPSS 13.0统计软件进行数据分析. 数据以mean±SD表示, 多组间两两比较采用方差分析后LSD-t检验. 以P<0.05为差异有统计学意义.
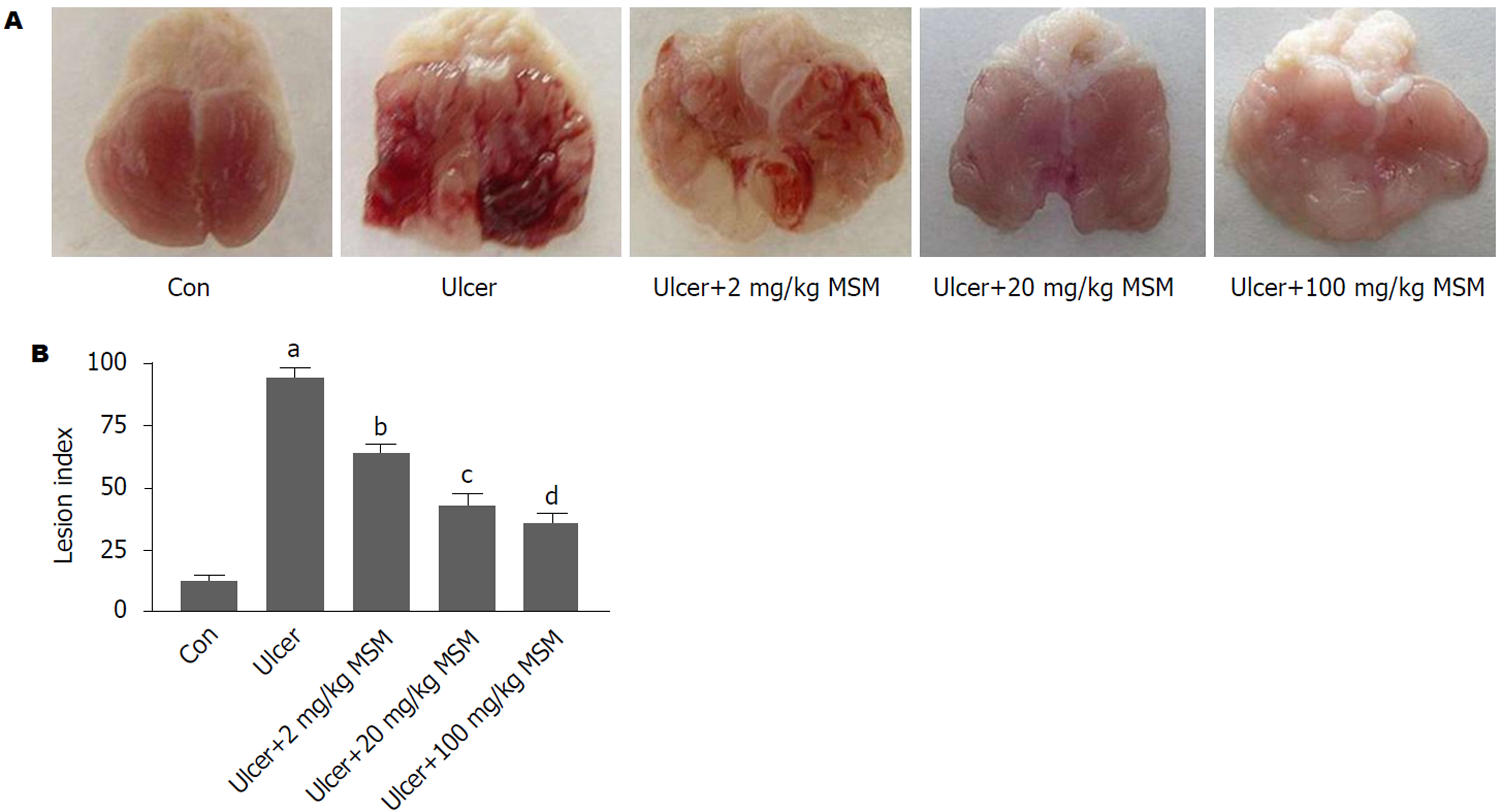
如图1A所示, 空白对照组小鼠的胃黏膜光滑、平整; GM模型组胃黏膜可观察到不同程度的损伤, 黏膜明显出血、水肿, 大面积糜烂, 表面附着大块血痂; 乙醇联合MSM低、中、高剂量处理组仅有轻度胃黏膜水肿, 未见明显出血和糜烂, 其中高剂量组作用最明显. 如图1B所示, 与空白对照组比较, GM模型组的小鼠的胃黏膜溃疡指数增加明显(P<0.001); 与GM模型组比较, 乙醇联合MSM低、中、高剂量处理组的溃疡指数显著降低(P<0.05; P<0.01; P<0.001), 并且高剂量MSM对乙醇损伤胃黏膜的保护作用最显著(P<0.001).
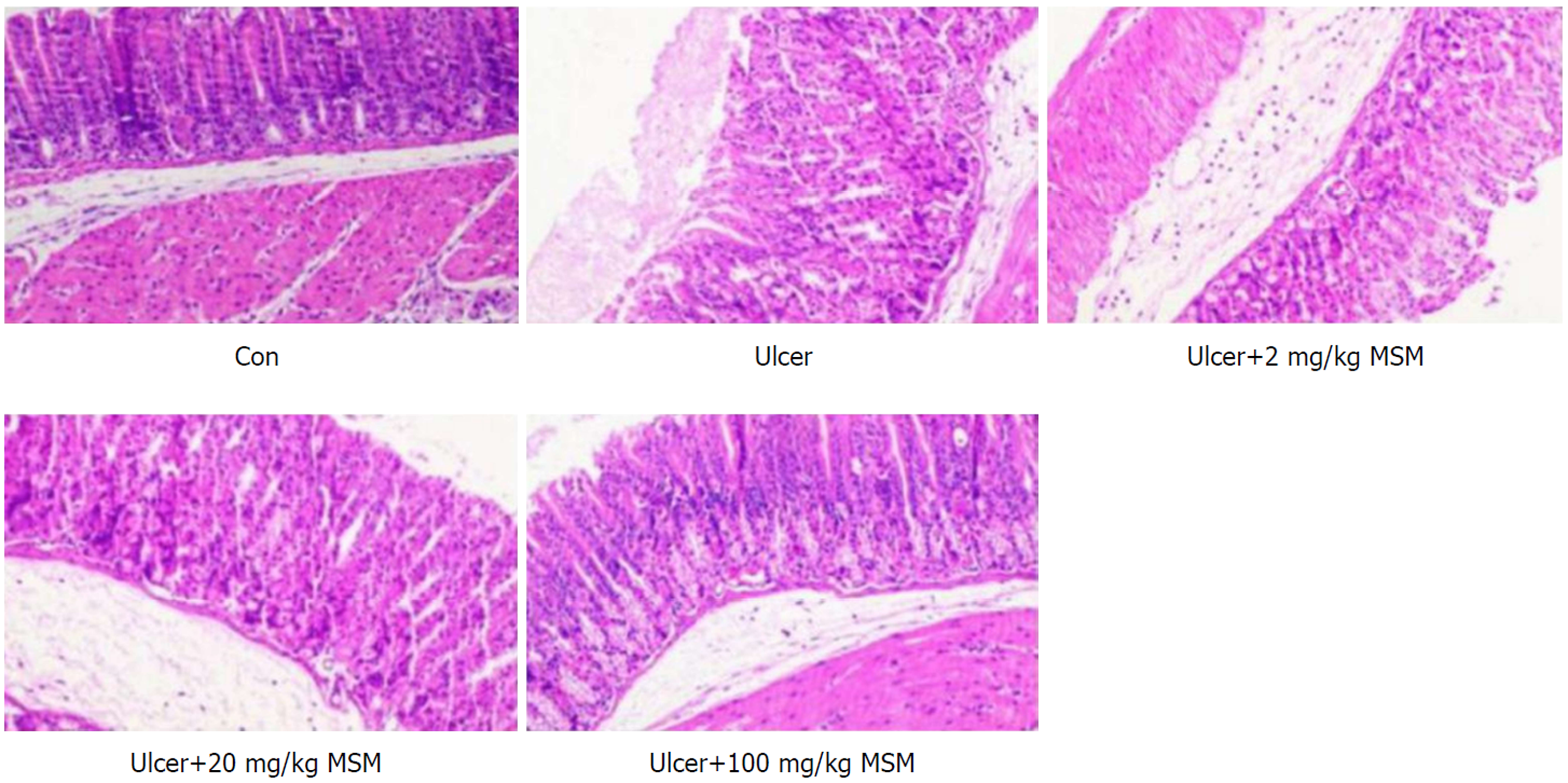
HE结果显示, 空白对照组小鼠胃黏膜上皮完整, 连续性好, 腺体排列整齐, 黏膜层组织结构层次清楚; GM模型组的胃组织有很高程度的出血性损伤、水肿、上皮细胞丢失和炎症细胞浸润; 与GM模型组相比, 用低、中、高剂量MSM预处理对胃组织显示出较好的保护作用, 表现为水肿减轻、炎性细胞浸润减少(图2).
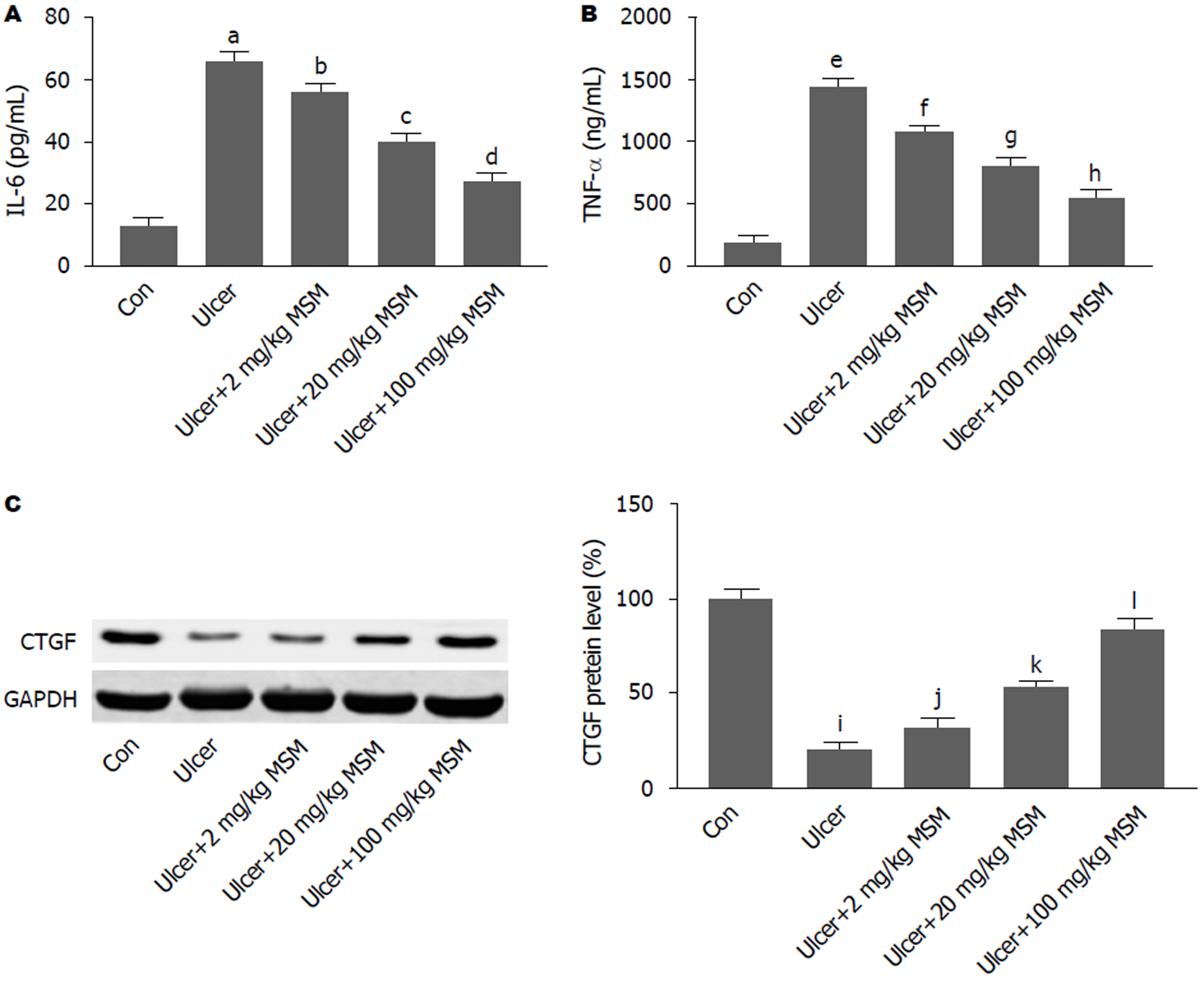
与空白对照组相比, GM模型组血清中IL-6和TNF-α含量显著升高(P<0.001). 与GM模型组比较, 乙醇联合低、中、高剂量MSM处理组血清液中IL-6和TNF-α含量显著降低(P<0.05; P<0.01; P<0.001), 其中乙醇联合高剂量MSM处理组降低最为显著(P<0.001), 结果见图3A-B. 如图3C所示, 与空白组相比, GM模型组小鼠胃组织中CTGF蛋白表达水平显著降低(P<0.001); 与GM模型组比较, 乙醇联合低、中、高剂量MSM处理组小鼠胃组织中CTGF表达显著增加(P<0.05; P<0.01; P<0.001).
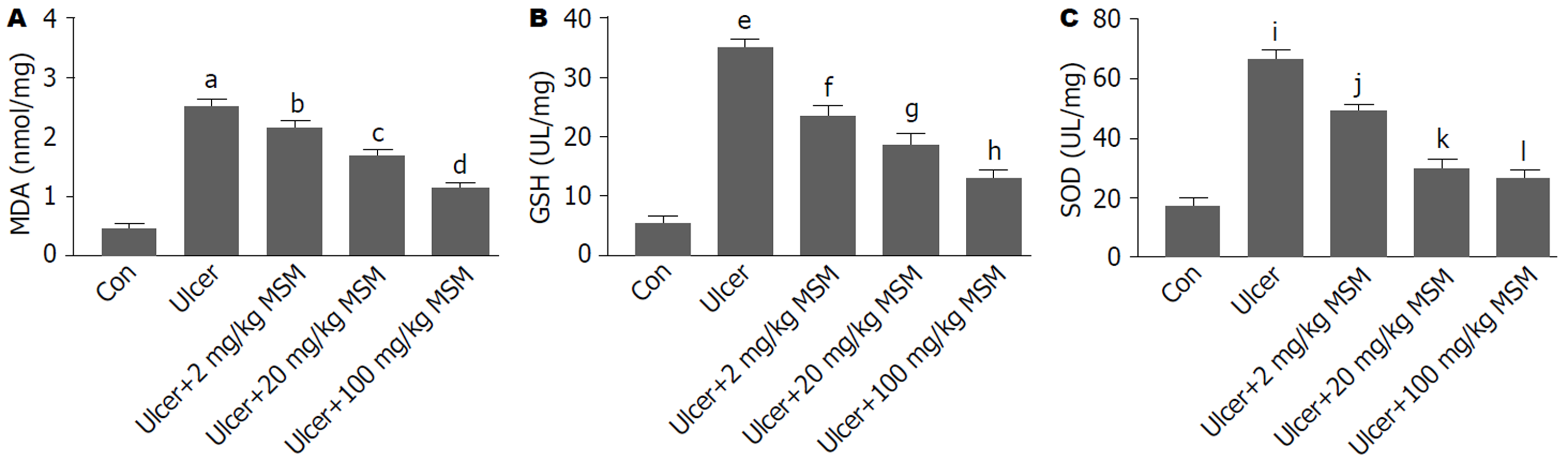
如图4所示, 与空白组相比, GM模型组小鼠MDA、GSH、SOD含量较空白组升高(P<0.001). 与GM模型组比较, MDA、GSH和SOD在乙醇联合低、中、高剂量MSM处理组显著降低(P<0.05; P<0.01; P<0.001), 其中高剂量MSM组MDA、GSH、SOD降低最为显著(P<0.001), 以上结果说明MSM能降低乙醇引起急性GM小鼠胃组织中的MDA、GSH、SOD含量.
GM是一种病因众多的疾病, 病因包括自由基、乙醇、胃酸等, 其中过度饮酒是GM的重要因素. 乙醇被认为是通过影响胃黏膜的保护因子(包括减少粘液生成和破坏黏膜内血液循环)从而造成胃损伤. 近几年来, 由于H2受体拮抗剂和质子泵抑制剂被广泛应用于临床, GM的近期愈合率得到了明显改善, 但这些药物的副作用以及停药后GM的复发率较高仍是尚未解决的问题. 而传统中药则在减少复发、改善GM愈合情况、增强胃黏膜防御力等方面发挥出了优势[9]. MSM是一种天然存在的有机硫化物, 在牛奶和肉类中含量较高, 具有广泛的生物效应, 已经成为一种流行的膳食补充剂用于多种用途[5,10]. MSM对人体的健康发挥重要作用, 为抗氧化剂谷胱甘肽提供硫, 因此对消除人体产生的氧自由基起着十分重要的作用[11,12]. 本实验结果显示模型组溃疡面积显著高于空白对照组, 表明急性GM模型造模成功. 低、中、高MSM剂量组能显著减少乙醇所致小鼠急性GM的面积, 表明MSM具有一定的胃保护作用.
小鼠通过灌胃无水乙醇来诱发溃疡, 导致其机体的抗氧化能力下降, 形成的自由基增多, 并使生物膜中不饱和脂肪酸过氧化, 而形成了多种脂质过氧化物, 脂质过氧化物破坏溶酶体膜和线粒体, 形成溃疡, 最终造成细胞的死亡[9,13]. 由于氧自由基的增多, 产生相应的脂质过氧化物MDA, MDA能与核酸、蛋白质等生物大分子结合, 最终造成细胞的损伤. 人体内有完善的自由基清除系统, GSH是体内重要的抗氧化剂和自由基清除剂, 而SOD是机体主要的抗氧化酶, 是清除自由基的多种酶之一, 所以, 这些指标可以反映机体的抗氧化能力和清除自由基的能力[14,15]. GM模型组小鼠胃组织MDA、GSH、SOD水平明显高于空白对照组, 说明GM小鼠胃组织存在氧化应激损伤. 而乙醇联合MSM处理组GM小鼠胃组织中MDA、GSH、SOD水平有所降低, 说明MSM对降低小鼠胃组织氧化应激水平, 促进对自由基的清除作用, 抑制脂质过氧化产物的形成, 减轻氧自由基对胃组织的损害作用效果明显. 炎症细胞因子IL-6, TNF-α等的大量合成与释放会造成炎症反应. GM模型组小鼠血清中IL-6, TNF-α水平明显高于空白对照组, 而乙醇联合MSM处理组GM小鼠血清中IL-6, TNF-α水平有所降低, 说明MSM可以抑制炎症因子 IL-6、TNF-α等的释放, 进而减轻其对胃黏膜的损伤. CTGF广泛存在于人类多种组织和器官中, 如结缔组织、心脏、脑、肝脏、胰腺和肌肉等, 与细胞增殖、分化、凋亡、伤口愈合等多种生理活动有关. 研究表明, CTGF参与了GM的发生与愈合过程, CTGF可能通过诱导成纤维细胞的增殖和细胞外基质的合成, 参与结缔组织的再生、肉芽组织的形成和机化; 另一方面, CTGF可能通过诱导血管内皮细胞的增殖, 促进微血管的形成, 参与结构重建, 最终有助于GM的愈合[16,17]. 本实验结果表明, MSM通过增加小鼠胃组织中CTGF蛋白的表达, 起到促进GM的愈合的作用.
综上所述, MSM可能通过清除氧自由基, 抑制脂质过氧化, 抑制炎症因子释放, 上调CTGF蛋白的表达, 起到对小鼠乙醇型GM的保护作用.
胃溃疡(gastric mucosa, GM)是胃内壁黏膜或更深层发生溃疡而引起的疾病, 多发于40-60岁男性患者. GM发病因素多样, 目前临床多主张以联合用药治疗, 例如抑酸治疗、抗幽门螺杆菌治疗和保护胃黏膜治疗. GM临床治愈率可达到85%-95%, 然而GM的复发仍然是临床治疗的挑战之一.
研究新型的GM治疗药物, 为临床治疗提供新的思路和手段.
研究MSM对GM中的治疗作用以及可能的机制.
通过乙醇诱导小鼠GM模型, 观察小鼠胃黏膜组织和溃疡指数变化, 通过HE染色研究组织病理学改变, 通过ELISA实验研究了小鼠胃组织中丙二醛(malondialdehyde, MDA)、谷胱甘肽(glutathione, GSH)、超氧化物歧化酶(superoxide dismutase, SOD)及血清中炎症因子白介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的表达水平, 通过蛋白免疫印迹实验研究了结缔组织生长因子(connective tissue growth factor, CTGF)的表达变化.
MSM可改善乙醇引起的胃损伤, 降低胃黏膜水肿, 小鼠未表现出明显出血和糜烂. MSM能显著降低GM小鼠胃组织中MDA、GSH、SOD及血清中炎症因子IL-6、TNF-α水平, 增加CTGF蛋白表达水平.
MSM可通过清除氧自由基, 抑制脂质过氧化, 抑制炎症因子释放对乙醇诱导小鼠急性GM起到保护作用.
该研究提供了MSM治疗GM以及其可能机制的新的见解. 这项研究的结果有助于临床GM治疗提供新的治疗手段, 但是作为未来的临床治疗推广, 其安全性和可靠性仍然需要深入的研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:刘继红
| 4. | Amirshahrokhi K, Khalili AR. Methylsulfonylmethane is effective against gastric mucosal injury. Eur J Pharmacol. 2017;811:240-248. [PubMed] [DOI] |
| 5. | Butawan M, Benjamin RL, Bloomer RJ. Methylsulfonylmethane: Applications and Safety of a Novel Dietary Supplement. Nutrients. 2017;9:E290. [PubMed] [DOI] |
| 6. | Withee ED, Tippens KM, Dehen R, Tibbitts D, Hanes D, Zwickey H. Effects of Methylsulfonylmethane (MSM) on exercise-induced oxidative stress, muscle damage, and pain following a half-marathon: a double-blind, randomized, placebo-controlled trial. J Int Soc Sports Nutr. 2017;14:24. [PubMed] [DOI] |
| 7. | Miller LE. Methylsulfonylmethane decreases inflammatory response to tumor necrosis factor-α in cardiac cells. Am J Cardiovasc Dis. 2018;8:31-38. [PubMed] |
| 10. | Coppa M, Martin B, Pradel P, Leotta B, Priolo A, Vasta V. Effect of a hay-based diet or different upland grazing systems on milk volatile compounds. J Agric Food Chem. 2011;59:4947-4954. [PubMed] [DOI] |
| 11. | Nakhostin-Roohi B, Barmaki S, Khoshkhahesh F, Bohlooli S. Effect of chronic supplementation with methylsulfonylmethane on oxidative stress following acute exercise in untrained healthy men. J Pharm Pharmacol. 2011;63:1290-1294. [PubMed] [DOI] |
| 12. | Marañón G, Muñoz-Escassi B, Manley W, García C, Cayado P, de la Muela MS, Olábarri B, León R, Vara E. The effect of methyl sulphonyl methane supplementation on biomarkers of oxidative stress in sport horses following jumping exercise. Acta Vet Scand. 2008;50:45. [PubMed] [DOI] |
| 14. | Chung SS, Kim M, Youn BS, Lee NS, Park JW, Lee IK, Lee YS, Kim JB, Cho YM, Lee HK, Park KS. Glutathione peroxidase 3 mediates the antioxidant effect of peroxisome proliferator-activated receptor gamma in human skeletal muscle cells. Mol Cell Biol. 2009;29:20-30. [PubMed] [DOI] |
| 15. | Kono H, Asakawa M, Fujii H, Maki A, Amemiya H, Yamamoto M, Matsuda M, Matsumoto Y. Edaravone, a novel free radical scavenger, prevents liver injury and mortality in rats administered endotoxin. J Pharmacol Exp Ther. 2003;307:74-82. [PubMed] [DOI] |