修回日期: 2019-07-26
接受日期: 2019-07-26
在线出版日期: 2019-08-08
急性胰腺炎(acute pancreatitis, AP)引起的急性炎症对人们健康的危害性极大, 严重时会危及生命. 其发病机制复杂, 尚未完全清楚, 研究发现miRNA参与了AP的发病过程. 研究发现miR-181a-5p可抑制癌细胞迁移、侵袭和血管生成; miR-181a-5p还能抑制胃癌细胞增殖、侵袭, 转移和上皮间充质转化. 抑制miR-181a-5p表达可通过负向靶向INPP5A抑制细胞增殖和侵袭, 增强宫颈癌细胞凋亡. miR-181a可抑制胰腺癌细胞系的生长、减少迁移, 增加凋亡. 但miR-181a-5p在AP的增殖凋亡中的影响及作用机制尚不清楚.
研究miR-181a-5p对AP腺泡细胞损伤的影响及潜在的作用机制.
用100 nmol/L的雨蛙肽处理大鼠胰腺腺泡AR42J和MPC-83构建AP模型, 设置Con组、Caerulein组、miR-NC组(转染miR-NC)、miR-181a-5p组(转染miR-181a-5p mimics)、anti-miR-NC组(转染anti-miR-NC)、anti-miR-181a-5p组(转染anti-miR-181a-5p)、Caerulein+anti-miR-NC组(转染anti-miR-NC后进行Caerulein处理)、Caerulein+anti-miR-181a-5p组(转染anti-miR-181a-5p后进行Caerulein处)、Caerulein+pcDNA组(转染pcDNA后进行Caerulein处理)、Caerulein+pcDNA-PIAS1组(转染pcDNA-PIAS1后进行Caerulein处理)、Caerulein+anti-miR-181a-5p+si-NC组(anti-miR-181a-5p和si-NC共转染后进行Caerulein处理)、Caerulein+anti-miR-181a-5p+si-PIAS1组(anti-miR-181a-5p和si-PIAS1共转染后进行Caerulein处理), 用脂质体法转染至AR42J和MPC-83细胞. 酶联免疫吸附试验法检测雨蛙肽处理AR42J和MPC-83细胞的TNF-α和IL-6的表达; qRT-PCR检测AR42J和MPC-83细胞中miR-181a-5p、PIAS1 mRNA的表达水平; Western Blot检测蛋白表达; 流式细胞术检测细胞凋亡; 双荧光素酶报告基因检测实验检测荧光活性.
雨蛙肽处理AR42J和MPC-83细胞后, TNF-α和IL-6的表达显著升高; miR-181a-5p的表达水平显著升高; PIAS1 mRNA和蛋白的表达水平显著降低. miR-181a-5p抑制表达和PIAS1过表达抑制TNF-α和IL-6的表达, 抑制细胞凋亡. miR-181a-5p靶向负调控PIAS1; 抑制PIAS1表达逆转了抑制miR-181a-5p对雨蛙肽处理AR42J和MPC-83细胞的凋亡抑制作用.
抑制miR-181a-5p表达可以抑制雨蛙肽诱导的AP腺泡细胞损伤, 其机制可能与靶向调控PIAS1有关. 可为AP诊断和治疗提供新靶点和新思路.
核心提要: 抑制miR-181a-5p表达可以抑制雨蛙肽诱导的急性胰腺炎腺泡细胞损伤, 其机制可能与靶向调控PIAS1有关. 可为急性胰腺炎诊断和治疗提供新靶点和新思路.
引文著录: 王晓华, 陈铁江, 楼一波. miR-181a-5p靶向PIAS1对雨蛙肽诱导的急性胰腺炎腺泡细胞损伤的影响. 世界华人消化杂志 2019; 27(15): 927-935
Revised: July 26, 2019
Accepted: July 26, 2019
Published online: August 8, 2019
Acute inflammation caused by acute pancreatitis (AP) is extremely harmful to people's health and can be life-threatening in severe cases. Its pathogenesis is complex and not fully understood. MiRNAs have been involved in the pathogenesis of AP. It was found that miR-181a-5p can inhibit cancer cell migration, invasion, and angiogenesis. MiR-181a-5p can also inhibit gastric cancer cell proliferation, invasion, metastasis, and epithelial mesenchymal transition. Inhibition of miR-181a-5p expression inhibits cell proliferation and invasion by negatively targeting INPP5A, and enhances apoptosis of cervical cancer cells. In addition, miR-181a inhibits the growth of pancreatic cancer cell lines, reduces their migration, and increases their apoptosis. However, the effect and mechanism of miR-181a-5p on the proliferation and apoptosis of AP are still unclear.
To investigate the effect of miR-181a-5p on acinar cell injury in AP and the potential mechanism involved.
An AP model was constructed by treating rat pancreatic acinar AR42J and MPC-83 cells with 100 nmol/L caerulein. Different groups of cells were included: Con group (normal cells), caerulein group (treated with caerulein), miR-NC group (transfected with miR-NC), miR-181a-5p group (transfected with miR-181a-5p mimic), anti-miR-NC group (transfected with anti-miR-NC), anti-miR-181a-5p group (transfected with anti-miR-181a-5p), caerulein + anti-miR-NC group (caerulein treatment after transfection with anti-miR-NC), caerulein + anti-miR-181a-5p group (caerulein treatment after transfection with anti-miR-181a-5p), caerulein + pcDNA group (caerulein treatment after transfection with pcDNA), caerulein + pcDNA-PIAS1 group (caerulein treatment after transfection with pcDNA-PIAS1), caerulein + anti-miR-181a-5p + si-NC group (caerulein treatment after anti-miR-181a-5p and si-NC co-transfection), and caerulein + anti-miR-181a-5p + si-PIAS1 group (caerulein treatment after anti-miR-181a-5p and si-PIAS1 co-transfection). Cell transfections were performed by the liposome method. The expression of TNF-α and IL-6 in AR42J and MPC-83 cells treated with caerulein was detected by enzyme-linked immunosorbent assay. qRT-PCR was used to detect miR-181a-5p and PIAS1 mRNA in AR42J and MPC-83 cells treated with cerulein. Western blot was used to detect protein expression. Flow cytometry was used to detect apoptosis. Dual luciferase reporter gene assay was used to detect fluorescence activity.
After treatment of AR42J and MPC-83 cells with caerulein, the expression of TNF-α and IL-6 was significantly increased, the expression level of miR-181a-5p was significantly increased, and the expression of PIAS1 mRNA and protein was significantly decreased. Inhibition of miR-181a-5p expression and overexpression of PIAS1 inhibited the expression of TNF-α and IL-6 and inhibited cell apoptosis. MiR-181a-5p negatively regulated the expression of PIAS1, and inhibition of PIAS1 expression reversed the inhibitory effect of miR-181a-5p on apoptosis of AR42J and MPC-83 cells treated with caerulein.
Inhibition of miR-181a-5p expression inhibits caerulein-induced AP-induced acinar cell injury via mechanisms that may be related to the targeted regulation of PIAS1. Our findings may provide new targets and new ideas for the diagnosis and treatment of AP.
- Citation: Wang XH, Chen TT, Lou YB. Effect of miR-181a-5p targeting PIAS1 on cerulein-induced acute pancreatitis-induced acinar cell injury. Shijie Huaren Xiaohua Zazhi 2019; 27(15): 927-935
- URL: https://www.wjgnet.com/1009-3079/full/v27/i15/927.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i15.927
急性胰腺炎(acute pancreatitis, AP)是体内胰酶被激活并致胰腺自身消化, 继以胰腺局部炎症反应为主要特征的疾病, 其病情复杂多变, 严重时可发生全身炎性反应综合征[1]. 研究其发病机制对于靶向特异性治疗具有重要意义. 多种miRNAs在AP中异常表达, 与AP的发生发展相关, 研究其在AP发病机制中的作用有助于为AP的诊断和治疗提供新的思路和方法[2]. 研究发现miR-181a在脑缺血组织中过表达, 可以促进脑组织细胞凋亡和炎症的发生, 加重神经损伤的严重程度[3]; 且miR-181a能抑制胰腺癌细胞系的生长、增加细胞凋亡、减少迁移[4], 但miR-181a-5p在AP中的具体作用机制尚未清楚. 信号转导与转录激活子(signal transducer and activators of transcription, STAT)活化抑制蛋白1(protein inhibitor of activated signal transducer and activators of transcription 1, PIAS1)是一种特异性抑制蛋白, 调控肿瘤的发生发展, 可作为肿瘤的靶向治疗靶点[5]. 且研究发现PIAS1可抑制炎症微环境诱导的胃癌上皮-间质转化, 抑制肿瘤侵袭与转移[6]. PIAS1可降低血气屏障通透性, 抑制炎性细胞外渗, 进而改善急性坏死性胰腺炎继发急性肺损伤[7]. 本文旨在研究miR-181a-5p对雨蛙肽诱导的AP腺泡细胞损伤的影响及其与PIAS1的关系, 以及其作用机制是否与PIAS1有关. 将为AP的诊断和治疗提供新思路和新靶点.
胰腺腺泡细胞AR42J、MPC-38购自中国科学院上海细胞库. AP患者和健康者血清标本取自当地医院; 雨蛙素购自美国Sigma公司; 胎牛血清、RPMI 1640培养基均购自美国Gibco公司; RNA提取试剂盒、反转录试剂盒和qPCR试剂盒购自日本Takara公司; 酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)检测试剂盒购自上海联科生物技术有限公司; Western Blot试剂盒、BCA试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒购自碧云天生物技术研究所; 双荧光素酶报告基因检测试剂盒购自美国Promega公司; LipofectamineTM 2000转染试剂盒购自美国Invitrogen公司; 流式细胞仪购自赛默飞公司; 兔抗人Bax多克隆抗体、兔抗人Bcl-2多克隆抗体、兔抗人cleaved-caspase-3多克隆抗体、兔抗人PIAS1多克隆抗体、兔抗人GAPDH多克隆抗体、山羊抗兔IgG-辣根过氧化物酶(horseradish peroxidase,HRP)均购自北京博奥森生物科技有限公司.
1.2.1 细胞培养及AP建模: 大鼠胰腺腺泡AR42J、MPC-38细胞常规培养于含10% FBS的RPMI 1640培养基, 置于37 ℃, 含5%CO2恒温箱培养. 每2-3 d传代一次. 造模前1 d取AR42J细胞接种于6孔板上, 培养24 h后加入100 nm/L的雨蛙素, 震荡混匀后继续培养6 h, 收集备用.
1.2.2 细胞分组和转染: 取常规培养的大鼠胰腺腺泡AR42J、MPC-38细胞消化后接种于96孔板中, 待细胞融合生长至80%时进行实验, 正常培养的大鼠胰腺腺泡AR42J、MPC-38细胞添加100 nmol/L雨蛙素培养6 h作为Caerulein组、不做任何处理的AR42J、MPC-38细胞作为对照(Con)组; 将miR-NC、miR-181a-5p、anti-miR-NC和anti-miR-181a-5p质粒载体转染至常规培养的大鼠胰腺腺泡AR42J、MPC-38细胞中, 分别记为miR-NC组、miR-181a-5p组、anti-miR-NC组和anti-miR-181a-5p组. AP患者记为AP组, 健康者记为Healthy组.
将anti-miR-NC、anti-miR-181a-5p、pcDNA、pcDNA-PIAS1转染至大鼠胰腺腺泡AR42J、MPC-38细胞中, nti-miR-181a-5p分别与si-NC和si-PIAS1共转染至大鼠胰腺腺泡AR42J、MPC-38细胞中, 然后用100 nmol/L雨蛙素刺激培养6 h, 分别记为Caerulein+anti-miR-NC组、Caerulein+anti-miR-181a-5p组、Caerulein+pcDNA组、Caerulein+pcDNA-PIAS1组、Caerulein+anti-miR-181a-5p+si-NC组、Caerulein+anti-miR-181a-5p+si-PIAS1组, 转染按照LipofectamineTM 2000试剂盒进行操作.
1.2.3 ELISA法检测TNF-α和IL-6的表达: 取雨蛙素处理后的各组细胞, 离心取上清, 按ELISA试剂盒说明书进行检测.
1.2.4 qRT-PCR分析miR-181a-5p和PIAS1 mRNA表达水平: 按照Trizol说明书提取总RNA, 用反转录试剂盒逆转录成cDNA, 按照AceQ qPCR SYBR® Green Mix说明书进行qRT-PCR方法扩增. 循环条件为95 ℃ 30 s, 60 ℃ 30 s; 72 ℃ 30 s, 共40个循环; 60 ℃延长5 min. 相对表达量采用2-△△Ct法计算.
1.2.5 Western Blot检测蛋白表达: 提取各组细胞蛋白, 用BCA蛋白定量试剂盒进行蛋白定量. 各组蛋白上样量60 μg, SDS-PAGE后, 经电转将蛋白转移至PVDF膜上. 用5%脱脂牛奶室温封闭90 min, 分别加入相应的一抗: 兔抗人Bax多克隆抗体、兔抗人Bcl-2多克隆抗体、兔抗人cleaved-caspase-3多克隆抗体、兔抗人PIAS1多克隆抗体、兔抗人GAPDH多克隆抗体, 4 ℃孵育过夜, PBS洗涤3次, 每次5 min; 再加入相对应的二抗HRP, 室温孵育2 h, PBS洗涤3次, 每次10 min, 后在暗室中曝光显影, 再浸入定影, 最后洗去残液晾干, 将胶片用Quantity One凝胶分析软件处理, 测定各组蛋白条带的吸光度, 以目的条带和GAPDH条带的比值作为蛋白表达水平.
1.2.6 流式细胞术检测细胞凋亡: 用不含EDTA的胰酶消化细胞, 离心收集各组细胞, PBS漂洗2次, 加结合缓冲液重悬细胞. 依据试剂盒说明书, 先加入5 μL的Annexin V-FITC混匀后再加入5 μL的PI避光孵育15 min. 流式细胞仪检测激发波长488 nm和发射波长530 nm处的荧光强度, 实验重复3次.
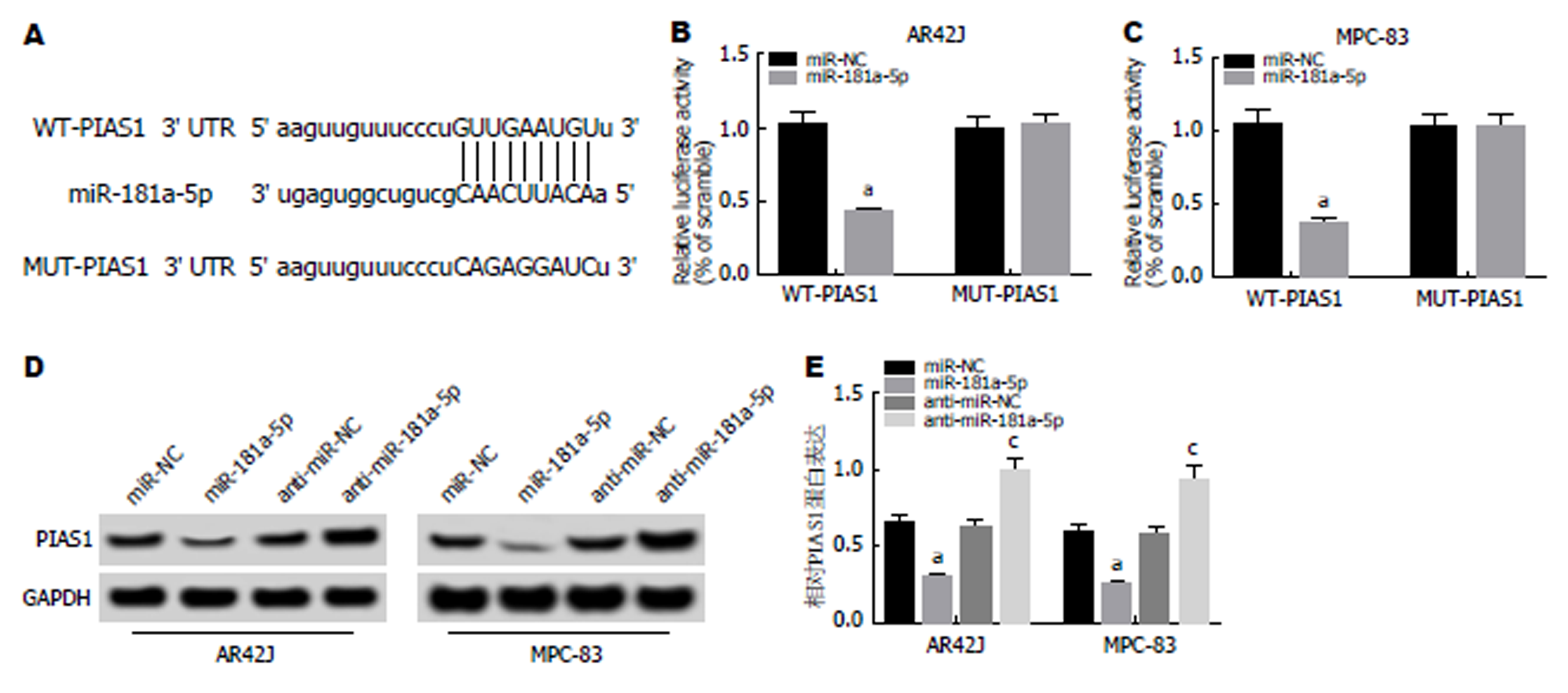
1.2.7 荧光素酶报告基因检测实验检测miR-181a-5p对PIAS1的靶向调控: TargetScan数据库显示PIAS1 3′UTR区域有miR-181a-5p结合位点. 构建野生型和突变型基因靶点PIAS1的3′UTR-荧光素酶表达载体(WT-PIAS1和MUT-PIAS1), 取对数生长期大鼠胰腺腺泡AR42J、MPC-38细胞接种于24孔板(5×104个/孔), 待细胞生长至80%融合时, 用LipofectamineTM 2000将WT-PIAS1和MUT-PIAS1组细胞分别转染miR-NC和miR-181a-5p. 依据说明书要求, 使用荧光素酶报告基因检测仪进行双荧光素酶报告实验测定. 实验结果以荧光素酶活性和Renilla活性的比值进行统计学分析. 实验重复3次.
统计学处理 采用SPSS 20.00进行统计学分析. 计量资料以mean±SD表示, 两组比较行t检验, 多组间比较采用单因素方差分析, 以P<0.05表示差异有统计学意义.
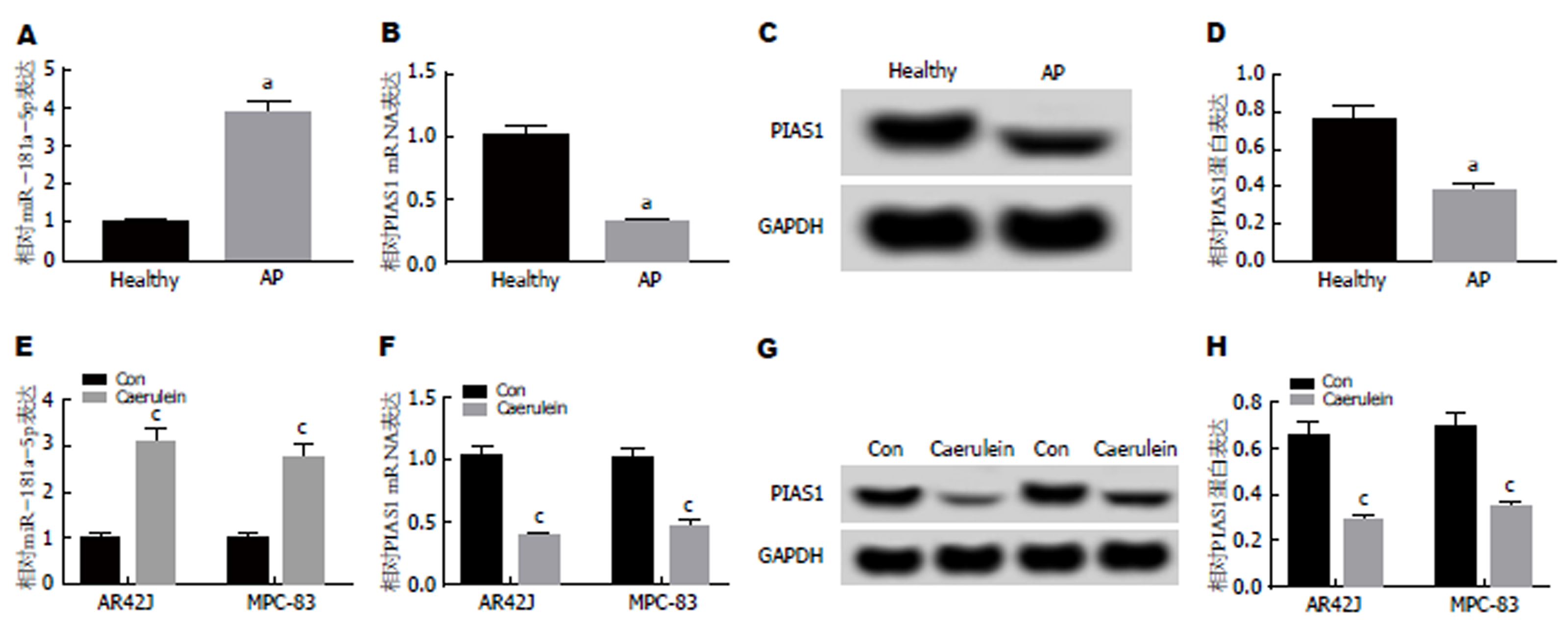
qRT-PCR检测结果(图1A, B)显示, 与健康组相比, AP患者血清中miR-181a-5p的表达水平显著升高, PIAS1 mRNA的表达水平显著降低; 与对照组相比, 雨蛙肽处理的AR42J细胞和MPC-38细胞中miR-181a-5p的表达水平显著升高, PIAS1 mRNA的表达水平显著下降(P<0.05). Western Blot检测结果(图1C, D)显示, 与健康组相比, AP患者血清中PIAS1蛋白的表达水平显著降低; 与对照组相比, 雨蛙肽处理后AR42J细胞和MPC-38细胞中PIAS1蛋白的表达水平显著下降(P<0.05). 可见, 在雨蛙肽处理的AR42J和MPC-38细胞以及AP患者血清中miR-181a-5p高表达, PIAS1低表达.
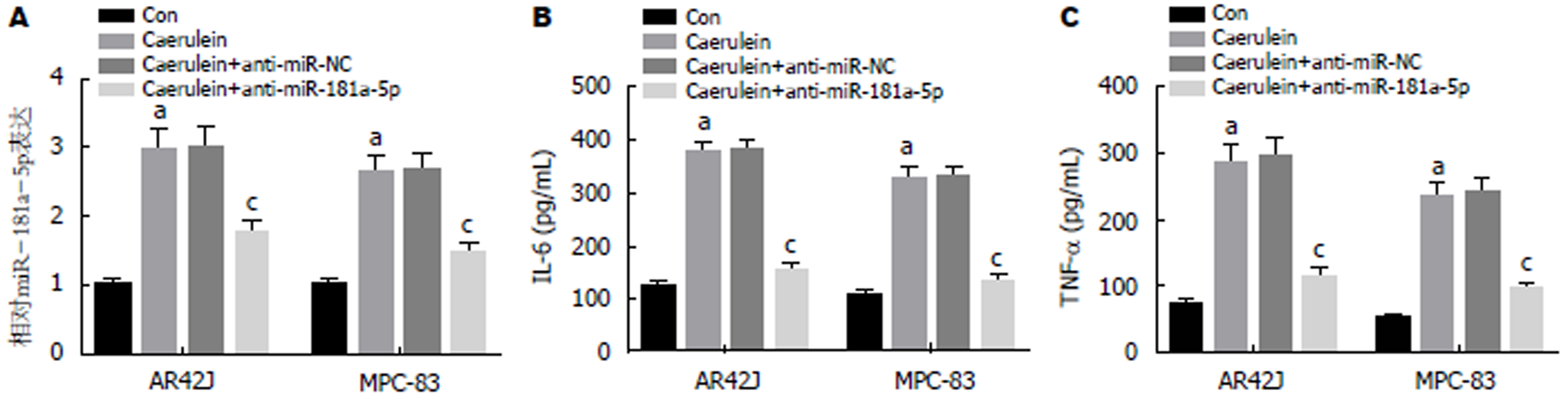
qRT-PCR检测结果(图2A)显示, 与Con组相比, Caerulein组AR42J和MPC-83细胞中miR-181a-5p的表达水平显著升高, 与Caerulein+anti-miR-NC组相比, Caerulein+anti-miR-181a-5p组的miR-181a-5p表达水平显著下降(P<0.05). ELISA法检测结果(图2B, C)显示, 与Con组相比, Caerulein组AR42J和MPC-83细胞中IL-6和TNF-α的含量显著升高; 与Caerulein+anti-miR-NC组相比, Caerulein+anti-miR-181a-5p组IL-6和TNF-α的含量显著降低(P<0.05). 可见, 抑制miR-181a-5p表达抑制雨蛙肽诱导的AR42J和MPC-83细胞炎症因子的表达.
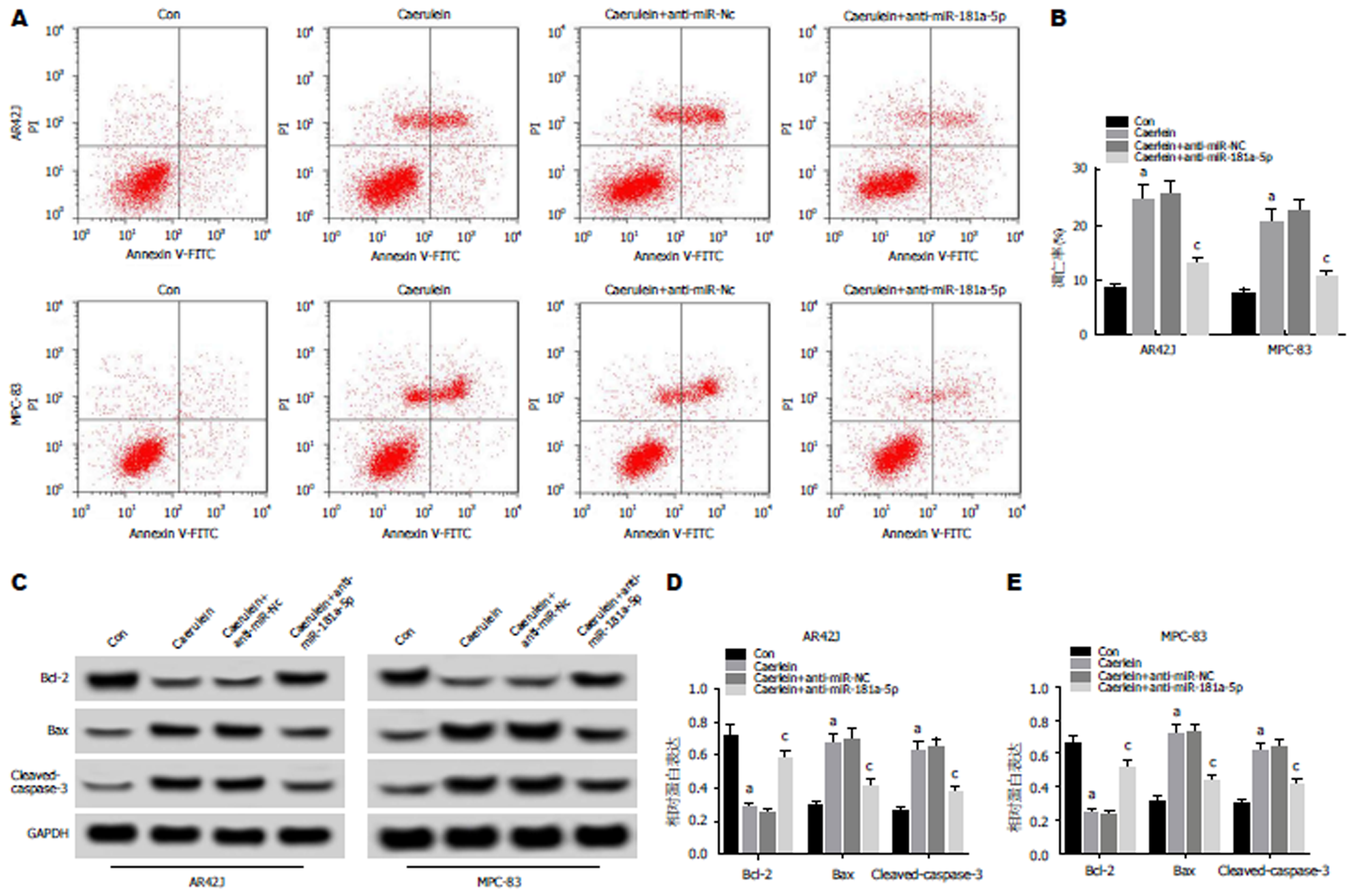
流式细胞仪检测结果(图3A, B)显示, 与Con组相比, Caerulein组AR42J和MPC-83细胞凋亡率显著升高, 与Caerulein+anti-miR-NC组相比, Caerulein+anti-miR-181a-5p组AR42J和MPC-83细胞凋亡率显著降低(P<0.05). Western Blot检测结果(图3C, D, E)显示, 与Con组相比, Caerulein组AR42J和MPC-83细胞中Bax、Caspase-3蛋白的表达水平显著升高, Bcl-2蛋白的表达水平显著降低; 与Caerulein+anti-miR-NC组相比, Caerulein+anti-miR-181a-5p组Bax、Caspase-3蛋白的表达水平显著降低, Bcl-2蛋白的表达水平显著升高(P<0.05). 可见, 抑制miR-181a-5p表达抑制雨蛙肽诱导的AR42J和MPC-83细胞凋亡.
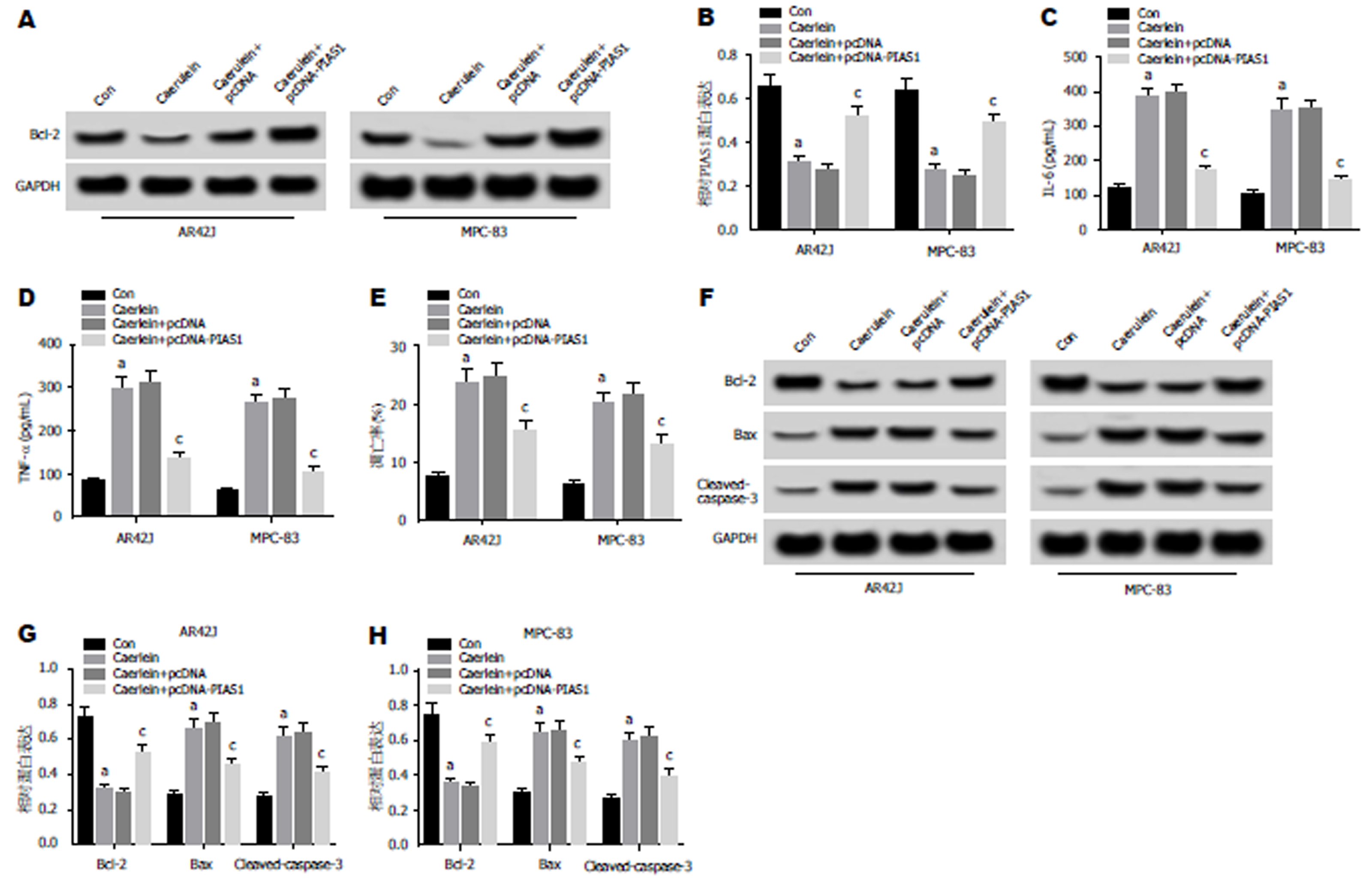
2.4 PIAS1过表达对雨蛙肽诱导的AR42J和MPC-83细胞损伤的影响 Western Blot检测结果(图4A, B, F, G, H)显示, 与Con组相比, Caerulein组AR42J和MPC-83细胞中Bax、Caspase-3蛋白的表达水平显著升高, PIAS1、Bcl-2蛋白的表达水平显著降低; 与Caerulein+pcDNA组相比, Caerulein+pcDNA-PIAS1组Bax、Caspase-3蛋白的表达水平显著降低, PIAS1、Bcl-2蛋白的表达水平显著升高(P<0.05). ELISA法检测结果(图4C, D)显示, 与Con组相比, Caerulein组AR42J和MPC-83细胞中IL-6和TNF-α的含量显著升高; 与Caerulein+pcDNA组相比, Caerulein+pcDNA-PIAS1组IL-6和TNF-α的含量显著降低(P<0.05). 流式细胞仪检测结果(图4E)显示, 与Con组相比, Caerulein组AR42J和MPC-83细胞凋亡率显著升高, 与Caerulein+pcDNA组相比, Caerulein+pcDNA-PIAS1组AR42J和MPC-83细胞凋亡率显著降低(P<0.05). 可见, PIAS1过表达抑制雨蛙肽诱导的AR42J和MPC-83细胞凋亡, 抑制细胞炎症因子IL-6和TNF-α的表达.
通过TargetScan数据库预测到PIAS1与miR-181a-5p存在结合位点(图5A). 荧光素酶报告基因检测实验结果(图5B, C)显示, 转染野生型PIAS1基因表达载体WT-PIAS1后, 相较于miR-NC组, miR-181a-5p组AR42J和MPC-83细胞的荧光素酶活性显著降低(P<0.05); 而转染突变型PIAS1基因表达载体MUT-PIAS1后, 相较于miR-NC组, miR-181a-5p组AR42J和MPC-83细胞的荧光素酶活性差异不显著. Western Blot检测结果(图5D, E)显示, 相较于miR-NC组, miR-181a-5p组AR42J和MPC-83细胞中PIAS1蛋白的表达水平显著降低; 而相较于anti-miR-NC组, anti-miR-181a-5p组AR42J和MPC-83细胞中PIAS1蛋白的表达水平显著升高(P<0.05). 可见, miR-181a-5p可靶向调控PIAS1的表达.
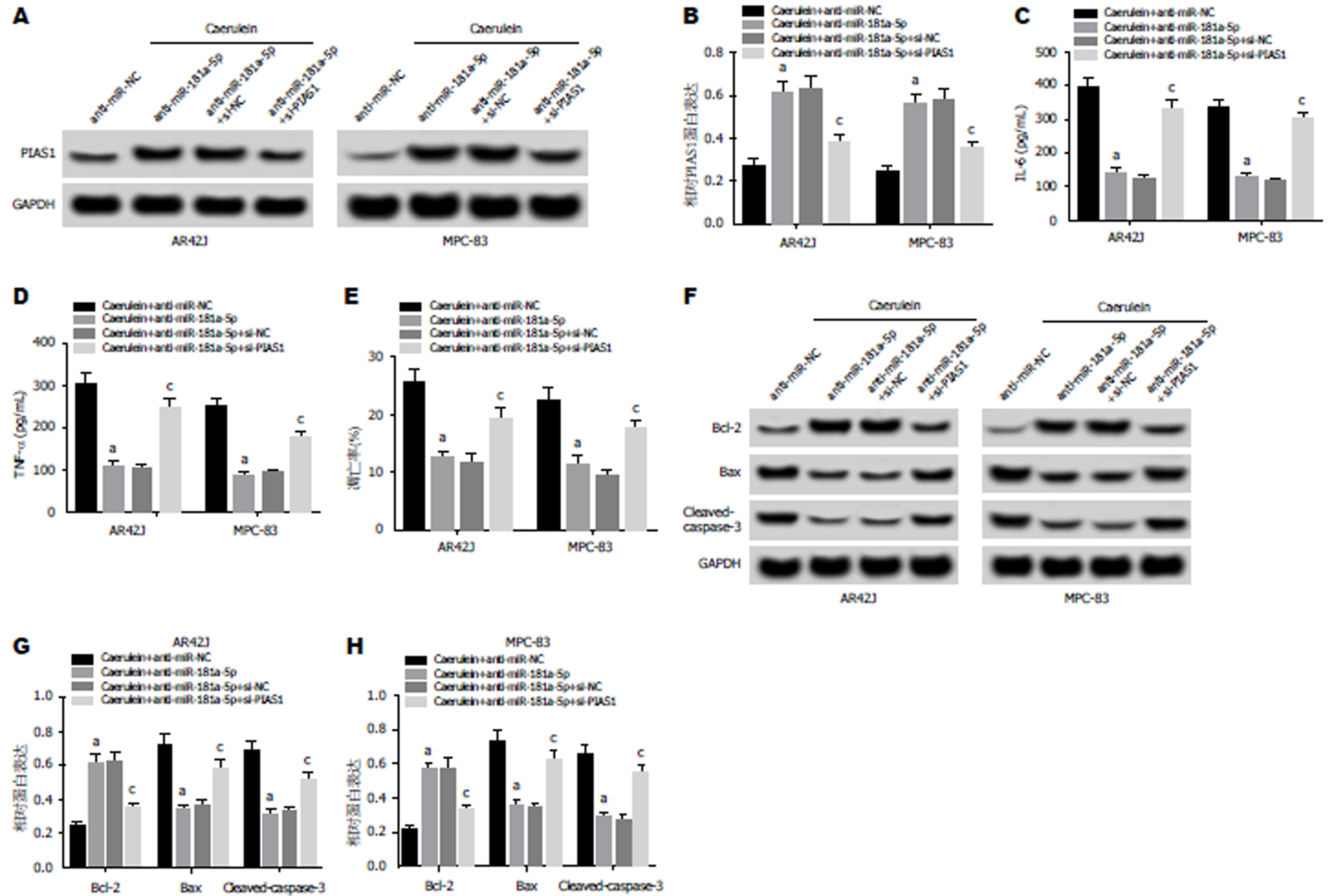
Western Blot检测结果(图6A, B, F, G, H)显示, 与Caerulein+anti-miR-NC组相比, Caerulein+anti-miR-181a-5p组AR42J和MPC-83细胞中Bax、cleaved-caspase-3蛋白的表达水平显著降低, PIAS1、Bcl-2蛋白的表达水平显著升高; 与Caerulein+anti-miR-181a-5p+si-NC组相比, Caerulein+anti-miR-181a-5p+si-PIAS1组Bax、cleaved-caspase-3蛋白的表达水平显著升高, PIAS1、Bcl-2蛋白的表达水平显著降低(P<0.05). ELISA法检测结果(图6C, D)显示, 与Caerulein+anti-miR-NC组相比, Caerulein+anti-miR-181a-5p组AR42J和MPC-83细胞中IL-6和TNF-α的含量显著降低; 与Caerulein+anti-miR-181a-5p+si-NC组相比, Caerulein+anti-miR-181a-5p+si-PIAS1组IL-6和TNF-α的含量显著升高(P<0.05). 流式细胞仪检测结果(图6E)显示, 与Caerulein+anti-miR-NC组相比, Caerulein+anti-miR-181a-5p组AR42J和MPC-83细胞凋亡率显著降低, 与Caerulein+anti-miR-181a-5p+si-NC组相比, Caerulein+anti-miR-181a-5p+si-PIAS1组AR42J和MPC-83细胞凋亡率显著升高(P<0.05). 可见, 抑制PIAS1表达逆转了抑制miR-181a-5p表达对雨蛙肽诱导的AR42J和MPC-83细胞凋亡.
AP是消化道常见的危重疾病, 其并发症多, 且近年来发病率不断升高, 对患者的生命安全造成了严重的威胁[8]. miRNAs在AP的发生发展中扮演重要角色[9]. 异常表达的miR-181a通过调控功能蛋白的表达及信号通路影响多种肿瘤的发生发展[10]. miR-181a在老年急性心肌梗死患者血清中高表达, 可作为诊断老年急性心肌梗死潜在的生物标志物[11]; 同样miR-181a在类风湿性关节炎中也上调表达[12]. 此外, 研究发现抑制miR-181a表达可减轻鱼藤酮诱导的SH-SY5Y细胞损伤, 对神经元细胞有保护作用[13]. miR-181a-5p在乳腺癌细胞中低表达, 过表达miR-181a-5p可通过靶向Kras抑制乳腺癌细胞增殖并诱导细胞凋亡[14]; 过表达miR-181a还可以增强胰腺癌细胞侵袭能力[15]. 而本研究结果显示, 在雨蛙肽处理AR42J和MPC-83细胞中miR-181a-5p高表达, 抑制miR-181a-5p表达可减少炎症因子肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和白细胞介素-6(interleukin-6, IL-6)的分泌, 抑制细胞凋亡. 即抑制miR-181a-5p表达能保护雨蛙肽诱导的胰腺腺泡细胞凋亡.
PIAS1是激活的STAT转录活性蛋白抑制家族成员之一, PIAS1高表达正向激活了Shh信号通路, 使胰腺癌细胞获得对吉西他滨的耐药能力, 降低其表达可以减弱细胞耐药能力[16]. 而过表达PIAS1可以通过抑制NF-κB活性起到抗细胞凋亡和抗炎作用, 显著改善心肌缺血再灌注损伤[17]. 且有研究发现PIAS1在AP中低表达, 沉默PIAS1会增强雨蛙肽活化的caspase-3凋亡途径诱导的胰腺腺泡细胞凋亡[18]; PIAS1还参与了雨蛙肽素诱导的胰腺腺泡细胞的炎症反应[19]. 本实验结果也表明, 在雨蛙肽处理的AR42J和MPC-83细胞中PIAS1低表达, PIAS1过表达可以抑制炎症因子TNF-α和IL-6的表达, 抑制细胞凋亡. 且miR-181a-5p靶向负调控PIAS1; 抑制PIAS1表达逆转了抑制miR-181a-5p对雨蛙肽处理AR42J和MPC-83细胞的凋亡抑制作用.
Bcl-2是凋亡抑制基因, Bax是凋亡促进基因, 二者结合可抑制Bcl-2的功能, Bax/Bcl-2比值升高则促进细胞凋亡; 此外, caspase-3是细胞凋亡信号途径的关键酶, cleaved-caspase-3蛋白的表达水平可以表示细胞的凋亡程度[20]. 本研究发现在雨蛙肽诱导的胰腺腺泡细胞凋亡中cleaved-caspase-3、Bax高表达, Bcl-2低表达. 抑制miR-181a-5p表达和PIAS1过表达均抑制cleaved-caspase-3和Bax表达, 促进Bcl-2表达, 且miR-181a-5p靶向负调控PIAS1, 说明miR-181a-5p可能通过PIAS1影响Bax/Bcl-2/cleaved-caspase-3的表达从而抑制细胞凋亡.
综上所述, 抑制miR-181a-5p表达可以抑制雨蛙肽诱导的胰腺炎腺泡细胞凋亡, 即可以保护雨蛙肽诱导的AP细胞损伤, 其机制可能与靶向调控PIAS1进而影响Bax/Bcl-2/cleaved-caspase-3有关. 为AP的诊断和治疗提供新靶点和新思路.
急性胰腺炎(acute pancreatitis, AP)是外科常见急腹症, 病情凶险, 病死率高. 除了胰酶的自身消化损伤作用外, 多种炎症介质也参与了胰腺炎的发展进程, 使胰腺脏器损伤不断加重. 由于胰腺炎病程中的免疫异常极易导致多器官功能不全综合症的发生. 通过调节致炎/抗炎细胞因子, 改善机体免疫状态, 有利于炎症的控制和患者预后的提升. 此外, 针对特异性靶点进行联合治疗可以提高治疗效率, 而更为精准高效的治疗需要弄清其发生发展机制. miRNA是一种小非编码RNA分子, 研究发现其此外可作为AP的生物标志物, 还可以调控AP的细胞死亡, 可作为AP的治疗靶点. 而本文主要是从miRNA方面研究其对AP凋亡的影响, 对AP中相关炎症因子的影响及其可能的作用机制.
本研究的主题是miR-181a-5p对AP细胞损伤的影响, 拟解决的关键问题是了解miR-181a-5p是如何影响AP细胞的凋亡, 以及其和PIAS1之间的关系及它们对AP的影响, 在AP中的发生发展机制, 为以后临床上的诊断治疗等提供新思路和新靶点.
研究的主要目标即miR-181a-5p, PIAS1, AP之间的关系, 研究得到在AP中miR-181a-5p高表达, PIAS1低表达, 抑制miR-181a-5p表达和过表达PIAS1均可抑制雨蛙素处理AR42J和MPC-83细胞凋亡, 抑制炎症因子TNF-α和IL-6的表达, 且miR-181a-5p靶向负调控PIAS1. 可以从调控AP凋亡的途径及相关炎症因子水平等来调控其进展, 为其治疗提供新思路.
本研究首先是用雨蛙素处理大鼠胰腺腺泡来构建AP的模型. 转染miR-181a-5p抑制表达和PIAS1过表达的载体质粒, MTT检测细胞增殖活性, 流式细胞术检测细胞凋亡, Western blot检测PIAS1蛋白表达, qRT-PCR检测miR-181a-5p和PIAS1 mRNA表达水平, 酶联免疫吸附试验法检测雨蛙肽处理AR42J和MPC-83细胞的TNF-α和IL-6的表达, 荧光素酶报告基因检测实验检测miR-181a-5p与PIAS1之间的靶向关系.
本实验的结果是在雨蛙素构建的AP模型细胞中, miR-181a-5p的表达水平升高, PIAS1的表达水平降低. 抑制miR-181a-5p表达、过表达PIAS1腺泡细胞凋亡率降低, TNF-α和IL-6的表达水平降低. miR-181a-5p靶向负调控PIAS1, 抑制PIAS1表达逆转了抑制miR-181a-5p对雨蛙素处理AR42J和MPC-83细胞的凋亡抑制作用; 达到了本实验的目的, 对该领域AP的发病进展机制又增加了相关的理论依据, 以后可以进一步在临床方面进行研究应用.
miR-181a-5p靶向负调控PIAS1; 抑制miR-181a-5p表达、过表达PIAS1抑制腺泡细胞凋亡和TNF-α和IL-6的表达. 可以通过调控PIAS1影响AP相关炎症因子的表达进而影响AP的进展. 从miRNA和其靶基因角度去研究其对AP的影响拓宽了研究的范围, 不同miRNA影响AP的进展的机制不同, 增加了其治疗的靶点. 不同的miRNA在AP中的表达及其作用机制不同, 可通过研究不同的miRNA及其靶基因和一些炎症分子对AP的影响可拓展研究思路. miR-181a-5p通过靶向负调控PIAS1影响腺泡细胞凋亡和TNF-α和IL-6的表达. 通过上调或下调miRNA可以影响AP的细胞的凋亡及其严重程度. 对未来临床诊断和治疗提供了新的标志物和新靶点.
仅对小鼠模型在理论层面上进行研究, 需要进一步在临床上进行相关研究和应用. 进一步深入研究miR-181a-5p和PIAS1对治疗AP小鼠的影响及其可能会产生的其他现象及是否会有副作用; 以及进一步向临床方向的研究靠拢. 寻找更接近于真实AP的小鼠或者与人AP更为相似的受体, 在其基础上进行实验治疗, 对其反应状况进行观察研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): E
编辑: 马亚娟 电编:刘继红
| 4. | 徐 楠. miR-181a的表达载体构建及其在胰腺癌细胞中抑制作用的初步探讨. 北京: 中国协和医科大学 2008; . |
| 5. | 吴 春丽, 张 顺, 蔡 挺. PIAS1与肿瘤. 中国生物化学与分子生物学报. 2017;33:423-428. [DOI] |
| 9. | 贾 重阳, 张 辰龙, 张 小强. microRNAs在急性胰腺炎中的研究新进展. 中华卫生应急电子杂志. 2017;3:180-182. [DOI] |
| 11. | 丁 学智, 韩 战营, 杨 巧丽. miR-181a在老年急性心肌梗死血清中的表达及其临床意义. 中国循证心血管医学杂志. 2018;10:104-106. [DOI] |
| 12. | 郑 锡铭, 娄 峻. RA患者外周血及关节液中miR-132、miR-140-5p、miR-150及miR-181a表达水平的临床意义. 热带医学杂志. 2018;18:362-366. [DOI] |
| 14. | 何 建苗, 赵 华洲, 王 婷, 邱 啸臣, 翁 剑峰, 张 心慧, 曹 志宇. miR-181a-5p靶向Kras对乳腺癌细胞MDA-MB-231增殖及凋亡的调控作用. 解放军医学杂志. 2018;43:21-25. [DOI] |
| 15. | 朱 玥璐. miR-181a表达载体的验证及其对胰腺癌细胞生物学行为的影响. 北京: 北京协和医学院 2009; . |
| 16. | 刘 怀泽, 俞 婷婷, 程 雁. PIAS1通过调控Sonic hedgehog信号通路使胰腺癌细胞SW1990获得对吉西他滨的耐药性. 南京医科大学学报(自然科学版). 2016;36:769-773. [DOI] |
| 17. | Xie B, Liu X, Yang J, Cheng J, Gu J, Xue S. PIAS1 protects against myocardial ischemia-reperfusion injury by stimulating PPARγ SUMOylation. BMC Cell Biol. 2018;19:24. [PubMed] [DOI] |