修回日期: 2019-05-29
接受日期: 2019-07-26
在线出版日期: 2019-08-08
重症急性胰腺炎(acute pancreatitis, AP)是消化系统常见的危重急症, 临床救治难度大, 病死率高, 严重危及患者生命. 近几年来多种miRNA在AP中的差异表达, 与其发生发展及诊断和预后密切相关, 进一步探索其在AP发生发展、并发症等各环节的作用有助于为AP的诊断和治疗提供新的思路和方法. 研究发现miR-216a-5p通过下调MMP16可抑制肺癌细胞的侵袭; miR-216a-5p通过靶向抑制PAK2基因可抑制膀胱癌细胞的增殖能力, 促进细胞凋亡. miR-216a-5p可抑制小细胞肺癌的恶性进展, 影响前列腺癌细胞的增殖、迁移和宫颈癌细胞的肿瘤发生. 仅发现miR-216a在AP患者外周血中高表达, 但miR-216a-5p在AP的增殖凋亡中的影响及作用机制尚不清楚.
研究miR-216a-5p对AP腺泡细胞增殖、凋亡的影响及潜在的作用机制.
用雨蛙素(caerulein, CAE)处理大鼠胰腺腺泡AR42J构建AP模型, 设置miR-NC组(转染miR-NC)、miR-216a-5p组(miR-216a-5p mimics)、anti-miR-NC组(转染anti-miR-NC)、anti-miR-216a-5p组(转染anti-miR-216a-5p)、pcDNA3.1组(转染pcDNA3.1)、pcDNA3.1-XIAP组(转染pcDNA3.1-XIAP)、anti-miR-216a-5p+si-NC组(共转染anti-miR-216a-5p和si-NC)、anti-miR-216a-5p+si-XIAP(共转染anti-miR-216a-5p和si-XIAP)组, 均用脂质体法转染. qRT-PCR检测AR42J细胞中miR-216a-5p的表达水平; Western Blot检测蛋白表达; MTT法检测细胞活性; 流式细胞术检测细胞凋亡; 双荧光素酶报告基因检测实验检测荧光活性.
CAE处理AR42J细胞后, miR-216a-5p的表达水平显著升高(P<0.05). 抑制表达miR-216a-5p和过表达XIAP细胞活性显著升高, 细胞凋亡率显著降低, Cyclin D1、Bcl-2蛋白的表达水平显著升高, P21、Bax蛋白的表达水平显著下降(P<0.05). miR-216a-5p靶向负调控XIAP; 抑制XIAP表达逆转了抑制miR-216a-5p对CAE处理的AR42J细胞增殖促进、凋亡抑制的作用.
抑制miR-216a-5p表达可以抑制胰腺炎腺泡细胞凋亡, 促进细胞增殖, 其机制可能与靶向调控XIAP有关. 可为AP诊断和治疗提供新靶点和新思路.
核心提要: miR-216a-5p在急性胰腺炎模型细胞中高表达, miR-216a-5p靶向负调控XIAP, 抑制miR-216a-5p表达可以通过上调XIAP的表达抑制胰腺炎腺泡细胞凋亡, 促进细胞增殖.
引文著录: 丁谦谦, 楼定进, 王海英. miR-216a-5p调控XIAP对急性胰腺炎腺泡细胞增殖、凋亡的影响. 世界华人消化杂志 2019; 27(15): 918-926
Revised: May 29, 2019
Accepted: July 26, 2019
Published online: August 8, 2019
Severe acute pancreatitis (AP) is a common critical illness in the digestive system. It is difficult to treat clinically and has a high mortality rate, which seriously endangers patients' lives. In recent years, the differential expression of multiple miRNAs has been found to be closely related to the development, diagnosis, and prognosis of AP. Further exploration of the role of miRNAs in the development, com-plications, and other aspects of AP may provide new clues to the diagnosis and treatment of AP. It has been found that miR-216a-5p can inhibit the invasion of lung cancer cells by down-regulating MMP16; miR-216a-5p can inhibit the proliferation of bladder cancer cells and promote their apoptosis by targeting the PAK2 gene. In addition, miR-216a-5p can inhibit the malignant progression of small cell lung cancer and affect the proliferation, migration, and tumorigenesis of prostate cancer cells. Although it has been found that miR-216a is highly expressed in peripheral blood of patients with AP, the effect and mechanism of miR-216a-5p in the proliferation and apoptosis of AP cells are still unclear.
To investigate the effects of miR-216a-5p on proliferation and apoptosis of AP acinar cells and the potential mechanism involved.
Pancreatic acinar AR42J cells were treated with cerulein to construct an AP model. The cells were then transfected with miR-NC, miR-216a-5p mimic, anti-miR-NC, anti-miR-216a-5p, pcDNA3.1, pcDNA3.1-XIAP, anti-miR-216a-5p + si-NC, and anti-miR-216a-5p + si-XIAP by the liposome method. The expression of miR-216a-5p in AR42J cells was detected by qRT-PCR, and protein expression was detected by Western blot. MTT assay was used to detect cell viability, flow cytometry was used to detect apoptosis, and dual luciferase reporter gene assay was used to detect fluorescence activity.
The expression of miR-216a-5p was significantly increased after treatment of AR42J cells with cerulein (P < 0.05). Cell viability was significantly increased and the apoptosis rate was significantly decreased by inhibiting the expression of miR-216a-5p and overexpressing XIAP; the expression levels of Cyclin D1 and Bcl-2 proteins were significantly increased, and the expression levels of P21 and Bax proteins were significantly decreased (P < 0.05). MiR-216a-5p negatively regulated the expression of XIAP, and inhibition of XIAP expression reversed the inhibitory effect of miR-216a-5p in proliferation promotion and apoptosis inhibition of cerulein-treated AR42J cells.
Inhibition of miR-216a-5p expression can inhibit the apoptosis of pancreatic acinar cells and promote their proliferation via mechanisms that may be related to the targeted regulation of XIAP. Our findings may provide new targets and new ideas for the diagnosis and treatment of AP.
- Citation: Ding QQ, Lou DJ, Wang HY. Regulatory effect of miR-216a-5p on XIAP-mediated differentiation, proliferation, and apoptosis of acinar cells in acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2019; 27(15): 918-926
- URL: https://www.wjgnet.com/1009-3079/full/v27/i15/918.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i15.918
急性胰腺炎(acute pancreatitis, AP)是一种临床常见的急腹症, 发病急, 进展快, 其发病机制复杂[1]. 细胞凋亡是AP的一个重要病理特征, 参与其发病过程, 是胰腺炎发病后对机体有利的一种反应, 凋亡能减轻炎症反[2,3]. 微小RNA(microRNA, miRNA)具有组织特异性且涉及调控转录后的基因表达, 在AP中的作用机制及临床实用性的研究有助于为AP的诊断和治疗提供新的思路和方法[4]. 已有研究表明AP患者血清miR-216a表达水平明显升高, 可作为AP辅助诊断及预后监测的生物标志物[5]. miR-216a-5p是致癌基因, miR-216-5p有助于宫颈癌细胞的肿瘤发生[6], 在胃癌中miR-216a-5p促进细胞增殖, 抑制细胞凋亡[7]. miR-216a-5p通过下调MMP16表达抑制人肺癌细胞的侵袭能力[8]. X-连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP) 是凋亡抑制基因家族中重要的成员之一, 可通过抑制caspase-3, caspase-7和caspase-9, 并参与其他途径来抑制细胞的凋亡, 与肿瘤的发生、发展和预后密切相关[9]. 但miR-216a-5p及XIAP在AP表达及对其分化、增殖、凋亡的影响和作用机制等尚未清楚, 本文旨在研究miR-216a-5p对XIAP的调控机制及对AP腺泡细胞分化、增殖、凋亡的影响. 为AP的诊断和治疗提供一定的理论依据.
胰腺腺泡细胞株AR42J购自中国科学院上海细胞库. 雨蛙素(caerulein, CAE)购自美国Sigma公司; 胎牛血清、RPMI 1640培养基均购自美国Gibco公司; RNA提取试剂盒、反转录试剂盒和qPCR试剂盒购自日本Takara公司; Western Blot试剂盒购自上海信裕生物技术有限公司; BCA试剂盒、MTT试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒购自碧云天生物技术研究所; LipofectamineTM 2000转染试剂盒购自美国Invitrogen公司; 双荧光素酶报告基因检测试剂盒购自美国Promega公司; 细胞板、流式细胞仪购自赛默飞公司; 兔抗人Bax多克隆抗体、兔抗人Bcl-2多克隆抗体、兔抗人Cyclin D1多克隆抗体、兔抗人p21多克隆抗体、兔抗人XIAP多克隆抗体、兔抗人GAPDH 多克隆抗体、山羊抗兔IgG-辣根过氧化物酶(horseradish peroxidase,HRP)的均购自上海煊翎生物科技有限公司.
1.2.1 细胞培养及CAE处理构建AP模型: 胰腺腺泡AR42J细胞常规培养于含10% FBS的RPMI 1640培养基, 置于37 ℃, 含5%CO2恒温箱培养. 每2-3 d传代一次. 取正常AR42J细胞接种于6孔板上, 培养24 h后加入10 nmol/L的CAE, 震荡混匀后继续培养, 即AP细胞, 记为AR42J+CAE组.
1.2.2 细胞分组和转染: 将miR-NC、miR-216a-5p、anti-miR-NC、anti-miR-216a-5p转染至正常培养的AR42J细胞中记为miR-NC组、miR-216a-5p组、anti-miR-NC组、anti-miR-216a-5p组; 将anti-miR-NC、anti-miR-216a-5p、pcDNA3.1、pcDNA3.1-XIAP分别转染至CAE处理后的胰腺腺泡AR42J细胞中, 记为AR42J+CAE+anti-miR-NC组、AR42J+CAE+anti-miR-216a-5p组、AR42J+CAE+pcDNA3.1组、AR42J+CAE+pcDNA3.1-XIAP组; 将anti-miR-216a-5p分别和si-NC、si-XIAP共转染至CAE处理后的胰腺腺泡AR42J细胞中, 分别记为AR42J+CAE+anti-miR-216a-5p+si-NC组、AR42J+CAE+anti-miR-216a-5p+si-XIAP组, 转染按照LipofectamineTM 2000试剂盒进行操作.
1.2.3 qRT-PCR分析miR-216a-5p的表达水平: 按照Trizol说明书提取总RNA, 用反转录试剂盒逆转录成cDNA, 按照AceQ qPCR SYBR® Green Mix说明书进行qRT-PCR方法扩增. 循环条件为95 ℃ 30 s, 60 ℃ 30 s; 72 ℃ 30 s, 共40个循环; 60 ℃延长5 min. 相对表达量采用2-△△Ct法计算.
1.2.4 Western Blot检测蛋白表达: 提取各组细胞蛋白, 用BCA蛋白定量试剂盒进行蛋白定量. 各组蛋白上样量60 μg, SDS-PAGE后, 经电转将蛋白转移至PVDF膜上. 用5%脱脂牛奶室温封闭90 min, 分别加入相应的一抗: 兔抗人Bax多克隆抗体、兔抗人Bcl-2多克隆抗体、兔抗人Cyclin D1多克隆抗体、兔抗人p21多克隆抗体、 兔抗人XIAP多克隆抗体、兔抗人GAPDH多克隆抗体, 4 ℃孵育过夜, PBS洗涤3次, 每次5 min; 再加入相对应的二抗HRP, 室温孵育2 h, PBS洗涤3次, 每次10 min, 后在暗室中曝光显影, 再浸入定影, 最后洗去残液晾干, 将胶片用Quantity One凝胶分析软件处理, 测定各组蛋白条带的吸光度, 以目的条带和GAPDH条带的比值作为蛋白表达水平.
1.2.5 MTT检测细胞增殖活性: 在各组细胞培养至24 h、48 h、72 h时加入20 μL(5 g/L)的MTT溶液, 继续孵育4 h; 弃去多余培养基并加入150 μL DMSO振荡反应10 min, 酶标仪检测490 nm处吸光度(OD)值. 细胞增殖活力(%) = 实验组OD值/空白对照组OD值×100%.
1.2.6 流式细胞术检测细胞凋亡: 用不含EDTA的胰酶消化细胞, 离心收集各组细胞, PBS漂洗2次, 加结合缓冲液重悬细胞. 依据试剂盒说明书, 先后加入Annexin V-FITC和PI避光孵育. 流式细胞仪检测激发波长488 nm和发射波长530 nm处的荧光强度. 实验重复3次.
1.2.7 荧光素酶报告基因检测实验检测miR-216a-5p对XIAP的靶向调控: TargetScan数据库显示XIAP 3′UTR区域有miR-7结合位点. 构建野生型和突变型基因靶点XIAP的3′UTR-荧光素酶表达载体(WT-XIAP和MUT-XIAP), 取对数生长期大鼠胰腺腺泡AR42J细胞接种于24孔板(5×104个/孔), 待细胞生长至80%融合时, 用LipofectamineTM 2000将WT-XIAP和MUT-XIAP组细胞分别转染miR-NC和miR-216a-5p. 依据说明书要求, 使用荧光素酶报告基因检测仪进行双荧光素酶报告实验测定. 实验结果以荧光素酶活性和Renilla活性的比值进行统计学分析. 实验重复3次.
统计学处理 采用SPSS 20.00进行统计学分析. 计量资料以mean±SD表示, 两组比较行t检验, 多组间比较采用单因素方差分析, 以P<0.05表示差异有统计学意义.
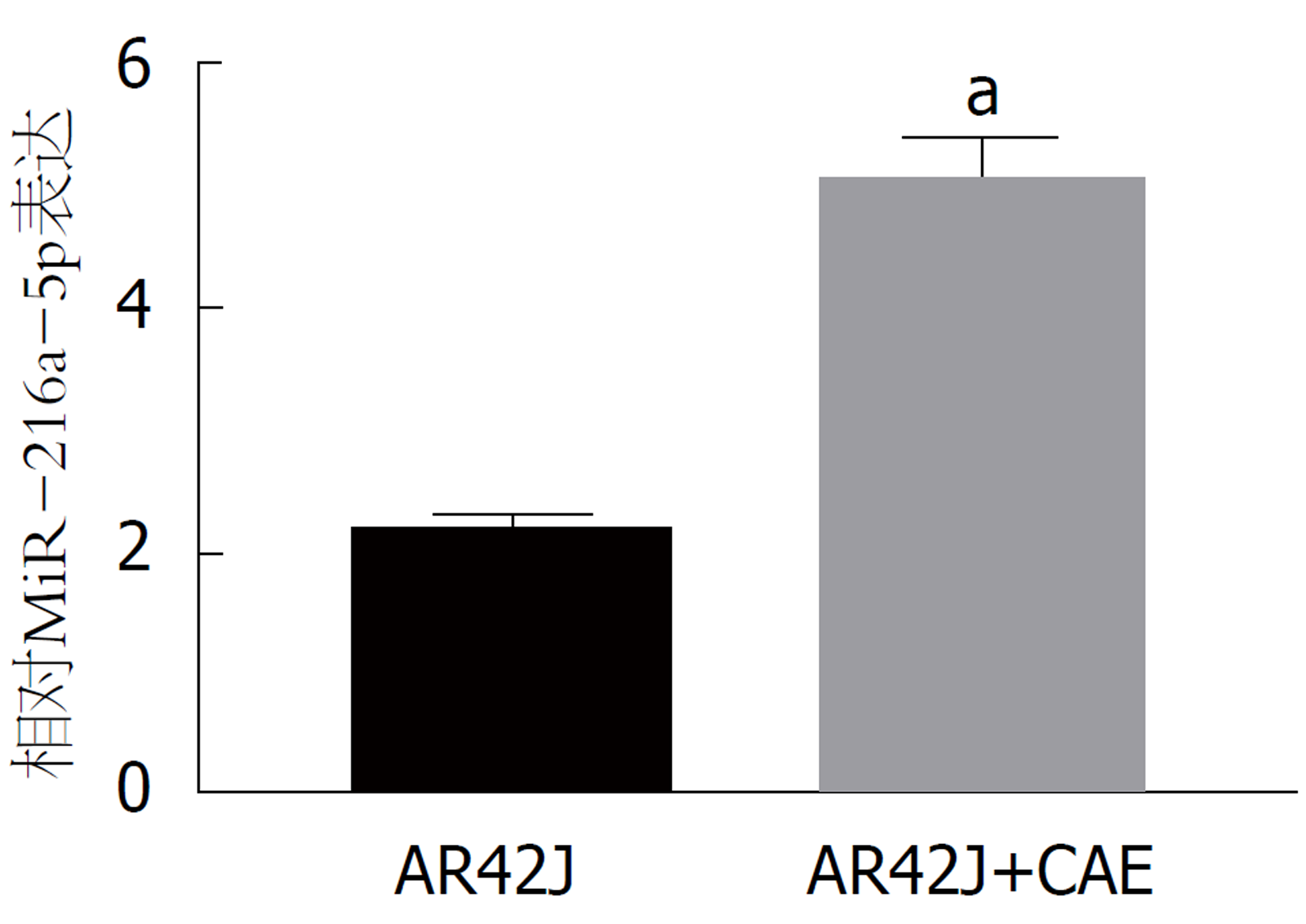
qRT-PCR检测结果(图1)显示, 与正常的AR42J细胞相比, CAE处理后的AR42J细胞中miR-216a-5p的表达水平显著升高(P<0.05). 可见, CAE处理可以提高miR-216a-5p的表达水平.
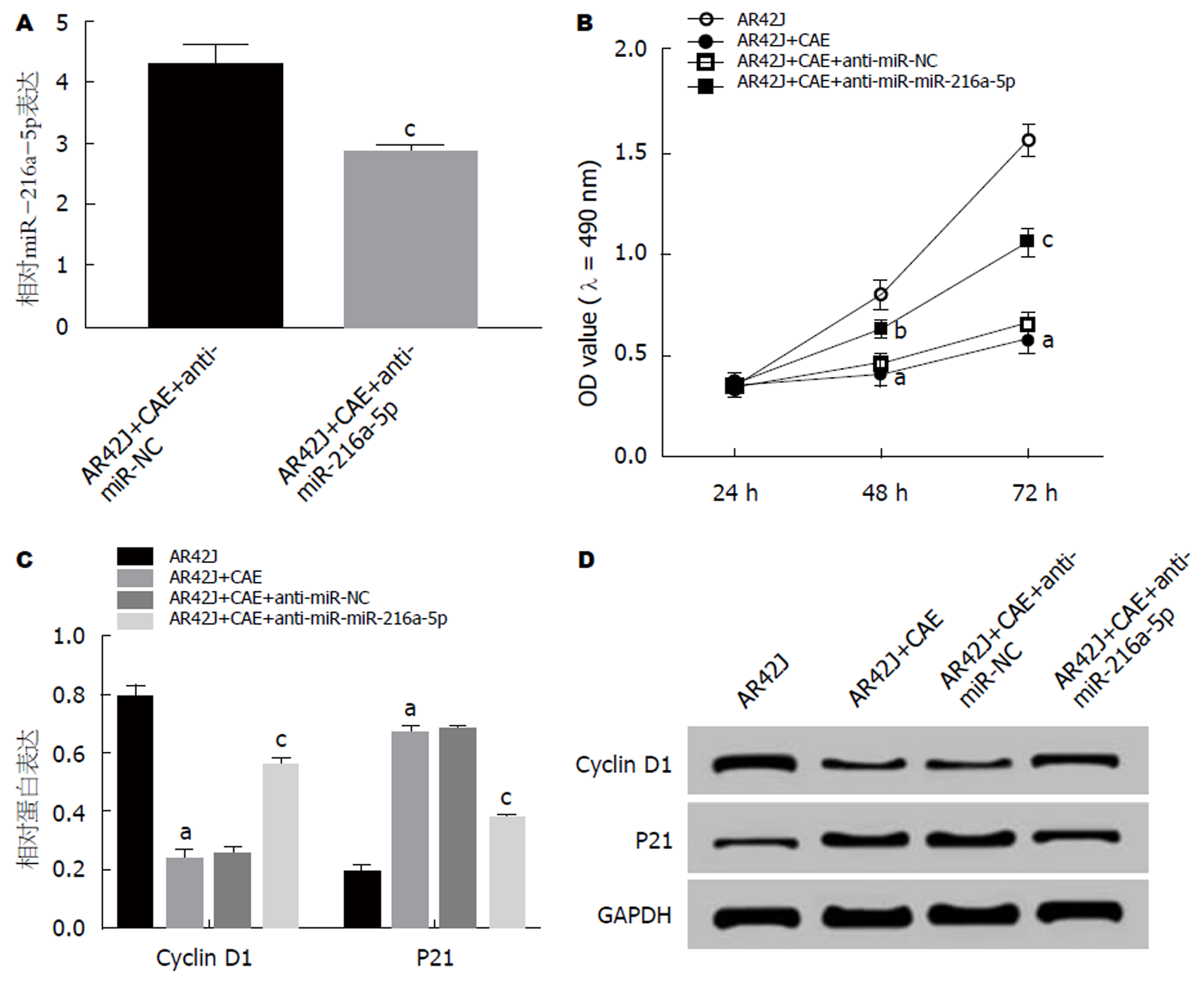
qRT-PCR检测结果(图2A)显示, 与AR42J+CAE+anti-miR-NC组相比, AR42J+CAE+anti-miR-216a-5p组miR-216a-5p的表达水平显著降低(P<0.05). MTT法检测结果(图2B)显示, 与AR42J组相比, AR42J+CAE组细胞活性显著降低, 与AR42J+CAE+anti-miR-NC组相比, AR42J+CAE+anti-miR-216a-5p组细胞活性显著升高(P<0.05). Western Blot检测结果(图2C, D)显示, 与AR42J+CAE+anti-miR-NC组相比, AR42J+CAE+anti-miR-216a-5p组Cyclin D1蛋白的表达水平显著升高, P21蛋白的表达水平显著下降(P<0.05). 可见, 抑制miR-216a-5p可促进AP腺泡细胞增殖.
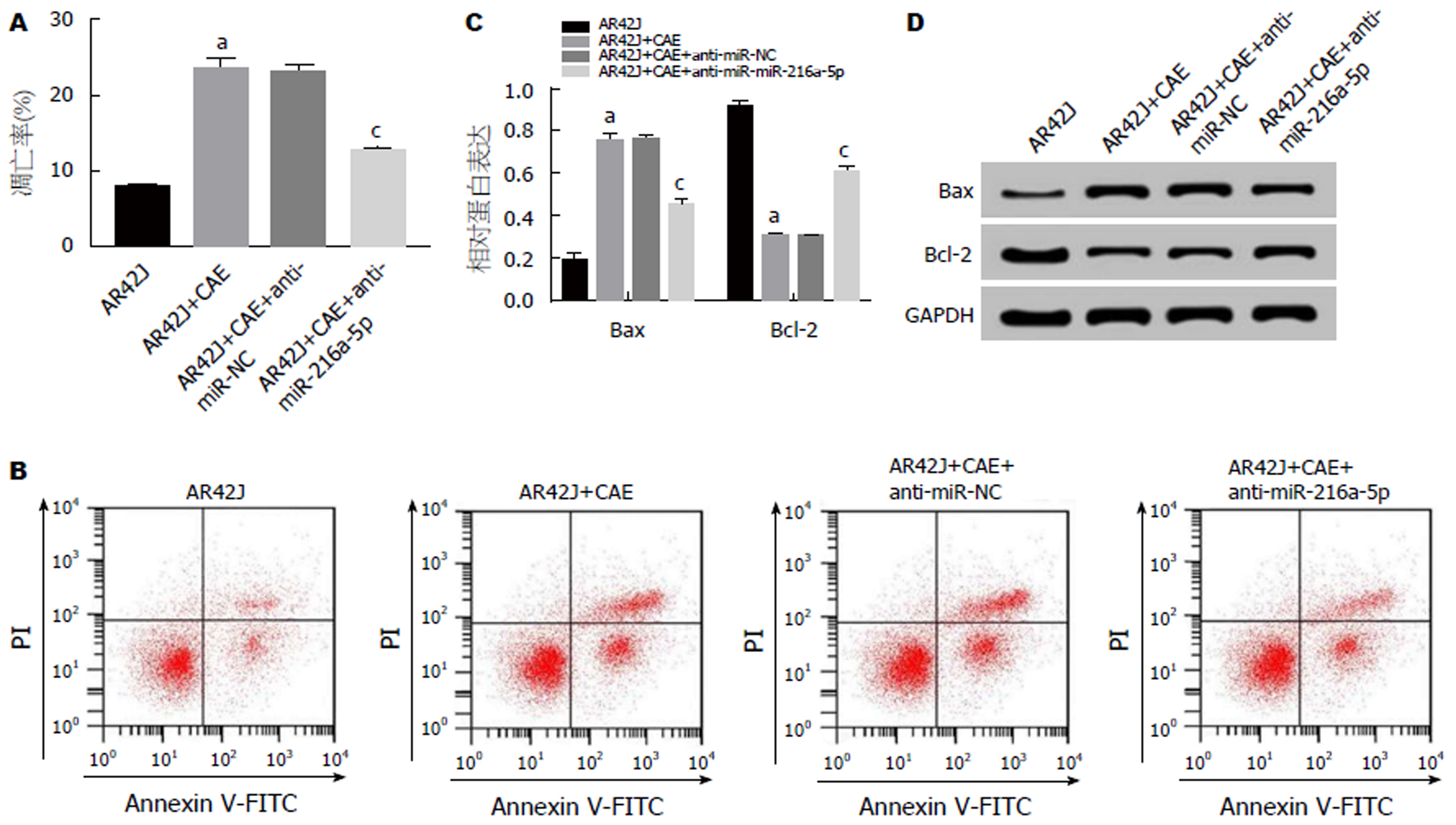
流式细胞仪检测结果(图3A, B)显示, 与AR42J组相比, AR42J+CAE组细胞凋亡率显著升高; 与AR42J+CAE+anti-miR-NC组相比, AR42J+CAE+anti-miR-216a-5p组CAE作用的AR42J细胞的凋亡率显著降低(P<0.05). Western Blot检测结果(图3C, D)显示, 与AR42J组相比, AR42J+CAE组Bcl-2蛋白的表达水平显著降低, Bax蛋白的表达水平显著升高; 与AR42J+CAE+anti-miR-NC组相比, AR42J+CAE+anti-miR-216a-5p组Bcl-2蛋白的表达水平显著升高, Bax蛋白的表达水平显著下降(P<0.05). 可见, 抑制miR-216a-5p可抑制AP腺泡细胞凋亡.
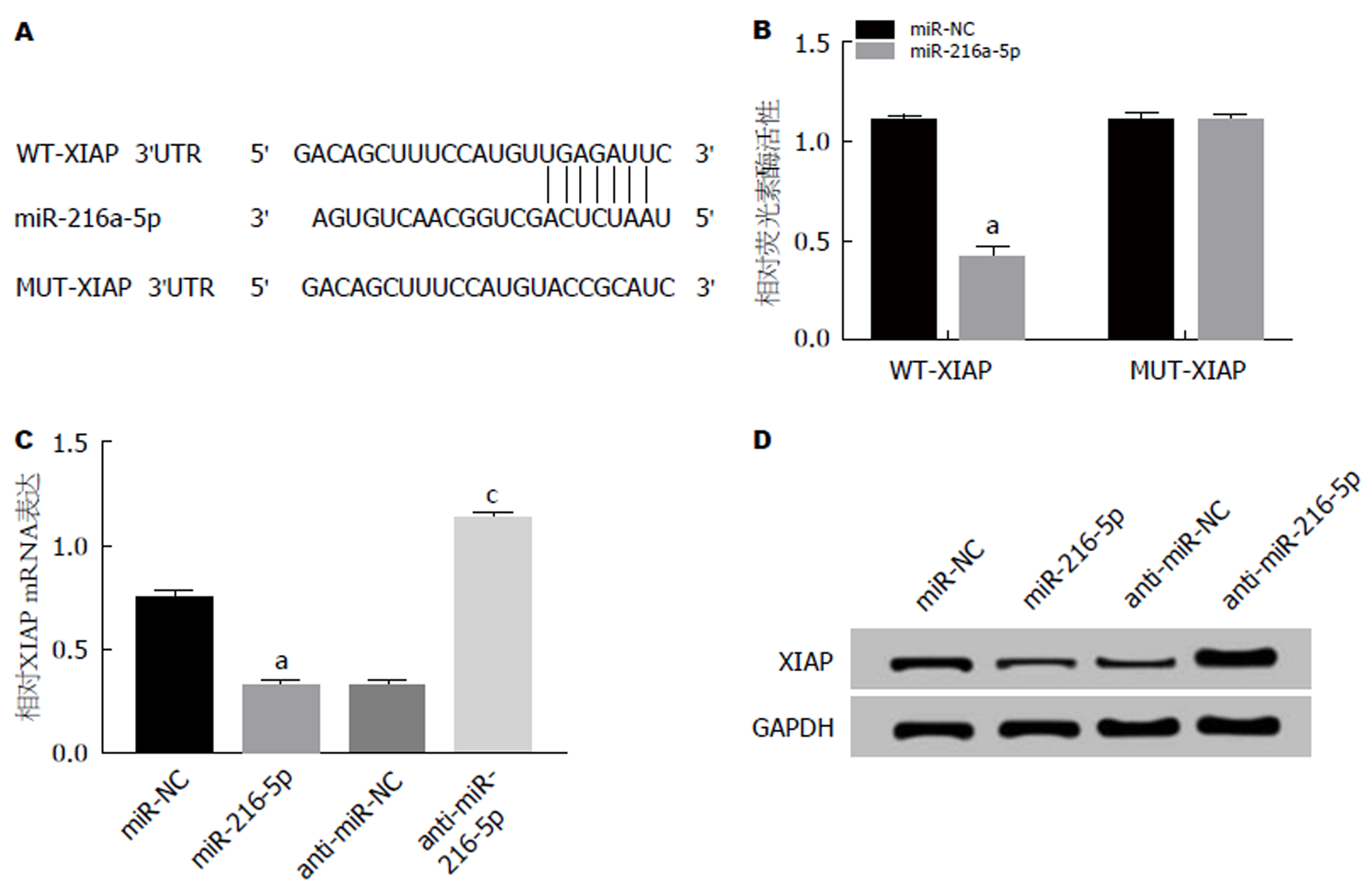
通过TargetScan数据库预测到XIAP与miR-216a-5p存在结合位点(图4A). 荧光素酶报告基因检测实验结果(图4B)显示, 转染野生型XIAP基因表达载体WT-XIAP后, 相较于miR-NC组, miR-216a-5p组AR42J细胞的荧光素酶活性显著降低(P<0.05); 而转染突变型XIAP基因表达载体MUT-XIAP后, 相较于miR-NC组, miR-216a-5p组AR42J细胞的荧光素酶活性差异不显著. qRT-PCR检测结果(图4C)显示, 相较于miR-NC组, miR-216a-5p组AR42J细胞中XIAP mRNA的表达水平显著降低; 而相较于anti-miR-NC组, anti-miR-216a-5p组AR42J细胞中XIAP mRNA的表达水平显著升高(P<0.05). Western Blot检测结果(图4D)显示, 相较于miR-NC组, miR-216a-5p组AR42J细胞中XIAP蛋白的表达水平显著降低; 而相较于anti-miR-NC组, anti-miR-216a-5p组AR42J细胞中XIAP蛋白的表达水平显著升高(P<0.05). 可见, miR-216a-5p可以靶向调控XIAP.
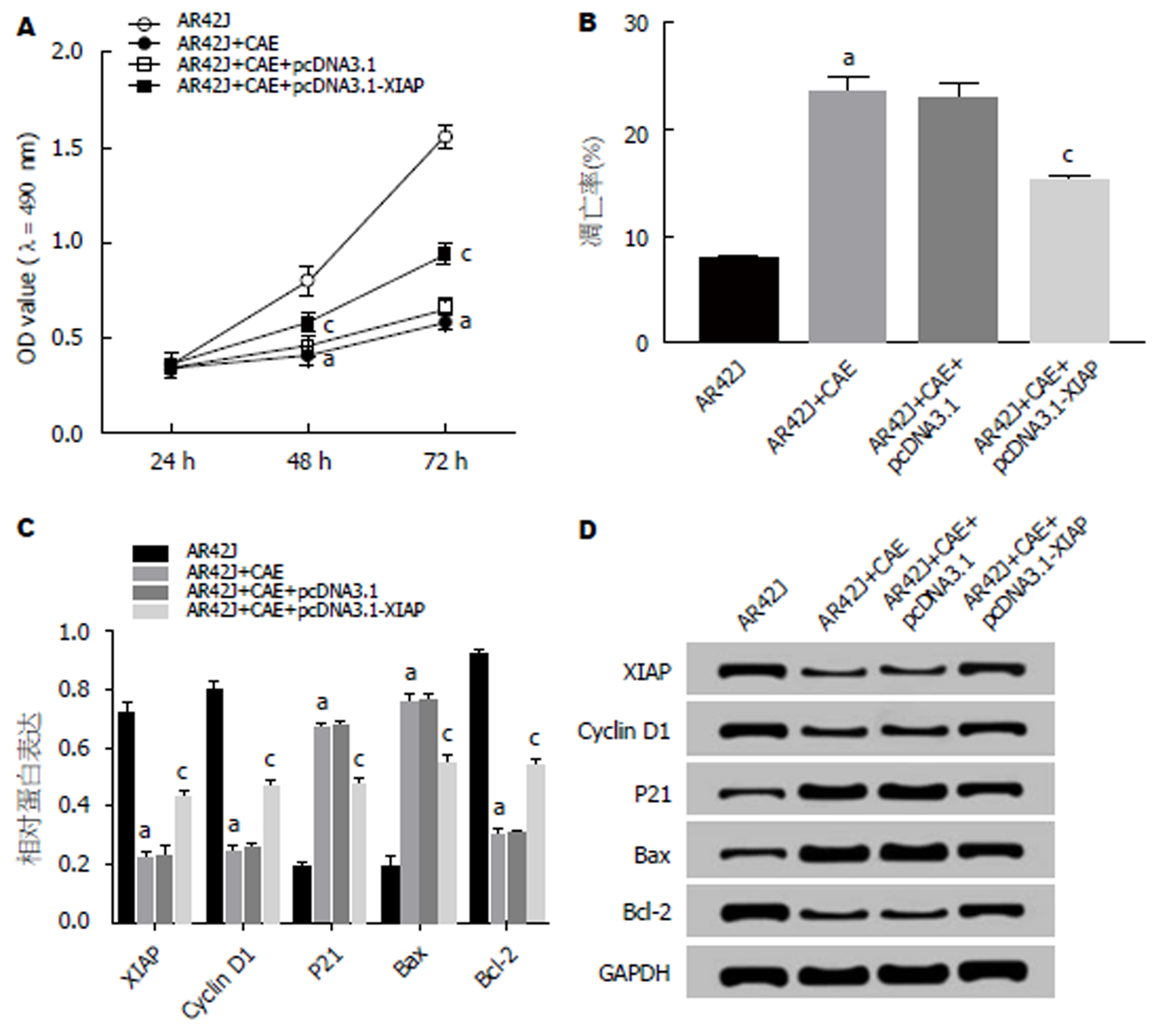
MTT法检测结果(图5A)显示, 与AR42J组相比, AR42J+CAE组细胞活性显著降低; 与AR42J+CAE+pcDNA3.1组相比, AR42J+CAE+pcDNA3.1-XIAP组细胞活性显著升高(P<0.05). 流式细胞仪检测结果(图5B)显示, 与AR42J组相比, AR42J+CAE组细胞的凋亡率显著升高; 与AR42J+CAE+pcDNA3.1组相比, AR42J+CAE+pcDNA3.1-XIAP组细胞的凋亡率显著降低(P<0.05). Western Blot检测结果(图5C, D)显示, 与AR42J组相比, AR42J+CAE组XIAP、Cyclin D1、Bcl-2蛋白的表达水平显著下降, P21、Bax蛋白的表达水平显著升高; 与AR42J+CAE+pcDNA3.1组相比, AR42J+CAE+pcDNA3.1-XIAP组中XIAP、Cyclin D1、Bcl-2蛋白的表达水平显著升高, P21、Bax蛋白的表达水平显著下降(P<0.05). 可见, 过表达XIAP促进AP腺泡细胞增殖, 抑制其凋亡.
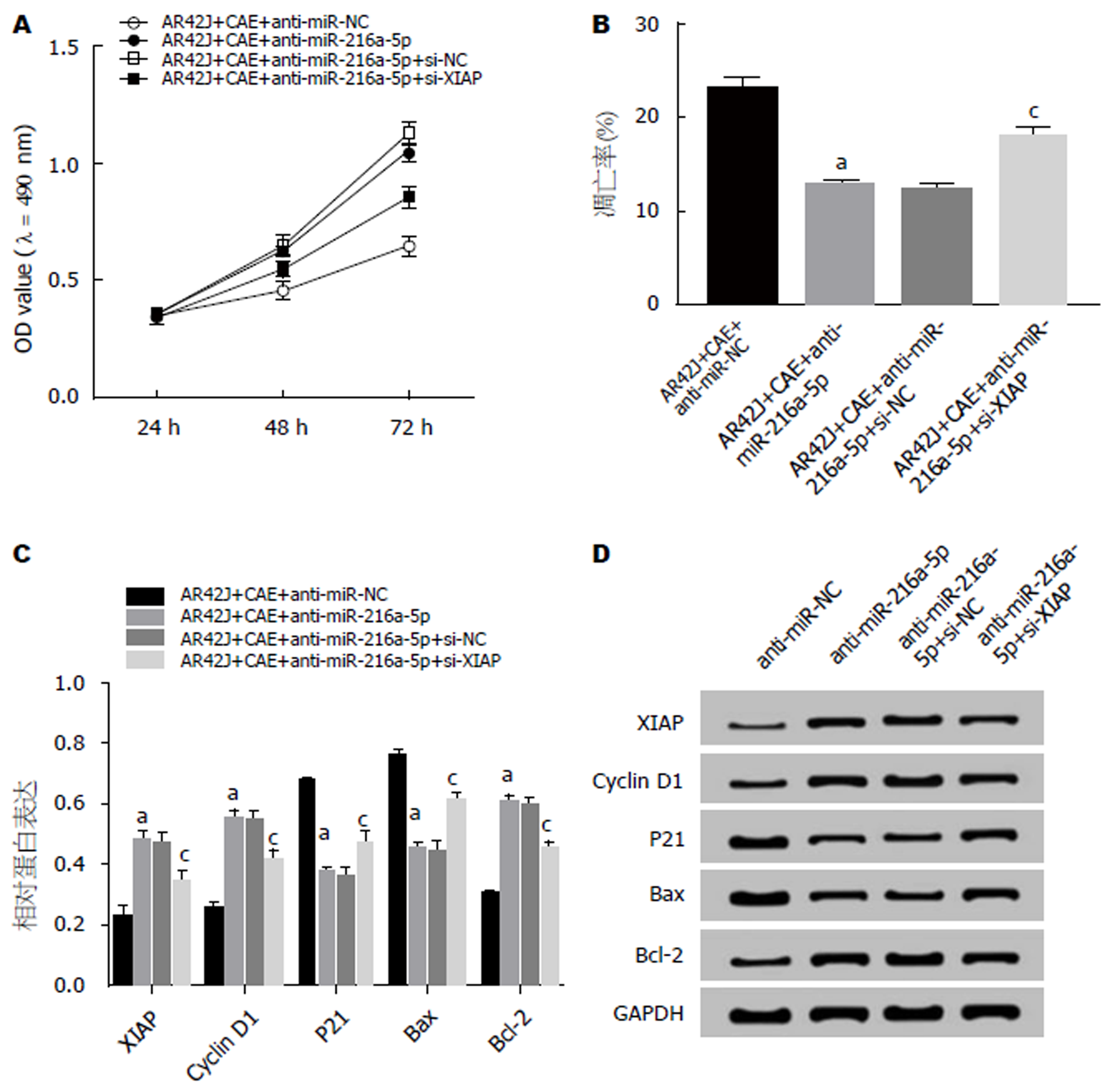
MTT法检测结果(图6A)显示, 与AR42J+CAE+anti-miR-NC组相比, AR42J+CAE+anti-miR-216a-5p组细胞活性显著升高, 与AR42J+CAE+anti-miR-216a-5p+si-NC组相比, AR42J+CAE+anti-miR-216a-5p+si-XIAP组细胞活性显著降低(P<0.05). 流式细胞仪检测结果(图6B)显示, 与AR42J+CAE+anti-miR-NC组相比, AR42J+CAE+anti-miR-216a-5p组细胞的凋亡率显著降低, 与AR42J+CAE+anti-miR-216a-5p+si-NC组相比, AR42J+CAE+anti-miR-216a-5p+si-XIAP组细胞的凋亡率显著升高(P<0.05). Western Blot检测结果(图6C, D)显示, 与AR42J+CAE+anti-miR-NC组相比, AR42J+CAE+anti-miR-216a-5p组中XIAP、Cyclin D1、Bcl-2蛋白的表达水平显著升高, P21、Bax蛋白的表达水平显著下降; 与AR42J+CAE+anti-miR-216a-5p+si-NC组相比, AR42J+CAE+anti-miR-216a-5p+si-XIAP组中XIAP、Cyclin D1、Bcl-2蛋白的表达水平显著下降, P21、Bax蛋白的表达水平显著升高(P<0.05). 可见, 抑制XIAP表达能逆转抑制miR-216a-5p对AP腺泡细胞增殖促进、凋亡抑制的作用.
AP是由多种病因诱发的一种急腹病, 发病率及病死率高, 严重影响人们生命健康[10]. 近些年来的研究发现多种miRNA在AP中异常表达, 在其诊断、预后和发病机制中具有重要作用[11]. miR-216a为急性胰腺损伤的标志物, 在AP大鼠模型中上调表达[12]. Kuśnierz等[13]研究发现miR-216a-5p在AP患者表达升高, 可以预测AP的严重程度. 转化生长因子(transforming growth factor, TGF)-β诱导的miR-216a-5p通过Akt和TGF-β通路加重小鼠AP[14]. miR-216a-5p在膀胱癌中低表达, 可抑制膀胱癌细胞的增殖, 促进细胞凋亡[15]. miR-216a-5p通过Bcl-2家族蛋白抑制小细胞肺癌的恶性进展[16]. 上调miR-216a-5p也能抑制前列腺癌细胞的增殖, 迁移和侵袭[17]; 还可通过靶向RUNX1激活NF-κB信号通路抑制人胃癌细胞的增殖, 迁移和侵袭[18]. 本研究结果显示, miR-216a-5p在CAE处理的AR42J细胞中表达水平显著升高, 抑制表达miR-216a-5p可提高细胞活性, 降低细胞凋亡率. miR-216a-5p靶向负调控XIAP表达.
XIAP是凋亡抑制蛋白家族中最强的内源性的抑制因子, 可通过不同的信号转导通路及调控相关凋亡蛋白酶的表达产生抗凋亡作用, 与肿瘤的发生、发展有密切关系[19]. XIAP下调可以促进肿瘤细胞的凋亡, 逆转肿瘤细胞耐药, 增强肿瘤细胞化疗的敏感性[20]. 研究发现AP病情轻重程度与XIAP蛋白表达有关, AP病情越重XIAP表达越高[21], XIAP参与细胞凋亡的调节[22]. 李富龙等[23]研究发现清下化瘀方可通过下调Survivin、XIAP的表达而起到治疗AP的作用. XIAP的下调与大鼠中CAE诱导的AP中的细胞凋亡相关[24]. XIAP会导致严重的AP[25], 而XIAP的缺失则能降低AP的严重程度[26]. XIAP在CAE刺激的大鼠胰腺腺泡细胞中负向调控AR42J细胞的凋亡[27]. 本研究结果显示, 过表达XIAP促进CAE处理的AR42J细胞增殖, 抑制细胞凋亡, 促进Cyclin D1、Bcl-2蛋白的表达, 抑制P21、Bax蛋白的表达. 抑制XIAP表达可逆转抑制miR-216a-5p对CAE处理的AR42J细胞增殖促进、凋亡抑制的作用.
综上所述, 抑制miR-216a-5p表达可以抑制胰腺炎腺泡细胞凋亡, 促进细胞增殖, 其机制可能与靶向调控XIAP有关. 可为AP诊断和治疗提供新靶点和新思路.
急性胰腺炎(acute pancreatitis, AP)的发病机制复杂, 并发症较多, 对人生命健康危害加大. 根据其严重程度的不同, 可分为轻型急性胰腺炎(mild acute pancreatitis, MAP)和重症急性胰腺炎(severe acute pancreatitis, SAP). MAP较容易治愈, 但SAP因为早期病情隐匿, 后期发展快, 发现时已很严重, 所以死亡率较高. 早诊断、早发现、早治疗是对SAP具有重要意义. AP主要病因有胆源性, 高脂血症性, 酒精性, 暴饮暴食性等. 早期主要采用非手术个体化治疗, 包括液体复苏、抗生素的使用、早期肠内营养、特效药物和我国的传统医学治疗等. 更为精准高效的治疗需要清楚其进展机制, 研究miRNA可以作为AP的生物标志物, 预测并且判定AP的发生、发展、并发症发生等, 还可以调控AP的程序性细胞死亡, 并且可以作为AP的治疗靶点. 而本文主要是从miRNA方面研究其对AP凋亡的影响及其可能的作用机制.
本研究的主题是miR-216a-5p对AP增殖凋亡的影响, 拟解决的关键问题是了解miR-216a-5p是如何影响AP细胞的增殖和凋亡, 以及其和XIAP之间的关系及它们对AP的影响, 在AP中的发生发展机制, 为以后临床上的诊断治疗等提供新思路和新靶点.
研究的主要目标即miR-216a-5p, XIAP, AP之间的关系, 研究得到miR-216a-5p和XIAP均在AP中异常表达, 抑制miR-216a-5p表达和过表达XIAP均可抑制雨蛙素(caerulein, CAE)处理AR42J细胞凋亡, 且miR-216a-5p靶向负调控XIAP. 可以从调控AP凋亡的途径来调控其进展, 为其治疗提供新思路.
本研究首先是用CAE处理大鼠胰腺腺泡来构建AP的模型. 转染miR-216a-5p抑制表达和XIAP过表达的载体质粒, MTT检测细胞增殖活性, 流式细胞术检测细胞凋亡, Western blot检测XIAP蛋白表达, qRT-PCR检测miR-216a-5p和XIAP mRNA表达水平, 荧光素酶报告基因检测实验检测miR-216a-5p与XIAP之间的靶向关系.
本实验的结果是在CAE构建的AP模型细胞中, miR-216a-5p的表达水平升高. 抑制miR-216a-5p表达、过表达XIAP腺泡细胞凋亡率降低. miR-216a-5p靶向负调控XIAP, 抑制XIAP表达逆转了抑制miR-216a-5p对CAE处理AR42J细胞的凋亡抑制作用; 达到了本实验的目的, 对该领域AP的发病进展机制又增加了相关的理论依据, 以后可以进一步在临床方面进行研究应用.
miR-216a-5p靶向负调控XIAP; 抑制miR-216a-5p表达、过表达XIAP抑制腺泡细胞凋亡. 可以通过调控XIAP影响AP的进展. 从miRNA角度去研究其对AP的影响拓宽了研究的范围, 更多的miRNA影响AP的进展, 增加了可治疗的靶点. 不同的miRNA在AP中的表达不同, 可通过研究不同的miRNA及其不同的靶基因影响AP的进展进而拓展研究思路. miR-216a-5p可以调控XIAP影响腺泡细胞凋亡. 通过上调或下调miRNA可以影响AP的细胞的凋亡及其严重程度. 对未来临床实践提供了新的靶点和思路.
只是在理论层面上对小鼠模型的研究, 到临床上的研究和应用还相差甚远. 进一步深入的研究调控miR-216a-5p和XIAP对治疗AP小鼠的影响及其可能会产生的现象以及进一步往临床方向进行相关研究. 寻找更接近于真实AP的小鼠或者与人AP更为相似的受体, 再次基础上进行治疗, 同时观察其后期的反应和状况.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:刘继红
| 1. | 冯 小萌, 王 原. 急性胰腺炎发病机制及治疗研究进展. 世界最新医学信息文摘(电子版). 2017;17:26-30. [DOI] |
| 6. | Zhu H, Zeng Y, Zhou CC, Ye W. SNHG16/miR-216-5p/ZEB1 signal pathway contributes to the tumorigenesis of cervical cancer cells. Arch Biochem Biophys. 2018;637:1-8. [PubMed] [DOI] |
| 7. | Chen P, Quan J, Jin L, Lin C, Xu W, Xu J, Guan X, Chen Z, Ni L, Yang S, Chen Y, Lai Y. miR-216a-5p acts as an oncogene in renal cell carcinoma. Exp Ther Med. 2018;15:4039-4046. [PubMed] [DOI] |
| 8. | 安 宁, 李 宏敏, 于 瑞莲, 罗 树春, 张 明, 兰 海涛. miR-216a-5p通过下调MMP16表达抑制肺癌细胞的侵袭. 中国癌症杂志. 2015;25:588-594. [DOI] |
| 11. | 贾 重阳, 张 辰龙, 张 小强. micro RNAs在急性胰腺炎中的研究新进展. 中华卫生应急电子杂志. 2017;3:180-182. [DOI] |
| 12. | Endo K, Weng H, Kito N, Fukushima Y, Iwai N. MiR-216a and miR-216b as markers for acute phased pancreatic injury. Biomed Res. 2013;34:179-188. [PubMed] [DOI] |
| 13. | Kuśnierz-Cabala B, Nowak E, Sporek M, Kowalik A, Kuźniewski M, Enguita FJ, Stępien E. Serum levels of unique miR-551-5p and endothelial-specific miR-126a-5p allow discrimination of patients in the early phase of acute pancreatitis. Pancreatology. 2015;15:344-351. [PubMed] [DOI] |
| 14. | Zhang J, Ning X, Cui W, Bi M, Zhang D, Zhang J. Transforming growth factor (TGF)-β-induced microRNA-216a promotes acute pancreatitis via Akt and TGF-β pathway in mice. Dig Dis Sci. 2015;60:127-135. [PubMed] [DOI] |
| 15. | 邵 焕军, 赵 振伶, 郝 丽娜, 朱 家红, 孙 峰. miR-216a-5p靶向作用于PAK2对膀胱癌细胞增殖和凋亡影响的体外研究. 医学研究杂志. 2018;47:151-156. [DOI] |
| 16. | Sun Y, Hu B, Wang Y, Li Z, Wu J, Yang Y, Wei Y, Peng X, Chen H, Chen R, Jiang P, Fang S, Yu Z, Guo L. miR-216a-5p inhibits malignant progression in small cell lung cancer: involvement of the Bcl-2 family proteins. Cancer Manag Res. 2018;10:4735-4745. [PubMed] [DOI] |
| 17. | Yang B, Gao G, Wang Z, Sun D, Wei X, Ma Y, Ding Y. Long non-coding RNA HOTTIP promotes prostate cancer cells proliferation and migration by sponging miR-216a-5p. Biosci Rep. 2018;38. [PubMed] [DOI] |
| 18. | Wu Y, Zhang J, Zheng Y, Ma C, Liu XE, Sun X. miR-216a-3p Inhibits the Proliferation, Migration, and Invasion of Human Gastric Cancer Cells via Targeting RUNX1 and Activating the NF-κB Signaling Pathway. Oncol Res. 2018;26:157-171. [PubMed] [DOI] |
| 22. | 王 培培, 吴 建胜, 高 道键, 周 蒙滔, 方 佩佩, 贾 国葆, 孙 学成, 王 旦. 急性胰腺炎大鼠胰腺组织中Smac/DIABLO、XIAP mRNA的表达及其意义. 中华胰腺病杂志. 2010;10:177-179. [DOI] |
| 23. | 李 富龙, 王 晓素, 周 莉, 汤 瑾, 孙 吉. 清下化瘀方对急性胰腺炎大鼠胰腺细胞Survivin、XIAP及Smac的影响. 上海中医药大学学报. 2016;30:67-71. [DOI] |
| 24. | Liu Y, Zhou ZG, Zhou B, Wang R, Yan H, Li Y. Downregulation of GRP78 and XIAP is correlated with apoptosis during cerulein-induced acute pancreatitis in rats via regulation of caspase activation. Mol Med Rep. 2013;7:725-730. [PubMed] [DOI] |
| 25. | Moon K, Zhou SY, Lee SH, Owyang C, DiMagno MJ. HSP70 and XIAP are potential key molecular mechanisms causing impaired apoptosis and severe acute pancreatitis (AP) in cf mice. Pancreas. 2007;35:417. [DOI] |
| 26. | Liu Y, Chen XD, Yu J, Chi JL, Long FW, Yang HW, Chen KL, Lv ZY, Zhou B, Peng ZH, Sun XF, Li Y, Zhou ZG. Deletion Of XIAP reduces the severity of acute pancreatitis via regulation of cell death and nuclear factor-κB activity. Cell Death Dis. 2017;8:e2685. [PubMed] [DOI] |