修回日期: 2019-05-27
接受日期: 2019-06-07
在线出版日期: 2019-06-28
血管靶向药物是临床治疗肝脏肿瘤所取得的重大进步之一, 尤其对于不能行手术切除的晚期原发性肝细胞癌(hepatocellular carcinoma, HCC)患者, 其疗效确切. 超声造影是一种无创性血流灌注显示方法, 能实时动态反映肿瘤组织的微循环血流灌注, 可为临床评估HCC抗血管生成疗效提供血流动力学参考信息.
探讨超声造影在评估HCC抗血管生成疗效中的应用价值.
选取经肝穿刺活检病理证实的72例HCC患者作为研究对象(共72个病灶), 随机分为A组(36例)和B组(36例). A组接受经肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)治疗, B组接受TACE联合沙利度胺治疗. 所有患者分别于治疗前、治疗12 wk后行超声造影检查, 测量病灶血流灌注参数: 曲线下面积(area under curve, AUC)、峰值强度(peak intensity, PI), 同期测定血清血管内皮生长因子(vascular endothelial growth factor, VEGF)水平作比较分析.
B组治疗后AUC、PI以及血清VEGF水平分别低于各组治疗前, 差异有统计学意义(P<0.05); B组治疗后AUC、PI以及血清VEGF水平明显低于A组治疗后, 差异有统计学意义(P<0.05).
超声造影能定量分析HCC抗血管生成治疗后血流灌注参数变化, 有效评估HCC抗血管生成疗效, 具有一定应用价值.
核心提要: 超声造影能实时反映肿瘤组织的微循环血流灌注状态. 运用超声造影评估经肝动脉化疗栓塞术联合沙利度胺治疗原发性肝细胞癌前后病灶组织的血流灌注参数变化, 从而评估早期疗效.
引文著录: 仲康, 张亦青, 陈华. 原发性肝细胞癌抗血管生成治疗后血管内皮生长因子及血流灌注参数变化. 世界华人消化杂志 2019; 27(12): 786-790
Revised: May 27, 2019
Accepted: June 7, 2019
Published online: June 28, 2019
Vascular targeting drugs are one of the major advances in the treatment of liver tumors, especially for patients with advanced hepatocellular carcinoma (HCC) which cannot be resected surgically. Contrast-enhanced ultrasound is a non-invasive method for displaying perfusion. It can dynamically reflect microcirculation perfusion of tumor tissue in real time and provide hemodynamic information for clinical evaluation of anti-angiogenic effect on HCC.
To investigate the value of contrast-enhanced ultrasound in evaluating the effect of anti-angiogenic therapy in HCC.
Seventy-two patients with HCC (72 lesions) confirmed by pathology were randomly divided into either group A (36 cases) or group B (36 cases). Group A received transcatheter arterial chemoembolization (TACE). Group B received TACE combined with thalidomide. All patients were examined by contrast-enhanced ultrasound before treatment and 12 weeks after treatment. The parameters of blood perfusion including area under curve (AUC) and peak intensity (PI) were measured. Meanwhile, the levels of serum vascular endothelial growth factor (VEGF) were measured and compared.
The AUC, PI, and serum levels of VEGF after treatment were significantly lower than those before treatment in both groups A and B (P < 0.05), and these parameters after treatment were significantly lower in group B than in group A (P < 0.05).
Contrast-enhanced ultrasound can quantitatively analyze the changes of blood flow perfusion after anti-angiogenic therapy of HCC and effectively evaluate the effect of anti-angiogenic therapy in this malignancy.
- Citation: Zhong K, Zhang YQ, Chen H. Changes of serum vascular endothelial growth factor and perfusion parameters in hepatocellular carcinoma after anti-angiogenic therapy. Shijie Huaren Xiaohua Zazhi 2019; 27(12): 786-790
- URL: https://www.wjgnet.com/1009-3079/full/v27/i12/786.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i12.786
原发性肝细胞癌(hepatocellular carcinoma, HCC)是一种有着富血供特征的肝脏恶性肿瘤[1]. 对于不能手术切除的晚期HCC患者临床常采用经肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)联合抗血管生成药物进行治疗, 并在HCC非手术治疗中日益受到重视[2,3]. 因此, 寻找有效的疗效评估手段对于指导临床治疗意义重大. 本研究运用超声造影定量分析HCC患者经TACE联合沙利度胺治疗后血流灌注参数变化, 探讨超声造影在评估HCC抗肿瘤血管生成疗效中的应用价值.
选取2016-07/2018-12期间, 浙江萧山医院收治并经肝穿刺活检病理证实的72例HCC患者作为研究对象, 其中男58例, 女14例, 年龄31-68岁, 平均年龄50.64岁±8.32岁, 共计72个病灶, 病灶最大直径2.3-7.1 cm, 平均4.01 cm±1.33 cm. 入选标准: (1)均经肝穿刺活检病理证实为HCC; (2)均未接受过任何形式的放疗或化疗; (3)均存在转移, 不适合手术切除治疗; (4)估计生存期>3 mo; (5)非妊娠或哺乳期. 排除标准: (1)严重肝肾功能障碍; (2)对化疗药物过敏者; (3)肝功能为Child-Pugh C级. 随机分为两组: A组, 接受TACE治疗, 36例, 男28例, 女8例, 年龄31-68岁, 平均年龄51.89岁±8.58岁, 病灶最大直径2.3-7.1 cm, 平均4.08 cm±1.36 cm; B组, 接受TACE联合沙利度胺治疗, 36例, 男30例, 女6例, 年龄33~66岁, 平均年龄49.40岁±7.98岁, 病灶最大直径2.6-6.8 cm, 平均3.93 cm±1.32 cm. 两组间年龄(t = 1.272, P = 0.208)、性别(χ2 = 0.355, P = 0.551)、病灶最大直径(t = 0.484, P = 0.630)等一般资料比较差异无统计学意义(P>0.05). 本研究经浙江萧山医院医学伦理委员会审批同意, 患者均签署知情同意书.
A组患者接受TACE治疗: 局部浸润麻醉后, 采用Seldinger方法, 选取右侧股动脉进行穿刺, 置入导管至肝总动脉, 采用Yashiro导管行动脉造影, 观察病灶位置、大小及血供等情况. 采用2.7 F Progreat微导管超选插管病灶供血动脉, 采用20-50 mg盐酸阿霉素、5-20 mL碘油行化疗栓塞. 所有患者均接受1次TACE治疗. B组患者在A组基础上接受沙利度胺抗血管生成治疗: TACE治疗1 wk后, 每晚睡前顿服沙利度胺片(江苏常州制药厂), 以100 mg/d作为起始剂量, 1 wk后服用剂量增加至200 mg/d, 连续治疗12 wk.
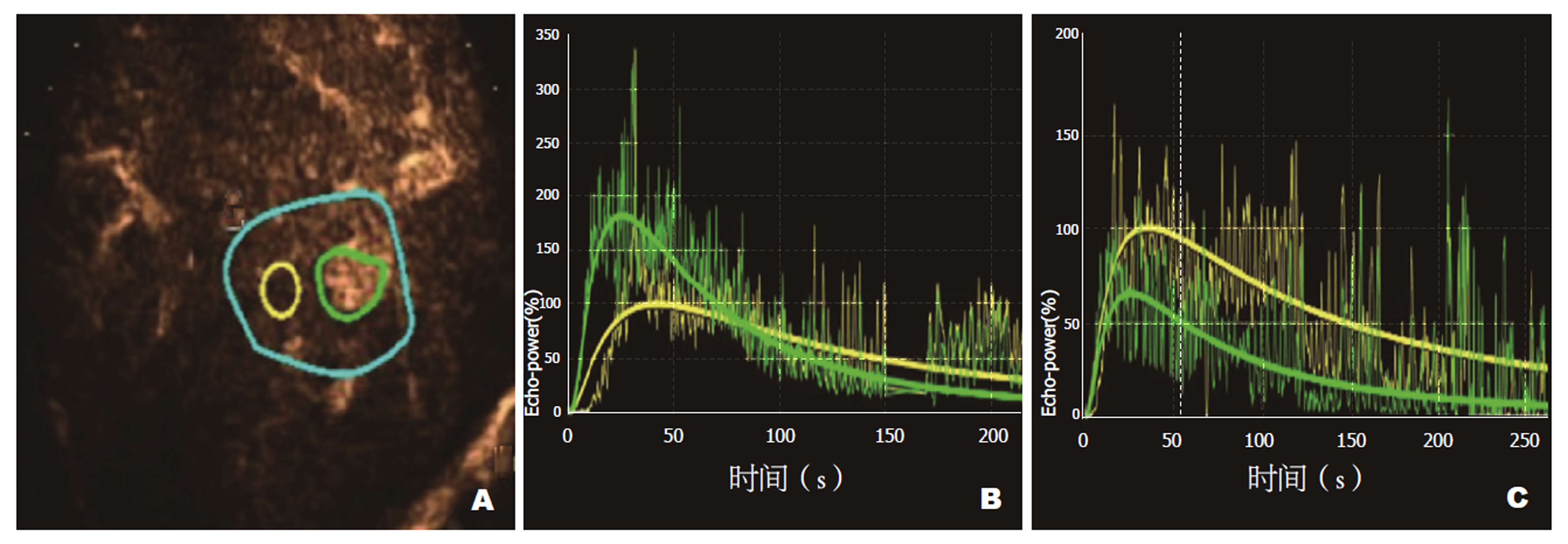
使用Acuson S2000超声诊断仪, 4C1探头, 探头频率4.0 MHz, 配有对比脉冲系列成像技术. 采用Bracco公司生产的Sono Vue作为超声造影剂, 按说明书制备成混悬液. 常规肝脏超声扫查, 明确病灶位置、形态、大小、边界等情况, 选择最佳显示切面, 进入超声造影模式, 以团注法经肘部浅静脉推注超声造影剂2.4 mL, 同步计时, 储存图像. 通过时间-强度曲线测定并记录病灶的曲线下面积、峰值强度(图1).
清晨, 空腹状态, 采用乙二胺四乙酸二钾抗凝管收集5 mL肘部静脉血, 低温状态下离心15 min(3000 r/min)分离血清, 保存于-20 ℃冰箱. 采用酶联免疫吸附试验测定血清VEGF水平.
统计学处理 采用SPSS 19.0版本软件包处理数据. 采用mean±SD表示计量资料, 组间比较用独立样本t检验, 组内治疗前后比较用配对样本t检验. 采用(%)表示计数资料, 组间比较用χ2检验. P<0.05为差异有统计学意义.
治疗前两组间AUC以及PI比较差异无统计学意义(P>0.05); A、B组治疗后AUC、PI分别低于各组治疗前, 差异有统计学意义(P<0.05); B组治疗后AUC、PI明显低于A组治疗后, 差异有统计学意义(P<0.05). 见表1.
HCC在全球范围内有着较高发病率及死亡率, 在我国尤为突出, HBV/HCV感染是其主要致病因素[4]. HCC发病较为隐匿, 部分患者被确诊时已处于晚期, 无法行手术切除治疗. 对于不可切除性HCC, TACE是其主要治疗手段之一[5]. TACE将抗肿瘤药物经动脉灌注入病灶组织, 不仅阻断病灶血液及营养供应, 而且使抗肿瘤药物滞留在病灶组织内缓慢释放, 以达到有效杀灭肿瘤细胞目的[6]. 单独TACE可取得的治疗效果有限, 临床常在TACE 基础上联合抗肿瘤血管生成治疗以进一步提高疗效. 因此有效的疗效评估手段有着重要临床意义.
大量病理研究证实HCC属于富血供肿瘤, 病灶内存在大量新生微小血管, 这些新生微小血管在结构上与正常血管存在显著差异, 如血管异常分支众多、扭曲、扩张, 血管网结构紊乱, 内皮细胞间隙大, 血管通透性强, 血管发育不成熟, 管内支持结构缺失, 基底膜缺失, 动静脉短路大量存在等, 上述病理结构特征可导致HCC病灶内血流灌注异常[7]. 抗肿瘤血管生成治疗主要针对肿瘤新生血管发挥作用, 可导致肿瘤内血流动力学参数发生改变, 通过监测上述参数变化有助于临床评价疗效[8]. 超声造影所使用的微泡造影剂属于纯血池造影剂, 能实时动态显示灌注组织的微循环血流灌注状态, 且通过时间-强度曲线能定量分析感兴趣区域组织微血管的血流动力学参数变化. 本研究结果显示: A、B组治疗后AUC、PI分别低于各组治疗前(P<0.05), 而B组治疗后AUC、PI明显低于A组治疗后(P<0.05), 证实了TACE联合沙利度胺治疗HCC有助于进一步提高治疗效果, 使HCC患者取得更为显著的治疗收益. 原因可能是沙利度胺是一种强力有效的抗肿瘤血管生成药物, 其一方面可通过抑制肿瘤组织的血管生成, 减少肿瘤组织的血液供应, 从而发挥抑制肿瘤生长作用[9], 另一方面可通过阻滞细胞生长周期, 使其停止于G1期, 并诱导肿瘤细胞凋亡, 从而实现抗肿瘤作用[10]. 本研究结果同时提示超声造影能通过定量监测HCC抗血管生成治疗前后血流灌注参数变化, 有效评估HCC抗血管生成疗效, 从而为临床评估治疗效果提供一种无创性影像学方法.
VEGF是一种作用强、特异性高且针对血管内皮细胞的促血管生成因子, 可降解血管外基质, 刺激血管内皮细胞增殖, 使内皮细胞发生分裂并迁移继而促进新生血管形成. VEGF在肿瘤发生发展、侵袭浸润、远处转移的各阶段发挥着重要作用, 可增加血管通透性, 致使病灶组织血流动力学发生改变[11]. 既往研究证实, HCC增强CT扫描时动脉相强化程度, 血管造影时染色程度, 增强MRI时血流等级均与VEGF表达密切相关[12-14], 而血清VEGF水平可作为评估TACE疗效的有效监测指标[15]. 本研究结果显示: A、B组治疗后血清VEGF水平分别低于各组治疗前(P<0.05), 而B组治疗后血清VEGF水平明显低于A组治疗后(P<0.05), 进一步说明TACE联合沙利度胺治疗HCC的疗效明显优于单纯TACE治疗. 同时提示沙利度胺通过抑制HCC的微小血管生成发挥着抗肿瘤作用, 伴随着血清VEGF水平的下降, 反映HCC血流量的超声造影血流灌注参数(AUC、PI)随之下降, 从另一个侧面反映了运用超声造影评估HCC抗血管生成疗效具有可行性.
总之, 超声造影能定量分析HCC抗血管生成治疗后血流灌注参数变化, 有效评估HCC抗血管生成疗效, 具有一定临床应用价值.
抗血管生成治疗是原发性肝细胞癌(hepatocellular carcinoma, HCC)的重要治疗方法之一, 准确的疗效评估有助于指导临床用药, 而影像学以及检验学指标在其早期疗效评估方面发挥着重要作用.
本研究运用超声造影分析HCC经肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)联合沙利度胺治疗前后血流灌注变化, 探讨超声造影在评估HCC抗血管生成疗效中的应用价值, 以期为临床评估疗效提供无创性影像学方法.
探讨HCC经抗血管生成治疗后超声造影血流灌注参数以及血清血管内皮生长因子(vascular endothelial growth factor, VEGF)水平变化. 结果显示HCC经抗血管生成治疗后超声造影血流灌注参数以及血清VEGF水平发生明显变化, 可为临床早期评估疗效提供有价值参考.
本研究采用了超声造影以及血清VEGF水平测定来评估HCC抗血管生成疗效. 超声造影能无创性定量反映肿瘤组织的微循环血流灌注状态, 而血清VEGF水平能有效反映肿瘤微小血管的生成状态.
本篇论文的研究达到实验目标并取得以下研究结果: HCC经抗血管生成治疗后曲线下面积、峰值强度以及血清VEGF水平明显下降. 说明超声造影能有效反映病灶血流灌注状态变化, 联合血清VEGF水平测定能为临床评估HCC抗血管生成疗效提供有价值参考.
HCC经抗血管生成治疗后超声造影血流灌注参数以及血清VEGF水平发生明显变化, 证实了超声造影结合血清VEGF水平监测能有效评估HCC抗血管生成疗效. 超声造影能反映肿瘤的微循环血流灌注状态, 而血清VEGF水平能反映肿瘤微小血管生成状态. 两者结合能从不同角度有效反映HCC抗血管生成疗效, 可为临床疗效评估提供一种可靠方法, 具有一定应用价值.
超声造影时病灶位置靠近胃肠道或膈顶, 容易受气体干扰而导致图像质量下降, 影响观察结果. 未来我们将运用动态三维超声造影结合其它监测指标评估TACE联合沙利度胺对HCC的疗效.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:刘继红
| 1. | Moudgil S, Kalra N, Prabhakar N, Dhiman RK, Behera A, Chawla YK, Khandelwal N. Comparison of Contrast Enhanced Ultrasound With Contrast Enhanced Computed Tomography for the Diagnosis of Hepatocellular Carcinoma. J Clin Exp Hepatol. 2017;7:222-229. [PubMed] [DOI] |
| 2. | Gomes AS, Monteleone PA, Sayre JW, Finn RS, Sadeghi S, Tong MJ, Britten CD, Busuttil RW. Comparison of Triple-Drug Transcatheter Arterial Chemoembolization (TACE) With Single-Drug TACE Using Doxorubicin-Eluting Beads: Long-Term Survival in 313 Patients. AJR Am J Roentgenol. 2017;209:722-732. [PubMed] [DOI] |
| 3. | De Mattia E, Cecchin E, Polesel J, Bignucolo A, Roncato R, Lupo F, Crovatto M, Buonadonna A, Tiribelli C, Toffoli G. Genetic biomarkers for hepatocellular cancer risk in a caucasian population. World J Gastroenterol. 2017;23:6674-6684. [PubMed] [DOI] |
| 4. | Ozakyol A. Global Epidemiology of Hepatocellular Carcinoma (HCC Epidemiology). J Gastrointest Cancer. 2017;. [PubMed] [DOI] |
| 5. | Onizuka H, Sueyoshi E, Ishimaru H, Sakamoto I, Uetani M. Arterial injury during transcatheter arterial chemoembolization for hepatocellular carcinoma: predictors of risk and outcome. Abdom Radiol (NY). 2017;42:2544-2550. [PubMed] [DOI] |
| 6. | Shiozawa S, Usui T, Kuhara K, Tsuchiya A, Miyauchi T, Kono T, Shimojima Y, Asaka S, Yamaguchi K, Yokomizo H, Shimakawa T, Yoshimatsu K, Katsube T, Naritaka Y. Significance of Transcatheter Arterial Chemoembolization for BCLC Stage B Hepatocellular Carcinoma with Mal-Nutrition. Gan To Kagaku Ryoho. 2018;45:350-352. [PubMed] [DOI] |
| 11. | Roskoski R. Vascular endothelial growth factor (VEGF) and VEGF receptor inhibitors in the treatment of renal cell carcinomas. Pharmacol Res. 2017;120:116-132. [PubMed] [DOI] |
| 12. | 胡 哲, 王 培恩, 瞿 海江. TACE联合索拉菲尼治疗晚期肝癌患者的疗效及对血清VEGF、CTGF、HIF-1α及OPN水平的影响. 中国生化药物杂志. 2017;20:345-347. [DOI] |