修回日期: 2017-12-27
接受日期: 2018-01-06
在线出版日期: 2018-02-18
探讨恩替卡韦与阿德福韦酯对乙型病毒性肝炎失代偿性肝硬化患者临床疗效、甲状腺功能及肝功能的影响.
选取浙江中医药大学附属第二医院从2014-09/2016-09收治的120例乙型病毒性肝炎失代偿性肝硬化患者, 按随机数字表法均分为两组: 两组均给予常规治疗, 对照组60例, 在常规治疗基础上给予阿德福韦酯治疗; 观察组60例, 在常规治疗基础上给予恩替卡韦治疗. 治疗3、6和12 mo后, 观察两组患者的乙型肝炎病毒(hepatitis B virus, HBV)DNA转阴率、乙型肝炎e抗原(hepatitis B e antigen, HBeAg)转阴率、Child-Pugh评分、肝功能、甲状腺功能、并发症发生率、死亡率及药物不良反应发生率等.
治疗3、6及12 mo后, 观察组HBV DNA转阴率明显高于对照组, 差异具有统计学意义(P<0.05); 两组HBeAg转阴率差异均无统计学意义(P>0.05); 治疗12 mo后, 观察组Child-Pugh评分明显低于对照组, 差异具有统计学意义(P<0.05). 两组患者谷丙转氨酶、谷草转氨酶、总胆红素水平均明显低于治疗前(P<0.05), 且观察组明显低于对照组, 差异具有统计学意义(P<0.05). 两组患者治疗1年后, T3、T4、FT3、FT4表达水平均高于治疗前水平(P<0.05), 且观察组明显高于对照组, 差异具有统计学意义(P<0.05); TSH明显低于治疗前水平, 且观察组明显低于对照组, 差异具有统计学意义(P<0.05). 两组患者并发症总发生率、总死亡率差异无统计学意义(P>0.05), 但观察组均略低于对照组; 两组未出现严重药物不良反应.
恩替卡韦对乙型肝炎肝硬化失代偿的患者的临床疗效显著, 同时能够改善肝功能及甲状腺功能, 且安全性好, 值得推广应用.
核心提要: 恩替卡韦是一种新型的鸟嘌呤核苷类似物抗病毒药物, 有研究表明, 其抑制乙型病毒性肝炎DNA多聚酶活性及抑制病毒逆转录和复制的作用较阿德福韦酯更强, 且耐药性低. 本文就对该两种药物的疗效及安全性进行研究.
引文著录: 程燕, 颜默磊, 王玲, 刘旺森. 恩替卡韦与阿德福韦酯对乙型病毒性肝炎失代偿性肝硬化患者甲状腺功能和肝功能的影响. 世界华人消化杂志 2018; 26(5): 311-317
Revised: December 27, 2017
Accepted: January 6, 2018
Published online: February 18, 2018
To explore the effect of entecavir and adefovir dipivoxil on thyroid function and liver function in patients with decompensated hepatitis B cirrhosis.
One hundred and twenty patients with decompensated hepatitis B cirrhosis treated from September 2014 to September 2016 at our hospital were randomly divided into an observation group (n = 60) and a control group (n = 60). Both groups received conventional treatment. The control group was additionally given adefovir dipivoxil, and the observation group was given entecavir. At 3, 6, and 12 mo after treatment, hepatitis B virus (HBV) DNA negative rate, HBeAg negative rate, Child-Pugh score, liver function, thyroid function, the incidence of complications, mortality, and the incidence of adverse drug reactions were observed.
At 3, 6, and 12 mo after treatment, HBV DNA negative rates were significantly higher in the observation group than in the control group (P < 0.05), although there was no significant difference in hepatitis B e antigen negative rates (P > 0.05); the Child-Pugh scores and serum levels of alanine transaminase, aspartate transaminase, and total bilirubin were significantly lower in the observation group than in the control group (P < 0.05). After treatment for 1 year, the levels of T3, T4, FT3, and FT4 were significantly higher and that of TSH was significantly lower in the observation group than in the control group (P < 0.05). There was no significant difference in the incidence of complications or mortality (P > 0.05), and no severe adverse reactions were observed in either group.
Entecavir is significantly effective in patients with decompensated hepatitis B cirrhosis and can improve liver function and thyroid function with good safety.
- Citation: Cheng Y, Yan ML, Wang L, Liu WS. Effect of entecavir and adefovir dipivoxil on thyroid function and liver function in patients with decompensated hepatitis B cirrhosis. Shijie Huaren Xiaohua Zazhi 2018; 26(5): 311-317
- URL: https://www.wjgnet.com/1009-3079/full/v26/i5/311.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i5.311
乙型病毒性肝炎(hepatitis B virus, HBV)在我国发病率较高, 主要是由HBV感染而引起的传染性疾病, 主要对肝脏造成损伤, 危害性极大. 随着病情的进展, 5年内发展成为肝硬化的可能高达10%-20%, 少部分患者可以继续发展进入肝硬化失代偿期或肝癌[1-4]. 一旦进入失代偿期, 患者将出现严重的肝功能损伤及门脉高压等一系列的并发症, 治疗难度大、费用高, 严重影响患者的生存质量及生命健康.
目前, HBV肝硬化失代偿患者主要给予抗病毒、改善肝功能及防治并发症等治疗. 阿德福韦酯是临床应用较为广泛的抗HBV药物, 但其疗效一般且不良反应多; 恩替卡韦是一种新型核苷酸类似物, 有研究[5-8]表明, 该药抗病毒能力更好. 故本研究主要探讨恩替卡韦与阿德福韦酯对HBV肝硬化失代偿期患者临床疗效、甲状腺功能及肝功能的影响, 取得了较为满意的效果, 现报道如下.
1.1.1 一般材料: 选取浙江中医药大学附属第二医院从2014-09/2016-09收治的120例HBV肝硬化失代偿性患者, 按随机数字表法均分为两组: 对照组和观察组均为60例. 两组患者一般资料差异无统计学意义(P>0.05), 具有可比性(表1).
| 一般资料 | 观察组 | 对照组 | χ2/t值 | P值 |
| 年龄 (岁) | 53.1 ± 9.8 | 54.2 ± 9.5 | -0.623 | 0.534 |
| 男性 (男/女)(例) | 35 ± 25 | 37/23 | 0.139 | 0.709 |
| HBV肝炎病程 (年) | 9.8 ± 2.8 | 10.5 ± 3.1 | -1.298 | 0.197 |
| 肝硬化病程 (年) | 4.3 ± 1.6 | 4.1 ± 1.5 | 0.706 | 0.481 |
| HBV DNA (lgcopies/mL) | 5.8 ± 1.5 | 5.6 ± 1.5 | 0.730 | 0.467 |
| Child-Pugh评分 | 9.5 ± 1.8 | 9.8 ± 1.7 | -0.939 | 0.350 |
1.1.2 入选及排除标准: 入选标准: 符合中华医学会肝病学分会2015年制定的《慢性乙型肝炎防治指南》[9]诊断标准, 所有患者均诊断为HBV肝硬化失代偿期; HBV DNA大于1000 copies/L; Child-Pugh评分>7分, 肝功能分级为B级以上; 近半年未服用抗病毒药物; 本研究通过浙江中医药大学附属第二医院伦理学委员会审议; 知情同意. 排除标准: 患有严重心、脑、肾等脏器疾病; 患有其他代谢或免疫性疾病; 患有甲状腺疾病; 对恩替卡韦和阿德福韦酯过敏患者; 妊娠或哺乳期妇女.
两组患者从入组开始均给予利尿、输注血浆、营养支持及防治并发症等常规治疗. 对照组在此基础上给予阿德福韦酯(商品名: 阿迪仙, 生产厂家: 珠海联邦制药股份有限公司中山分公司, 国药准字H20070123, 10 mg/粒), 口服, 1粒/次, 1次/d; 观察组给予在常规治疗基础上恩替卡韦(商品名: 和恩, 生产厂家: 海南中和药业股份有限公司, 国药准字: H20100064, 0.5 mg/片), 口服, 1片/次, 1次/d. 两组疗程为1年.
观察两组患者的HBV DNA转阴率、乙型肝炎e抗原(hepatitis B e antigen, HBeAg)转阴率、Child-Pugh评分、肝功能、甲状腺功能、并发症发生率、死亡率及药物不良反应发生率. 采用美国伯乐Bio-rad T100 PCR仪检测HBV DNA及HBeAg的表达水平; 采用美国贝克曼库尔特AU5800型全自动生化分析仪检测肝功能谷草转氨酶(aspartate transaminase, AST)、谷丙转氨酶(alanine transaminase, ALT)及总胆红素(total bilirubin, TBIL)等表达水平; 采用上海恒远生物科技有限公司提供的放射免疫试剂盒检测甲状腺功能T3、T4、FT3、FT4及TSH的表达水平. Child-pugh评分按照Child提出的分级标准进行计分, 总共从一般状况、血清胆红素、凝血酶原时间、腹水及血清白蛋白浓度5个方面按3个级别分别计1-3分, 总分15分, 分数越高, 代表肝脏储备功能越差.
统计学处理 采用SPSS18.0软件, 计量资料均采用mean±SD表示, 计量资料组间比较采用t检验, 计数资料组间比较采用χ2检验, 检验水准取α = 0.05, P<0.05为差异有统计学意义.
治疗3、6及12 mo后, 两组HBV DNA转阴率差异均具有统计学意义(P<0.05), 观察组明显高于对照组; 两组HBeAg转阴率差异均无统计学意义(P>0.05); 治疗12 mo, 观察组Child-Pugh评分明显低于对照组(6.08分±1.27分 vs 6.95分±1.59分), 差异具有统计学意义(t = -3.312, P = 0.001, 表2).
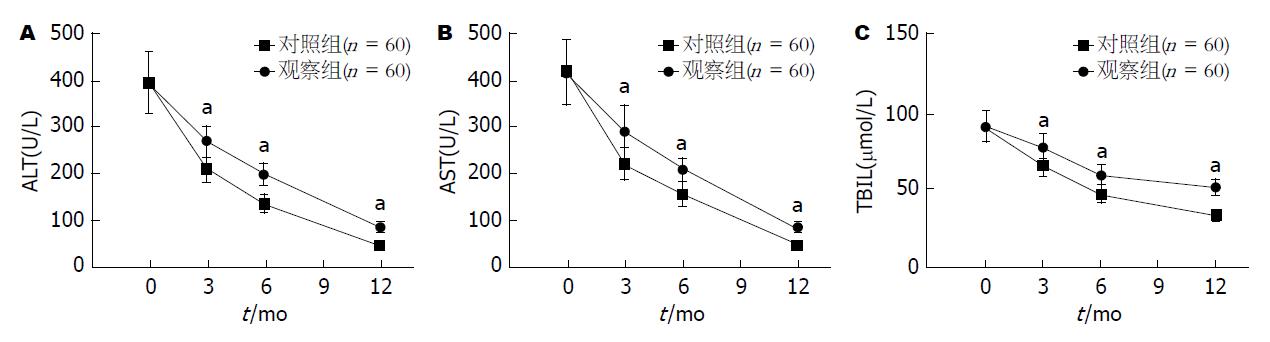
两组患者治疗前血清ALT、AST、TBIL差异无统计学意义(P>0.05), 治疗3、6及12 mo后两组ALT、AST、TBIL水平均明显低于治疗前(P<0.05), 且观察组明显低于对照组, 差异具有统计学意义(P<0.05, 图1).
两组患者治疗1年后, T3、T4、FT3、FT4表达水平均高于治疗前水平(P<0.05), 且观察组明显高于对照组, 差异具有统计学意义(P<0.05); TSH明显低于治疗前水平, 且观察组明显低于对照组, 差异具有统计学意义(P<0.05, 表3).
| 分组 | FT3 (pmol/L) | FT4 (pmol/L) | T3 (nmol/L) | T4 (nmol/L) | TSH (uU/mL) | |||||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | |
| 观察组 | 2.3 ± 1.1 | 4.6 ± 1.5ac | 8.1 ± 4.0 | 11.3 ± 3.8ac | 0.8 ± 0.5 | 1.6 ± 0.7ac | 56.2 ± 21.3 | 99.5 ± 35.8ac | 6.6 ± 4.9 | 2.8 ± 1.3ac |
| 对照组 | 2.2 ± 1.2 | 3.5 ± 1.3a | 8.2 ± 4.3 | 9.6 ± 3.2a | 0.7 ± 0.6 | 1.1 ± 0.5a | 57.5 ± 23.9 | 75.5 ± 30.7a | 6.5 ± 4.6 | 3.5 ± 1.5a |
| t值 | 0.468 | 4.22 | -0.132 | 2.651 | 0.992 | 4.502 | -0.315 | 3.943 | 0.115 | -2.732 |
| P值 | 0.641 | <0.01 | 0.895 | 0.009 | 0.323 | <0.01 | 0.754 | 0.001 | 0.908 | 0.007 |
两组患者总并发症发生率分别为15.0%和26.67%, 差异无统计学意义, 但观察组总发生率稍低于对照组; 两组总死亡率分别为5%和8.33%, 差异无统计学意义, 观察组死亡率稍低于对照组; 两组治疗期间均未出现严重药物不良反应(表4).
| 分组 | 消化道出血 | 肝性脑病 | 肝肾综合征 | 并发症发生率 | 总死亡率 |
| 观察组 | 4 (6.67) | 3 (5.00) | 2 (3.33) | 9 (15.00) | 3 (5.00) |
| 对照组 | 5 (8.33) | 8 (13.33) | 3 (5.00) | 16 (26.67) | 5 (8.33) |
| χ2值 | 0.120 | 1.746 | 0.209 | 1.875 | 0.536 |
| P值 | 0.729 | 0.186 | 0.647 | 0.116 | 0.464 |
HBV肝炎是一种见常见的传染性疾病, 发病率较高, 随着病情的进展, 可逐渐发展成为肝硬化. 由于现在生活习惯的改变, 肝硬化发病率也呈逐年增高的趋势, 部分肝硬化患者可以继续发展成为肝硬化失代偿期或肝癌. 肝硬化会引起肝细胞发生变性和坏死, 假小叶形成, 肝内结构发生变化, 形成不可逆的病理性改变[10-15], 因此, 治疗时间长、难度大, 且预后差, 严重危及患者的生命健康. 临床上主要给予抗病毒、改善肝功能及防治并发症等治疗.
阿德福韦酯是临床使用较为广泛的抗病毒药物, 他是一种单磷酸腺苷的核苷类似物, 进入细胞后被代谢转化为阿德福韦二磷酸盐, 该代谢物能通过与HBV DNA多聚酶的底物结合以及整合病毒DNA链, 进而抑制HBV DNA多聚酶活性, 从而抑制病毒的逆转录和复制[16-19]. 抗病毒小效果较好, 但耐药性高且不良反应较多. 恩替卡韦是一种新型的抗病毒药物, 是一种鸟嘌呤核苷类似物, 该药进入人体后, 被代谢为恩替卡韦三磷酸盐, 其半衰期长达15 h, 也是通过抑制HBV DNA多聚酶活性达到抑制病毒逆转录及复制的作用, 该复合物主要与天然底物竞争, 进而在HBV DNA多聚酶的启动、mRNA负链及正的合成起干扰作用, 从而抑制病毒逆转录和复制[20-23]. 有报道[24-26]提示, 该药的抗病毒能力强, 耐药性低. 本研究主要探讨恩替卡韦与阿德福韦酯对HBV肝炎失代偿性肝硬化患者临床疗效、甲状腺功能及肝功能的影响, 取得了较为满意的效果.
HBV DNA转阴率及HBeAg转阴率是用于评价临床治疗效果的常用指标, 可以明确HBV在体内的活跃程度及治疗效果, 转阴率越高, 说明抗病毒效果越好. 本研究表明: 两组HBeAg转阴率无明显差异. 治疗3、6及12 mo后, 两组HBV DNA转阴率均明显低于治疗前, 且恩替卡韦组转阴率明显高于阿德福韦酯组, 提示恩替卡韦抗病毒效果明显由于阿德福韦酯, 这与其他研究[27]结果一致. 可能与这几个机制有关: 首先, 恩替卡韦的耐药率更低, 更容易抑制HBV病毒; 其次, 恩替卡韦代谢产物三磷酸盐, 其半衰期更长, 可达15 h, 作用时间更加持久; 最后, 恩替卡韦代谢物能与HBV DNA多聚酶天然底物竞争, 在HBV DNA多聚酶的启动、mRNA负链及正的合成等多个方面抑制HBV的逆转录和复制. 因此, 恩替卡韦抗病毒效果更加优于阿德福韦酯.
Child-Pugh评分是临床常用的评价肝硬化患者肝脏储备功能的评分标准, 分数越高, 表明肝功能越差. ALT、AST、TBIL是反应患者肝细胞损伤及分泌功能的只要指标, 表达值越低, 表明肝细胞损伤的程度越轻[28,29]. 本研究表明: 治疗12 mo后, 恩替卡韦组Child-Pugh评分明显低于阿德福韦酯组, 提示恩替卡韦对患者肝功能恢复疗效更加显著. 治疗3、6及12 mo后, 两组ALT、AST、TBIL水平均明显低于治疗前, 且恩替卡韦组明显低于阿德福韦酯组, 提示恩替卡韦对患者肝细胞的保护作用更好, 对肝功的恢复作用更佳. 这与恩替卡韦具有更强的抗病毒能力密切有关, 不仅可以抑制HBV复制, 同时还可以抑制肝脏炎症, 减轻HBV对肝细胞的损伤以及肝纤维化的形成, 故对肝功效果更佳.
肝脏是人体最重要的代谢器官, 慢性肝硬化患者肝脏长期处于疾病状态, 代谢功能减退, 机体呈现低消耗、低代谢的特点, 因此, 肝硬化患者甲状腺激素常下降较为明显, 严重者甚至可能出现甲状腺功能减退症[30]. 本研究表明: 治疗1年后, T3、T4、FT3、FT4表达水平均高于治疗前水平, 且恩替卡韦组明显高于阿德福韦酯组, TSH明显低于治疗前水平, 且恩替卡韦组明显低于阿德福韦酯组, 提示患者甲状腺功能得到明显改善. 恩替卡韦有效地抑制了HBV DNA的复制, 肝损伤减轻, 肝功能得到改善, 患者的代谢情况自然而然就会得到改善. 此外, 两组患者总并发症发生率及死亡率差异无统计学意义, 但恩替卡韦组总发生率稍低于阿德福韦酯组, 且两组治疗期间均未出现严重药物不良反应, 因此恩替卡韦的安全性也较好.
总之, 恩替卡韦对HBV肝炎肝硬化失代偿的患者的临床疗效显著, 同时能够改善肝功能及甲状腺功能, 且安全性好, 值得推广应用. 尽管取得了较为满意的效果, 但本研究也存在一些不足, 由于条件限制, 本研究病例样本数量有待增加, 同时也可以行多中心研究. 总之, 可进一步完善和改进研究方案, 进一步证实研究结果.
目前, 乙型肝炎病毒(hepatitis B virus, HBV)肝硬化失代偿患者主要是给予抗病毒及防治并发症等治疗. 抗病毒治疗在根本上和长期预后来看, 是最重要的治疗. 阿德福韦酯是临床应用较为广泛的抗HBV药物, 但其疗效一般且不良反应多; 恩替卡韦是近年来发明的一种新型核苷酸类似物, 可以有效干扰HBV DNA多聚酶的启动、mRNA负链及正的合成, 进而达到抑制病毒逆转录及复制的作用, 有研究表明, 该药抗病毒能力更强. 目前针对这两种药物对甲状腺功能及肝功的研究有所欠缺, 故本研究从这方面进行了探讨研究.
本研究采用前瞻性对照研究方式探讨恩替卡韦与阿德福韦酯对HBV肝炎失代偿性肝硬化患者甲状腺功能和肝功能的影响, 旨在为临床治疗提供客观参考.
本研究通过前瞻性对照研究方式, 探讨恩替卡韦与阿德福韦酯对HBV肝炎失代偿性肝硬化患者甲状腺功能和肝功能的影响, 分析两种药物治疗的疗效及其对患者的甲状腺功能和肝功能的影响差异, 旨在选取一种对HBV肝炎失代偿性肝硬化患者治疗效果更佳的治疗方法.
将120例HBV肝炎失代偿性肝硬化患者按随机数字表法均分为对照组和观察组, 各60例. 两组均给予常规治疗, 对照组在常规治疗的基础上给予阿德福韦酯治疗, 观察组给予在常规治疗基础上恩替卡韦治疗. 两组疗程为1年. 观察两组患者的HBV DNA转阴率、乙型肝炎e抗原(hepatitis B e antigen, HBeAg)转阴率、Child-Pugh评分、肝功能、甲状腺功能、并发症发生率、死亡率及药物不良反应发生率. 本研究独特之处在于动态观察了两组HBV DNA转阴率、肝功能和甲状腺功能变化情况.
本研究的目的已经达到: 治疗3、6及12 mo后, 观察组HBV DNA转阴率明显高于对照组(P<0.05), 两组HBeAg转阴率差异均无统计学意义(P>0.05); 治疗12 mo后, 观察组Child-Pugh评分明显低于对照组(P<0.05); 治疗3、6及12 mo后, 观察组ALT、AST、TBIL水平均明显低于对照组(P<0.05); 治疗1年后, 观察组T3、T4、FT3、FT4水平明显高于对照组(P<0.05), TSH明显低于对照组(P<0.05); 两组患者并发症总发生率、总死亡率及不良反应发生率差异无统计学意义(P>0.05).
本研究对比分析了阿德福韦酯与恩替卡韦对HBV肝炎肝硬化失代偿患者的治疗效果, 得出了恩替卡韦的临床疗效和HBV DNA转阴率的效果更佳, 尤其是在能够改善肝功能及甲状腺功能方面效果较理想, 且安全性好的结果, 为今后临床治疗提供了一个可靠的治疗方法, 值得推广应用.
本研究表明了恩替卡韦对HBV肝炎肝硬化失代偿患者的临床疗效和HBV DNA转阴率的效果更佳, 能够改善肝功能及甲状腺功能, 且安全性好, 但本研究也存在一些不足, 比如观察时间不够长, 研究病例样本数量较少, 同时未行多中心研究. 总之, 可进一步完善和改进研究方案, 证实研究结果.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:杜冉冉
| 1. | 李 保欣, 李 俊红, 张 丽霞, 马 文波, 郭 力红, 申 伟, 佟 立新. 恩替卡韦与阿德福韦酯治疗乙型肝炎失代偿性肝硬化的临床疗效. 世界华人消化杂志. 2015;23:3460-3463. [DOI] |
| 2. | Park CH, Kim HY, Lee SW, Song do S, Song MJ, Kwon JH, You CR, Jang JW, Kim CW, Choi SW. On-treatment and off-treatment efficacy of entecavir in a real-life cohort of chronic hepatitis B patients. Eur J Gastroenterol Hepatol. 2016;28:1179-1187. [PubMed] [DOI] |
| 5. | 王 永华, 陈 雄兵, 张 佳光, 黄 利青, 石 次国, 谭 倩, 朱 晓微. 恩替卡韦和阿德福韦酯治疗乙型病毒性肝炎肝硬化合并糖尿病临床效果对比分析. 解放军医药杂志. 2017;29:71-77. [DOI] |
| 6. | Shen H, Ding F, Wang Z, Sun F, Yu Y, Zhou J, Xu W, Ni J, Wang J, Yang Y. Comparison of Telbivudine and Entecavir Therapy on Nephritic Function and Drug Resistance in Patients with Hepatitis B Virus-Related Compensated Cirrhosis. Cell Physiol Biochem. 2016;40:370-378. [PubMed] [DOI] |
| 7. | Han Y, Zeng A, Liao H, Liu Y, Chen Y, Ding H. The efficacy and safety comparison between tenofovir and entecavir in treatment of chronic hepatitis B and HBV related cirrhosis: A systematic review and Meta-analysis. Int Immunopharmacol. 2017;42:168-175. [PubMed] [DOI] |
| 10. | Su TH, Hu TH, Chen CY, Huang YH, Chuang WL, Lin CC, Wang CC, Su WW, Chen MY, Peng CY. Four-year entecavir therapy reduces hepatocellular carcinoma, cirrhotic events and mortality in chronic hepatitis B patients. Liver Int. 2016;36:1755-1764. [PubMed] [DOI] |
| 11. | Gai XD, Wu WF. Effect of entecavir in the treatment of patients with hepatitis B virus-related compensated and decompensated cirrhosis. Exp Ther Med. 2017;14:3908-3914. [PubMed] [DOI] |
| 12. | Sun Y, Wu K, Shen F, Qiu L, Chen B, Yu L, Chang S. Effects of the combined administration of entecavir and adefovir dipivoxil to improve hepatic fibrosis in hepatitis B patients with interferon resistance. Minerva Med. 2017;108:507-512. [PubMed] [DOI] |
| 13. | Chen CH, Lee CM, Lai HC, Hu TH, Su WP, Lu SN, Lin CH, Hung CH, Wang JH, Lee MH. Prediction model of hepatocellular carcinoma risk in Asian patients with chronic hepatitis B treated with entecavir. Oncotarget. 2017;8:92431-92441. [PubMed] [DOI] |
| 14. | Shi H, Li XY, Zhu JY, Lin CS, Zhang Y. [Clinical effect of entecavir versus tenofovir in treatment of HBeAg-positive chronic hepatitis B patients with a high viral load: a comparative analysis]. Zhonghua Ganzangbing Zazhi. 2017;25:721-725. [PubMed] [DOI] |
| 15. | Park JG, Lee YR, Park SY, Lee HJ, Tak WY, Kweon YO, Jang SY, Chun JM, Han YS, Hur K. Tenofovir, entecavir, and lamivudine in patients with severe acute exacerbation and hepatic decompensation of chronic hepatitis B. Dig Liver Dis. 2017; Oct 28. [Epub ahead of print]. [PubMed] [DOI] |
| 16. | Pan HY, Pan HY, Song WY, Zheng W, Tong YX, Yang DH, Dai YN, Chen MJ, Wang MS, Huang YC. Long-term outcome of telbivudine versus entecavir in treating higher viral load chronic hepatitis B patients without cirrhosis. J Viral Hepat. 2017;24 Suppl 1:29-35. [PubMed] [DOI] |
| 17. | Li SY, Li H, Xiong YL, Liu F, Peng ML, Zhang DZ, Ren H, Hu P. Peginterferon is preferable to entecavir for prevention of unfavourable events in patients with HBeAg-positive chronic hepatitis B: A five-year observational cohort study. J Viral Hepat. 2017;24 Suppl 1:12-20. [PubMed] [DOI] |
| 18. | Yang YM, Choi EJ. Renal safety of tenofovir and/or entecavir in patients with chronic HBV monoinfection. Ther Clin Risk Manag. 2017;13:1273-1285. [PubMed] [DOI] |
| 19. | Liao YJ, Li YC, Lee SW, Wu CY, Yang SS, Yeh HZ, Chang CS, Lee TY. Lamivudine versus entecavir in the rescue of chemotherapy-induced hepatitis B flare-up. J Chin Med Assoc. 2017;80:758-765. [PubMed] [DOI] |
| 20. | Kayaaslan B, Akinci E, Ari A, Tufan ZK, Alpat SN, Gunal O, Tosun S, Guner R, Tabak F. A long-term multicenter study: Entecavir versus Tenofovir in treatment of nucleos(t)ide analogue-naive chronic hepatitis B patients. Clin Res Hepatol Gastroenterol. 2017; Jul 27. [Epub ahead of print]. [PubMed] [DOI] |
| 21. | Okada M, Enomoto M, Kawada N, Nguyen MH. Effects of antiviral therapy in patients with chronic hepatitis B and cirrhosis. Expert Rev Gastroenterol Hepatol. 2017;11:1095-1104. [PubMed] [DOI] |
| 22. | Shaheen AA, AlMattooq M, Yazdanfar S, Burak KW, Swain MG, Congly SE, Borman MA, Lee SS, Myers RP, Coffin CS. Tenofovir disoproxil fumarate significantly decreases serum lipoprotein levels compared with entecavir nucleos(t)ide analogue therapy in chronic hepatitis B carriers. Aliment Pharmacol Ther. 2017;46:599-604. [PubMed] [DOI] |
| 23. | Li X, Jin Q, Xu H, Zhang Z, Zhou H, Yan D, Li D, Gao P, Niu J. Chronic hepatitis B patients with high liver fibrosis levels should receive antiviral treatment. Exp Ther Med. 2017;13:3624-3630. [PubMed] [DOI] |
| 24. | Sun M, Tan G, Song J, Wang J, Wu X. Profile of HBV polymerase gene mutations during entecavir treatment in patients with chronic hepatitis B. Clin Res Hepatol Gastroenterol. 2016;40:590-596. [PubMed] [DOI] |
| 25. | Yuan M, Wang W, Chen H, Lu J, He M, Liu C, Tang H, Wang L. ABCC4, ABCC5 and SLC28A1 polymorphisms: host genome on responses of chronic hepatitis B patients with entecavir treatment. Antivir Ther. 2016;21:689-696. [PubMed] [DOI] |
| 26. | Wang BQ, Wang YL, Shi KQ. Four-year entecavir therapy reduces hepatocellular carcinoma, cirrhotic events and mortality in chronic hepatitis B patients. Liver Int. 2017;37:309-310. [PubMed] [DOI] |
| 27. | Kim HY. Comparative Effectiveness of Lamivudine versus Entecavir in Patients with Hepatocellular Carcinoma: Watch out for Confounders! Gut Liver. 2016;10:869-870. [PubMed] [DOI] |
| 28. | Kim JH, Sinn DH, Kim K, Kim H, Gwak GY, Paik YH, Choi MS, Lee JH, Koh KC, Paik SW. Lamivudine versus Entecavir for Newly Diagnosed Hepatitis B Virus-Related Hepatocellular Carcinoma. Gut Liver. 2016;10:939-947. [PubMed] [DOI] |
| 29. | Tacke F, Kroy DC. Treatment for hepatitis B in patients with drug resistance. Ann Transl Med. 2016;4:334. [PubMed] [DOI] |
| 30. | Lee HA, Seo YS, Park SW, Park SJ, Kim TH, Suh SJ, Jung YK, Kim JH, An H, Yim HJ. Hepatitis B surface antigen titer is a good indicator of durable viral response after entecavir off-treatment for chronic hepatitis B. Clin Mol Hepatol. 2016;22:382-389. [PubMed] [DOI] |