修回日期: 2018-11-13
接受日期: 2018-11-29
在线出版日期: 2018-12-18
研究miR-133对胃癌(gastric cancer, GC)细胞增殖、迁移和侵袭的影响, 并探讨其作用机制.
运用qRT-PCR法检测组织和细胞中miR-133、JAK2的mRNA表达; 将miR-133组(转染miR-133 mimics)、miR-NC组(未转染细胞)、miR-133 inhibitors组(转染miR-133 inhibitors)、inhibitors-NC组(转染inhibitors)、JAK2 WT(载体psiCHECK2-JAK2-3ʹUTR WT和miR-133共转染)、JAK2 MUT(载体psiCHECK2-JAK2-3ʹUTR MUT和miR-133共转染)、miR-133+JAK2组(miR-133 mimics和JAK2共转染)、miR-133+Vector组(miR-133 mimics和pc-DNA 3.1共转染)均用脂质体法转染至AGS、MGC-803细胞; 用Western blot检测细胞中JAK2的蛋白表达; MTT法检测细胞增殖; Transwell法检测细胞迁移和侵袭; 双荧光素酶报告基因检测实验检测细胞荧光素酶活性.
与人癌旁组织、人正常胃黏膜细胞GES-1相比, GC组织、GC细胞AGS、MGC-803中miR-133均低表达, JAK2均高表达; 且过表达miR-133、沉默JAK2均可抑制GC细胞增殖、迁移和侵袭; JAK2为miR-133的靶点, 且回补JAK2可逆转miR-133对GC细胞增殖、迁移和侵袭的抑制作用.
miR-133可抑制GC细胞增殖、迁移和侵袭, 其可能与靶向JAK2有关, 将可为GC的临床诊断治疗提供新靶点.
核心提要: miR-133能抑制胃癌(gastric cancer, GC)细胞增殖、迁移和侵袭, 其作用机制可能为靶向JAK2. miR-133有望成为临床诊断治疗GC的新靶点.
引文著录: 彭玉平, 蒋红钢, 陈治横, 沈徐宁, 李进, 周元, 朱奕. miR-133靶向JAK2抑制胃癌细胞增殖、迁移和侵袭. 世界华人消化杂志 2018; 26(35): 2036-2045
Revised: November 13, 2018
Accepted: November 29, 2018
Published online: December 18, 2018
To investigate the role of miR-133 in the proliferation, migration, and invasion of gastric cancer (GC) cells, and to explore the underlying mechanism.
The expression of miR-133 and JAK2 mRNA in tissues and cells was detected by qRT-PCR. AGS and MGC-803 cells were transfected with miR-133 mimic (miR-133 group), miR-133 inhibitor (miR-133 inhibitor group), nonspecific inhibitor (inhibitor-NC group), psiCHECK2-JAK2-3 UTR WT vector and miR-133 mimic (JAK2 WT group), psiCHECK2-JAK2-3 UTR MUT vector and miR-133 mimic (JAK2 MUT group), miR-133 mimic and JAK2 (miR-133 + JAK2 group), or miR-133 mimic and pc-DNA 3.1 (miR-133 + vector group) using a liposome-mediated method. Untransfected cells (miR-NC group) were also included as a control. The protein expression of JAK2 was detected by Western blot. Cell proliferation was detected by MTT assay. Cell migration and invasion were detected by Transwell assay. The luciferase activity was detected by double luciferase reporter assay.
Compared with human paracancerous tissues or normal gastric mucosal cells (GES-1), miR-133 was down-regulated in GC tissues and GC cells (AGS and MGC-803), and JAK2 was highly expressed in GC tissues and AGS and MGC-803 cells (P < 0.05). Overexpression of miR-133 or silencing JAK2 could inhibit cell proliferation, migration, and invasion in GC cells. JAK2 is a target of miR-133, and JAK2 could rescue the inhibitory effect of miR-133 on cell proliferation, migration, and invasion in GC cells.
MiR-133 could inhibit the proliferation, migration, and invasion of GC cells via mechanisms possibly related to targeting of JAK2, which will provide a new target for the clinical diagnosis and treatment of GC.
- Citation: Peng YP, Jiang HG, Chen ZH, Shen XN, Li J, Zhou Y, Zhu Y. MiR-133 inhibits cell proliferation, migration, and invasion in gastric cancer cells by targeting JAK2. Shijie Huaren Xiaohua Zazhi 2018; 26(35): 2036-2045
- URL: https://www.wjgnet.com/1009-3079/full/v26/i35/2036.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i35.2036
2018年国际癌症研究机构发布亚洲癌症发病率和死亡率居首位, 其中胃癌(gastric cancer, GC)以8.2%的死亡率位居世界癌症死亡率第三, 其70%以上的病例存在于发展中国家, 以中国为首, 且呈逐年上升趋势[1]. miRNA为19-23个核苷酸组成的内源性单链非编码RNA, 其通过结合靶基因的3ʹ端非编码区, 降解靶基因或抑制翻译而调控基因表达, 其涉及细胞增殖、凋亡、分化、代谢和炎症, 调控细胞内稳态及各种细胞信号通路. 特定的miRNA可为癌基因或抑癌基因, 将正常细胞转化为癌细胞[2]. 甚至有研究证明, miRNA的表达可用来预测器官损伤、脓毒症的风险[3]. miR-133在多种消化系统恶性肿瘤中表达异常, 与肿瘤细胞的分化、增殖、迁移、侵袭和凋亡密切相关, 参与肿瘤的发生发展, 并影响治疗和预后[4]. 大量研究证实, miR-133在GC组织中低表达, 且与恶性程度呈负相关. 但miR-133在GC中的作用机制尚未完全清楚. 酪氨酸激酶2(Janus kinase 2, JAK2), 是Janus家族的非受体蛋白家族之一, 可作为原激酶介导STAT3磷酸化, 且在大多数肿瘤活化中均具有重要作用[5]. 梁斌等[6]研究报道, JAK2激酶抑制剂可抑制GC细胞的细胞侵袭, 其机制与下调MMP-2、MMP-9, 上调TIMP-1、TIMP-2有关[6]. 但JAK2在GC细胞中的作用机制尚未十分明白. 本研究将检测GC组织和细胞中miR-133、JAK2的表达, 观察过表达miR-133、沉默JAK2对GC细胞增殖、迁移、侵袭的影响, 揭示miR-133抑制GC细胞增殖、迁移、侵袭, 其机制可能与靶向JAK2有关, 为GC的预防和治疗提供新靶点.
组织标本收集于浙江省嘉兴市第一医院2017-03/2018-08期间外科手术切除的GC标本39例, 本研究经本医院医学伦理委员会批准, 所有患者及家属均签署知情同意书; 人正常胃黏膜细胞GES-1、GC细胞AGS、MGC-803均购自美国ATCC公司; DMEM培养基、胎牛血清、MTT、基质胶、胰蛋白酶均购自美国GIBCO公司; LipofectamineTM2000、BCA蛋白定量试剂盒、逆转录试剂盒和qRT-PCR试剂盒均购自大连Takara公司; PVDF膜购自德国罗氏诊断有限公司; SDS-PAGE 试剂盒、ECL发光液和RIPA蛋白裂解液均购自碧云天生物技术公司; 双荧光素酶报告基因检测试剂盒购自美国Promega公司; Transwell小室购自美国Coming公司; miR-133 mimics、miR-133 inhibitor、inhibitor-NC、pc-DNA 3.1均由上海吉玛公司合成; 凝胶成像分析仪购自柯达公司; 半干转膜仪购自美国BIO-RAD公司; ABI 7500型实时荧光定量PCR系统购自美国ABI公司; 紫外分光光度计购自美国Thermo公司; 细胞培养箱购自美国Forma Scientific公司; PCR 仪购自美国BIO-RAD公司.
1.2.1 细胞培养: 用含有10%胎牛血清的DMEM培养基培养人正常胃黏膜细胞GES-1和GC细胞AGS、MGC-803, 置于37 ℃, 5%CO2的培养箱中常规培养.
1.2.2 转染: 将AGS、MGC-803细胞, 均分成miR-133组(转染miR-133 mimics )、miR-NC组(未转染细胞)、miR-133 inhibitors组(转染miR-133 inhibitors)、inhibitors-NC组(转染inhibitors)、JAK2 WT(载体psiCHECK2-JAK2-3ʹUTR WT和miR-133共转染)、JAK2 MUT(载体psiCHECK2-JAK2-3ʹUTR MUT和miR-133共转染)、miR-133+JAK2组(miR-133 mimics和JAK2共转染)、miR-133+Vector组(miR-133 mimics和pc-DNA 3.1共转染)均按照LipofectamineTM2000试剂说明书转染至AGS、MGC-803细胞. 转染成功后, 用MTT法检测各组细胞的活力, Western blot检测各组细胞的miR-133、JAK2蛋白表达, Transwell法检测各组细胞的迁移、侵袭, 双荧光素酶报告基因检测实验检测各组细胞的荧光素酶活性.
1.2.3 qRT-PCR实验: Trizol法提取细胞和组织样本总RNA,并进行RNA定量. 按照逆转录反应试剂盒说明书操作, 合成模板链cDNA. 按照qRT-PCR试剂盒说明书操作步骤进行miR-133、JAK2的测定. 反应结束后通过分析Ct值, 以2-△△Ct法计算定量结果, 测定miR-133、JAK2的相对表达水平. 按照每个样品重复5次, 取平均值, 实验重复3次.
1.2.4 MTT实验: 取适量对数生长期的1.2.2转染组细胞, 培养至24 h、48 h和72 h时各加入20 μL 5 g/L的MTT溶液, 继续培养4 h, 取出后吸去上清, 每孔加入150 μL DMSO, 震荡待结晶充分溶解, 在490 nm波长下检测细胞吸光度(A). 每组设5个重复孔, 实验重复3次.
1.2.5 Western blot实验: 取适量对数生长期1.2.2各转染组细胞, RIPA裂解后, 提取总蛋白, 用BCA法蛋白定量后变性, 然后按照免疫印迹实验操作步骤进行蛋白电泳-转膜-封闭-Ⅰ抗孵育-Ⅱ抗孵育-显影曝光. 以目的条带灰度值与内参GADPH灰度值的比值表示目的蛋白的表达情况.
1.2.6 Transwell实验: 将对数生长期的1.2.2各转染组细胞以106个/孔接种于细胞6孔板, 常规培养至细胞融合度达80%时, 更换为无血清培养基培养过夜. 调整各组细胞密度为105个/mL, 取100 μL加入上室内, 600 μL含血清的培养基加入下室内, 细胞常规培养过夜. 取出小室, 用棉签擦去上室内的细胞, PBS洗涤2次, 甲醇固定30 min, 0.1%结晶紫染色20 min, PBS洗涤2次. 显微镜下观察小室下表面附着的迁移细胞, 随机取5个视野拍照计数, 取平均值.
将小室的上室涂薄层基质胶后, 再加入105个/mL的转染细胞100 μL, 其他操作与检测细胞迁移一样, 最后显微镜下观察小室下表面附着的细胞数量, 随机取5个视野拍照计算, 取平均值.
1.2.7 双荧光素酶报告基因检测实验: 取适量对数生长期的1.2.2各组细胞, Trizol细胞裂解液裂解, 取5 μL细胞裂解液与萤火虫荧光素酶缓冲液和5 μL底物, 混匀测荧光强度. 然后加入海肾荧光素酶缓冲液和5 μL腔肠素底物, 混匀, 再次测得海肾荧光素酶活性. psiCHECK2载体以萤火虫荧光素酶活性为内参, psiCHECK2-JAK2-3ʹUTR WT和psiCHECK2-JAK2-3ʹUTR MUT的表达为对照, 观察miR-133对JAK2表达的影响.
统计学处理 实验数据采用SPSS 13.0软件进行分析. 计量资料用mean±SD表示, 多组间数据比较采用单因素方差分析, 两两比较采用NFK-q检验, 以P<0.05表示差异有统计学意义.
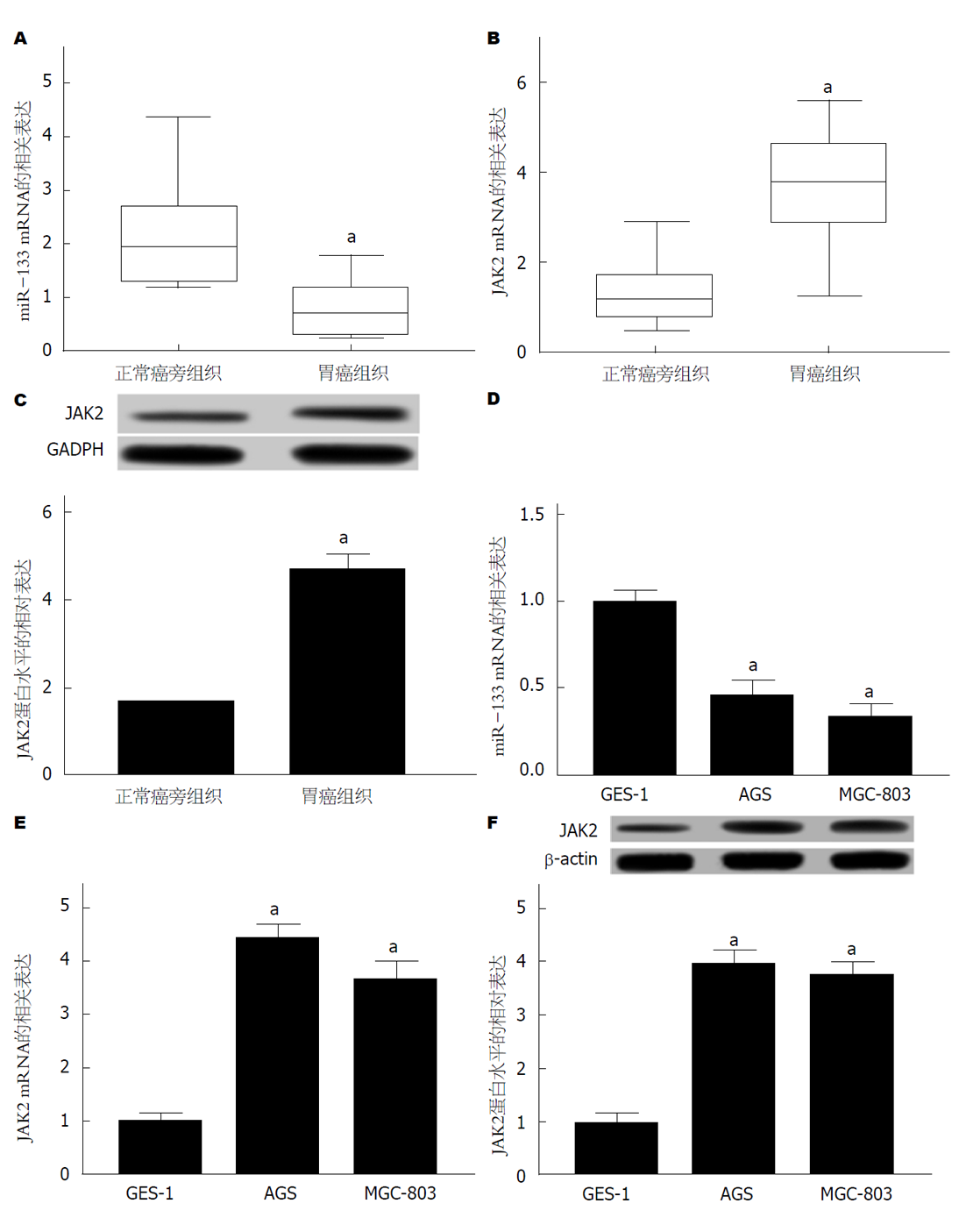
运用qRT-PCR检测GC组织和癌旁正常组织中miR-133 mRNA、JAK2 mRNA的相关表达, GC组织于癌旁正常组织, miR-133 mRNA表达显著降低(图1A), JAK2 mRNA表达显著升高(图1B); Western blot检测组织中JAK2的蛋白表达, GC组织于癌旁正常组织, JAK2蛋白表达显著升高(图1C), 均具有统计学意义(P<0.05). GC细胞AGS、MGC-803于人胃黏膜细胞GES-1, miR-133 mRNA表达显著降低(图1D), JAK2 mRNA表达显著升高(图1E), JAK2蛋白表达显著升高(图1F), 均具有统计学意义(P<0.05). 可见, miR-133在GC组织和GC细胞中低表达, JAK2在GC组织和GC细胞中高表达.
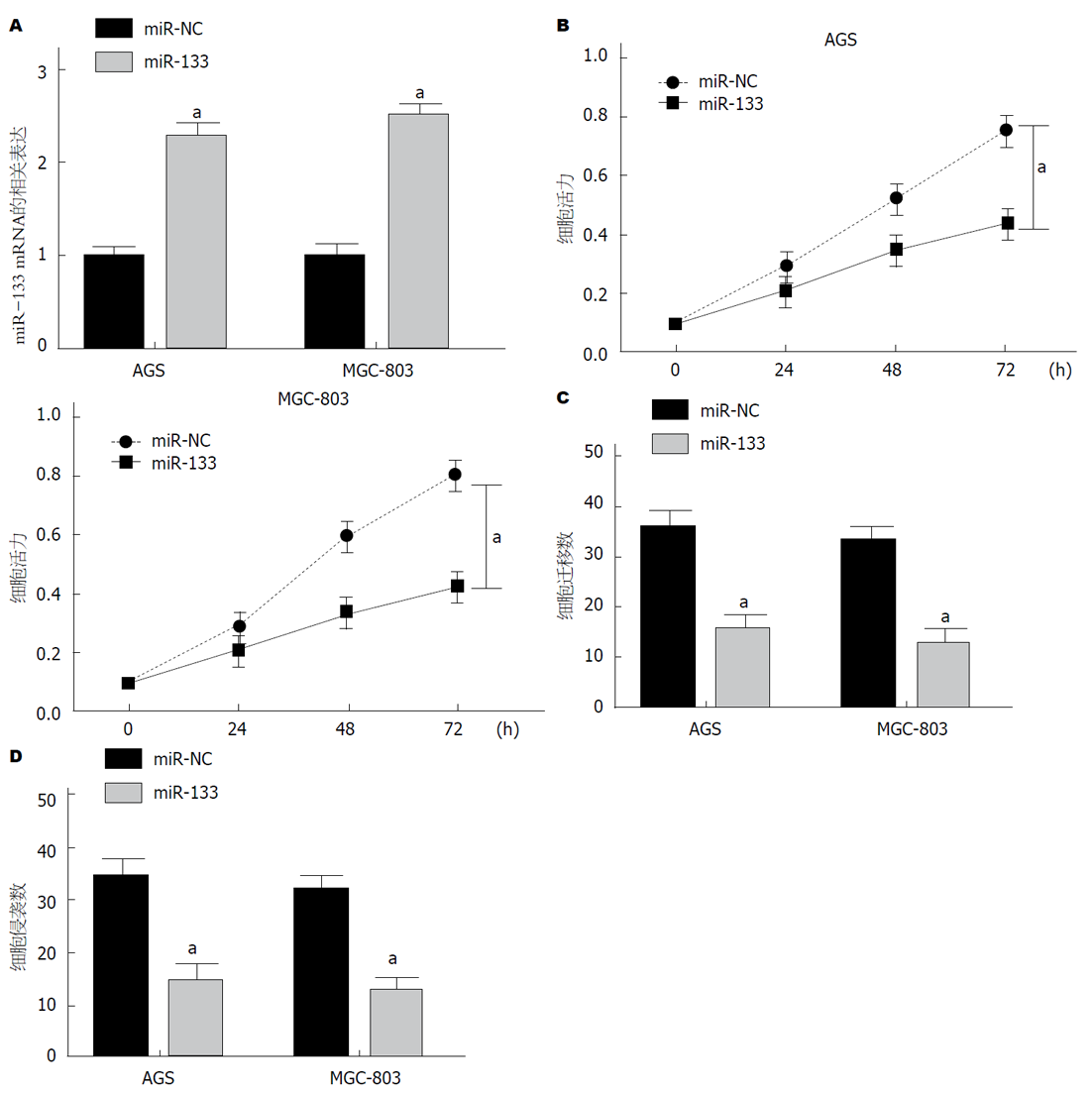
运用MTT法检测过表达miR-133的AGS、MGC-803细胞增殖, Transwell法检测过表达miR-133的AGS、MGC-803细胞迁移数和侵袭数. miR-133组于miR-NC组GC细胞AGS、MGC-803, miR-133 mRNA表达均显著升高(图2A), 细胞增殖均显著降低(图2B), 细胞迁移数显著降低(图2C), 细胞侵袭数显著降低(图2D), 均具有统计学意义(P<0.05). 可见, 过表达miR-133抑制GC细胞增殖、迁移、侵袭.
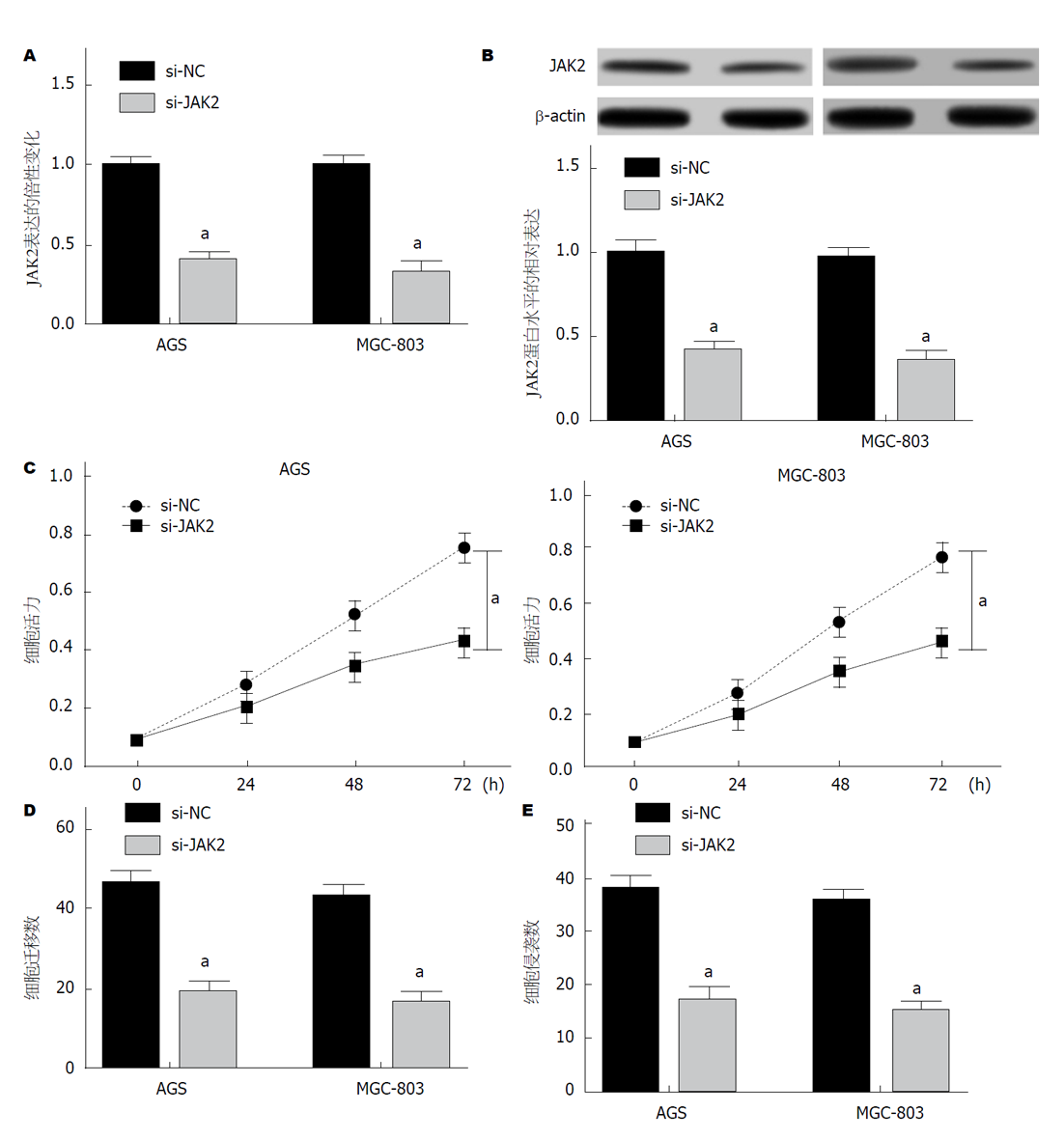
si-JAK2组于si-NC组AGS、MGC-803细胞, JAK2表达均显著降低(图3A), JAK2蛋白表达均显著降低(图3B); 细胞增殖均显著降低(图3C), 细胞迁移数均显著降低(图3D), 细胞侵袭数均显著降低(图3E), 均具有统计学意义(P<0.05). 可见, 沉默JAK2抑制GC细胞增殖、迁移、侵袭.
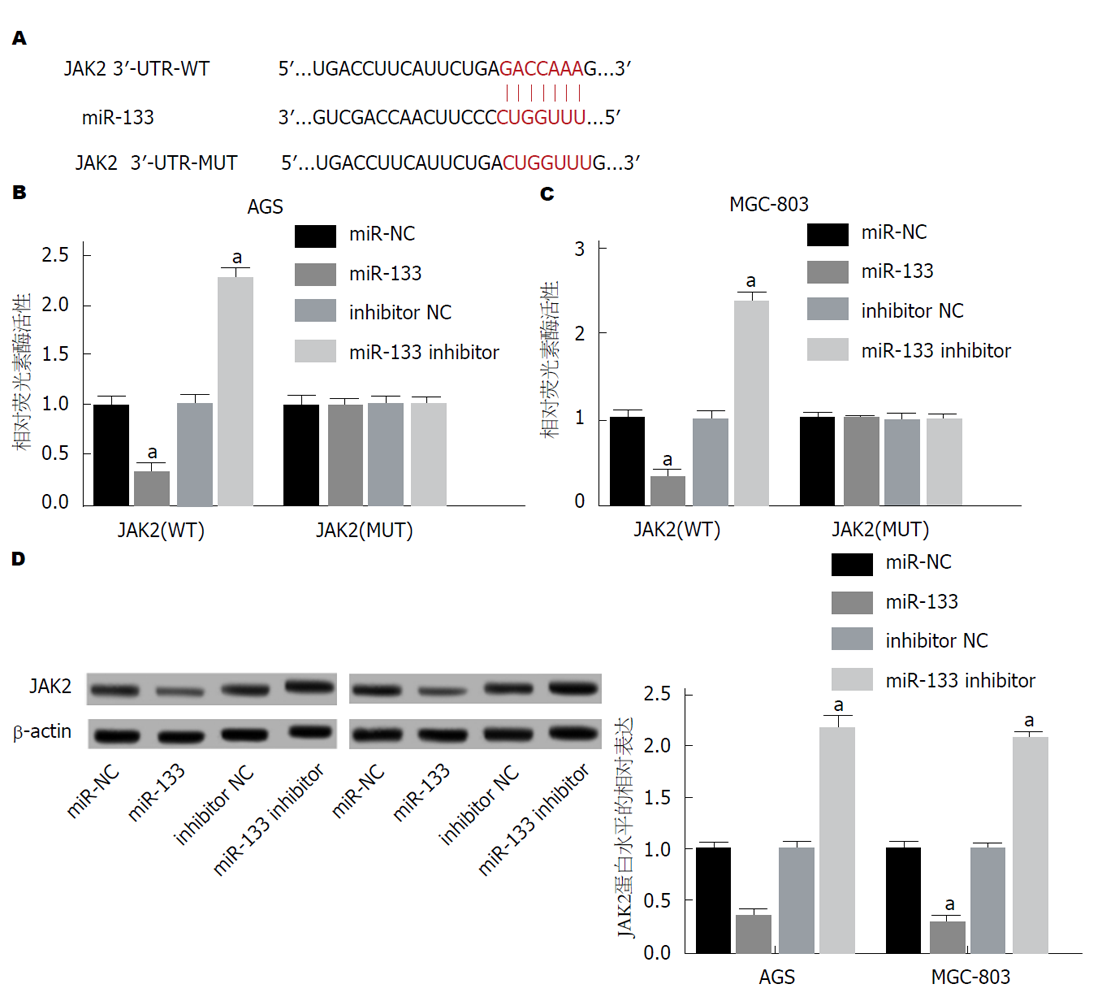
运用miRcode对miR-133和JAK2的结合进行预测, 发现miR-133的3ʹUTR与JAK2存在结合位点(图4A). 运用双荧光素酶报告基因检测实验检测miR-133对GC细胞AGS、MGC-803的荧光素酶活性的影响, 与miR-NC组相比, 荧光素酶载体JAK2(WT)的miR-133组细胞荧光强度均显著降低, miR-133 inhibitor组细胞荧光活性均显著升高, 均不影响荧光素酶载体JAK2(MUT)的细胞荧光素酶活性(图4B和C). 与miR-NC组相比, miR-133组细胞JAK2蛋白表达均显著降低, miR-133 inhibitor组JAK2蛋白表达均显著升高(图4D), 均具有统计学意义(P<0.05). 可见, miR-133靶向JAK2.
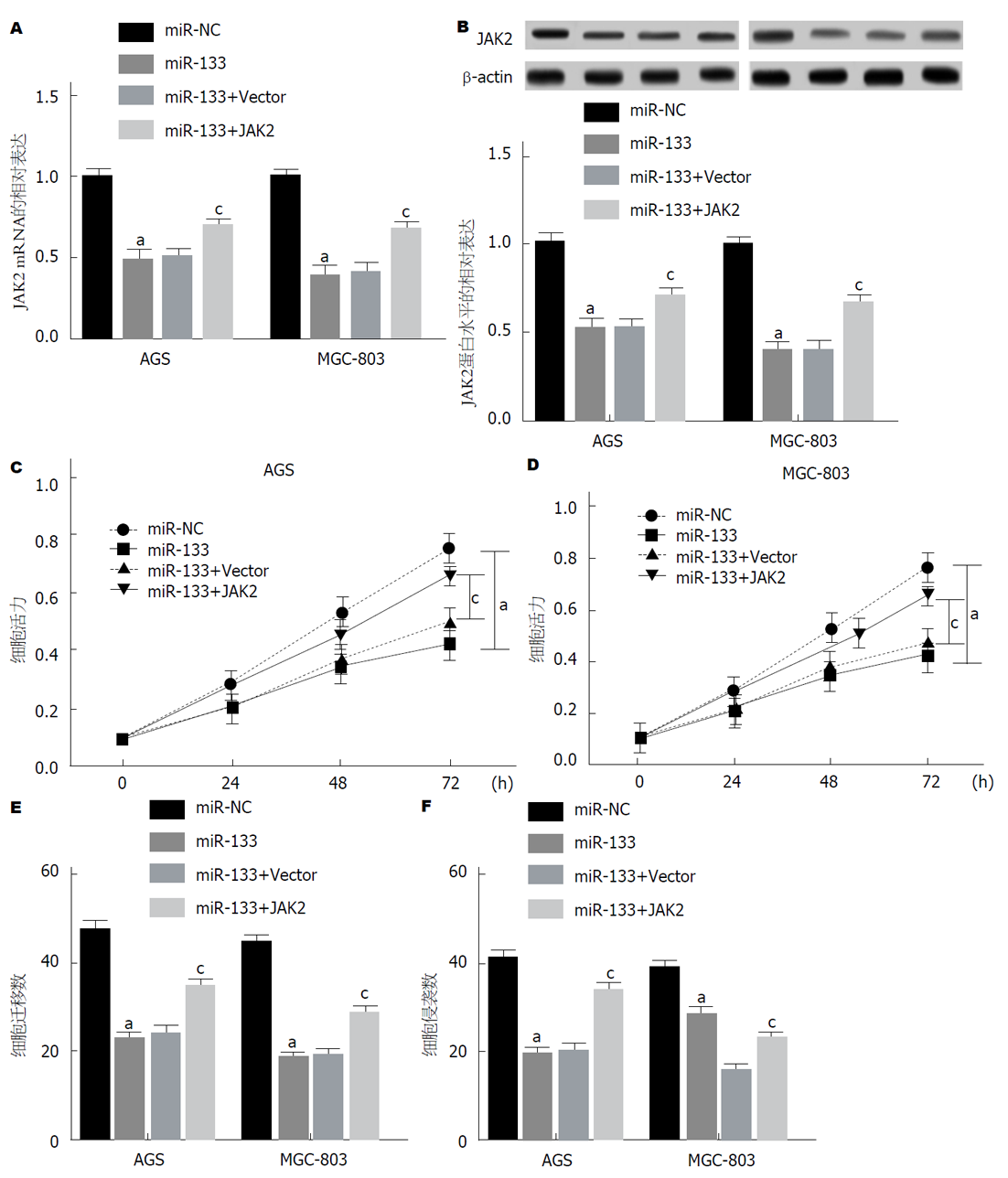
miR-133组于miR-NC组AGS、MGC-803细胞, JAK2 mRNA表达均显著降低, JAK2蛋白表达均显著降低, miR-133+JAK2组于miR-133+Vector组, JAK2 mRNA表达均显著升高, JAK2蛋白表达均显著升高(图5A和B). miR-133组于miR-NC组AGS、MGC-803细胞, 细胞增殖均显著降低, miR-133+JAK2组于miR-133+Vector组, 细胞增殖均显著升高(图5C). miR-133组于miR-NC组AGS、MGC-803细胞, 细胞迁移数均显著降低, 细胞侵袭数均显著降低, miR-133+JAK2组于miR-133+Vector组, 细胞迁移数均显著升高, 细胞侵袭数均显著升高(图5D和E). 可见, JAK2可部分逆转miR-133对GC增殖、迁移、侵袭的抑制作用.
miR-133为一种在骨骼肌、心肌等肌源性疾病中特异表达的非编码小RNA[7]. 在多种肿瘤组织中均存在miR-133表达紊乱, 其通过抑制转录后靶基因(EGFR、iGF-1R、MMPs)表达, 参与肿瘤的生长、转移, 肿瘤细胞的增殖、凋亡、迁移、侵袭等病理过程[8].
miR-133在肺腺癌[9]、胶质瘤[10]、淋巴瘤[11]、胰腺癌[12]、膀胱癌[13]中均具具有调节作用.
Liu等[10]在研究胶质瘤中, 运用qRT-PCR检测胶质瘤组织和细胞中miR-133的表达发现, miR-133在胶质瘤中低表达, 过表达miR-133抑制U87细胞的细胞增殖、侵袭, 其作用机制可能与直接靶向FOXC1有关, 提示miR-133可能是胶质瘤的潜在治疗靶点. Wang等[14]研究发现, miR-133在垂体瘤中低表达, 其可靶向FOXC1抑制垂体腺瘤细胞迁移、侵袭, 且miR-133的表达与FOXC1呈负相关. Cheng等[15]在GC的研究中阐明, miR-133在GC组织中表达下调, 其表达与肿瘤大小、侵袭、外周器官转移呈负相关, 且可抑制癌症细胞增殖、迁移、侵袭, 推测其机制与靶向CDC42失活CDC42 / PAKs通路有关. 本研究检测了GC组织和细胞中miR-133的表达发现, miR-133在GC中低表达, 这与前人的研究结果相吻合; 进一步运用MTT、Transwell检测过表达miR-133的GC细胞的细胞增殖、迁移、侵袭发现, 过表达miR-133抑制GC细胞增殖、迁移、侵袭; 运用双荧光素酶报告基因检测实验验证了miR-133可靶向JAK2.
JAK2是Janus激酶(JAKs)非受体蛋白酪氨酸激酶家族的成员, 其包括JAK1、JAK2、JAK3和TYK2. JAK为细胞因子的细胞质信号传导组分, 可被细胞因子介导的磷酸化激活, 引起转录激活因子(STAT)蛋白的募集和磷酸化[16]. JAK具有位于C-末端酪氨酸激酶结构域上游的假激酶结构域. JAK的假激酶结构域对维持酪氨酸激酶活性的稳定至关重要. JAK2的假激酶结构域中的V617F, 已被用于确诊和治疗患有血液疾病的患者, 包括骨髓增生性肿瘤和白血病[17]. 谭豆豆等[18]在食管鳞状细胞癌的研究中证实, p-JAK2在食管鳞状细胞癌组织中高表达, 其与肿瘤的恶性程度呈负相关, 可能为食管癌预后判断的依据. Cheng等[19]在鼻咽癌的研究中, 运用Western blotting和免疫组化方法检测鼻咽癌组织中JAK2、STAT3、VEGF的蛋白表达, 并进行Kaplan-Meier法评估JAK2、STAT3、VEGF与患者存活率之间的关系, 揭示了JAK2、STAT3、VEGF在癌组织中均高表达, 且与患者的存活率呈负相关, 提示JAK2、STAT3和VEGF的高表达可能与鼻咽癌患者的临床病理特征和预后相关. 报道显示, miR-375具有抑制GC细胞增殖、迁移、侵袭的作用, 其机制与靶向JAK2有关, 且JAK2可部分逆转miR-375的抑制GC细胞增殖作用, miR-375可负向调控Snail、JAK2的表达[20,21]. 本研究检测了GC组织中JAK2的mRNA和蛋白表达发现, JAK2高表达, 这与前人研究结果相一致; 沉默JAK2可得到与过表达miR-133一致的抑制GC细胞增殖、迁移、侵袭结果; 进一步研究发现, JAK2可部分逆转miR-133的抑制GC细胞增殖、迁移、侵袭作用.
总之, miR-133可抑制GC细胞增殖、迁移、侵袭, 其机制可能与靶向JAK2有关, 为miR-133靶向治疗GC提供理论依据.
近几年胃癌(gastric cancer, GC)的发病率和死亡率呈逐年上升趋势. miR-133在GC细胞中具有抑制增殖、迁移、侵袭作用, JAK2在GC中具有促癌作用, 但JAK2与JAK2在GC细胞中的作用关系国内外均尚未阐明.
本研究旨在研究miR-133、JAK2对GC细胞增殖、迁移、侵袭的影响, 并探讨其分子作用机制, 以期望为GC的精准靶向治疗提供理论支持.
探讨miR-133和JAK2对GC细胞增殖、迁移、侵袭的作用及二者之间的相互关系, 以期为GC的靶向治疗提供依据.
将GC组织和GC细胞中miR-133、JAK2的mRNA表达用qRT-PCR法检测; 涉及基因的干预均采用脂质体法转染到AGS、MGC-803细胞, 其中JAK2的蛋白表达用Western blot检测、细胞的增殖用MTT法检测、细胞的迁移和侵袭用Transwell法检测; miR-133靶向JAK2用双荧光素酶报告基因检测实验验证.
本研究发现过表达miR-133与沉默JAK2对GC细胞具有同样的抑制增殖、迁移、侵袭作用, 同时, JAK2为miR-133的靶标, 且回补JAK2又能反向调控miR-133的抑癌作用.
miR-133可靶向JAK2抑制GC细胞增殖、迁移、侵袭, 为miR-133靶向治疗GC的作用机制研究提供理论依据.
本研究仅在体外研究miR-133对GC细胞增殖、迁移、侵袭的作用, 后期还需增加miR-133在裸鼠体内对GC生长、转移的治疗作用的实验, 以更清晰的展示miR-133对GC的治疗价值, 也为miR-133的靶向治疗提供更充分的理论依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Qu Y, Dang S, Hou P. Gene methylation in gastric cancer. Clin Chim Acta. 2013;424:53-65. [PubMed] [DOI] |
| 2. | 李 淑英, 万 福生. miRNA与肿瘤转移的研究进展. 南昌大学学报(医学版). 2018;58:77-81. [DOI] |
| 3. | Neudecker V, Brodsky KS, Kreth S, Ginde AA, Eltzschig HK. Emerging Roles for MicroRNAs in Perioperative Medicine. Anesthesiology. 2016;124:489-506. [PubMed] [DOI] |
| 5. | Yu H, Pardoll D, Jove R. STATs in cancer inflammation and immunity: a leading role for STAT3. Nat Rev Cancer. 2009;9:798-809. [PubMed] [DOI] |
| 7. | Yu H, Lu Y, Li Z, Wang Q. microRNA-133: expression, function and therapeutic potential in muscle diseases and cancer. Curr Drug Targets. 2014;15:817-828. [PubMed] |
| 9. | Xiao B, Liu H, Gu Z, Ji C. Expression of microRNA-133 inhibits epithelial-mesenchymal transition in lung cancer cells by directly targeting FOXQ1. Arch Bronconeumol. 2016;52:505-511. [PubMed] [DOI] |
| 10. | Liu Y, Han L, Bai Y, Du W, Yang B. Down-regulation of MicroRNA-133 predicts poor overall survival and regulates the growth and invasive abilities in glioma. Artif Cells Nanomed Biotechnol. 2018;46:206-210. [PubMed] [DOI] |
| 11. | Li W, Zhong Y, Shuang Y, Huang H, Huang Y, Yu L, Huang X. High concentration of miR-133 is a useful marker for the diagnosis of lymphoma- associated hemophagocytic syndrome. Cancer Biomark. 2017;20:159-164. [PubMed] [DOI] |
| 12. | Li TF, Liu J, Fu SJ. The interaction of long non-coding RNA MIAT and miR-133 play a role in the proliferation and metastasis of pancreatic carcinoma. Biomed Pharmacother. 2018;104:145-150. [PubMed] [DOI] |
| 13. | Uchida Y, Chiyomaru T, Enokida H, Kawakami K, Tatarano S, Kawahara K, Nishiyama K, Seki N, Nakagawa M. MiR-133a induces apoptosis through direct regulation of GSTP1 in bladder cancer cell lines. Urol Oncol. 2013;31:115-123. [PubMed] [DOI] |
| 14. | Wang DS, Zhang HQ, Zhang B, Yuan ZB, Yu ZK, Yang T, Zhang SQ, Liu Y, Jia XX. miR-133 inhibits pituitary tumor cell migration and invasion via down-regulating FOXC1 expression. Genet Mol Res. 2016;15. [PubMed] [DOI] |
| 15. | Cheng Z, Liu F, Wang G, Li Y, Zhang H, Li F. miR-133 is a key negative regulator of CDC42-PAK pathway in gastric cancer. Cell Signal. 2014;26:2667-2673. [PubMed] [DOI] |
| 16. | Yang T, Shi X, Kang Y, Zhu M, Fan M, Zhang D, Zhang Y. Novel compounds TAD-1822-7-F2 and F5 inhibited HeLa cells growth through the JAK/Stat signaling pathway. Biomed Pharmacother. 2018;103:118-126. [PubMed] [DOI] |
| 17. | Hubbard SR. Mechanistic Insights into Regulation of JAK2 Tyrosine Kinase. Front Endocrinol (Lausanne). 2018;8:361. [PubMed] [DOI] |
| 18. | 谭 豆豆, 马 蓉, 刘 涛, 刘 清, 郑 树涛, 周 剑, 陈 玉梅, 申 铜雪, 张 潇, 卢 晓梅. p-JAK2蛋白在食管鳞状细胞癌中的表达及意义. 新疆医科大学学报. 2018;41:281-283; 287. [DOI] |
| 19. | Cheng JZ, Chen JJ, Xue K, Wang ZG, Yu D. Clinicopathologic and prognostic significance of VEGF, JAK2 and STAT3 in patients with nasopharyngeal carcinoma. Cancer Cell Int. 2018;18:110. [PubMed] [DOI] |