修回日期: 2018-08-29
接受日期: 2018-09-06
在线出版日期: 2018-10-08
研究miR-144-3p靶向调控ATP结合转运蛋白G家族成员2(ATP-binding transporter G family member 2, ABCG2)对胃癌(gastric cancer, GC)HGC-27细胞侵袭和迁移能力的影响, 并对其作用机制进行初步探讨.
通过qRT-PCR检测人GCHGC-27细胞株和人胃黏膜上皮GES-1细胞株中miR-144-3p和ABCG2的表达情况; 通过靶基因预测软件预测miR-144-3p和ABCG2靶向结合位点, 通过双荧光素酶报告基因实验检测二者靶向结合关系; 通过qRT-PCR检测miR-144-3p mimic或miR-144-3p inhibitor转染GC细胞后miR-144-3p及ABCG2的表达水平; 通过明胶酶谱实验检测对转染ABCG2 siRNA的GC细胞中基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)和基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)活性的影响; 通过Transwell侵袭和迁移实验检测转染miR-144-3p mimic、miR-144-3p inhibitor、ABCG2 siRNA对GC细胞侵袭和迁移能力的影响.
与正常细胞组人胃黏膜上皮GES-1细胞株相比, GC细胞组人GCHGC-27细胞株中miR-144-3p的表达量明显降低, ABCG2的表达水平明显升高, 差异具有统计学意义(P<0.05); 靶基因预测miR-144-3p和ABCG2 3'UTR存在结合位点, 双荧光素酶报告基因实验证实了miR-144-3p和ABCG2靶向结合关系; 与对照组相比, 转染miR-144-3p mimic组GC细胞中miR-144-3p的表达明显升高, ABCG2的表达明显降低, 细胞侵袭和迁移能力显著降低, 差异具有统计学意义(P<0.05), 转染miR-144-3p inhibitor则表现出相反的作用; 明胶酶谱实验检测结果表明ABCG2 siRNA转染可显著抑制GC细胞中MMP-2和MMP-9蛋白活性, 抑制GC细胞侵袭和迁移能力, 差异具有统计学意义(P<0.05).
MiR-144-3p能够抑制GC细胞侵袭和迁移能力, 其作用机制与靶向调控ABCG2-MMP-2/9信号通路有关.
核心提要: 本实验首次证实了ATP结合转运蛋白G家族成员2(ATP-binding transporter G family member 2, ABCG2)是miR-144-3p的靶基因, 且发现miR-144-3p能够抑制人胃癌(gastric cancer, GC)HGC-27细胞侵袭和迁移能力, 其作用机制与miR-144-3p通过靶向负调控ABCG2的表达, 介导基质金属蛋白酶2和基质金属蛋白酶9蛋白活性有关. 本研究以期为GC临床治疗及预后提供新的作用靶点.
引文著录: 吕弢, 俞兴旺, 胡静, 周东辉. miR-144-3p靶向调控ABCG2信号通路对胃癌细胞侵袭和迁移的影响. 世界华人消化杂志 2018; 26(28): 1635-1644
Revised: August 29, 2018
Accepted: September 6, 2018
Published online: October 8, 2018
To investigate the effect of targeted regulation of ATP-binding transporter G family member 2 (ABCG2) signaling pathway by miR-144-3p on the invasion and migration of gastric cancer (GC) cells HGC-27, and to explore the underlying mechanism.
The expression of miR-144-3p and ABCG2 in human GC cell line HGC-27 and human gastric mucosal epithelial cell line GES-1 was detected by qRT-PCR. The target gene prediction software was used to predict whether miR-144-3p binds to ABCG2, and the binding site was used to detect whether miR-144-3p targets ABCG2 by dual luciferase reporter gene assay. The expression of miR-144-3p and ABCG2 was detected by qRT-PCR after transfection of miR-144-3p mimic or miR-144-3p inhibitor into GC cells. The expression of matrix metalloproteinase-2 (MMP-2) and matrix metalloproteinase-9 (MMP-9) in GC cells transfected with ABCG2 siRNA was detected by gelatin zymography assay. Transwell invasion and migration assays were employed to detect the effect of miR-144-3p mimic, miR-144-3p inhibitor, and ABCG2 siRNA on the invasion and migration of GC cells.
Compared with GES-1 cells, the expression of miR-144-3p in HGC-27 cells was significantly decreased and the expression of ABCG2 was significantly increased (P < 0.05). The target gene prediction software predicted the binding site of miR-144-3p in the ABCG2 3'UTR, and the dual luciferase reporter gene experiment confirmed the targeted binding relationship of miR-144-3p and ABCG2. Compared with the control group, the expression of miR-144-3p was significantly increased, the expression of ABCG2 was significantly decreased, and the cell invasion and migration ability were significantly decreased in the miR-144-3p mimic transfected group (P < 0.05), while transfection with miR-144-3p inhibitor showed the opposite effect. Gelatin zymography assay showed that ABCG2 siRNA transfection significantly inhibited the activity of MMP-2 and MMP-9 proteins in GC cells and suppressed the invasion and migration of GC cells (P < 0.05).
MiR-144-3p can inhibit the invasion and migration of GC cells possibly via mechanisms related to targeted regulation of the ABCG2-MMP-2/9 signaling pathway.
- Citation: Lv T, Yu XW, Hu J, Zhou DH. Effect of targeted regulation of ABCG2 signaling pathway by miR-144-3p on invasion and migration of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2018; 26(28): 1635-1644
- URL: https://www.wjgnet.com/1009-3079/full/v26/i28/1635.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i28.1635
胃癌(gastric cancer, GC)是常见的消化道恶性肿瘤之一, 近年来其发病率虽有减缓但其死亡率却一直居高不下[1]. 目前临床上治疗GC的主要手段有外科手术, 辅以放疗和化疗, 对于早期GC这种综合治疗的方式能够达到较好的治疗效果, 但对晚期GC的治疗效果不佳, 且预后较差. 癌转移是导致预后及疗效差的主要原因, 目前对转移的分子机制的研究尚不十分明确[2]. 因此, 深入探究癌转移的机制有利于为GC治疗和预后提供新的治疗靶点和治疗方向. miRNA是一类长度约为16-29 nt的非编码RNA, 可参与机体包括增殖、分化、发育、凋亡及肿瘤的发生等多种生物学过程[3,4]. 目前研究认为, miRNA可与mRNA的3'UTR靶向结合, 通过抑制靶mRNA的翻译或降解靶mRNA, 实现对靶基因的调控作用[5]. 有研究显示, miR-144-3p可通过靶向抑制跨膜蛋白16A基因的表达, 实现抑制骨肉瘤143B细胞的增殖和侵袭[6]. 在胰腺癌组织及细胞中miR-144-3p呈低表达, 上调miR-144-3p的表达可显著抑制胰腺癌细胞侵袭和迁移的能力, 该过程与miR-144-3p靶向抑制E26转录因子-1(E26 transformation specific-1, ETS1)的表达密切相关[7]. miR-144-3p作为肾细胞癌的抑癌基因, 通过靶向MAP3K8信号通路抑制其侵袭和转移[8]. 以上研究表明, miR-144-3p在肿瘤转移中发挥重要作用, 但miR-144-3p在GC转移过程中是否发挥同样的作用目前尚未无相关报道. ATP结合转运蛋白G家族成员2(ATP-binding cassette super family G member 2, ABCG2)属于ATP结合盒式转运蛋白超家族成员之一, 在食管癌、肠癌、GC等消化道系统肿瘤的预后相关[9-11]. Wang等[12]人研究显示胃泌素调节ABCG2通过激活NF-κB信号通路促进胰腺癌细胞的迁移、侵袭. 通过在线数据库预测miR-144-3p与ABCG2存在靶向结合位点, 因此本实验探讨miR-144-3p是否通过靶向ABCG2信号通路对GC细胞侵袭和迁移能力产生影响, 并对其作用的分子机制进行研究, 以期为GC临床治疗及预后提供一定的实验和理论基础.
人GC细胞HGC-27、人胃黏膜上皮细胞GES-1购于中南大学湘雅医医学院细胞生物学研究所; RPMI-1640培养基、DMEM培养基购于美国Hyclone公司; 胰蛋白酶、胎牛血清购于杭州四季青生物材料有限公司; Lipofectamine 2000、Trizol试剂购于美国Invitrogen公司; 荧光定量试剂盒购于日本TaKaRa公司; miR-144-3p inhibitor、miR-144-3p mimic以及对照所用的无意义序列均购于广州锐博生物科技有限公司; SYBR Premix Ex Taq检测试剂盒购于大连宝生物工程有限公司; 明胶酶谱检测试剂盒、双荧光素酶报告基因检测试剂盒购于上海碧云天生物技术有限公司; Transwell小室(孔径8.0 μm, 直径6.5 mm)购于美国Corning公司; Matrigel胶购于美国Sigma公司; ABCG2 siRNA及siRNA control购于上海吉玛制药技术有限公司; 实验所用引物均有上海生工生物工程有限公司合成; 基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)/基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)抗体购于美国Novus Biologicals公司.
1.2.1 细胞培养: 人GC细胞HGC-27接种于含10%胎牛血清的RPMI-1640培养基的培养瓶中, 人胃黏膜上皮细胞GES-1接种于含10%胎牛血清的DMEM培养基的培养瓶中, 分别置于37 ℃含5%CO2及100%湿度的细胞培养箱中培养, 依照各自细胞生长状态更换新鲜的培养基, 当细胞汇合度达80%时加入0.25%胰蛋白酶消化细胞进行传代. 待细胞传至2-3代后可用于后续实验.
1.2.2 qRT-PCR法检测细胞中miR-144-3p和ABCG2的表达水平: 采用Trizol法提取细胞中总RNA, 经紫外分光光度计检测提取RNA的浓度和纯度, 选取A260/A280值为2.01的RNA采用逆转录试剂盒合成cDNA, 将逆转录产物cDNA稀释后调整浓度成50 ng/μL, 以β-actin为内参进行荧光定量PCR检测, PCR反应条件为: 94 ℃2 min, 94 ℃20 s, 60 ℃35 s, 72 ℃1 min, 40个循环, 最后72 ℃10 min. 反应结束后进行熔解曲线分析, 分析有无非特异性扩增. 以相对定量2-△△CT法计算细胞中miR-144-3p和ABCG2相对表达水平. 每组设置3个复孔, 每组实验进行3次重复取均值.
1.2.3 双荧光素酶报告基因实验: 使用在线数据库TargetScan进行预测分析, 发现ABCG2 3'-UTR上存在miR-144-3p靶向结合位点, 提示ABCG2可能是miR-144-3p靶基因. 将ABCG2 3'-UTR克隆并连接到报告基因载体上, 同时将3'-UTR结合位点进行突变的序列连接到报告基因载体上. 将处于对数生长期的HGC-27细胞以2×104个/孔接种于24孔板中, 置于37 ℃培养箱中培养, 转染前3 h更换为无血清培养基, 将预测靶基因ABCG2的3'-UTR报告基因质粒与miR-144-3p mimic共同转染HGC-27细胞, 记为3'-UTR-WT miR-144-3p组, 以共转染mimic control为对照, 记为3'-UTR-WT NC组, 将miR-144-3p与ABCG2的3'-UTR结合位点突变的报告基因质粒与miR-144-3p mimic共同转染HGC-27细胞, 记为3'-UTR-Wut miR-144-3p组, 以共转染mimic control为对照, 记为3'-UTR-Wut NC组. 转染48 h后, 采用双荧光素酶报告基因检测试剂盒测定各组萤火虫荧光素酶荧光强度及海肾荧光素酶荧光强度, 以二者的比值表示荧光素酶相对活性.
1.2.4 细胞转染和分组: 将生长状态良好的GCHGC-27细胞以2×105/孔的浓度接种于6孔板中, 置于37 ℃培养箱中培养24 h, 当细胞汇合度达50%-60%时进行转染, 转染操作步骤严格按照Lipofectamine 2000说明书进行, 置于37 ℃含5%CO2及100%湿度的培养箱中培养, 转染后6 h用新鲜的含血清的完全培养基更换不含血清的培养基, 置于37 ℃培养箱中继续培养. 本实验分组, 将转染miR-144-3p inhibitors的细胞记为抑制剂组, 将转染miR-144-3p mimic的细胞记为模拟物组, 将转染无意义序列的细胞记为对照组, 将转染ABCG2 siRNA的细胞记为siRNA组.
1.2.5 Transwell实验检测细胞侵袭和迁移能力: 转染48 h后各组细胞以0.25%的胰蛋白酶进行消化, PBS洗涤后用无血清培养基重悬细胞, 制成单细胞悬液, 将细胞调整为2×105/mL. 用无血清培养基稀释Matrigel胶, 加入到Transwell小室的上室, 置于37 ℃培养箱中静置1 h, 制备Matrigel基质胶涂层. 将制备好的单细胞悬液以5×103/孔铺于Transwell上层腔室, 下层腔室加入含20%胎牛血清的培养基, 置于37 ℃培养箱中孵育24 h, 取出Transwell小室, 用棉签将上室细胞及碎片拭去, 得到的细胞以0.1%结晶紫染色, 用PBS洗涤后, 在倒置显微镜下观察Transwell小室滤膜下层腔室附着的细胞, 计数穿过膜的细胞个数, 统计细胞相对侵袭能力. Transwell上室滤膜不经Matrigel基质胶涂覆检测各组细胞迁移能力, 其余步骤与Transwell侵袭实验相同.
1.2.6 明胶酶谱检测MMP-2、MMP-9活性: 使用明胶酶谱检测试剂盒检测细胞培养上清液中基质金属酶MMP-2、MMP-9活性. 收集转染48 h后各组细胞培养液上清, 将上清液与十二烷基硫酸钠(sodium dodecyl sulfate, SDS)上样缓冲液混合, 以10% SDS-聚丙烯酰胺凝胶电泳-0.1%明胶进行电泳, 条件为电压70 V, 时间2 h, 之后以2.5%的Triton X进行洗胶以除去SDS, 每次1.5 h, 洗胶2次. 随后将胶置于分析液中过夜孵育. 结束后以考马斯亮蓝进行染色, 时间为2 h, 之后在脱色液中脱色, 时间为0.5 h. 以0.7%的乙酸进行脱色, 置于蓝色背景下明胶酶活性呈现出光亮区域.
统计学处理 采用SPSS 21.0统计学软件对实验数据进行统计分析, 以单因素方差分析比较多组差异, 以SNK-q检验比较组间差异, 每组数据代表3个生物学重复, 以P<0.05表示差异具有统计学意义.
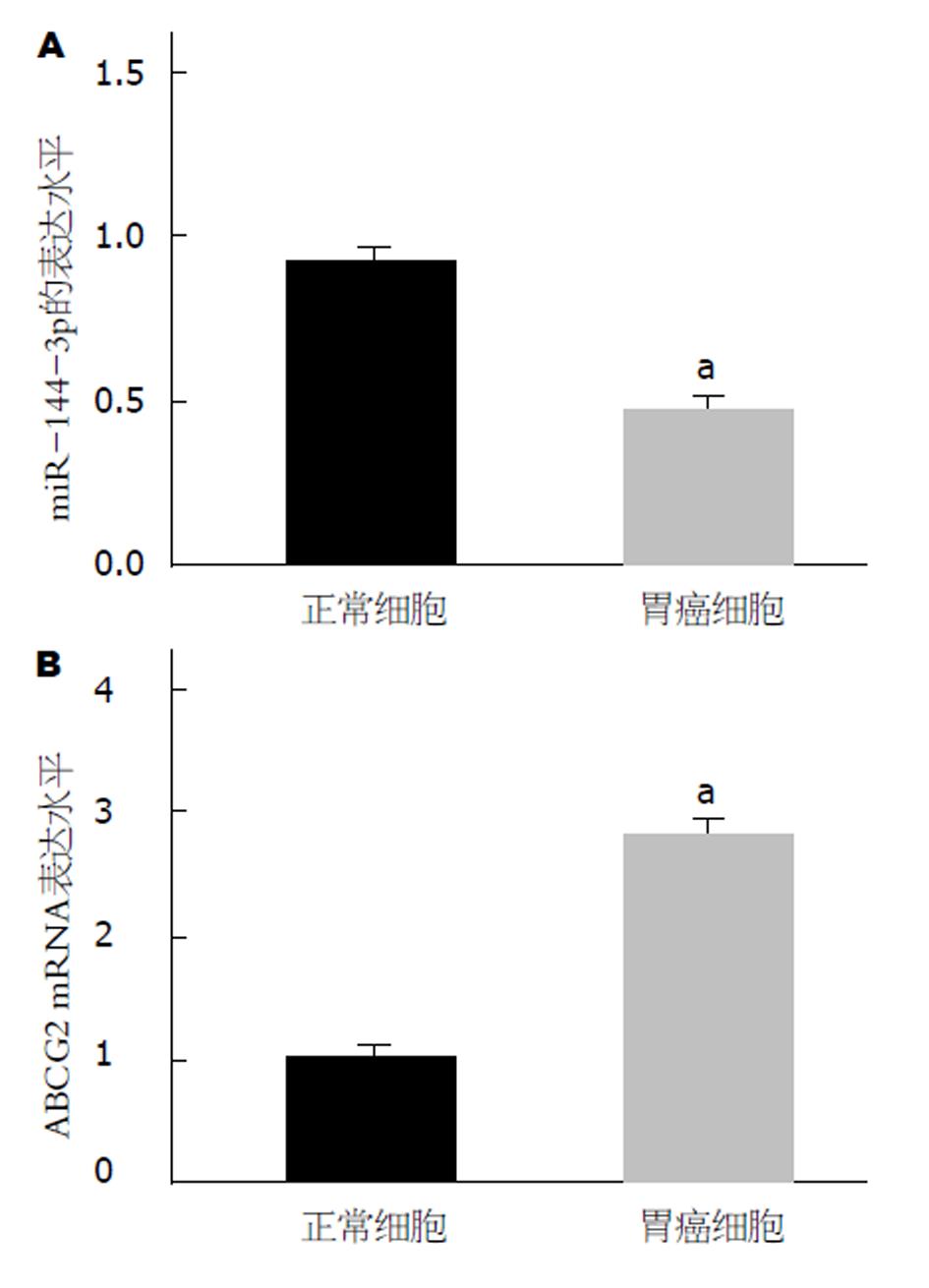
研究采用qRT-PCR技术分析了人GCHGC-27细胞和人胃黏膜上皮GES-1细胞中miR-144-3p和ABCG2的相对表达水平, 结果如图1所示, 正常细胞组和GC细胞组miR-144-3p的相对表达水平分别为0.92±0.08、0.48±0.06, ABCG2的相对表达水平1.00±0.06、2.85±0.11. GC细胞组miR-144-3p的相对表达水平显著降低, ABCG2的相对表达水平显著升高, 与正常细胞组相比, 差异具有统计学意义(P<0.05).
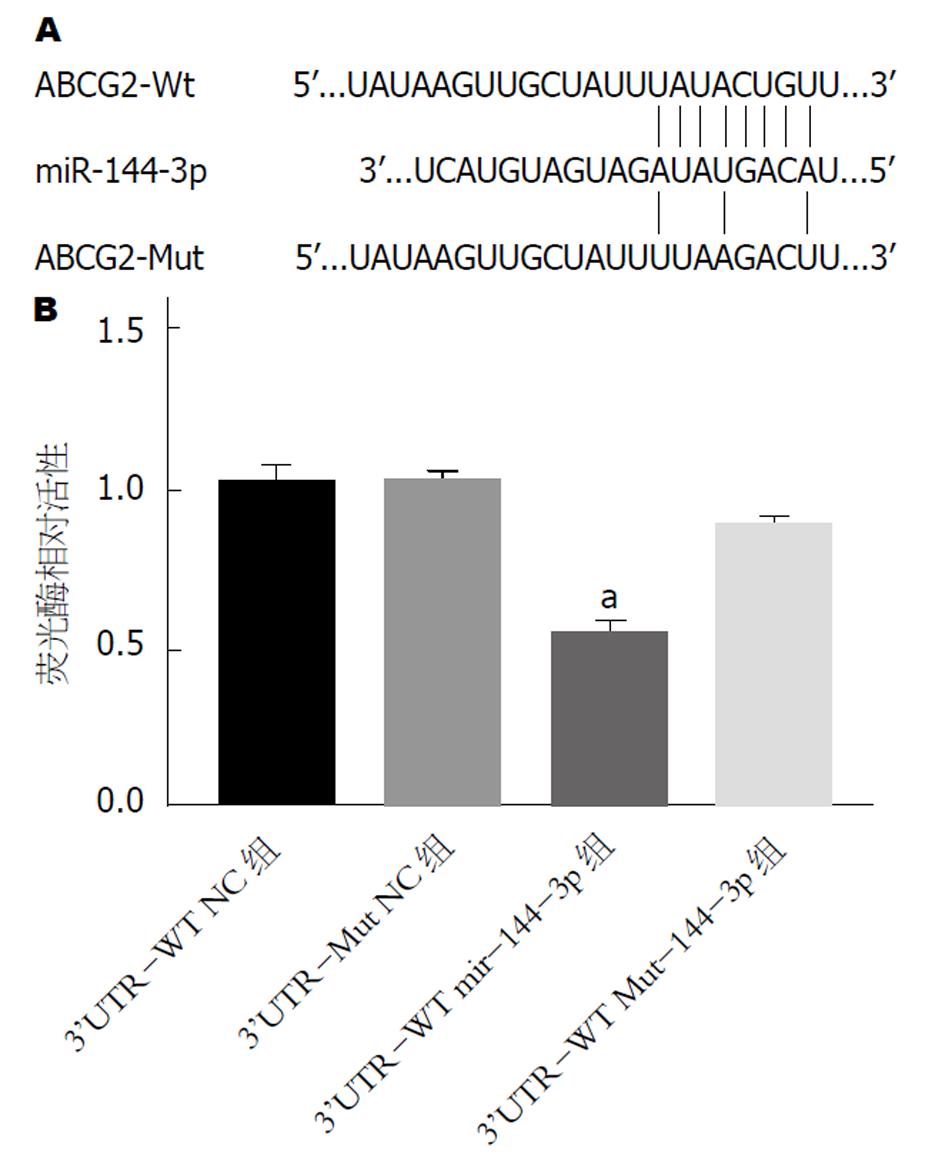
使用在线数据库TargetScan进行预测分析, 得出ABCG2 3'UTR与miR-144-3p存在靶向结合位点, 如图2A所示. 通过双荧光素酶报告基因实验验证了二者靶向结合的关系, 如图2B所示, 共转染48 h后, 检测到3'-UTR-WT miR-144-3p组细胞的荧光素酶相对活性显著降低, 与3'-UTR-WT NC组相比, 差异具有统计学意义(P<0.05); 而3'-UTR-Wut miR-144-3p组细胞的荧光素酶相对活性变化较小. 以上实验结果提示, miR-144-3p能够通过与ABCG2 3'UTR上的靶向结合位点相结合, ABCG2是miR-144-3p的一个直接靶基因.
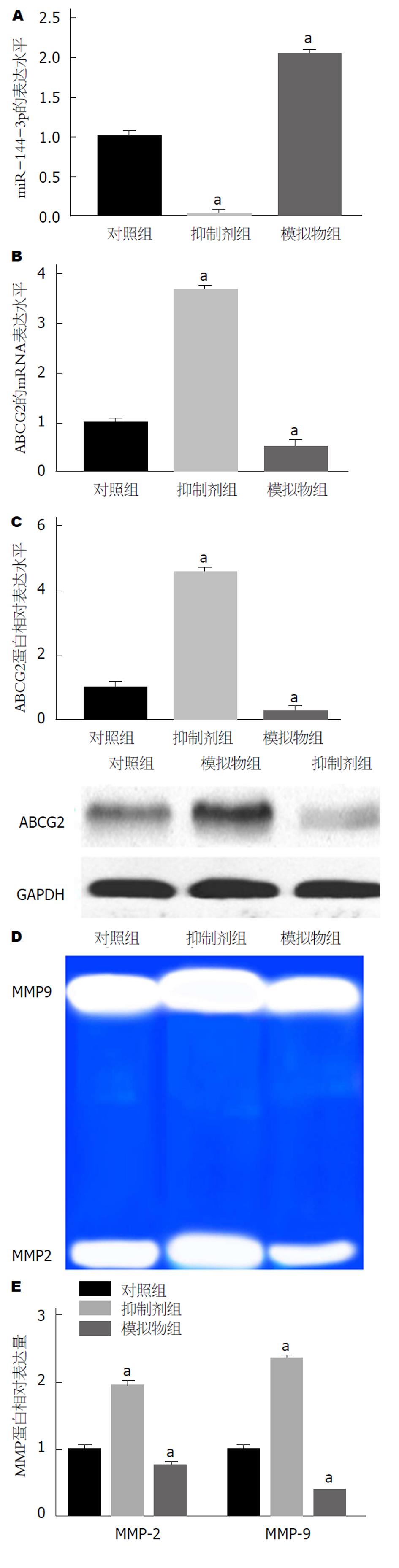
通过转染miR-144-3p模拟物和抑制剂上调或下调GC细胞中miR-144-3p的表达, 结果如图3A所示, 转染miR-144-3p模拟物后模拟物组细胞中miR-144-3p的表达量显著升高, 转染miR-144-3p抑制剂后抑制剂组细胞中miR-144-3p的表达量显著降低, 与对照组相比, 差异具有统计学意义(P<0.05). 提示转染模拟物和抑制剂可上调或下调miR-144-3p的表达. 上调或下调miR-144-3p的表达后检测对细胞中ABCG2表达水平的影响, 结果如图3B和C所示, 模拟物组细胞中ABCG2 mRNA和蛋白表达均明显降低, 抑制剂组细胞中ABCG2 mRNA和蛋白表达均明显升高, 与对照组相比, 差异具有统计学意义(P<0.05). miR-144-3p和ABCG2的表达水平呈负相关, 说明miR-144-3p能够负向调控ABCG2的表达. 此外本实验通过明胶普实验检测了细胞中基质金属蛋白酶MMP-2和MMP-9活性, 结果如图3D和E所示, 模拟物组细胞中MMP-2和MMP-9活性均明显降低, 抑制剂组细胞中MMP-2和MMP-9活性均明显升高, 与对照组相比, 差异具有统计学意义(P<0.05). 提示miR-144-3p能够负向调控ABCG2的表达, 且能够介导基质金属蛋白酶MMP-2和MMP-9的活性.
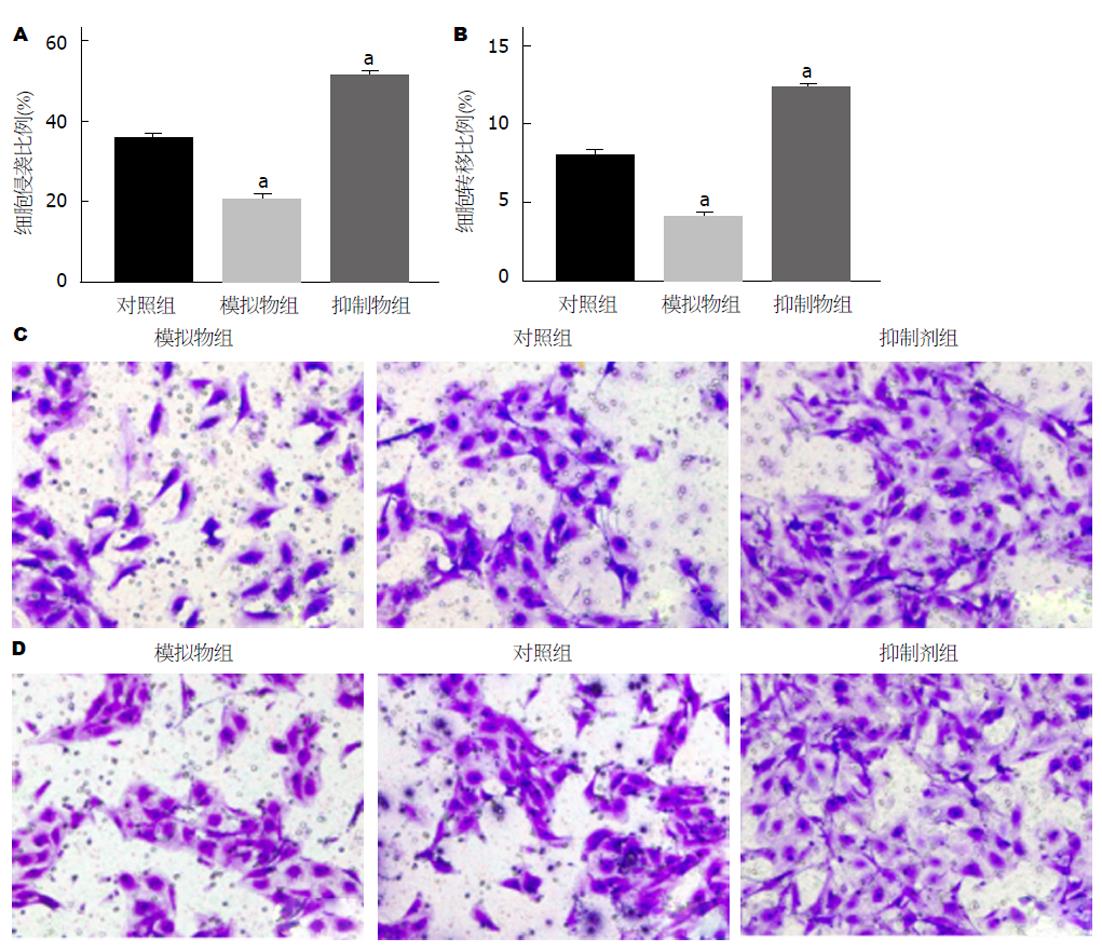
Transwell侵袭和迁移实验结果显示(图4), 对照组、模拟物组和抑制剂组侵袭细胞比例分别为35.42±2.28、20.45±1.36、51.08±2.31, 迁移细胞比例分别为7.98±0.23、4.01±0.29、12.35±0.93. 模拟物组细胞侵袭和迁移能力均降低, 与对照组相比, 差异具有统计学意义(P<0.05); 抑制剂组细胞侵袭和迁移能力均降低, 与对照组相比, 差异具有统计学意义(P<0.05). 说明miR-144-3p可调控人GC细胞侵袭和迁移能力, 且发挥重要的作用.
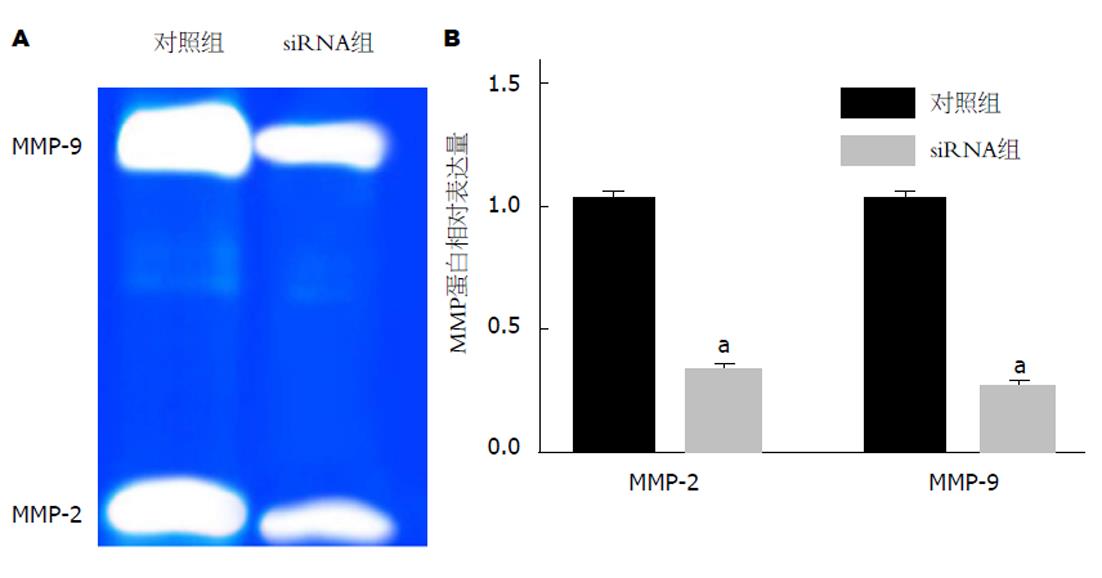
以上实验结果证明了ABCG2是miR144-3p靶基因, 为进一步探讨miR144-3p是否通过调控ABCG2调节基质金属蛋白酶的活性, 本实验通过转染ABCG2 siRNA敲低ABCG2的表达, 检测对MMP-2和MMP-9表达活性变化的影响. 明胶酶谱检测结果如图5所示, 敲低ABCG2表达的siRNA组细胞中基质金属蛋白酶MMP-2和MMP-9活性显著降低, 与对照组相比, 差异具有统计学意义(P<0.05). 说明敲低ABCG2可抑制GC细胞中基质金属蛋白酶MMP-2和MMP-9活性.
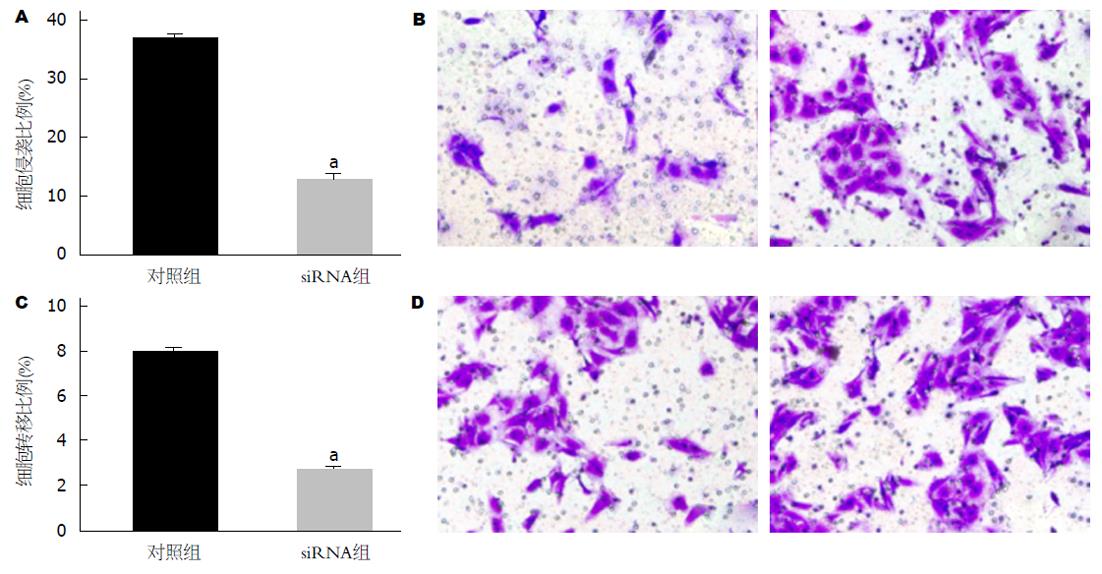
敲低GC细胞中ABCG2 的表达, 通过Transwell侵袭和迁移实验检测对细胞侵袭和迁移能力的影响, 结果如图6所示, 对照组和siRNA组侵袭细胞比例分别为36.47±1.21、12.82±0.85, 迁移细胞比例分别为7.91±0.40、2.73±0.18. siRNA组细胞侵袭和迁移能力均降低, 与对照组相比, 差异具有统计学意义(P<0.05). 说明敲低GC细胞中ABCG2 的表达可抑制细胞侵袭和迁移能力.
GC是一种常见起源于胃黏膜上皮的恶性肿瘤, 在我国其发病率和病死率均高于全球平均水平, 严重的影响人类的健康和生命. GC的预后不良是导致GC死亡率较高的主要原因之一, 浸润和转移是导致GC预后不良的主要原因, GC发生转移是由GC细胞的侵袭和迁移引起的[13]. 因此研究GC细胞发生侵袭和转移的机制对GC的治疗和预后至关重要. miRNA在多种恶性肿瘤的发生和进展中发挥调控作用, 参与肿瘤增殖、凋亡、侵袭和迁移等生物学行为. 目前研究证实了miRNA参与了GC的发病及进展, 不同发展阶段有不同种类的miRNA出现异常表达[14,15]. Jianjun等[16]研究显示miR-218参与GC临床分期、患者预后及淋巴结转移, 在体内和体外研究均显示miR-218通过靶向调控Robol基因抑制GC细胞的侵袭和转移. miR101、miR-126、miR-29等多种miRNA参与GC细胞的侵袭和迁移[17-19]. 本实验结果显示, 与正常细胞相比, miR144-3p在GC细胞中呈低表达. 通过转染上调miR144-3p表达, 经检测结果发现, 上调miR144-3p可抑制GC细胞的侵袭和迁移能力, 下调miR144-3p的表达可增强GC细胞侵袭和迁移能力. 以上结果说明miR144-3p与GC细胞侵袭和迁移密切相关, 可能参与GC转移和恶性进程.
ABCG2作为肿瘤标志物, 检测发现其在GC组织和细胞中高表达[11], 与本实验中检测不同细胞株中ABCG2的表达水平, 显示GC细胞中ABCG2表达水平显著高于正常细胞的结果一致. 临床研究显示食管癌转移、病理分级及临床分期与ABCG2的表达量高低有一定的关联[20]. 与正常大肠黏膜组织相比, 大肠癌组织中ABCG2阳性表达水平明显升高, 且肿瘤分化、淋巴结转移和患者无瘤生存时间与ABCG2的表达水平有关[21]. 本实验中, 通过转染敲低ABCG2的表达后, GC细胞的侵袭和转移能力均下降, 与以上ABCG2参与肿瘤转移的研究相符. 通过预测发现ABCG2是miR144-3p的靶基因, 双荧光素酶报告基因实验证实了miR144-3p可与ABCG2 mRNA 3'UTR靶向结合. 在GC细胞中上调miR144-3p的表达可抑制ABCG2的表达, 下调miR144-3p的表达增加了ABCG2的表达. 说明miR144-3p通过靶向ABCG2在GC中发挥抑制细胞侵袭和迁移的作用. 基质金属蛋白酶能够促进肿瘤细胞侵袭和转移已被学术界广泛认同[22], MMP-2和MMP-9是基质金属蛋白酶的两个主要成员, 参与GC细胞侵袭和转移已被多项研究证明[23,24]. 最近研究提示miR15b能够靶向ABCG2- MMP-2/9通路调控胶质瘤干细胞侵染和迁移[25]. 本实验中, 敲低ABCG2的表达, 通过明胶酶谱实验检测对MMP-2和MMP-9蛋白活性的影响, 结果显示, MMP-2和MMP-9蛋白活性显著降低, 结合Transwell实验结果, 提示ABCG2-MMP-2/9通路影响细胞侵袭和迁移. 综合以上实验结果, 说明miR144-3p负调控ABCG2的表达影响GC细胞侵袭和迁移与MMP-2和MMP-9蛋白活性有关.
总之, miR144-3p在GC细胞中呈低表达, 影响GC细胞侵袭和迁移能力, 其作用机制是与靶向ABCG2-MMP-2/9信号通路有关. 为进一步研究miR144-3p和ABCG2-MMP-2/9信号通路在GC中的作用机制提供实验支持, 为GC的治疗和预后提供新的作用靶点.
胃癌(gastric cancer, GC)的预后不良是导致GC死亡率较高的主要原因之一, 浸润和转移是导致GC预后不良的主要原因, GC细胞的侵袭和迁移引起GC发生转移. 因此研究GC细胞发生侵袭和转移的机制对GC的治疗和预后至关重要. 目前研究证实了miRNA参与了GC的发病及进展, 不同发展阶段有不同种类的miRNA出现异常表达. miR144-3p参与多种肿瘤细胞的侵袭和迁移, 但在GC细胞中的作用机制的研究鲜有报道. 且ATP结合转运蛋白G家族成员2(ATP-binding cassette super family G member 2, ABCG2)作为肿瘤标志物在GC组织中异常表达, 可能与GC的发展有关. 前期通过生物信息学软件预测得出miR144-3p与ABCG2存在靶向结合位点. 因此本实验探讨miR144-3p是否通过靶向ABCG2影响GC细胞侵袭和迁移.
本实验探讨miR144-3p是否通过靶向ABCG2影响GC细胞侵袭和迁移. 通过生物信息学软件预测miR144-3p和ABCG2靶向结合位点, 双荧光素酶报告基因实验验证miR144-3p和ABCG2靶向结合关系. 通过转染miR144-3p模拟物或抑制物探讨对ABCG2表达的影响, 验证miR144-3p能够靶向负调控ABCG2的表达. 通过明胶谱检测抑制ABCG2的表达对基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)和基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)活性的影响, 通过Transwell实验检测细胞侵袭和迁移能力, 证实miR144-3p通过靶向负调控ABCG2的表达, 介导MMP-2和MMP-9蛋白活性, 影响细胞侵袭和迁移能力.
本实验主要目标是探讨miR144-3p是否通过靶向ABCG2影响GC细胞侵袭和迁移能力. 为进一步研究miR144-3p和ABCG2-MMP-2/9信号通路在GC中的作用机制提供实验支持, 为GC的治疗和预后提供新的作用靶点.
本实验主要研究方法包括通过生物信息学软件预测miR144-3p和ABCG2靶向结合位点, 通过双荧光素酶报告基因实验验证miR144-3p和ABCG2靶向结合关系. 通过细胞转染法转染miR144-3p模拟物或抑制物, 过表达或敲低miR144-3p的表达. 明胶谱检测基质金属蛋白酶MMP-2和MMP-9活性, Transwell实验检测细胞侵袭和迁移能力.
本实验结果显示, 与正常细胞相比, miR144-3p在GC细胞中呈低表达. 通过转染上调miR144-3p表达, 经检测结果发现, 上调miR144-3p可抑制GC细胞的侵袭和迁移能力, 下调miR144-3p的表达可增强GC细胞侵袭和迁移能力. 以上结果说明miR144-3p与GC细胞侵袭和迁移密切相关, 可能参与GC转移和恶性进程. 此外, 通过转染敲低ABCG2的表达后, GC细胞的侵袭和转移能力均下降. 通过预测发现ABCG2是miR144-3p的靶基因, 双荧光素酶报告基因实验证实了miR144-3p可与ABCG2 mRNA 3'UTR靶向结合. 在GC细胞中上调miR144-3p的表达可抑制ABCG2的表达, 下调miR144-3p的表达增加了ABCG2的表达. 说明miR144-3p通过靶向负调控ABCG2的表达在GC中发挥抑制细胞侵袭和迁移的作用. 敲低ABCG2的表达, 通过明胶酶谱实验检测对MMP-2和MMP-9蛋白活性的影响, 结果显示, MMP-2和MMP-9蛋白活性显著降低, 结合Transwell实验结果, 提示ABCG2-MMP-2/9通路影响细胞侵袭和迁移. 综合以上实验结果, 说明miR144-3p负调控ABCG2的表达介导MMP-2和MMP-9蛋白活性影响GC细胞侵袭和迁移. 为进一步研究miR144-3p靶向ABCG2-MMP-2/9信号通路在其他肿瘤细胞的的作用提供实验依据.
本实验发现miR144-3p能够通过负调控ABCG2的表达, 介导MMP-2和MMP-9蛋白活性影响GC细胞侵袭和迁移. 说明miR144-3p负调控ABCG2的表达介导MMP-2和MMP-9蛋白活性影响GC细胞侵袭和迁移. 为进一步研究miR144-3p靶向ABCG2-MMP-2/9信号通路在其他肿瘤细胞的的作用提供实验依据. 为临床上治疗GC提供新的思路和新的分子作用靶点.
本研究只单从人GCHGC-27细胞水平上探究了miR144-3p通过负调控ABCG2的表达介导MMP-2和MMP-9蛋白活性影响GC细胞侵袭和迁移, 但未在多种细胞株中验证. 后续研究将从多角度以及其他细胞株中进行验证, 为在临床上治疗GC提供一定的实验和理论依据. 通过靶向作用miR144-3p或ABCG2用于GC的治疗及预后仍需临床实验进行验证.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Fu DG. Epigenetic alterations in gastric cancer (Review). Mol Med Rep. 2015;12:3223-3230. [PubMed] [DOI] |
| 3. | Ludwig N, Leidinger P, Becker K, Backes C, Fehlmann T, Pallasch C, Rheinheimer S, Meder B, Stähler C, Meese E. Distribution of miRNA expression across human tissues. Nucleic Acids Res. 2016;44:3865-3877. [PubMed] [DOI] |
| 4. | Rupaimoole R, Calin GA, Lopez-Berestein G, Sood AK. miRNA Deregulation in Cancer Cells and the Tumor Microenvironment. Cancer Discov. 2016;6:235-246. [PubMed] [DOI] |
| 5. | Li A, Zhang J, Zhou Z, Wang L, Sun X, Liu Y. Genome-scale identification of miRNA-mRNA and miRNA-lncRNA interactions in domestic animals. Anim Genet. 2015;46:716-719. [PubMed] [DOI] |
| 7. | Zhang SY, Lu ZM, Lin YF, Chen LS, Luo XN, Song XH, Chen SH, Wu YL. miR-144-3p, a tumor suppressive microRNA targeting ETS-1 in laryngeal squamous cell carcinoma. Oncotarget. 2016;7:11637-11650. [PubMed] [DOI] |
| 8. | Liu F, Chen N, Xiao R, Wang W, Pan Z. miR-144-3p serves as a tumor suppressor for renal cell carcinoma and inhibits its invasion and metastasis by targeting MAP3K8. Biochem Biophys Res Commun. 2016;480:87-93. [PubMed] [DOI] |
| 9. | Liu L, Zuo LF, Guo JW. ABCG2 gene amplification and expression in esophageal cancer cells with acquired adriamycin resistance. Mol Med Rep. 2014;9:1299-1304. [PubMed] [DOI] |
| 10. | Sui H, Zhou LH, Zhang YL, Huang JP, Liu X, Ji Q, Fu XL, Wen HT, Chen ZS, Deng WL. Evodiamine Suppresses ABCG2 Mediated Drug Resistance by Inhibiting p50/p65 NF-κB Pathway in Colorectal Cancer. J Cell Biochem. 2016;117:1471-1481. [PubMed] [DOI] |
| 11. | Wang J, Yunyun Z, Wang L, Chen X, Zhu Z. ABCG2 confers promotion in gastric cancer through modulating downstream CRKL in vitro combining with biostatistics mining. Oncotarget. 2017;8:5256-5267. [PubMed] [DOI] |
| 12. | Hsu HH, Chen MC, Baskaran R, Lin YM, Day CH, Lin YJ, Tu CC, Vijaya Padma V, Kuo WW, Huang CY. Oxaliplatin resistance in colorectal cancer cells is mediated via activation of ABCG2 to alleviate ER stress induced apoptosis. J Cell Physiol. 2018;233:5458-5467. [PubMed] [DOI] |
| 13. | Zhang J, Yan Y, Yang Y, Wang L, Li M, Wang J, Liu X, Duan X, Wang J. High Infiltration of Tumor-Associated Macrophages Influences Poor Prognosis in Human Gastric Cancer Patients, Associates With the Phenomenon of EMT. Medicine (Baltimore). 2016;95:e2636. [PubMed] [DOI] |
| 14. | Kim CH, Kim HK, Rettig RL, Kim J, Lee ET, Aprelikova O, Choi IJ, Munroe DJ, Green JE. miRNA signature associated with outcome of gastric cancer patients following chemotherapy. BMC Med Genomics. 2011;4:79. [PubMed] [DOI] |
| 15. | Hao NB, He YF, Li XQ, Wang K, Wang RL. The role of miRNA and lncRNA in gastric cancer. Oncotarget. 2017;8:81572-81582. [PubMed] [DOI] |
| 16. | Gu JJ, Gao GZ, Zhang SM. miR-218 inhibits the migration and invasion of glioma U87 cells through the Slit2-Robo1 pathway. Oncol Lett. 2015;9:1561-1566. [PubMed] [DOI] |
| 17. | Chen DL, Ju HQ, Lu YX, Chen LZ, Zeng ZL, Zhang DS, Luo HY, Wang F, Qiu MZ, Wang DS. Long non-coding RNA XIST regulates gastric cancer progression by acting as a molecular sponge of miR-101 to modulate EZH2 expression. J Exp Clin Cancer Res. 2016;35:142. [PubMed] [DOI] |
| 18. | Chen H, Li L, Wang S, Lei Y, Ge Q, Lv N, Zhou X, Chen C. Reduced miR-126 expression facilitates angiogenesis of gastric cancer through its regulation on VEGF-A. Oncotarget. 2014;5:11873-11885. [PubMed] [DOI] |
| 19. | Zhao X, Hou Y, Tuo Z, Wei F. Application values of miR-194 and miR-29 in the diagnosis and prognosis of gastric cancer. Exp Ther Med. 2018;15:4179-4184. [PubMed] [DOI] |
| 20. | Liu L, Zuo LF, Guo JW. Reversal of multidrug resistance by the anti-malaria drug artesunate in the esophageal cancer Eca109/ABCG2 cell line. Oncol Lett. 2013;6:1475-1481. [PubMed] [DOI] |
| 21. | 梁 燕, 王 新颖, 彭 亮, 许 岸高, 王 伟飞, 苏 宁, 陈 楚弟, 姜 泊. ABCG2在大肠癌中的表达及其对预后的影响. 现代消化及介入诊疗. 2011;16:260-266. [DOI] |
| 22. | Brown GT, Murray GI. Current mechanistic insights into the roles of matrix metalloproteinases in tumour invasion and metastasis. J Pathol. 2015;237:273-281. [PubMed] [DOI] |
| 23. | Lu S, Zhang Z, Chen M, Li C, Liu L, Li Y. Silibinin inhibits the migration and invasion of human gastric cancer SGC7901 cells by downregulating MMP-2 and MMP-9 expression via the p38MAPK signaling pathway. Oncol Lett. 2017;14:7577-7582. [PubMed] [DOI] |
| 24. | Burlaka AP, Ganusevich II, Gafurov MR, Lukin SM, Sidorik EP. Stomach Cancer: Interconnection between the Redox State, Activity of MMP-2, MMP-9 and Stage of Tumor Growth. Cancer Microenviron. 2016;9:27-32. [PubMed] [DOI] |