修回日期: 2018-07-26
接受日期: 2018-08-01
在线出版日期: 2018-08-28
研究达芬奇机器人在胃癌根治术中的使用价值.
收集中国人民解放军兰州总医院普外科自2016-12/2017-04接受达芬奇机器人胃癌根治术的患者信息, 以同期接受腹腔镜胃癌根治术患者信息做对照, 将二组手术治疗效果、术后恢复情况、住院费用以及预后等信息行统计分析.
相比于腹腔镜组, 达芬奇组术中出血少(P<0.05)、淋巴结清扫彻底(P<0.05)、手术切缘更安全(P<0.05), 但手术时间会增加(P<0.05); 而在患者的术后恢复中, 二组术后首次进食、消化道功能恢复所需时间以及手术并发症的发生率均未见明显差异(P>0.05), 而手术费用却会明显增加(P<0.05); 但接受达芬奇根治性全胃手术的患者术后住院日明显低于腹腔镜组(P<0.05), 而这种差异在根治性远侧胃切除术患者中却并未发现(P>0.05); 另外, 二组患者术后的远期生存情况并未明显的差异(P>0.05).
达芬奇机器人在外科手术中的使用确实存在一定优势, 但仍需要术者不断提升自身技能并慎重对待.
核心提要: 通过本研究发现, 相比于腹腔镜胃癌根治术而言, 达芬奇操作系统能够使患者获得更好的手术近期疗效, 且这种优势在根治性全胃手术患者中可能更加明显; 而在远期恢复中却未见明显优势.
引文著录: 李盖天, 陈鹏, 阎龙, 李洪涛, 徐麟, 刘宏斌. 达芬奇机器人在根治性胃癌手术中的应用疗效研究. 世界华人消化杂志 2018; 26(24): 1455-1462
Revised: July 26, 2018
Accepted: August 1, 2018
Published online: August 28, 2018
To assess the value of Da Vinci robot in radical gastrec-tomy for gastric cancer.
The information of patients who underwent Da Vinci robot assisted radical gastrectomy for gastric cancer at the Department of General Surgery, Lanzhou General Hospital of the Chinese People's Liberation Army from December 2016 to April 2017 was collected. The information of patients who received laparoscopic radical gastrectomy for gastric cancer was also obtained. The information on surgical treatment, postoperative recovery, hospital expenses, and prognosis was statistically analyzed between the two groups.
Compared with the laparoscopic group, the Da Vinci group had less bleeding during operation (P < 0.05), more complete lymph node dissection (P < 0.05), and safer incision margin (P < 0.05), but the operative time was increased (P < 0.05). In the postoperative recovery of patients of the two groups, the time to first food intake, the time to the recovery of the digestive tract, and the incidence of complications were not significantly different between the two groups (P > 0.05), but surgical cost was significantly increased (P < 0.05). The hospital stay was significantly shorter in patients who received Da Vinci robot assisted radical gastrectomy than in the laparoscopy group (P < 0.05), but this difference was not found in patients who underwent distal radical gastrectomy (P > 0.05). There was no significant difference in long-term survival between the two groups (P > 0.05).
Da Vinci robot assisted radical gastrectomy has certain advantages over laparoscopic radical gastrectomy in the treatment of gastric cancer, but it is still necessary for practitioners to improve their skills and be cautious.
- Citation: Li GT, Chen P, Yan L, Li HT, Xu L, Liu HB. Curative effect of Da Vinci robot assisted radical gastrectomy for gastric cancer. Shijie Huaren Xiaohua Zazhi 2018; 26(24): 1455-1462
- URL: https://www.wjgnet.com/1009-3079/full/v26/i24/1455.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i24.1455
胃癌是世界上最常见的一种消化系统恶性肿瘤疾病, 其发病率可达约9%, 同时死亡率也高达约8.8%, 分别位居世界恶性肿瘤疾病中的第四和第二位[1]. 对于胃癌的治疗, 根治性手术切除一直是其治疗的主要手段[2]. 随着科技的发展和进步, 现如今胃癌根治术的方式已由传统的开腹治疗晋升为常规的腹腔镜手术, 并且凭借手术方式的微创、低损伤以及恢复快等优势得到广大患者以医生的好评[3]. 在新时代背景下, 达芬奇机器人手术操作系统开始进入人们的视线, 并于2000-07在美国食品药品管理局的批准下于开始正式应用于临床外科手术中. 之后, 各国的专家及学者在不断熟悉掌握这项新科技的同时也对其在临床中的使用价值进行不断的探索[4]. 中国人民解放军兰州军区总医院于2016-12引入达芬奇机器人手术操作系统并大力开展其在胃癌患者治疗中的应用, 现将我科治疗病人相关信息总结如下.
选取中国人民解放军兰州军区总医院普外科于2016-12/2017-04接受达芬奇机器人胃癌根治术的患者为研究对象, 收集患者相关资料进行回顾性研究; 并将同一时间段在我科接受腹腔镜胃癌根治术的患者相关信息收集进行对比. 纳入标准: 术前电子胃镜及病理等检查明确诊断为胃癌; 无手术禁忌症; 接受根治性胃癌切除+D2淋巴结清扫术. 排除标准: 术前检查或者术中发现疾病存在远处转移; 合并其他肿瘤疾病; 行姑息性手术. 术前向患者授权委托人及其家属详细说明达芬奇机器人及腹腔镜手术相关信息, 由其自主决定接受何种手术方式, 并签署相应手术知情同意书.
经过筛选后共收集到接受达芬奇机器人手术及腹腔镜手术患者分别41和52例; 其中根治性全胃切除术患者分别15和22例, 根治性远侧胃切除术患者分别26和30例. 依据患者的年龄、体重指数以及肿瘤分期等信息以达芬奇手术患者为参照, 从腹腔镜手术患者中寻找相应的患者资料进行配对, 若可选配对患者资料数≥2, 则按照随机原则进行选择配对; 如此逐一寻找相应配对的对照组病例, 最终筛选出达芬奇机器人手术及腹腔镜手术患者共41组; 其中根治性全胃切除术患者15组, 根治性远侧胃切除术患者26组, 基本信息如下(表1).
| 项目 | 年龄 (岁) | 性别 | BMI | 肿瘤直径 (cm) | 肿瘤分期 | 远侧胃 | 全胃 | |||
| 男 | 女 | Ⅰ | Ⅱ | Ⅲ | ||||||
| 腹腔镜组 | 57.63 ± 8.96 | 15 | 26 | 23.05 ± 3.16 | 5.63 ± 2.96 | 5 | 6 | 30 | 26 | 15 |
| 达芬奇组 | 54.26 ± 13.21 | 18 | 23 | 22.69 ± 2.87 | 4.37 ± 2.68 | 5 | 4 | 32 | 26 | 15 |
| χ2 | 0.456 | 0.465 | ||||||||
| t | 0.347 | 0.674 | 0.247 | |||||||
| P | 0.769 | 0.499 | 0.568 | 0.835 | 0.793 | |||||
所有患者在完善相关术前辅助检查的同时接受相同的饮食以及术前宣教等围手术期护理, 完善相关术前准备后分别接受达芬奇机器人或腹腔镜下胃癌根治术, 所有操作均依照日本13版胃癌D2根治术的标准行根治性全胃或远侧胃切除及胃周淋巴结清扫术. 术中操作差异如下.
根治性全胃切除术: 术中离断胃周血管并完成D2清扫及相应组织游离后, 将已用直线切割闭合器离断十二指肠及食管下段的全胃及胃周网膜组织标本暂置一旁, 镜下于距屈氏韧带15 cm处切断空肠, 将远侧断端提至食管闭合处, 以直线切割闭合器行食管-空肠端侧吻合并缝合吻合口; 距吻合口40 cm处将空肠与近侧断端行端侧吻合. 吻合完成后取上腹部正中6 cm切口取出标本并探查吻合口, 必要时进行加固.
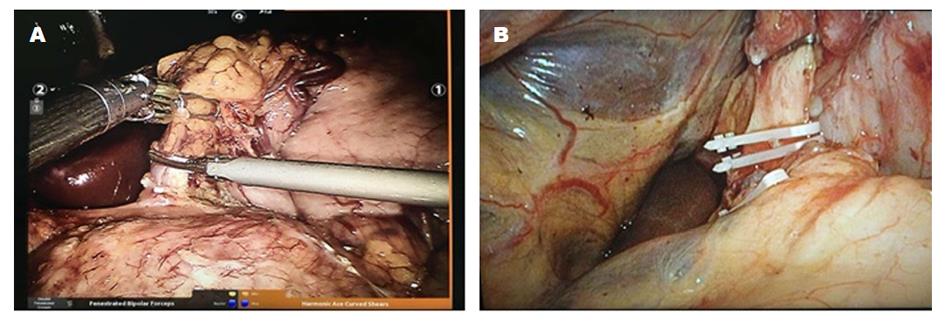
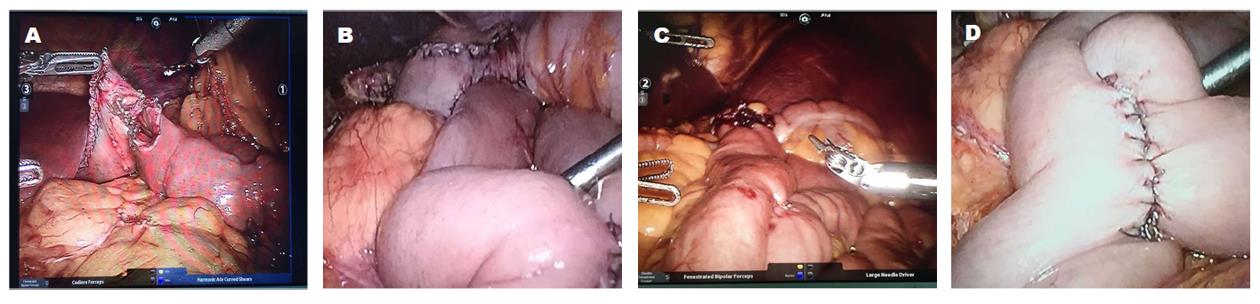
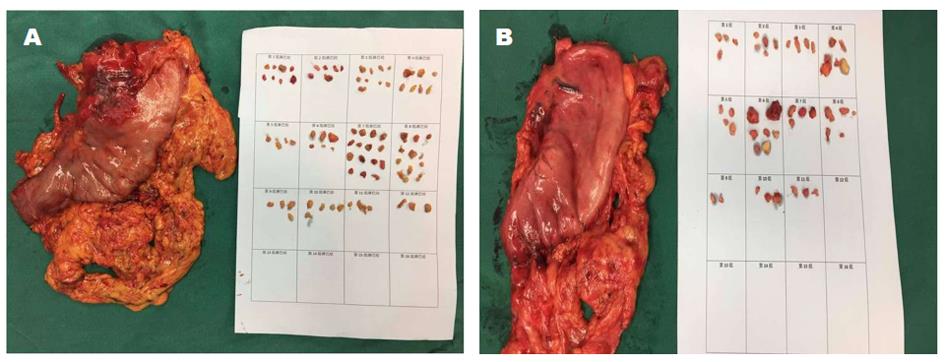
根治性远侧胃切除术: 术中标本离断及淋巴结清扫同根治性全胃手术, 不同之处在于沿胃大弯侧游离标本时仅游离至胃大弯侧无血管区上第二分支, 保留部分近侧胃并于胃上部以直线切割闭合器离断胃壁; 在屈氏韧带下方10-15 cm处行毕Ⅱ式残胃-空肠吻合, 并于距残胃-空肠吻合口10 cm行输出-输入袢空肠侧侧吻合. 术中情况及术后标本(图1、图2、图3).
分别对两种手术方式手术时间、术中出血量、淋巴结清扫数目以及标本上下切缘距瘤体距离进行统计; 同时统计患者术后拔除胃管、首次进食和肛门排气时间以及术后并发症发生率和术后住院时间; 将这些数据依照患者接受根治性全胃及远侧胃手术分别进行对比分析. 另外, 术后定期对患者进行随访, 了解患者预后情况.
统计学处理 所有数据以SPSS22.0软件系统分析处理, 计量资料以mean±SD表示, 二组之间以t检验进行处理, 若方差不齐以t检验处理; 计数资料以χ2检验处理, n<40时使用Fisher确切法进行检验, P<0.05差异具有统计学意义.
通过对患者术中相关信息的统计分析, 发现达芬奇组在根治性远侧胃切除术及全胃切除术中的手术操作时间、切除标本的上下切缘距离以及清扫的淋巴结数目均明显大于腹腔镜组, 同时手术出血量明显少于腹腔镜手术组, 且通过t检验后发现差异具有统计学意义(P<0.05)(表2和表3).
| 项目 | 腹腔镜组 | 达芬奇组 | t值 | P值 |
| 术中时间 (min) | 182.36 ± 40.68 | 223.67 ± 32.58 | 8.647 | <0.001 |
| 术中出血量 (mL) | 158.67 ± 88.93 | 113.24 ± 42.57 | 2.967 | 0.003 |
| 淋巴结数目 (枚) | 32.54 ± 12.87 | 44.48 ± 10.65 | 8.426 | <0.001 |
| 上切缘距离 (cm) | 3.68 ± 1.46 | 4.27 ± 1.32 | 4.822 | <0.001 |
| 下切缘距离 (cm) | 7.69 ± 3.64 | 8.97 ± 3.52 | 7.041 | <0.001 |
| 项目 | 腹腔镜组 | 达芬奇组 | t值 | P值 |
| 术中时间 (min) | 225.33 ± 39.03 | 264 ± 31.8 | 2.795 | 0.013 |
| 术中出血量 (mL) | 243.33 ± 113.66 | 156.67 ± 53.00 | 2.676 | 0.017 |
| 淋巴结数目 (枚) | 36.87 ± 11.32 | 48.53 ± 10.35 | 2.944 | 0.011 |
| 上切缘距离 (cm) | 2.03 ± 1.3 | 3.33 ± 1.87 | 2.211 | 0.041 |
| 下切缘距离 (cm) | 6.83 ± 2.74 | 8.93 ± 2.41 | 2.229 | 0.037 |
虽然达芬奇组患者(无论是根治性远侧胃还是全胃手术)术后拔除胃管、肛门首次通气、首次进食以及术后住院时间均早于接受腹腔镜组, 但仅达芬奇根治性全胃切除手术患者术后出院时间早于腹腔镜组, 且差异具有统计学意义(P<0.05), 其余指标之间的差异均无明显统计学意义(P>0.05); 但达芬奇组所有患者住院期间所产生的住院费用均明显多与接受腹腔镜组, 差异具有统计学意义(P<0.05)(表4和表5).
| 项目 | 腹腔镜组 | 达芬奇组 | t值 | P值 |
| 胃管拔除 (h) | 21.56 ± 7.84 | 19.37 ± 4.95 | 1.848 | 0.083 |
| 肛门排气 (d) | 1.87 ± 1.42 | 1.64 ± 1.28 | 1.908 | 0.072 |
| 术后首次进食 (d) | 2.07 ± 1.35 | 1.78 ± 0.98 | 1.593 | 0.127 |
| 术后住院日 (d) | 11.64 ± 7.37 | 9.86 ± 3.25 | 1.372 | 0.187 |
| 并发症 n (%) | 1(3.85) | 0 | 1.003 | |
| 住院费用 (元) | 82523.16 ± 12893.12 | 104897.37 ± 23594.16 | 4.385 | <0.001 |
| 项目 | 腹腔镜组 | 达芬奇组 | t值 | P值 |
| 胃管拔除 (h) | 21.32 ± 6.78 | 17.64 ± 4.52 | 1.288 | 0.124 |
| 肛门排气 (d) | 1.76 ± 1.46 | 1.45 ± 1.32 | 1.304 | 0.573 |
| 术后首次进食 (d) | 2.03 ± 1.52 | 1.56 ± 1.02 | 1.615 | 0.068 |
| 术后住院日 (d) | 15.33 ± 8.72 | 10.4 ± 1.5 | 2.223 | 0.032 |
| 并发症 n (%) | 2(13.33) | 0 | 0.483 | |
| 住院费用 (元) | 91364.16 ± 14598.28 | 119765.86 ± 25684.59 | 5.205 | <0.001 |
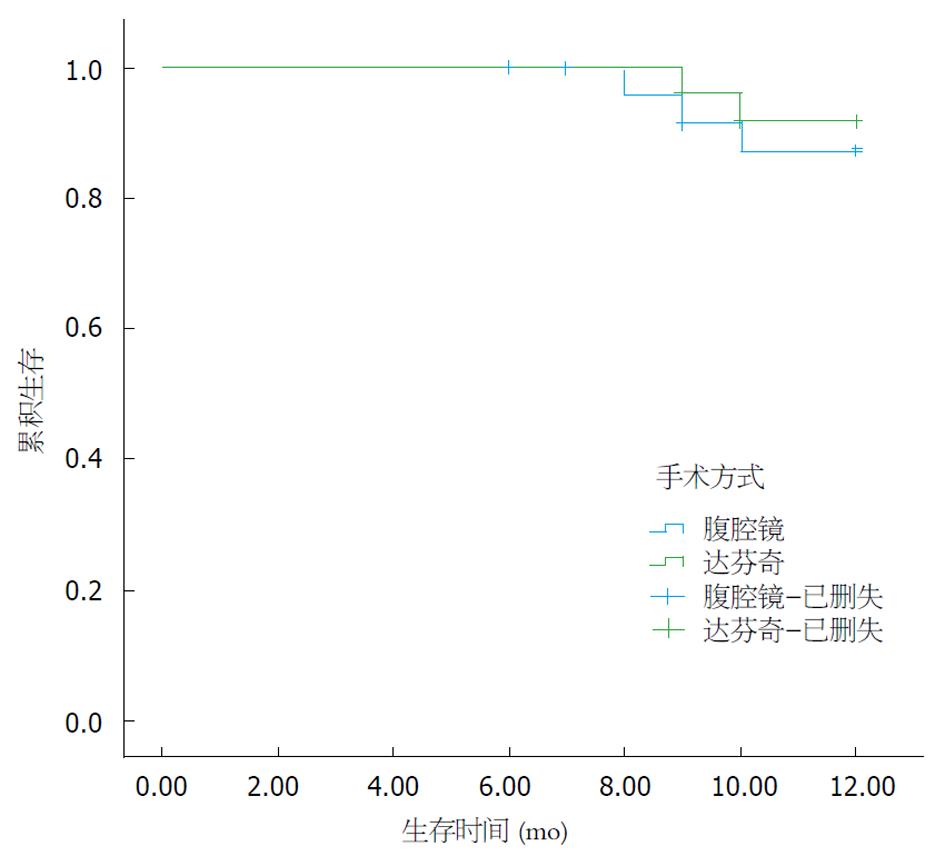
截至2018-04对患者随访结果显示, 术后达芬奇组中2例患者出现肝脏, 1例出现腹腔多发转移, 死亡2例, 失访3例, 1年生存率93.2%, 中位生存时间11.797个月, 95%CI: 11.521-12.072; 腹腔镜组中有1例患者出现吻合口局部复发, 2例出现肝脏转移结节, 1例出现腹腔多发转移, 死亡3例, 失访3例, 1年生存率88.5%, 中位生存时间11.621 mo, 95%CI: 11.205-12.037; 但经过Kaplan-Meier分析后发现, 二种手术方式对患者术后1年生存率影响的差异并无统计学意义, P = 0.583(图4).
研究显示, 全世界约70%的胃癌新发病例出现在发展中国家, 高达50%的新发患者属于亚洲东部人群, 且主要集中在中国[5]. 目前, 我国胃癌疾病的状况越来越严峻, 据相关数据统计, 每年我国胃癌新发病例数约为68万, 同时每年死于胃癌疾病的患者高达约50万人, 发病率及死亡率均位居我国恶性肿瘤疾病中的第二位[6]. 我国自2009年开始第一台达芬奇直肠癌手术后就将此操作系统不断推广应用于胃癌等疾病的外科治疗之中, 由于其具有相比于传统腔镜操作系统更优的3D成像系统以及高精密的灵活操作等优势不断获得广大外科医师的好评.
通过对本科室收治的82例腹腔镜与达芬奇治疗的胃癌患者相关信息进行对比后发现, 相比于腹腔镜手术而言, 患者接受达芬奇根治性全胃及远侧胃手术过程中会有更少的出血、更彻底的淋巴结清扫, 同时能够获得更安全的手术切缘距离, 但是, 术中所消耗的时间会有一定程度的增加; 而在患者的术后恢复中, 接受达芬奇手术的患者无论是根治性全胃还是远侧胃在术后首次进食、消化道功能恢复所需时间以及手术并发症的发生率方面均未见相比于腹腔镜手术患者而言的明显改变, 而手术费用方面却会明显高于后者; 但是值得注意的是, 经过对患者的相关数据分析发现, 接受达芬奇根治性全胃手术的患者术后住院日明显低于腹腔镜全胃切除术患者, 而这种差异在根治性远侧胃切除术患者中却并未发现, 这可能就是达芬奇手术系统优势的体现; 另外, 通过对患者的术后随访发现二组患者术后的远期生存情况并未因手术操作方式的改变而发生明显的改变.
自2002第一台达芬奇机器人辅助下胃癌根治术的完成后[7], 各国专家及学者不断在各个领域摸索此先进技术的可行性, 并逐渐将其熟练应用于普外科、泌尿外科及妇科等外科手术中[8]. 专家们通过在达芬奇操作系统的使用探索及经验总结发现, 其确实具有较多相比于腹腔镜操作的独特优势, 尤其是在患者治疗中的近期疗效[9,10]. 首先, 其具有独特的3D操作系统及可360°旋转的机械臂, 能够在保证充分且清晰的手术操作视野的同时获得更加灵活自如且精准的手术操作角度及空间, 极大程度的减少因术者个人因素所造成的操作不足[11,12]; 同时, 在此基础上其还保证了较高的手术安全性[13]. 其次, 在手术操作过程中, 由于其具有灵活自如且精准的机械臂, 在一定程度上能够更加精准自如的完成一些较高难度的病灶切除、血管裸化及淋巴结的清扫, 并且能够避免血管、神经的损伤, 从而获得更加彻底的病灶切除及淋巴结清扫, 同时还能确保更少的手术出血[14]; 尤其是在脾门及脾动脉周围的No. 10及No. 11组淋巴结清扫中, 其精准稳定的优势能够在清扫此处淋巴结时保证血管安全的前提下更大程度的完成淋巴结清扫[15,16], 且这种优势在根治性全胃手术[17]及高BMI患者[18]中的更加明显. 本研究中也得出相似结论. 最后, 在对患者术后并发症的研究中存在一定程度的争议, 有的研究者指出达芬奇机器人操作系统相比于腹腔镜手术能够一定程度上降低胃癌患者术后并发症发生的几率, 为患者带来一定福音[19,20]; 但也有研究表明, 两种手术方式的术后并发症发生率并无明显差异[21,22]. 而对于这两种操作方式对患者术后恢复及远期生存的影响方面的研究结果较为一致, 均认为达芬奇操作系统相比于腹腔镜手术不会起到明显改善作用[23]. 目前, 由于达芬奇操作系统具有对有熟练腹腔镜操作经验的外科医生而言较为容易掌握[24,25]、能够依靠其灵活精准的操作最大程度的完成主刀医师所希望的术中操作细节[26]、能够在保护胰脾等重要脏器及周围血管的前提下完成更加彻底的淋巴结清扫[27]以及甚至可以在小切口辅助下完成全镜下标本切除及消化道的重建吻合[28]等优势, 在2015年达芬奇机器胃癌手术专家共识中将达芬奇操作系统在胃癌疾病治疗中的适用范围推广至T4a的原发灶, 并且指出对于经验丰富、技术熟练的出色外科医师可适当将其使用于Ⅲ期胃癌患者的治疗中[29].
尽管如此, 达芬奇操作系统也并非完美无缺. 第一, 由于达芬奇操作系统开机时间较长, 机械臂连接要求较高, 连接不当会直接导致术中操作时机械臂之间相互碰撞影响手术操作甚至损伤机器, 机械臂连接时必须小心谨慎, 即使是经过专业培训且熟练的外科医生也需要一定的时间完成安装步骤, 因此, 整个手术操作时间会一定程度上增加[30], 而长时间的人工气腹会在一定程度上增加患者心脑血管意外发生的几率[31], 虽然技术娴熟的术者及助手能够最大程度的缩减手术时间, 但这仍是一个潜在的风险. 第二, 由于整个手术过程均是由术者远程操控机器完成, 缺乏术者对机械臂的直接控制, 万一术中机器出现故障, 无法保证及时停止所进行的操作, 很有可能出现一些危机患者生命的意外, 且有统计数据分析表明达芬奇机器人手术系统机械故障的发生率约为2.4%[32], 这也是值得注意的问题. 第三, 面对该新兴的进口产品, 目前在我国使用过程中所产生的费用仍较高, 已有多位专家指出达芬奇胃癌手术相比于腹腔镜而言会有较高的费用增加[33,34], 而在本研究中也同样发现了此类问题, 虽然我科有意识的尽可能降低患者住院费用, 但接受达芬奇手术的胃癌患者其住院费用仍较接受腹腔镜的患者高出2万元左右.
总之, 达芬奇手术操作系统是顺应时代的先进科技产物, 其在根治性胃癌手术乃至其他外科手术中若能应用得当可以一定程度上减少患者手术所承受的创伤, 并获得更好的治疗效果, 为患者疾病的治疗带来福音; 但是, 其也是一把双刃剑, 若技术熟练程度不足或者使用不当反而可能会对患者产生一定的危害. 这就要求外科医师在不断提升自身技术能力的同时慎重对待每一位病人、每一台手术, 充分发挥该科技的优势减轻患者疾患的痛苦. 另外, 其手术费用问题也是一个有待解决的现实问题, 现如今我国已经开始研发国产手术操作系统, 并取得一定的成果, 不久的未来能够在一定程度上减轻患者的经济压力.
外科手术一直是胃癌治疗的主要方式, 随着技术的发展, 根治性胃切除手术由原来的开腹逐渐向腹腔镜手术转变; 现阶段, 随着达芬奇机器人操作系统的出现, 外科微创手术更加精细, 但其在胃癌根治术中的具体应用价值仍缺乏较多临床数据支持.
本研究通过将达芬奇操作系统与腹腔镜手术在胃癌根治术中的具体疗效进行对比分析, 希望能够为达芬奇操作系统在胃癌根治手术中的应用提供一定依据.
寻找达芬奇操作系统相比于腹腔镜手术在胃癌根治术中优势.
本研究通过对比同期达芬奇胃癌根治术及腹腔镜胃癌根治术的患者在住院期间的临床数据以及术后随访资料, 以t检验、χ2以及生存曲线分析的方法对二组患者的相关数据资料进行统计学分析.
通过对比分析后发现, 达芬奇操作系统相比于腹腔镜而言能够使胃癌患者获得更好的近期治疗效果, 尤其是需要接受根治性全胃切除手术的患者; 但并不会明显改善患者疾病的预后情况, 且一定程度上会增加患者的经济压力.
达芬奇操作系统的优势在于能够使胃癌患者有较明显的近期获益, 能在一定程度上提高患者的生存质量, 且这种优势在需行根治性全胃切除术的患者中更加明显, 但并不能对疾病的预后有明显的改善.
本研究所纳入样本数据较小, 且随访时间较短; 下一步将扩大研究样本量并进行三至五年的详细随访. 希望能够获得更加全面且更有价值的研究结果.
学科分类: 胃肠病学和肝病学
手稿来源地: 甘肃省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | McGuire S. World Cancer Report 2014. Geneva, Switzerland: World Health Organization, International Agency for Research on Cancer, WHO Press, 2015. Adv Nutr. 2016;7:418-419. [PubMed] [DOI] |
| 2. | 胡 建昆, 陈 心足. 胃癌多学科协作诊疗模式现状. 中国普外基础与临床杂志. 2012;19:1-3. |
| 3. | Qiu J, Pankaj P, Jiang H, Zeng Y, Wu H. Laparoscopy versus open distal gastrectomy for advanced gastric cancer: a systematic review and meta-analysis. Surg Laparosc Endosc Percutan Tech. 2013;23:1-7. [PubMed] [DOI] |
| 4. | 江 志伟, 赵 坤, 王 刚, 鲍 扬, 谢 立飞, 刘 凤涛, 潘 华峰, 张 小磊, 阮 虎, 李 宁. 手术机器人系统在120例胃癌患者治疗中的应用. 中华胃肠外科杂志. 2012;15:801-803. [DOI] |
| 5. | Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136:E359-E386. [PubMed] [DOI] |
| 6. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 7. | Hashizume M, Shimada M, Tomikawa M, Ikeda Y, Takahashi I, Abe R, Koga F, Gotoh N, Konishi K, Maehara S. Early experiences of endoscopic procedures in general surgery assisted by a computer-enhanced surgical system. Surg Endosc. 2002;16:1187-1191. [PubMed] [DOI] |
| 8. | Ishikawa N, Watanabe G. Ultra-minimally invasive cardiac surgery: robotic surgery and awake CABG. Surg Today. 2015;45:1-7. [PubMed] [DOI] |
| 9. | Shen W, Xi H, Wei B, Cui J, Bian S, Zhang K, Wang N, Huang X, Chen L. Robotic versus laparoscopic gastrectomy for gastric cancer: comparison of short-term surgical outcomes. Surg Endosc. 2016;30:574-580. [PubMed] [DOI] |
| 10. | 杜 晓辉, 邢 晓伟. 单中心达芬奇机器人胃癌根治术140例临床分析. 中华普外科手术学杂志(电子版). 2017;11:20-22. [DOI] |
| 11. | Suda K, Ishida Y, Uyama I. Current status of robotic surgery for gastric cancer. Gan To Kagaku Ryoho. 2014;41:1358-1361. [PubMed] [DOI] |
| 12. | Procopiuc L, Tudor Ş, Mănuc M, Diculescu M, Vasilescu C. Robot-assisted surgery for gastric cancer. World J Gastrointest Oncol. 2016;8:8-17. [PubMed] [DOI] |
| 13. | Coratti A, Fernandes E, Lombardi A, Di Marino M, Annecchiarico M, Felicioni L, Giulianotti PC. Robot-assisted surgery for gastric carcinoma: Five years follow-up and beyond: A single western center experience and long-term oncological outcomes. Eur J Surg Oncol. 2015;41:1106-1113. [PubMed] [DOI] |
| 14. | 薛 勇敢, 张 秉栋, 李 鹏, 刘 洪一, 贾 宝庆. 达芬奇机器人胃癌根治术临床疗效评价. 中华腔镜外科杂志(电子版). 2014;7:6-9. [DOI] |
| 15. | Kim YM, Son T, Kim HI, Noh SH, Hyung WJ. Robotic D2 Lymph Node Dissection During Distal Subtotal Gastrectomy for Gastric Cancer: Toward Procedural Standardization. Ann Surg Oncol. 2016;23:2409-2410. [PubMed] [DOI] |
| 16. | Herrera-Almario G, Patane M, Sarkaria I, Strong VE. Initial report of near-infrared fluorescence imaging as an intraoperative adjunct for lymph node harvesting during robot-assisted laparoscopic gastrectomy. J Surg Oncol. 2016;113:768-770. [PubMed] [DOI] |
| 17. | Zhang S, Jiang ZW, Wang G, Feng XB, Liu J, Zhao J, Li JS. Robotic gastrectomy with transvaginal specimen extraction for female gastric cancer patients. World J Gastroenterol. 2015;21:13332-13338. [PubMed] [DOI] |
| 18. | Lee J, Kim YM, Woo Y, Obama K, Noh SH, Hyung WJ. Robotic distal subtotal gastrectomy with D2 lymphadenectomy for gastric cancer patients with high body mass index: comparison with conventional laparoscopic distal subtotal gastrectomy with D2 lymphadenectomy. Surg Endosc. 2015;29:3251-3260. [PubMed] [DOI] |
| 19. | Park JY, Kim YW, Ryu KW, Eom BW, Yoon HM, Reim D. Emerging Role of Robot-assisted Gastrectomy: Analysis of Consecutive 200 Cases. J Gastric Cancer. 2013;13:255-262. [PubMed] [DOI] |
| 20. | Okumura N, Son T, Kim YM, Kim HI, An JY, Noh SH, Hyung WJ. Robotic gastrectomy for elderly gastric cancer patients: comparisons with robotic gastrectomy in younger patients and laparoscopic gastrectomy in the elderly. Gastric Cancer. 2016;19:1125-1134. [PubMed] [DOI] |
| 21. | 余 佩武, 唐 波. 达芬奇机器人辅助胃癌根治术的相关问题探讨. 中华普通外科手术学杂志(电子版). 2010;4:250-253. [DOI] |
| 22. | Park JM, Kim HI, Han SU, Yang HK, Kim YW, Lee HJ, An JY, Kim MC, Park S, Song KY. Who may benefit from robotic gastrectomy?: A subgroup analysis of multicenter prospective comparative study data on robotic versus laparoscopic gastrectomy. Eur J Surg Oncol. 2016;42:1944-1949. [PubMed] [DOI] |
| 23. | Nakauchi M, Suda K, Susumu S, Kadoya S, Inaba K, Ishida Y, Uyama I. Comparison of the long-term outcomes of robotic radical gastrectomy for gastric cancer and conventional laparoscopic approach: a single institutional retrospective cohort study. Surg Endosc. 2016;30:5444-5452. [PubMed] [DOI] |
| 24. | Zhou J, Shi Y, Qian F, Tang B, Hao Y, Zhao Y, Yu P. Cumulative summation analysis of learning curve for robot-assisted gastrectomy in gastric cancer. J Surg Oncol. 2015;111:760-767. [PubMed] [DOI] |
| 25. | Hu WG, Ma JJ, Zang L, Xue P, Xu H, Wang ML, Lu AG, Li JW, Feng B, Zheng MH. Learning curve and long-term outcomes of laparoscopy-assisted distal gastrectomy for gastric cancer. J Laparoendosc Adv Surg Tech A. 2014;24:487-492. [PubMed] [DOI] |
| 26. | Son T, Hyung WJ. Robotic gastrectomy for gastric cancer. J Surg Oncol. 2015;112:271-278. [PubMed] [DOI] |
| 27. | Hosogi H, Yoshimura F, Yamaura T, Satoh S, Uyama I, Kanaya S. Esophagogastric tube reconstruction with stapled pseudo-fornix in laparoscopic proximal gastrectomy: a novel technique proposed for Siewert type II tumors. Langenbecks Arch Surg. 2014;399:517-523. [PubMed] [DOI] |
| 28. | Greenleaf EK, Sun SX, Hollenbeak CS, Wong J. Minimally invasive surgery for gastric cancer: the American experience. Gastric Cancer. 2017;20:368-378. [PubMed] [DOI] |
| 31. | Hong SS, Son SY, Shin HJ, Cui LH, Hur H, Han SU. Can Robotic Gastrectomy Surpass Laparoscopic Gastrectomy by Acquiring Long-Term Experience? A Propensity Score Analysis of a 7-Year Experience at a Single Institution. J Gastric Cancer. 2016;16:240-246. [PubMed] [DOI] |
| 32. | Magouliotis DE, Tasiopoulou VS, Sioka E, Zacharoulis D. Robotic versus Laparoscopic Sleeve Gastrectomy for Morbid Obesity: a Systematic Review and Meta-analysis. Obes Surg. 2017;27:245-253. [PubMed] [DOI] |
| 33. | Kim WT, Ham WS, Jeong W, Song HJ, Rha KH, Choi YD. Failure and malfunction of da Vinci Surgical systems during various robotic surgeries: experience from six departments at a single institute. Urology. 2009;74:1234-1237. [PubMed] [DOI] |
| 34. | Kim YW, Reim D, Park JY, Eom BW, Kook MC, Ryu KW, Yoon HM. Role of robot-assisted distal gastrectomy compared to laparoscopy-assisted distal gastrectomy in suprapancreatic nodal dissection for gastric cancer. Surg Endosc. 2016;30:1547-1552. [PubMed] [DOI] |