修回日期: 2018-07-04
接受日期: 2018-07-08
在线出版日期: 2018-07-28
探讨家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)的临床表现、病理特征、癌变危险因素及治疗方法.
收集江苏省人民医院47例家族性腺瘤性息肉病患者的临床资料, 回顾分析其临床表现、病理特征、癌变情况及治疗方法.
47例患者中29例患者表现为黑便或便血, 22例发生大便性状改变, 腹痛16例, 腹胀11例, 9例患者伴发胃息肉, 4例伴发十二指肠息肉, 2例术后发生硬纤维瘤. 病理结果以管状腺瘤及绒毛管状腺瘤为主, 少数表现为增生性息肉或幼年性息肉. 16例患者发生癌变, 发现年龄≥40岁及腺瘤直径>2 cm者与40岁以下及腺瘤小于2 cm的患者癌变差异有统计学意义(P<0.05), 年龄(OR = 1.084, 95%CI: 1.016-1.157)及腺瘤大小(OR = 10.264, 95%CI: 1.526-69.035)为影响FAP癌变的危险因素. 所有患者均行结直肠切除或内镜下治疗, 4例癌变患者术后辅以化疗.
家族性腺瘤性息肉病以结直肠生长大量息肉为主要特征, 可伴有一系列肠外表现. 病理表现以管状腺瘤及绒毛管状腺瘤为主. 发现年龄及腺瘤大小为影响FAP癌变的危险因素. 预防性结直肠切除和内镜下监测仍然是目前治疗FAP的主要措施.
核心提要: 年龄和腺瘤直径为家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)癌变危险因素, 发现年龄每增大1岁, 癌变风险增加1.084倍, 年轻患者、尤其是女性患者, 息肉直径小于2 cm及AFAP患者可每年定期行内镜下治疗, 而年龄大者及息肉过大、过多者应行预防性结直肠切除术.
引文著录: 胡平, 汤琪云. 家族性腺瘤性息肉病47例临床分析. 世界华人消化杂志 2018; 26(21): 1313-1319
Revised: July 4, 2018
Accepted: July 8, 2018
Published online: July 28, 2018
To investigate the clinical manifestations, pathological features, potential risk factors for cancerization, and therapeutics of familial adenomatous polyposis (FAP).
Forty-seven cases of FAP treated at Jiangsu Provincial Hospital were collected. The clinical data including clinical symptoms, pathological features and therapies of the 47 patients were retrospectively analyzed.
Of the 47 patients, 29 complained of melena or bloody stools and 22 had changes of character of stool; 16 had abdominal pain, 11 had abdominal bloating, 9 had gastric polyps, and 4 had duodenal polyps; 2 suffered from desmoid tumors after proctocolectomy. Main pathological features included tubular adenoma and tubulovillous adenoma, and a few manifested as hyperplastic polyps or juvenile polyps. Sixteen patients were diagnosed with colorectal cancer and there was a significantly higher canceration rate in patients who were older than 40 years or whose polyps were larger than 2 cm in diameter (P < 0.05). Age (OR = 1.084, 95%CI: 1.016-1.157) and the size of adenoma (OR = 10.264, 95%CI: 1.526-69.035) were potential risk factors for FAP. All patients underwent colorectal resection or endoscopic treatment, and four patients with colorectal cancer received adjuvant chemotherapy after surgical operation.
FAP is characterized by the formation of hundreds of colorectal polyps, which is accompanied by a series of extra-intestinal manifestations. Tubular adenoma and tubulovillous adenoma are the main pathological types. Age and the size of adenoma are potential risk factors for adenoma canceration. Prophylactic colorectal resection and endoscopic surveillance remain the main therapies for FAP at present.
- Citation: Hu P, Tang QY. Clinical analysis of 47 cases of familial adenomatous polyposis. Shijie Huaren Xiaohua Zazhi 2018; 26(21): 1313-1319
- URL: https://www.wjgnet.com/1009-3079/full/v26/i21/1313.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i21.1313
家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)是一种具有癌变高风险的常染色体显性遗传病, FAP相关的结直肠癌(colorectal cancer, CRC)占全部结直肠恶性肿瘤的1%[1], 癌变相关危险因素的分析一直为近年来国内外学者们所关注. 为提高对本病的认识, 探讨可能的癌变危险因素, 更好地管理FAP患者, 本文回顾了47例FAP患者的临床资料, 总结分析了该病的临床表现、病理特征、癌变情况及治疗方法, 结果如下.
收集南京医科大学第一附属医院江苏省人民医院2007-01/2017-09期间收治的47例经临床确诊为家族性腺瘤性息肉病患者的临床资料, 其中男性28例, 女性19例, 男女比1.47:1, 发现腺瘤年龄12-66岁, 平均年龄30.74岁±13.67岁. 47例患者中32例(68.09%)有明确的家族史, 另外15例否认家族史.
建立统一的数据登记表对47例家族性腺瘤性息肉病患者的一般情况(如性别、发现年龄、癌变年龄、家族史等)、临床表现(包括消化系统症状及肠外表现等)、腺瘤特征(大小、数目、部位)、病理类型及治疗方法等进行记录, 回顾分析这47例FAP患者的临床表现、病理特征、癌变情况及治疗方法.
1.2.1 随访: 对有条件者定期复查内镜, 对所有患者进行电话回访.
1.2.2 诊断标准及分类方法: 结肠镜检查患者结肠息肉多于100枚或结肠息肉数虽不足100枚, 但具有FAP阳性家族史或一级亲属中有生长少数息肉、患结直肠癌者可临床诊断为家族性腺瘤性息肉病. 依据息肉数目的多少, 分为经典型FAP(classical familial adenomatous polyposis, CFAP)(≥100枚)和轻表型FAP(attenuated familial adenomatous polyposis, AFAP)(<100枚).
统计学处理 应用SPSS23.0进行统计学分析, 计量资料用mean±SD表示, 分类资料与等级资料均采用例数表示, 采用χ2检验或Fisher确切概率法进行分类资料人数分布的比较, 秩和检验进行两组间分类资料比较, 危险因素研究采用二元Logistic回归(Wald向前法), 以P<0.05为差异有统计学意义.
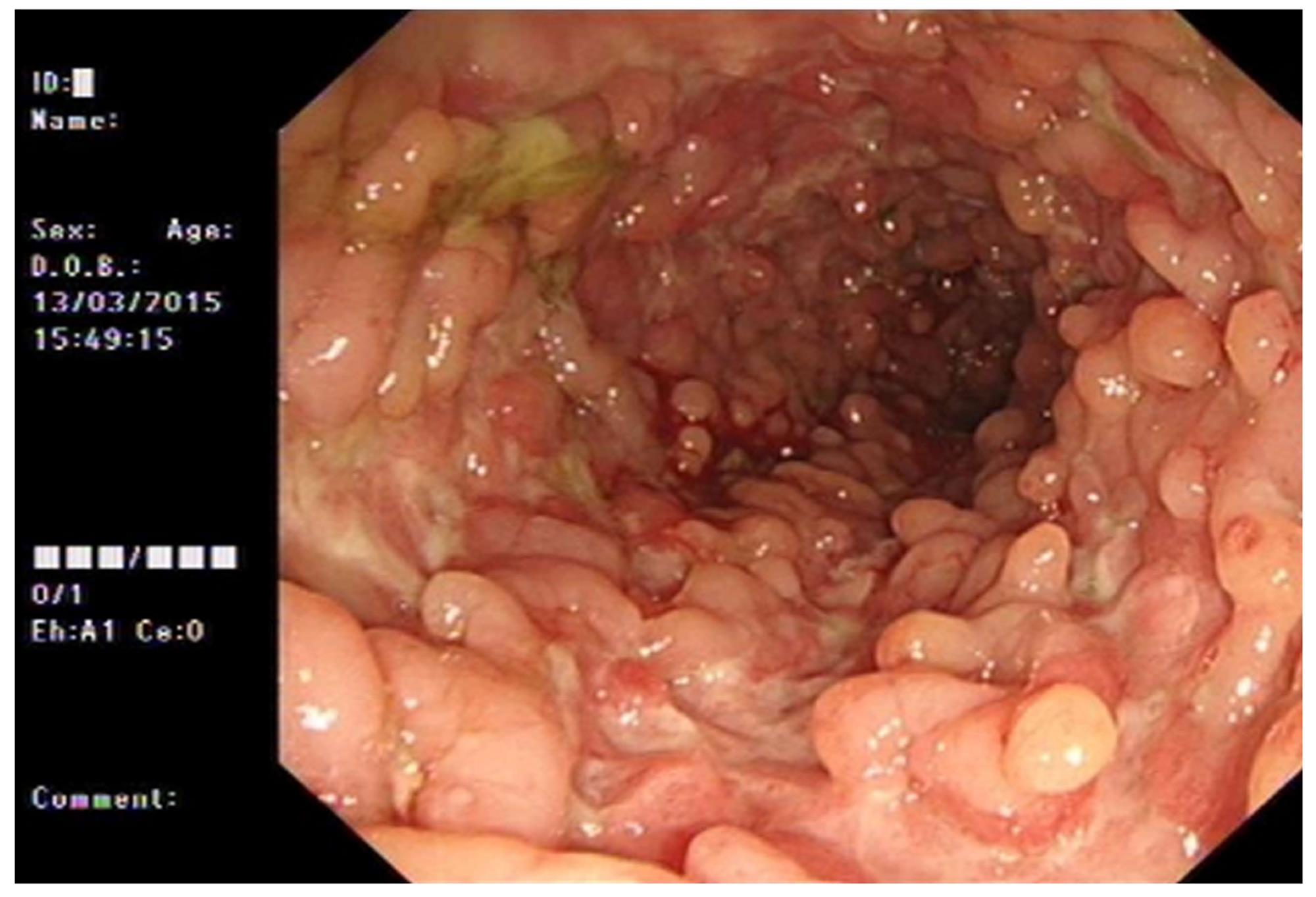
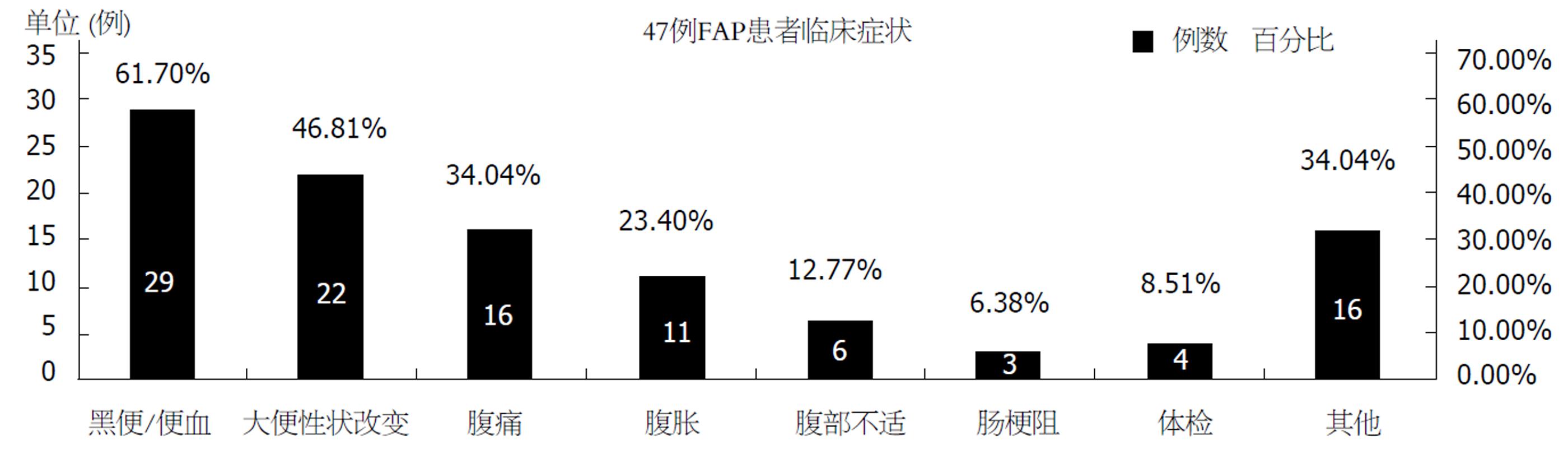
2.1.1 结直肠息肉: 39例患者结直肠有大量息肉, 数百至上千不等, 仅8例患者息肉数少于100枚, 可弥散分布在结直肠的任何位置, 甚至密布整段大肠呈地毯式生长(图1), 直径大小不一, 多数仅数mm, 大者则可达5-6 cm. 47例患者以便血或黑便、大便性状改变、腹痛、腹胀为最常见的症状, 其他较少的临床表现包括排便不尽感, 恶心, 呕吐, 嗳气, 纳差, 贫血, 消瘦等, 另有4例患者系因家族中其他成员患FAP行肠镜检查或正常体检时发现, 未诉明显不适(图2).
2.1.2 肠外表现: 47例患者中有9例伴发胃息肉, 4例伴发十二指肠息肉, 2例继发硬纤维瘤, 1例患者有先天性听力障碍, 1例患者先天性子宫缺如, 未发现甲状腺癌、肝母细胞瘤等肠外恶性肿瘤. 胃息肉数目、大小不等, 发生于贲门、胃底、胃体、胃窦者分别为1例、6例、5例、5例, 全部十二指肠息肉均位于降部.
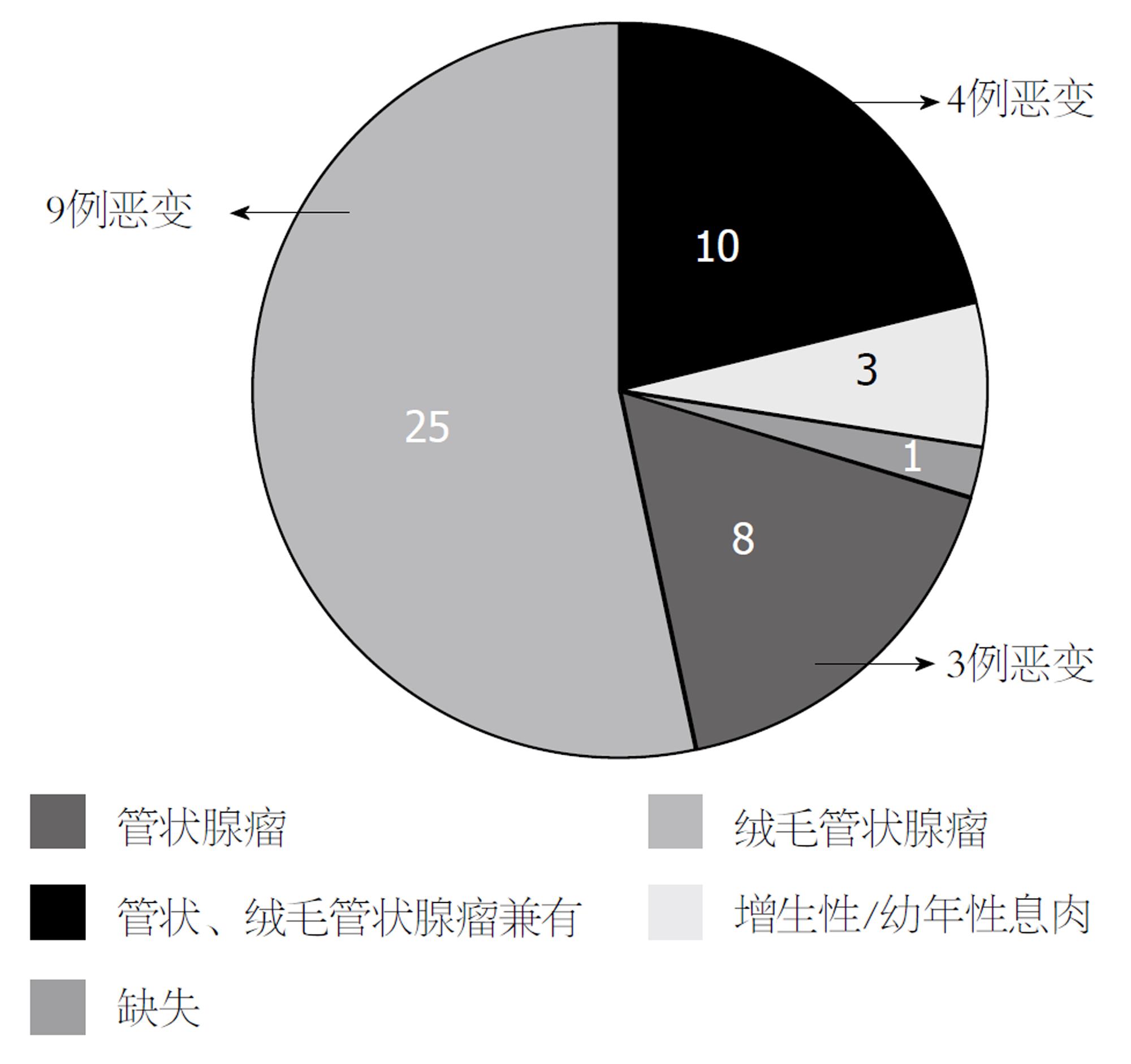
本组FAP患者病理类型以管状腺瘤和绒毛管状腺瘤为主, 未见单纯绒毛状腺瘤, 少数患者为幼年性息肉或增生性息肉, 1例因入院前已于外院治疗病理资料缺乏(图3). 伴发胃息肉的患者中有3例为胃底腺息肉, 5例为增生性息肉, 1例病理资料缺失, 无患者为腺瘤性息肉. 4例十二指肠息肉患者中管状腺瘤、绒毛管状腺瘤各1例, 其余两人未行病理学检查.
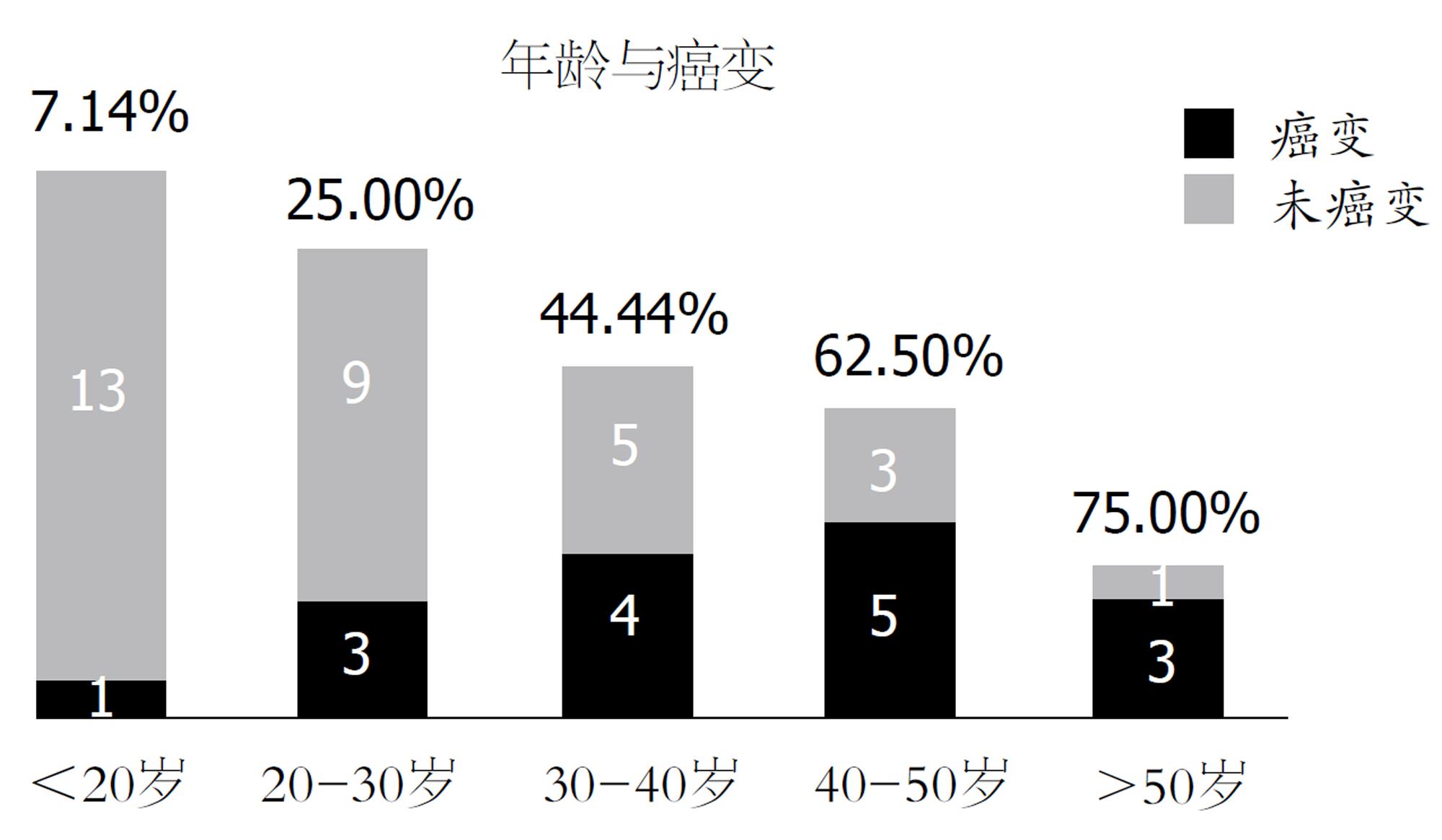
2.3.1 癌变情况: 47例FAP患者中, 有16(34.04%)例经病理组织学检查证实发生了癌变, 其中12例患者在初诊时即已经发生癌变, 其他4例在2-20年随访过程中逐渐发展为结直肠恶性肿瘤, 癌变患者性别比男:女 = 9:7. 最小癌变患者年龄为16岁, 最大者63岁, 平均年龄43.13岁±12.81岁. 随发现年龄及腺瘤直径的增加, 癌变率相应增加(图4和5). 腺瘤数目100枚以下者有2例发生癌变, 其余14例癌变者腺瘤数均多于100枚. 癌变患者中管状腺瘤、绒毛管状腺瘤、两种腺瘤成分兼有者分别为3例、9例、4例. 所有胃、十二指肠息肉均未发生恶变.
2.3.2 癌变危险因素分析: 比较癌变患者与未癌变患者的性别、发现年龄、腺瘤数目、腺瘤直径及病理组织类型, 发现40岁以后发现腺瘤者及腺瘤直径大于2 cm者与40岁以下、腺瘤小于2cm的患者癌变率差异有统计学意义(P<0.05)(表1). Logistic多因素回归分析的结果提示, 年龄(OR = 1.084, 95%CI: 1.016-1.157)及腺瘤大小(OR = 10.264, 95%CI: 1.526-69.035)均为FAP发生癌变的危险因素, 随着腺瘤直径增大, CRC发生风险增加, 且发现年龄每增大一岁, 发生CRC风险概率增加1.084倍(表2).
| B | 标准误差 | 瓦尔德 | 自由度 | P | OR | 95CI | ||
| 下限 | 上限 | |||||||
| 直径 | 2.329 | 0.972 | 5.734 | 1 | 0.017 | 10.264 | 1.526 | 69.035 |
| 发病年龄 | 0.081 | 0.033 | 5.976 | 1 | 0.015 | 1.084 | 1.016 | 1.157 |
| 常量 | -9.502 | 3.236 | 8.620 | 1 | 0.003 | 0.000 | ||
12例初诊时即已发生癌变的患者均行外科手术治疗, 手术方式包括Hartmann、Mile's手术等, 其中2例术后辅以化疗. 这12例患者中3例在随访过程中因肿瘤转移而死亡, 3例患者随访至今仍健在, 未发现肿瘤复发与转移的征象, 其他6位患者因信息变更失访. 4例初诊未发生癌变、而在2-20年内镜随访过程中发现腺瘤恶变的患者在确诊癌变之后改行外科手术治疗, 2例辅以化疗. 31例未发生癌变的患者中17例行内镜下治疗、随访, 其中11例患者因结直肠息肉反复发作改行预防性结直肠切除, 包括全结肠切除+回肠直肠吻合术(ileorectal anastamosis, IRA)、全结直肠切除+回肠储袋肛管吻合术(ileal pouch-anal anastomosis, IPAA)等, 术后定期复查内镜, 10例随访至今未发生恶变, 另1例患者在随访6年后因信息变更失访, 最后复查内镜日期为2015-09, 截止最后复查日期, 该患者未发生癌变. 其余6例患者继续每半年至一年行内镜下治疗, 随访至今, 全部健在, 无1例患者发生癌变, 最长随访时间已达6.5年. 另外14例患者在初诊时即行预防性结直肠切除, 12例随访至今未发生结直肠恶性肿瘤, 2例患者在术后1-2年内失访.
家族性腺瘤性息肉病于1721年首次报道[2], 该病人群患病率为3-10/100000[3], 常呈家族性发病, 但亦有20-25%的患者缺乏家族史, 可能因基因突变所致. 发病机制为5q21-5q22上的腺瘤性息肉病(adenomatous polyposis coli, APC)基因发生胚系突变, 但5%-30%的患者APC基因突变阴性, 这些患者中有相当一部分携带碱基切除修复酶基因(MUTYH)双等位基因的突变.
家族性腺瘤性息肉病以结直肠生长大量息肉为主要特征, 结合典型临床表现、内镜特征及阳性家族史不难作出诊断. 但结直肠息肉并非出生时即有, 多数患者在儿童或者青少年时期起病, 平均发病年龄16岁, 国内报道年龄最小的FAP患者为一名4.5岁的女童[4]. 随着年龄的增长, 息肉逐渐增多、增大, 既而出现便血、腹痛、腹胀、腹部不适感、排便习惯改变等非特异性消化系统症状, 同时可伴发上消化道息肉、硬纤维瘤、先天性视网膜色素上皮细胞肥大、骨瘤以及甲状腺癌、肝母细胞瘤、中枢神经系统恶性肿瘤等多种肠外表现, 其中先天性视网膜色素上皮细胞肥大在FAP患者中的发生率高达70%, 被认为是FAP筛查最具敏感性和特异性的检查[5], 但本组患者均未进行眼底检查, 可能与患者缺乏相应临床症状而重视不足有关. 从腺瘤形成到出现症状之间可长达十年之久[6], 若不及时治疗, 腺瘤形成后经过15-20年的发展[7], 终将发展为恶性肿瘤, 平均癌变年龄40-50岁. 樊人瑜等[8]通过对65例FAP患者的随访, 发现发病年龄越大、息肉数目越多、直径越大及绒毛状腺瘤的患者癌变可能性更大. 本组患者中40岁以上及腺瘤直径大于2 cm者具有更高的癌变风险, Logistic多因素回归分析证实腺瘤直径和发现年龄为FAP发展为CRC的两个潜在危险因素, 与其结果基本一致, 但癌变患者与未癌变患者腺瘤数目及病理组织类型方面未见统计学差异, 一方面可能由于本组患者样本量较少, 另一方面也与患者对该病认识提高及早期干预有关, 腺瘤数目及病理类型在FAP发展为CRC病程中的作用需要更大样本量的临床研究进一步探讨.
上消化道息肉为FAP最常见的肠外表现. 胃息肉主要发生在胃窦和胃小弯侧, 最常见的为基底腺息肉[9], 占50%-60%, 不同于一般人群, 基底腺息肉在FAP患者中存在恶变倾向[10,12]. 腺瘤性胃息肉则为一种癌前病变, 需密切关注. 十二指肠息肉较胃息肉更加常见, 发生率高达50%-90%[7]. 随肠镜检查和预防性结直肠切除术在FAP患者中的普及, 因结直肠恶性肿瘤导致的死亡率随之下降, 十二指肠腺瘤恶变已成为家族性息肉病患者肠切除后主要的死亡原因之一[9,11], 大量研究表明Spigelman Ⅳ期的患者恶变风险达到36%[12]. 笔者认为对病理类型为绒毛状腺瘤、重度不典型增生或者在短期内增大的十二指肠息肉应考虑预防性切除.
硬纤维瘤是FAP患者预防性肠切除后另一主要死亡因素[11,13]. 硬纤维瘤在FAP患者中的发病率达10%-25%[13], 远高于普通人群, 除与阳性家族史相关外, 很多研究表明特定的基因突变位点(如密码子1399[10,12]、1444[7,14]处突变)、手术、雌激素暴露等均可增加发生硬纤维瘤的风险. 尽管硬纤维瘤本身不具有转移能力, 但其在局部呈侵袭性生长, 压迫邻近的组织器官, 可引起肠梗阻、穿孔、肠壁缺血、输尿管梗阻等严重的临床症状, 从而危及生命. 本组患者中有一名年轻女性和一名中年男性分别在术后10 mo和术后3年发现腹壁肿块, 病理证实为硬纤维瘤, 前者因肿瘤转移死亡, 后者健在.
目前, 预防性结直肠切除仍是FAP最有效的治疗方法, 推荐预防性结直肠切除年龄为15-25岁. 本组患者中共25人行预防性结直肠切除术, 22人(88%)随访至今未发生结直肠恶性肿瘤, 但存在排便能力、生育能力下降, 吻合口狭窄, 继发硬纤维瘤形成, 残留直肠黏膜癌变等风险. 故部分患者放弃手术而接受内镜下治疗. 尽管内镜不能取代外科手术, 但定期行结直肠镜检查及早期干预息肉对延缓结直肠切除、降低腺瘤癌变风险仍有着积极作用. 有研究表明, 在有症状FAP患者中, 结直肠癌的发生率为50%-70%, 而在定期内镜监测的患者中癌变率仅为3%-10%[7]. 本组6例单纯经内镜下治疗、随访的患者中, 最长随访时间已达6.5年, 仍未发生恶变. 笔者认为, 40岁以下的年轻患者、尤其是女性患者, 息肉直径小于2 cm及AFAP者可选择内镜下息肉治疗, 并至少每年随访复查一次, 而对年龄大者及息肉过大、过多者一方面内镜下很难彻底切除所有息肉, 另一方面存在较高的恶变风险, 应行预防性结直肠切除术.
Vasen等[7]建议对携带APC基因胚系突变的FAP家族成员, 结直肠镜检查应早至10-12岁, AFAP家族成员可推迟至18-20岁, 每两年一次, 发现息肉后每年一次直至肠切除. 若未发现APC基因突变或未行基因检测的高危人群(FAP患者的一级亲属), 也应至少每两年行一次肠镜检查, 若至40岁仍未发现息肉, 则之后的10年检查间隔可延长至3-5年一次, 50岁以后可按正常人群的方法行结直肠镜检查. 鉴于上消化道息肉在FAP患者中的高发性, 25岁以后即使无上消化道症状, 也应常规检查胃镜.
此外, 非甾体类消炎药(nonsteroidal antiinflammatory drugs, NSAIDs)在FAP中的功效一直备受关注. 刘玉兰等[15]对NSAIDs在FAP患者中的临床疗效进行Meta分析的结果显示, NSAIDs对FAP患者具有正性作用, 可使息肉数目减少、直径缩小, 可作为外科手术和内镜治疗之外的一种辅助治疗方法. 目前研究较多的药物包括非选择性COX抑制剂舒林酸、选择性COX2抑制剂塞来昔布等, 但消化道出血、消化性溃疡、心血管不良事件增加、停药复发等风险使其在FAP患者中的临床应用受到限制. 考虑其不良反应, 本组患者均未使用NSAIDs.
本研究存在很多不足之处. 首先, 样本量较少, 资料的代表性不足. 其次, 本次研究为回顾性研究, 所有数据均来自病历资料, 且部分患者因信息变更失访, 可能存在较大的偏倚. 最后, 本组患者均未进行APC或MUTYH检测, 基因信息不可获取.
总之, 家族性腺瘤性息肉病是一种以结直肠生长大量息肉为主要临床特征的常染色体显性遗传病, 临床主要表现为便血、腹痛、大便性状改变等, 同时可伴有上消化道息肉、硬纤维瘤等肠外表现. 管状腺瘤及绒毛管状腺瘤为其主要病理类型, 绒毛状腺瘤较少. 该病极易恶变, 发现年龄和腺瘤直径为其发展为CRC的危险因素, 发现年龄越晚, 息肉越大, 癌变风险越高. 预防性结直肠切除和定期内镜检查仍然是目前降低结直肠癌发生率的主要措施. 非甾体消炎药虽可以减少腺瘤的数目和直径, 但诸多副作用限制了其临床应用, 需要进一步临床探讨.
家族性腺瘤性息肉病又称腺瘤性结肠息肉病, 是一种少见的常染色体显性遗传病, 主要由腺瘤性息肉病基因突变所致, 基因型-表现型相关性一直为国内外研究热点. 该病具有100%癌变风险, 给患者带来了很大的心理负担, 因而癌变危险因素的分析是今年来家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)研究的另一热点, 现有研究表明年龄、腺瘤数目、直径、病理类型可能为FAP发展为结直肠癌(colorectal cancer, CRC)的危险因素. 治疗上目前仍主要依赖于内镜下息肉治疗和预防性结直肠切除术.
本文旨在学习家族性腺瘤性息肉病的临床特征, 提高临床工作者对该病的认识, 同时探讨可能的危险因素, 为FAP患者的管理及临床决策的选择提供参考.
本文目标为探讨家族性腺瘤性息肉病的肠内、肠外表现及内镜特征、病理组织表现, 提高临床工作者对该病的警惕性, 早期发现可能存在恶变高风险的腺瘤, 做到早期诊断、早期干预、早期治疗.
本文回顾分析了南京医科大学第一附属医院江苏省人民医院近10年来收治的47例家族性腺瘤性息肉病患者的临床资料, 并对所有患者进行随访, 采用卡方检验、秩和检验、Fisher确切概率法、Logistic二元回归分析(Wald向前法)等多种统计学方法进行FAP癌变危险因素的研究.
本文实验目标基本达到, 在47例患者中表现为黑便或便血、大便性状改变、腹痛、腹胀的分别为29例、22例、16例、11例. 本组病例中肠外表现以胃息肉及十二指肠息肉为主, 分别为9例和4例, 另有2例术后继发硬纤维瘤. 病理结果以管状腺瘤及绒毛管状腺瘤为主, 少数表现为增生性息肉或幼年性息肉. 16例患者发生癌变, 发现年龄≥40岁及腺瘤直径>2 cm者与40岁以下及腺瘤小于2 cm的患者癌变差异有统计学意义(P<0.05), 二元回归分析提示年龄(OR = 1.084, 95%CI: 1.016-1.157)及腺瘤大小(OR = 10.264, 95%CI: 1.526-69.035)为影响FAP癌变的危险因素. 所有患者均接受结直肠切除或内镜下治疗, 4例癌变患者术后辅以化疗. 考虑非甾体消炎药心血管不良事件、消化道出血等副反应, 本组患者未使用非甾体消炎药.
本文通过多因素分析, 明确了发现年龄和腺瘤直径大小为影响家族性腺瘤性息肉病的癌变危险因素, 且随发现年龄每增加一岁, FAP发展为CRC的风险增加1.084倍, 因而在家族性腺瘤性息肉病患者的诊治中我们应早期诊断, 早期干预, 对其家族中其它高风险人员(FAP患者的一级亲属), 也应尽早进行筛查, 发现腺瘤后及时行内镜或外科手术治疗, 减缓疾病发展的进程.
由于家族性腺瘤性息肉病为罕见病, 本文纳入的病例数较少, 且为回顾性研究, 可能存在较大的偏倚, 需要更大样本量的数据来证实. 未来, 我们需要更多前瞻性临床数据来评价这些潜在的危险因素在FAP患者癌变风险评估、临床决策选择等方面的意义. 随着基因检测技术的成熟, 或许我们可以进一步探索具备这些危险因素的患者在基因突变位点上有无共性, 进而通过基因技术实现FAP患者的二级预防. 此外, 非甾体类消炎药在FAP患者中的价值值得我们去思考、探索.
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D, D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Cyrany J. Familial Adenomatous Polyposis Registry in Czech Republic - History, Present and Future. Acta Medica (Hradec Kralove). 2017;60:55-57. [PubMed] [DOI] |
| 3. | Half E, Bercovich D, Rozen P. Familial adenomatous polyposis. Orphanet J Rare Dis. 2009;4:22. [PubMed] [DOI] |
| 6. | Mallinson EK, Newton KF, Bowen J, Lalloo F, Clancy T, Hill J, Evans DG. The impact of screening and genetic registration on mortality and colorectal cancer incidence in familial adenomatous polyposis. Gut. 2010;59:1378-1382. [PubMed] [DOI] |
| 7. | Vasen HF, Möslein G, Alonso A, Aretz S, Bernstein I, Bertario L, Blanco I, Bülow S, Burn J, Capella G. Guidelines for the clinical management of familial adenomatous polyposis (FAP). Gut. 2008;57:704-713. [PubMed] [DOI] |
| 9. | Yamaguchi T, Ishida H, Ueno H, Kobayashi H, Hinoi T, Inoue Y, Ishida F, Kanemitsu Y, Konishi T, Tomita N. Upper gastrointestinal tumours in Japanese familial adenomatous polyposis patients. Jpn J Clin Oncol. 2016;46:310-315. [PubMed] [DOI] |
| 10. | Garrean S, Hering J, Saied A, Jani J, Espat NJ. Gastric adenocarcinoma arising from fundic gland polyps in a patient with familial adenomatous polyposis syndrome. Am Surg. 2008;74:79-83. [PubMed] |
| 11. | Speake D, Evans DG, Lalloo F, Scott NA, Hill J. Desmoid tumours in patients with familial adenomatous polyposis and desmoid region adenomatous polyposis coli mutations. Br J Surg. 2007;94:1009-1013. [PubMed] [DOI] |
| 12. | Cordero-Fernández C, Garzón-Benavides M, Pizarro-Moreno A, García-Lozano R, Márquez-Galán JL, López Ruiz T, Sobrino S, Bozada JM, Laguna OB. Gastroduodenal involvement in patients with familial adenomatous polyposis. Prospective study of the nature and evolution of polyps: evaluation of the treatment and surveillance methods applied. Eur J Gastroenterol Hepatol. 2009;21:1161-1167. [PubMed] [DOI] |
| 13. | Septer S, Lawson CE, Anant S, Attard T. Familial adenomatous polyposis in pediatrics: natural history, emerging surveillance and management protocols, chemopreventive strategies, and areas of ongoing debate. Fam Cancer. 2016;15:477-485. [PubMed] [DOI] |
| 14. | Lefevre JH, Parc Y, Kernéis S, Goasguen N, Benis M, Parc R, Tiret E. Risk factors for development of desmoid tumours in familial adenomatous polyposis. Br J Surg. 2008;95:1136-1139. [PubMed] [DOI] |
| 15. | 刘 玉兰, 董 卫国, 王 军, 李 櫆, 潘 俊. 非甾体类抗炎药治疗家族性腺瘤性息肉病临床疗效的系统评价. 胃肠病学和肝病学杂志. 2015;24:645-650. [DOI] |