修回日期: 2018-05-23
接受日期: 2018-06-09
在线出版日期: 2018-07-18
研究胆汁酸受体FXR、TGR5在梗阻性黄疸(obstru ction-jaundice, OJ)肾脏中的表达变化.
通过结扎胆总管建立OJ模型, 12只SD大鼠随机分成两组, 胆总管结扎组(bile duct ligation, BDL)6只, 和对照组(control group, CON)6只. 建立模型两周后检测两组血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、总胆汁酸(total bile acid, TBA)、总胆红素(total bilirubin, TBIL)以及直接胆红素(direct bilirubin, DBIL)的浓度变化; 检测两组血清尿素氮(serum urea nitrogen, BUN), 肌酐(creatinine, Cr), 尿酸(uric acid, UA)的浓度变化, 并收集两组大鼠尿液进行尿干化学分析. Western blot方法定量检测大鼠肾组织中FXR和TGR5蛋白表达水平, qRT-PCR检测FXR和TGR5的mRNA表达水平, HE染色检测SD大鼠肾脏病理改变.
同CON组比较, BDL组大鼠肾脏FXR和TGR5蛋白表达量和mRNA表达量均降低,差异有统计学意义(P﹤0.05). HE染色显示, BDL组大鼠肾脏组织中, 肾小球密度减少; 肾小管局部上皮细胞脱落、消失; 小管腔隙扩张, 内含大量粉染无结构物质.
梗阻性黄疸时, 会引起大鼠肾脏的损害; 胆汁酸受体FXR和TGR5在肾脏的蛋白和mRNA表达量均显著降低, 可能同肾脏损伤有关.
核心提要: 梗阻性黄疸引起的肾脏损伤早已经被证实, 其机制复杂, 研究者众多, 但是胆汁酸受体FXR、TGR5在梗阻性黄疸时肾脏中的表达以及对肾脏损伤的意义鲜有报道, 笔者则通过FXR、TGR5在肾脏的表达变化探讨与肾损伤的关系.
引文著录: 张洋, 张桂信, 汪凯, 谭用, 詹晨. FXR和TGR5在梗阻性黄疸大鼠肾脏中的表达变化. 世界华人消化杂志 2018; 26(20): 1234-1240
Revised: May 23, 2018
Accepted: June 9, 2018
Published online: July 18, 2018
To investigate the changes in the expression of bile acid receptors FXR and TGR5 in obstructive jaundice (OJ) induced renal injury.
Twelve male Sprague-Dawley rats were randomly divided into two groups to undergo either sham operation (CON) or bile duct ligation (BDL). The animals were operated by surgical ligation of the common bile duct to establish an OJ model. Two weeks post operation, serum samples were collected to assess renal associated biochemical markers including alanine aminotransferase (ALT), aspartate aminotransferase (AST), total bile acid (TBA), total bilirubin (TBIL), direct bilirubin (DBIL), serum urea nitrogen (BUN), creatinine (Cr), and uric acid (UA). In addition, the urine of the rats was collected for urine chemistry analysis. Transcription and translation of FXR and TGR5 genes were detected by qRT-PCR and Western blot, respectively. Tissue sections of the kidneys were stained with hematoxylin and eosin (HE) and examined for microscopically pathological changes.
Compared with the CON group, the protein and mRNA expression of FXR and TGR5 was significantly decreased in the kidneys of the BDL rats. HE staining revealed that the kidneys of the BDL rats had decreased glomerular density and the local epithelial cells of the tubules shed. Also, the small tube lacuna was expanded, accompanied with the presence of a large number of unstructured substances.
This in vivo study demonstrated significant down-regulation of the bile acid receptors FXR and TGR5 in the kidneys of OJ rats, suggesting their role in kidney damage.
- Citation: Zhang Y, Zhang GX, Wang K, Tan Y, Zhan C. Obstructive jaundice induced kidney damage is mediated by down-regulation of bile acid receptors FXR and TGR5. Shijie Huaren Xiaohua Zazhi 2018; 26(20): 1234-1240
- URL: https://www.wjgnet.com/1009-3079/full/v26/i20/1234.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i20.1234
梗阻性黄疸(obstruction-jaundice, OJ)是一种由于胆管堵塞引起的胆汁流受阻而导致血清胆红素水平升高的疾病, 临床主要表现为巩膜和皮肤黄染, 尿色变深黄, 重度黄疸出现白陶土便和身体瘙痒. 患者会出现各种病理生理变化从而影响肝, 肾, 心脏和免疫系统功能. OJ发病的常见原因包括胆总管结石和壶腹周围恶性肿瘤等, 常可导致肝功肾功不全甚至衰竭, 凝血机制异常, 心脏功能障碍, 以及身体免疫功能异常等[1].
法尼酯衍生物X受体(farnesoid X receptor, FXR)是1995年发现的胆汁酸核受体, 在胆汁酸的代谢过程中起着重要作用[2,3]. FXR主要在肝脏和小肠中表达, 负责调节脂肪酸、胆固醇、胆汁酸和葡萄糖在体内平衡. 最近研究表明, FXR也在肾脏中高度表达[4].
G蛋白偶联受体5(takeda G protein-coupled receptor 5, TGR5)是2003年发现的胆汁酸膜受体, TGR5也称为M-BAR, GPBAR或GPR131, 在多种细胞和器官中有不同程度的表达, 其中包括肝, 肾, 肠, 脾和棕色(褐色)脂肪组织等, 且TGR5在多种疾病中对肝脏起保护作用[5-7]. 梗阻性黄疸时, 肾脏胆汁酸受体FXR和TGR5表达情况及同肾脏功能损伤之间的关系鲜有报道.
SPF级SD雄性大鼠12只, 体重200 g±20 g, 购于大连医科大学重大疾病基因工程模式动物研究所, 于大连医科大学附属第一医院二部中心实验室饲养、造模和观察.
β-actin、FXR、TGR5抗体均购自北京博奥森生物技术有限公司, 二抗辣根酶标记山羊抗兔IgG(H+L)购自北京中山金桥生物技术有限公司; RT-PCR试剂盒购自大连宝生物公司, 引物为通用生物系统公司合成, β-actin上游引物序列5'-CCCATCTATGAGGGTTACGC-3',下游引物序列5'-TTTAATGTCACGCACGATTTC-3'; FXR上游引物序列5'-CAGCAGACCCTCCTGGATTA-3', 下游引物序列5'-ACGTGACTGGTAGCCATTTC-3'. TGR5上游引物序5'-CCTGGACCGCCACTTACG-3',下游引物序列5'-CCCTGTGAGTAGCCCAGCTAGT-3'; 免疫组化DAB显色试剂盒购自北京索莱宝科技有限公司, ECL发光液(Advansta, 美国).
1.2.1 动物分组: 将12只SD大鼠随机分为对照组(control group, CON)和胆总管结扎组(bile duct ligation, BDL), 每组各6只. 正常饲养, 光线充足, 空气流通, 饲料和水充足, 在实验开始之前, 将大鼠在实验室饲养7 d以适应条件.
1.2.2 模型制备: 术前禁食12 h, 自由饮水, 10%水合氯醛0.33 mL/100 g腹腔注射麻醉. CON组大鼠剖腹游离胆总管后行腹部缝合, BDL组大鼠剖腹游离胆总管后行胆总管结扎术, 近肝门部双线结扎, 远端单线结扎, 腹部缝合, 术后两组分笼饲养. 于代谢笼收取两组大鼠术后第14 d的尿液; 取术后14 d两组大鼠动脉血液和肾脏组织. 将获得的肾脏组织1/2用4%的多聚甲醛固定, 进行石蜡包埋及切片用于HE染色; 余下1/2肾脏组织冻入-80 ℃冰箱, 用于Western blot和qRT-PCR蛋白及基因测定. 提取大鼠腹主动脉血液静置1 h后, 3000 r/min离心15 min取血清, 进行各项血清指标检测.
1.2.3 肾脏组织HE染色: 将两组肾脏组织石蜡切片脱蜡、水化, PBS洗涤后放入苏木素染色3 min, 流动自来水冲洗, 放入盐酸乙醇1-2 s, 自来水冲洗, 放入伊红1 min, 冲洗后梯度脱水, 封片.
1.2.4 血清标本的检测: 抽取两组大鼠腹腔动脉血, 3000 rp/min离心15 mim, 提取血清, 全自动生化分析仪检测血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、总胆汁酸(total bile acid, TBA)、总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)、尿素氮(serum urea nitrogen, BUN), 肌酐(creatinine, Cr), 尿酸(uric acid, UA)指标.
1.2.5 尿液标本的检测: 两组大鼠术后14 d于代谢笼收取尿液进行尿干化学分析: 尿蛋白(urine protein, PRO)、尿胆红素(urine bilirubin, BIL)、尿胆原(urine urobilinogen, URO)、白细胞、尿液颜色.
1.2.6 Western blot蛋白质免疫印迹法: 取100 mg大鼠肾脏组织, 剪成3 mm×3 mm左右小块, 用RIPA裂解液(强)在低温情况下进行裂解, 将组织匀浆离心, 取上清, 煮沸5 min. 配制10% SDS-PAGE胶上样, 琼脂糖凝胶电泳对蛋白进行分离, 半干转膜器将蛋白转移到PVDF膜上, 5%脱脂奶粉37 ℃摇床封闭1 h, 一抗(FXR 1: 200; TGR5 1: 200; β-actin 1: 5000)4 ℃孵育过夜. PBST洗膜10 min×3次, 辣根酶标记山羊抗兔IgG(H+L)37 ℃摇床孵育1 h, PBST洗膜10 min×3次, 覆盖ECL发光液使用凝胶成像系统FluorChem3进行曝光, 曝光后用ImageJ软件分析其灰度值, 并计算各组与β-actin的比值.
1.2.7 qRT-PCR相对定量反转录聚合酶连锁反应: RnaEx tm(上海捷瑞生物工程有限公司)提取各组肾脏组织 Total RNA,使用紫外分光光度法测Total RNA的浓度和纯度. 使用5×PrimeScript RT Master Mix(大连宝生物工程有限公司)并按其说明书配制20 μL体系的反应液, 反转录37 ℃ 15 min, 85 ℃5 s, 4 ℃保存; 使用SYBR Premix Ex Taqtm Ⅱ配制20 μL反应体系: SYBR Premix Ex TaqtmⅡ10 μL, 上游引物0.8 μL, 下游引物0.8 μL, Rox0.4 μL, DEPC水6 μL, c DNA 2 μL. 使用StepOne Plus测出其CT值及RQ值.
统计学处理 采用SPSS Statistics V 21.0统计学软件对结果进行统计学分析, 计量资料用mean±SD表示, 两组之间的比较用独立样本t检验. 以P<0.05视为结果有统计学意义, 以P<0.01视为有显著差异.
BDL组大鼠术后出现尿液变黄, 尿量减少, 粪便颜色变浅, 皮肤及巩膜黄染, 毛发无光泽, 精神萎靡, 饮食减少, 随梗阻时间延长而加重. 取组织时见肝脏组织明显增大, 颜色变淡黄或暗黄; 胆管明显扩张; 肾脏及肠组织外观变化不明显.
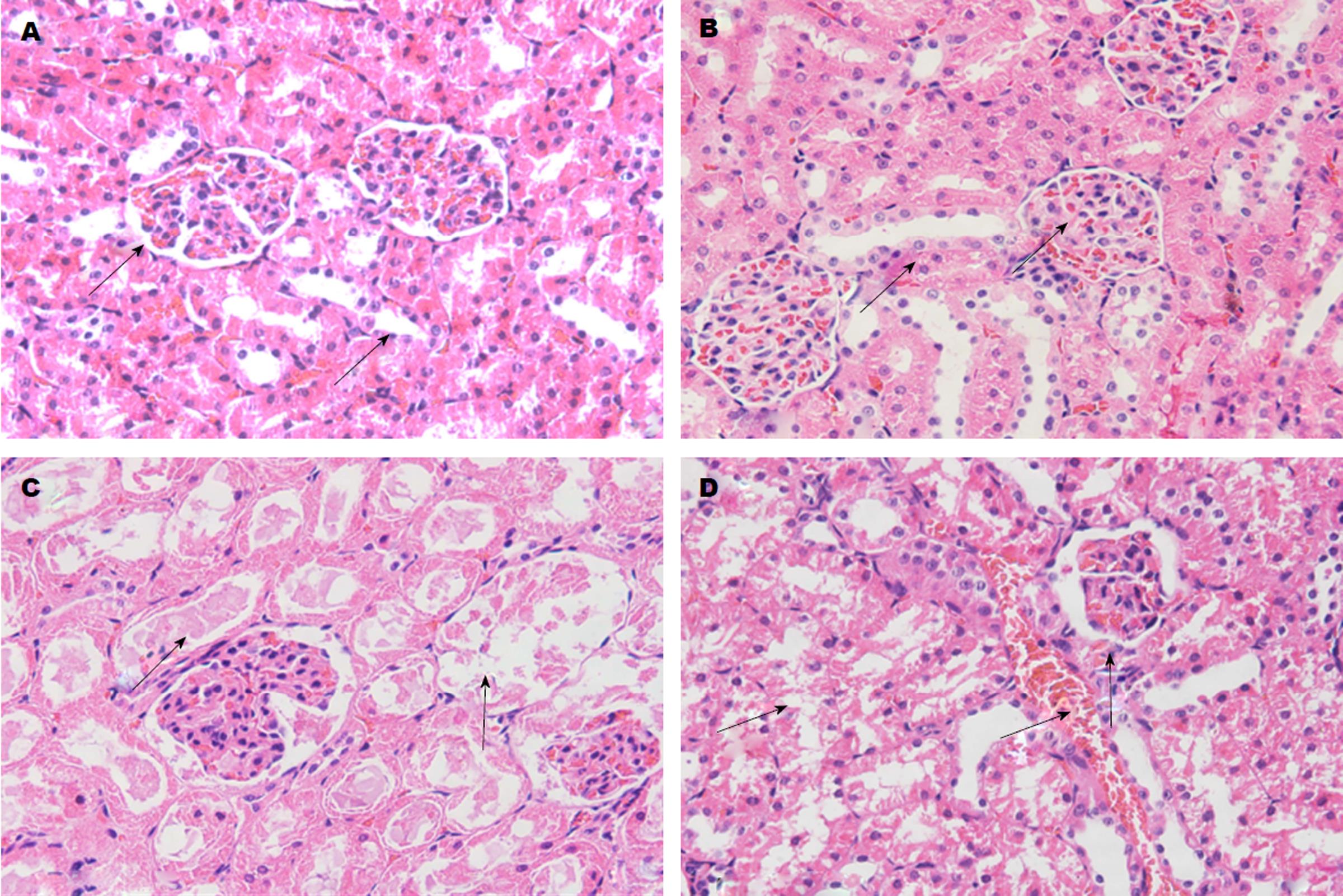
组织切片HE染色×400显示(图1)CON大鼠肾脏肾小球形态饱满, 肾小管上皮细胞无水肿脱落, 小管腔隙无扩张; 大鼠胆总管结扎14 d后, BDL大鼠的肾脏中肾小球周围血管扩张充血, 局部肾小球轻微萎缩呈现分叶状; 肾小管局部上皮细胞水肿成颗粒状, 部分上皮细胞脱落、消失(图1D); 小管上皮细胞大量脱落消失, 小管腔隙扩张, 内含大量粉染无结构物质(图1C).
与CON组相比, BDL组血清检测值AST(P<0.05)、ALT(P<0.01)、TBIL(P<0.01)、DBIL(P<0.01)、TBA(P<0.01)均有显著升高, 且差异有统计学意义(表1).
| 分组 | ALT (U/L) | AST (U/L) | TBIL (μmol/L) | DBIL (μmol/L) | TBA (μmol/L) |
| CON | 43.20 ± 14.60 | 158.00 ± 36.67 | < 1 | < 0.8 | 32.96 ± 9.60 |
| BDL | 299.80 ± 105.08b | 1439.4 ± 662.10a | 101.28 ± 11.34b | 91.64 ± 11.03b | 175.78 ± 25.43b |
与CON组相比, BDL组血清检测值BUN有所升高, 但结果没有统计学差异(P>0.05); Cre、UA均显著升高且有统计学意义(P<0.01).
CON组胆红素、尿胆原、蛋白质均为阴性, 白细胞个数为零, 尿液颜色为淡黄色. BDL组胆红素+4±1、尿胆原+1、蛋白质+1, 白细胞50±25, 尿液颜色为深褐色、深黄色. 两组尿液干化学法分析结果差异显著.
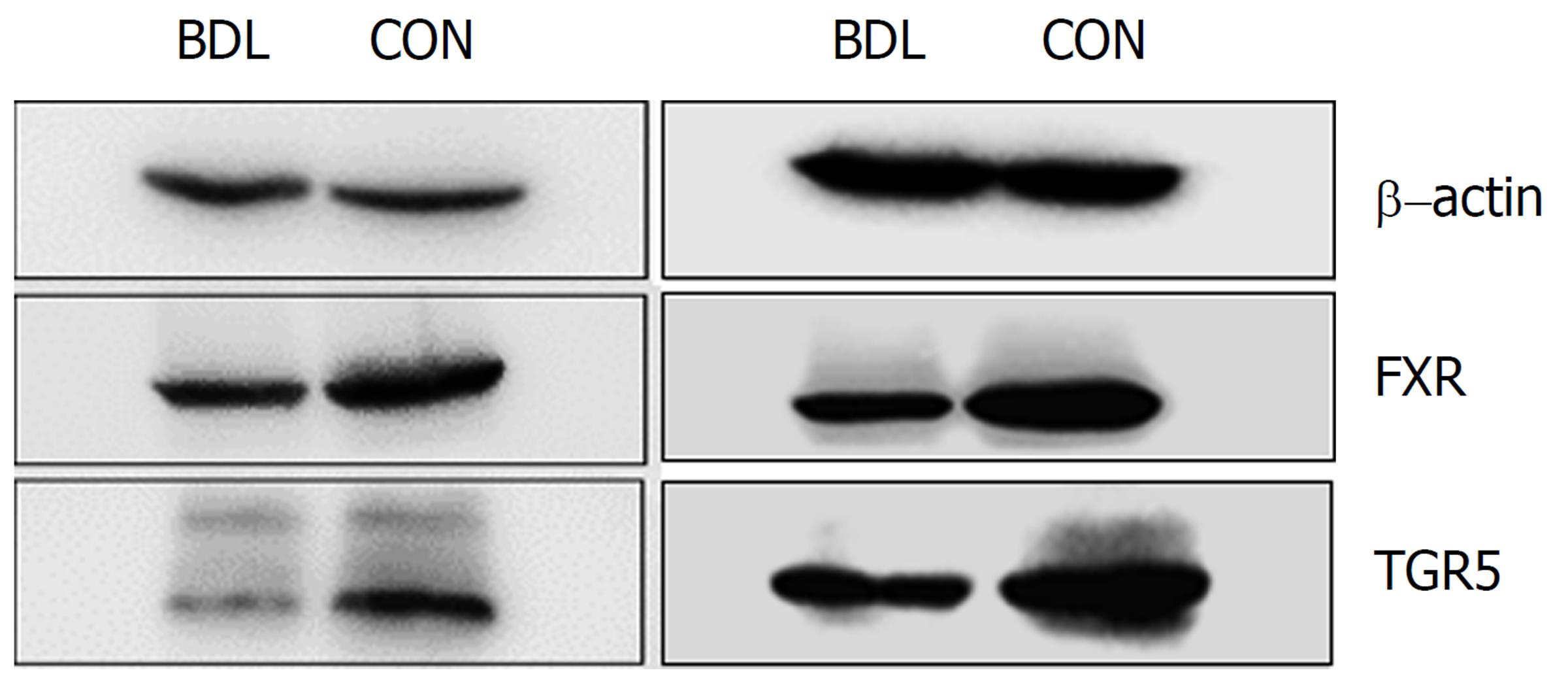
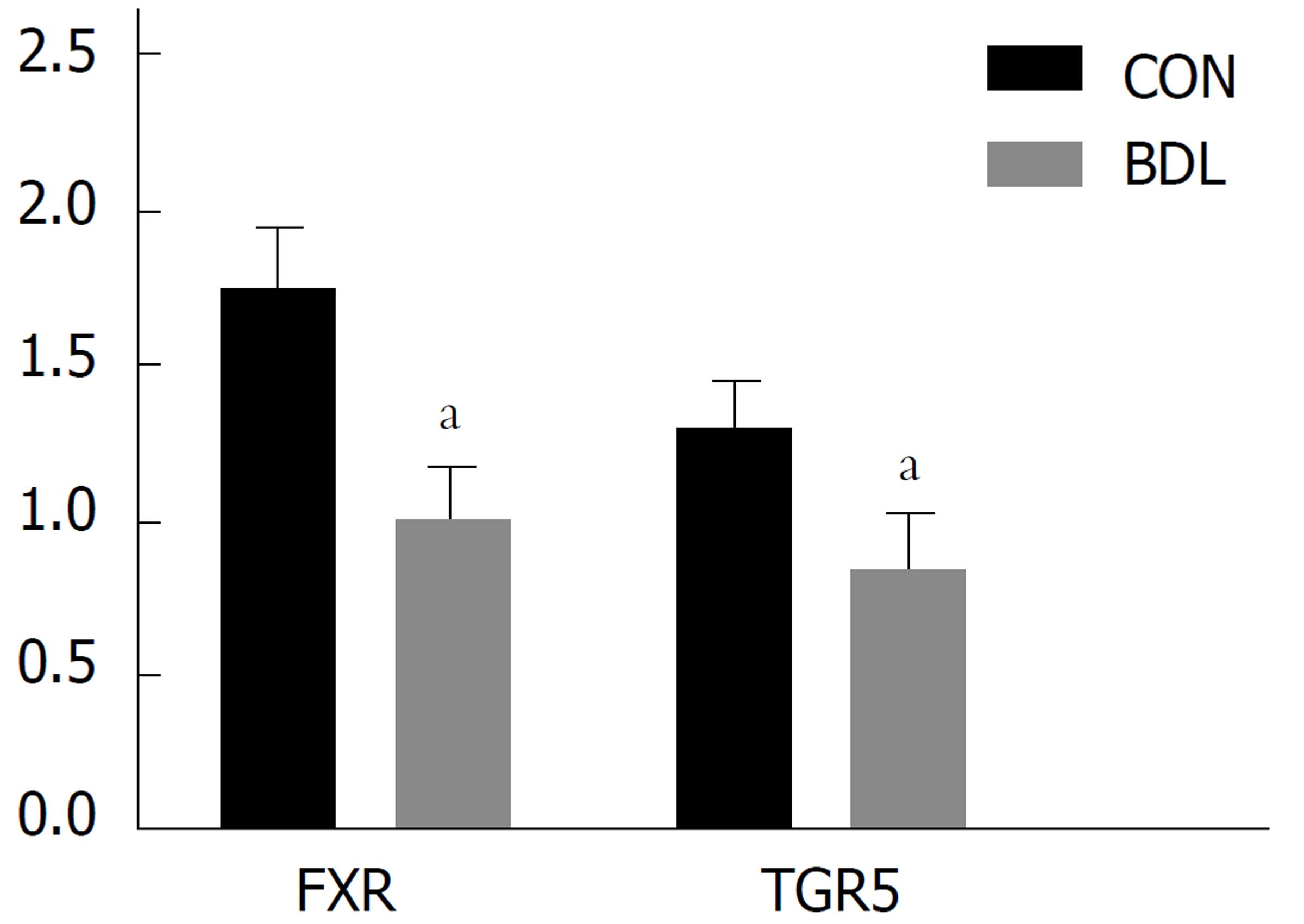
取五次重复实验的结果, 目的蛋白的相对表达量为目的蛋白灰度值比内参蛋白灰度值. BDL组大鼠FXR、TGR5在肾脏中的表达量均少于CON组, 差异均具有统计学意义(图2-3, P<0.05).
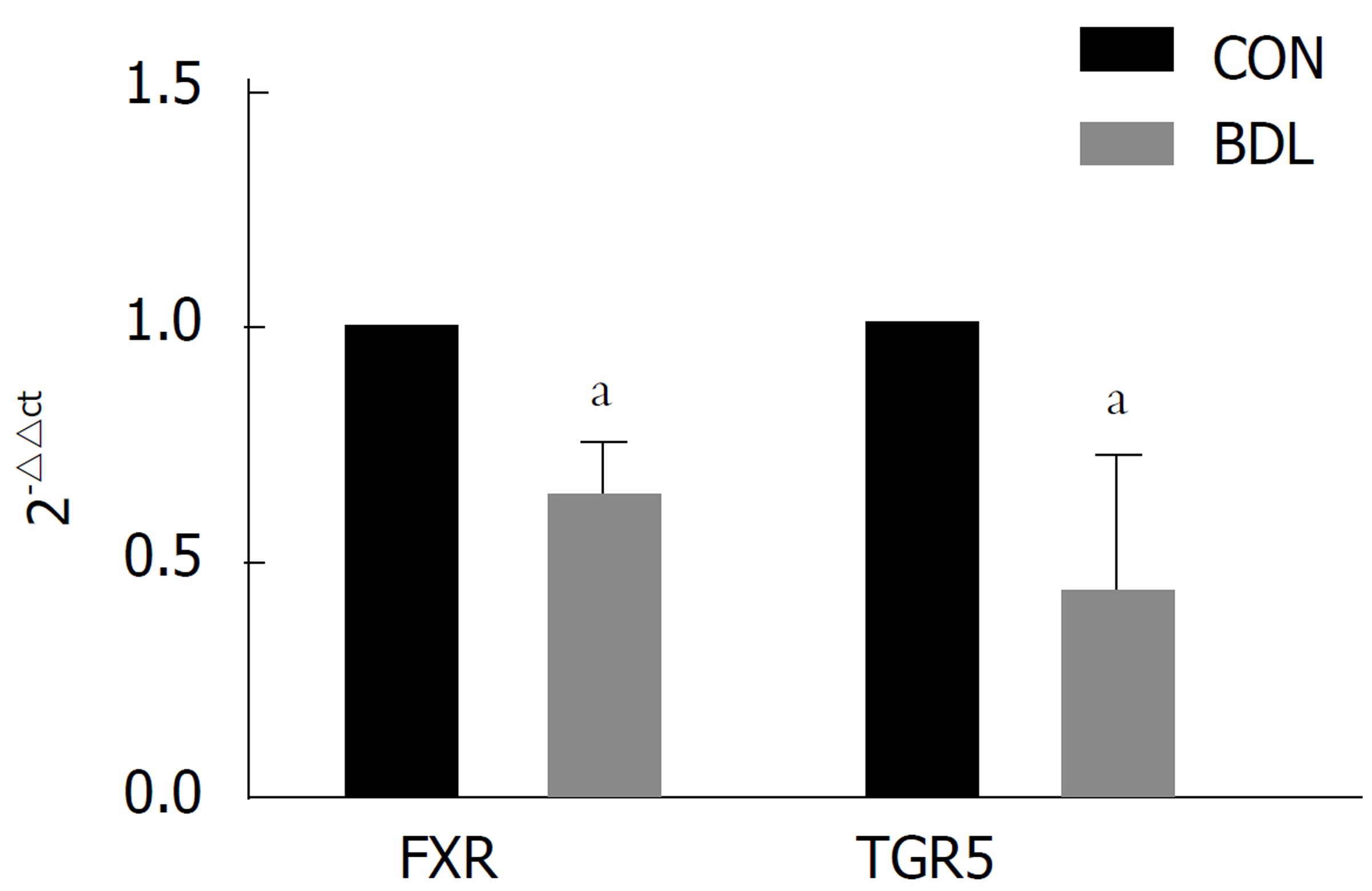
每个基因做三个副孔, 实验重复三次, 模型组FXR、TGR5mRNA表达水平均比对照组的降低, 且差异有统计学意义(图4, P<0.05).
胆汁酸是胆固醇的最终代谢物. 胆汁酸可以帮助消化, 调节胆固醇, 脂质和葡萄糖代谢, 并可作为信号分子, 调节炎症反应等.
研究发现[8]内源性胆汁酸结合并激活FXR, 其在调节胆汁酸代谢中具有关键的作用. FXR除了在肝、肠、肾上腺中高度表达外, 在肾脏中也有很高的表达. 疏水性胆汁酸鹅脱氧胆酸及其结合形式是FXR最有效的内源性激动剂, FXR的激活在维持肠肝系统中的葡萄糖、脂质和胆汁酸稳态中都起到了重要作用.
TGR5是一种新型胆汁酸膜受体, 由330个氨基酸组成的膜型G蛋白偶联受体, 在胆汁酸的调节中起关键作用. 它在各种人体器官中广泛表达, 脾脏和胎盘中最高, 其次是肾、肺、肝、胃、小肠、脂肪组织和骨髓. TGR5也在其他组织如乳腺、子宫组织和骨骼肌也有表达[9,10]. TGR5不仅调节代谢性疾病、能量稳态, 也参与炎症相关疾病, 包括肿瘤发生和生长的调控. 关于TGR5在肾脏相关疾病中所起作用的报道还很少见[11], 但最近研究表明, TGR5能够通过诱导线粒体增殖和抵抗氧化应激和脂质积累来抑制肾脏疾病[10].
OJ病因包括胆道系统结石、肿瘤或壶腹部炎症和肿瘤等引起的胆汁流出受阻. 梗阻性黄疸时体内网状内皮系统功能障碍, 除了直接引起肝脏功能损伤, 还引起心血管系统、肾脏系统和呼吸系统功能损伤甚至衰竭, 严重者危及生命. 急性肾功能衰竭是OJ常见的相关并发症. 自1910年以来OJ与肾功能衰竭之间的关联就已经得到认可, 当时Clairmont报道了5例OJ患者术后因发生急性肾功能衰竭而死亡[12]. OJ时大量胆汁淤积, 胆汁酸排泄受阻, 肾脏排泄成为胆汁酸消除的主要途径[13], 因此OJ除了与肝脏紧密相关外也与肾脏密切相关. 此外有研究发现TGR5是肾癌细胞增殖和迁移的抑制因子[11].
由OJ所引起的肾损伤的病理机制很复杂, 大致可分为以下几种: 内毒素、氧化应激的损伤作用, Bcl-2、Bax介导的细胞凋亡作用, 肿瘤坏死因子α、NO等细胞因子的作用, 血清白蛋白的下降阻碍了肾脏的自身修复作用; 除此之外, 还可能与细胞自噬作用相对不足以致细胞凋亡增加及氧化应激水平的升高等因素有关[14]. 有文章显示TGR5高表达于肝窦内皮细胞表面, 其通过环磷酸腺苷途径抑制黏附分子、核转录因子-κB的表达保护内皮细胞受到氧化应激的损伤[15]. 到目前为止, 国内外尚没有关于OJ时肾脏胆汁酸受体表达同肾脏损伤相关性的报道. 本研究则是通过检测胆汁酸核受体FXR以及胆汁酸膜受体TGR5在OJ大鼠模型肾脏组织中表达的变化, 探讨FXR、TGR5与梗阻性黄疸大鼠肾脏损伤的相关性.
Wang等[16]人研究证明了FXR和TGR5在肾脏中活化的有益作用, 推测FXR和TGR5可能会是很有效的治疗靶点. FXR和TGR5激动剂可能在预防和/或逆转年龄相关的肾功能衰退中发挥重要作用. 有研究结果表明靶向TGR5具有治疗肾脏炎症甚至肾癌的治疗潜力. 活化的TGR5抑制NF-κB和STAT3信号通路, 揭示TGR5配体在肾脏中具有抗炎和抗癌作用[11]. FXR在肝及其以外的组织激活, 如肝脏, 肾脏和脂肪组织, 在代谢疾病中发挥作用[17].
笔者研究显示: 胆总管结扎14 d后, 梗阻性黄疸大鼠模型会导致肝脏、肾脏损伤, 胆红素会从肾脏排出. FXR和TGR5在梗阻性黄疸大鼠模型肾脏中的蛋白及基因水平表达量均减少(图1-2), 与CON组相比, BDL组大鼠肾脏HE染色显示肾脏出现损伤, 肝功生化(表1)、肾功生化(表2)也显示肝肾脏器受到损伤, 但与CON组相比, BDL组血清检测值BUN有所升高, 但结果没有统计学差异(P>0.05); Cre、UA均显著升高且有统计学意义(P<0.01). 肾脏的损伤可能是与FXR和TGR5的表达减少有关. 一项研究[18]表明FXR在糖尿病肾病中发挥重要作用, 糖尿病病人肾脏中的FXR表达降低. 糖尿病小鼠模型FXR敲除后加速其肾脏损伤. 相反, 使用FXR激动剂INT-747的小鼠能够通过减少蛋白尿, 肾小管间质纤维化和肾小球硬化并且调节肾脏脂质代谢从而改善肾脏损伤. 另外, FXR的激活可以通过抗纤维化, 抗炎和抗细胞凋亡作用预防肾脏损伤. FXR和TGR5激动剂在预防肾脏疾病, 动脉粥样硬化和血管钙化的进展中发挥重要作用. 该研究还发现除了激活FXR能减轻肾损伤之外, 通过INT-777激活TGR5也有减少肾脏中的蛋白尿, 足细胞损伤, 肾小球膜扩张, 纤维化和CD68巨噬细胞浸润的作用, 从而减轻肾损伤. 本文的研究与上述结果相吻合. 另一项研究[7]显示,分别通过qRT-PCR和Western blot在经过高糖处理24 h后的大鼠肾小球系膜细胞中检测TGR5的mRNA水平和TGR5的蛋白表达, 其表达量均降低. 免疫染色显示TGR5在2型糖尿病肾病模型小鼠中的蛋白及mRNA表达显著低于C57小鼠. 该研究还显示 TGR5可以抑制NF-κB信号, 影响TGF-β1表达, 抑制糖尿病肾病的发展. 因此, 可以看出TGR5对糖尿病肾病具有保护作用, 且在糖尿病肾病时其蛋白表达量降低, 笔者研究与其有相似之处.
| 分组 | BUN (μmol/L) | Cre (μmol/L) | UA (μmol/L) |
| CON | 7.54 ± 0.63 | 38.40 ± 2.88 | 100.80 ± 25.01 |
| BDL | 9.26 ± 2.32 | 61.60 ± 14.55b | 174.00 ± 28.32b |
总之, OJ时会出现肾脏组织病理学及功能损伤伴随胆汁酸核受体FXR及膜受体TGR5蛋白及基因水平表达量的降低. FXR、TGR5表达的变化可能同肾脏损伤相关, 但OJ引起肾脏损伤机制复杂, 目前未有明确文章支持FXR、TGR5对OJ肾损伤的保护作用及其作用机制, 因此在未来的实验中我们将对其具体的分子机制进行更深入的研究.
梗阻性黄疸(obstruction jaudance, OJ)是一种由于胆管堵塞引起的胆汁流受阻而导致血清胆红素水平升高的疾病, 该疾病会影响身体的多种器官损伤. 胆汁酸受体TGR5、FXR在胆汁酸代谢过程中起到了重要作用. 通过胆汁酸受体TGR5、FXR表达的变化探讨治疗梗阻性黄疸的新思路.
胆汁酸受体FXR、TGR5在梗阻性黄疸大鼠肾脏的表达变化与肾损伤的关系, 可通过进一步机制研究提供治疗梗阻性黄疸肾损伤的新思路.
观察探讨胆汁酸受体FXR、TGR5在梗阻性黄疸大鼠肾脏的表达变化与肾损伤的关系,未来可对进一步研究梗阻性黄疸肾损伤与胆汁酸受体之间的相关性提供依据, 为治疗梗阻性黄疸造成的脏器损伤提供新的方向.
通过Western blot蛋白质免疫印迹法、qRT-PCR相对定量反转录聚合酶连锁反应检测胆汁酸受体FXR、TGR5蛋白及mRNA水平, HE染色观察肾脏病理变化, 血清及尿液分析证明大鼠梗阻性黄疸模型成功; 数据采用SPSS statistics V 21.0统计学软件对结果进行统计学分析.
BDL组大鼠FXR、TGR5在肾脏中的蛋白表达水平均少于CON组, 差异均具有统计学意义(P<0.05); BDL组FXR、TGR5基因表达水平均比对照组的降低, 且差异有统计学意义(P<0.05). 本研究为胆汁酸受体在梗阻性黄疸肾损伤中的作用做了初步研究, 为以后进一步的作用机制以及临床治疗提供了新的思路方向.
本文发现与CON组相比BDL组FXR、TGR5蛋白及基因表达水平均下降, FXR和TGR5的表达减少可能与梗阻性黄疸引起肾脏损伤有关, 因此提高FXR和TGR5在肾脏的表达可能会减轻肾损伤, 可以作为新的研究方向, 更深入探讨其机制, 以期为临床治疗梗阻性黄疸及其并发症提供新的思路.
本研究实验方法有进一步完善的空间, 在今后的实验当中增加实验大鼠样本量, 减少误差, 提高数据准确性. 未来研究将从梗阻性黄疸肾损伤的机制入手, 探讨加入药物干预之后, 多组之间FXR、TGR5在肾脏的表达变化及比较情况, 实验方法上除了Western blot蛋白质免疫印迹法、qRT-PCR相对定量反转录聚合酶连锁反应等方法外, 也会加入免疫组织化学检测蛋白表达情况.
学科分类: 胃肠病学和肝病学
手稿来源地: 辽宁省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): E
编辑: 崔丽君 电编:张砚梁
| 1. | Fang Y, Gurusamy KS, Wang Q, Davidson BR, Lin H, Xie X, Wang C. Pre-operative biliary drainage for obstructive jaundice. Cochrane Database Syst Rev. 2012;CD005444. [PubMed] [DOI] |
| 2. | Lieu T, Jayaweera G, Bunnett NW. GPBA: a GPCR for bile acids and an emerging therapeutic target for disorders of digestion and sensation. Br J Pharmacol. 2014;171:1156-1166. [PubMed] [DOI] |
| 3. | Zhang Y, Kast-Woelbern HR, Edwards PA. Natural structural variants of the nuclear receptor farnesoid X receptor affect transcriptional activation. J Biol Chem. 2003;278:104-110. [PubMed] [DOI] |
| 4. | Zhang XY, Wang B, Guan YF. Nuclear Receptor Regulation of Aquaporin-2 in the Kidney. Int J Mol Sci. 2016;17:E1105. [PubMed] [DOI] |
| 5. | Jonker JW, Liddle C, Downes M. FXR and PXR: potential therapeutic targets in cholestasis. J Steroid Biochem Mol Biol. 2012;130:147-158. [PubMed] [DOI] |
| 6. | Kawamata Y, Fujii R, Hosoya M, Harada M, Yoshida H, Miwa M, Fukusumi S, Habata Y, Itoh T, Shintani Y. A G protein-coupled receptor responsive to bile acids. J Biol Chem. 2003;278:9435-9440. [PubMed] [DOI] |
| 7. | Xiong F, Li X, Yang Z, Wang Y, Gong W, Huang J, Chen C, Liu P, Huang H. TGR5 suppresses high glucose-induced upregulation of fibronectin and transforming growth factor-β1 in rat glomerular mesangial cells by inhibiting RhoA/ROCK signaling. Endocrine. 2016;54:657-670. [PubMed] [DOI] |
| 8. | Levi M. Nuclear receptors in renal disease. Biochim Biophys Acta. 2011;1812:1061-1067. [PubMed] [DOI] |
| 9. | Yang Z, Li J, Xiong F, Huang J, Chen C, Liu P, Huang H. Berberine attenuates high glucose-induced fibrosis by activating the G protein-coupled bile acid receptor TGR5 and repressing the S1P2/MAPK signaling pathway in glomerular mesangial cells. Exp Cell Res. 2016;346:241-247. [PubMed] [DOI] |
| 10. | Yang Z, Xiong F, Wang Y, Gong W, Huang J, Chen C, Liu P, Huang H. TGR5 activation suppressed S1P/S1P2 signaling and resisted high glucose-induced fibrosis in glomerular mesangial cells. Pharmacol Res. 2016;111:226-236. [PubMed] [DOI] |
| 11. | Su J, Zhang Q, Qi H, Wu L, Li Y, Yu D, Huang W, Chen WD, Wang YD. The G-protein-coupled bile acid receptor Gpbar1 (TGR5) protects against renal inflammation and renal cancer cell proliferation and migration through antagonizing NF-κB and STAT3 signaling pathways. Oncotarget. 2017;8:54378-54387. [PubMed] [DOI] |
| 12. | Naranjo A, Cruz A, López P, Chicano M, Martín-Malo A, Sitges-Serra A, Muntané J, Padillo J. Renal function after dopamine and fluid administration in patients with malignant obstructive jaundice. A prospective randomized study. J Gastrointestin Liver Dis. 2011;20:161-167. [PubMed] |
| 13. | Wang L, Hartmann P, Haimerl M, Bathena SP, Sjöwall C, Almer S, Alnouti Y, Hofmann AF, Schnabl B. Nod2 deficiency protects mice from cholestatic liver disease by increasing renal excretion of bile acids. J Hepatol. 2014;60:1259-1267. [PubMed] [DOI] |
| 14. | 范 迪欢, 邬 善敏. 梗阻性黄疸肾脏损伤机制的研究进展. 胃肠病学和肝病学杂志. 2017;12:1432-1435. [DOI] |
| 16. | Wang XX, Luo Y, Wang D, Adorini L, Pruzanski M, Dobrinskikh E, Levi M. A dual agonist of farnesoid X receptor (FXR) and the G protein-coupled receptor TGR5, INT-767, reverses age-related kidney disease in mice. J Biol Chem. 2017;292:12018-12024. [PubMed] [DOI] |
| 17. | Halilbasic E, Fuchs C, Traussnigg S, Trauner M. Farnesoid X Receptor Agonists and Other Bile Acid Signaling Strategies for Treatment of Liver Disease. Dig Dis. 2016;34:580-588. [PubMed] [DOI] |
| 18. | Levi M. Role of Bile Acid-Regulated Nuclear Receptor FXR and G Protein-Coupled Receptor TGR5 in Regulation of Cardiorenal Syndrome (Cardiovascular Disease and Chronic Kidney Disease). Hypertension. 2016;67:1080-1084. [PubMed] [DOI] |