修回日期: 2016-12-01
接受日期: 2016-12-05
在线出版日期: 2017-02-08
建立基于细胞表面vimentin(cell-surface vimentin, csVim)的实体肿瘤细胞上皮间叶转化(epithelial-mesenchymal transition, EMT)样循环肿瘤细胞(circulating tumor cells, CTC)检测技术, 认识食管癌不同表型的CTC和EMT样CTC与肿瘤进展的关系.
在具有EMT表型的食管癌细胞KYSE 510-PURα和食管癌患者外周血CTC上免疫荧光分析csVim的表达和膜转位改变. 选择30例单纯手术治疗的食管癌患者术前外周血样本, 经免疫磁珠负性富集并制备CTC滴片. 在CTC细胞滴片上免疫荧光分析CTC、EMT样CTC和外周血白细胞并计数. 统计分析不同表型CTC含量与食管癌进展的相关性.
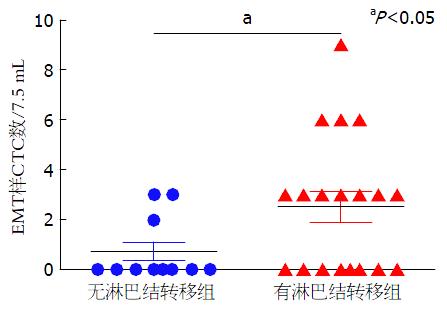
在食管癌KYSE 510-PURα细胞中, csVim表达水平升高, 主要定位于细胞膜, 发生明显的膜转位. 食管癌患者外周血具有CK8/18/19+、DAPI+和CD45-表型的CTC检出率为63.3%(19/30), 具有csVim+、CK8/18/19+、DAPI+和CD45-表型的EMT样CTC检出率为46.7%(14/30), 占CTC检出率的73.7%(14/19). 与无淋巴结转移个体相比, 外周血EMT样CTC数目在伴有淋巴结转移的食管癌患者中升高, 差异具有统计学意义(P = 0. 049).
食管癌患者外周血CTC是一种具有异质性的细胞群体, 其中EMT样CTC含量与肿瘤进展相关, 有可能作为判断食管癌淋巴结转移的潜在标志, 辅助监测病情进展和预测预后.
核心提要: 本研究建立了基于细胞表面vimentin的食管癌外周血细胞上皮间叶转化(epithelial-mesenchymal transition, EMT)样循环肿瘤细胞(circulating tumor cells, CTC)的检测方法, 并统计分析不同表型CTC含量与食管癌进展的相关性, 发现EMT样CTC含量与肿瘤进展相关, 有可能作为判断食管癌淋巴结转移及动态监测病情进展和预测预后的潜在标志.
引文著录: 代淑阳, 高佳佳, 赵丽娜, 孙玉琳, 赵晓航. 基于细胞表面vimentin的食管癌上皮间叶转化循环肿瘤细胞检测. 世界华人消化杂志 2017; 25(4): 316-325
Revised: December 1, 2016
Accepted: December 5, 2016
Published online: February 8, 2017
to develop a cell-surface vimentin (csVim) based circulating tumor cell (CTC) detection technique for identifying epithelial-mesenchymal transition (EMT)-like CTCs and investigating whether it can be used to assess tumor progression in esophageal squamous cell carcinoma (ESCC) patients.
Immunofluorescence assay was used to analyze the expression and cell membrane translocation of csVim in KYSE510-PURα cell line and peripheral blood CTCs from ESCC patients. In this study, 30 patients undergoing surgical therapy were recruited. The numbers of CTCs, EMT-like CTCs and white blood cells were counted. The correlation of different CTC subtypes with tumor progression was assessed in ESCC patients.
The expression of csVim was significantly increased in KYSE 510-PURα cells. CsVim was mainly located on the cell membrane, and it underwent cell membrane translocation. CTCs with the phenotype of CK8/18/19+, DAPI+ and CD45- were detected in 63.3% (19/30) of patients. EMT-like CTCs with the phenotype of csVim+, CK8/18/19+, DAPI+ and CD45- were detected in 46.7% (14/30) of patients, accounting for 73.7% (14/19) of CTCs. Compared with ESCC patients without lymph node metastasis, the number of EMT-like CTCs in peripheral blood was higher in patients with lymph node metastasis (P = 0.049).
CTCs in ESCC patients are highly heterogeneous. EMT-like CTCs are related to tumor progression and may be a potential biomarker for lymph node metastases in ESCC. The identification of EMT-like CTCs provides a new approach to estimate tumor progression and prognosis.
- Citation: Dai SY, Gao JJ, Zhao LN, Sun YL, Zhao XH. Cell-surface vimentin based detection of epithelial-mesenchymal transition-like circulating ESCC cells. Shijie Huaren Xiaohua Zazhi 2017; 25(4): 316-325
- URL: https://www.wjgnet.com/1009-3079/full/v25/i4/316.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i4.316
食管癌是我国常见肿瘤, 发病率和死亡率分别居我国恶性肿瘤第4位和第5位[1]. 循环肿瘤细胞(circulating tumor cells, CTC)检测已经被证明与肿瘤患者的进展及预后相关[2], 日益成为肿瘤液体活检的重要内容[3]. CTC是一种高度异质性的细胞群体, 包含不同的亚型. 研究[4]发现乳腺癌外周血存在一类CTC的亚群, 这些细胞缺失上皮性标志分子而表达vimentin、snail、slug和twist等细胞上皮间叶转化(epithelial-mesenchymal transition, EMT)标志, 进一步分析发现这些EMT样CTC的数量与乳腺癌肿瘤进展相关. EMT样CTC在侵袭性乳腺癌患者外周血的CTC中所占比例较高, 可能与肿瘤转移密切相关[5]. 通常, 外周血CTC的检测中主要基于上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM)等上皮性标志而忽略了发生EMT的高侵袭性的CTC[6]. 因此, 尝试研发新的可检测外周血EMT样CTC的技术非常重要. 本研究选取食管癌患者外周血样本30例, 负性富集有核细胞并经传统上皮细胞标志CK+鉴定CTC后, 进一步尝试分析CTC细胞表面vimentin(cell-surfice vimentin, csVim)的表达从而鉴定EMT样CTC, 比较EMT样CTC在食管癌患者外周血的含量及与患者临床病理特征的关系, 为评估食管癌的肿瘤进展提供新的手段.
收集2015-08/2016-05就诊于中国医学科学院肿瘤医院的单纯手术治疗的食管癌患者30例, 在知情同意前提下采集术前枸橼酸抗凝静脉血7.5 mL, 室温保存并在12 h内完成负性富集. 患者术前未接受手术治疗或放化疗, 所有样本术后均经病理确诊为食管鳞状细胞癌. 食管癌病理分期根据2009年第7版UICC/AJCC国际食管鳞癌TNM分期方法分期[7], 其中伴有淋巴结转移病例19例, 无淋巴结转移病例11例. 抗人白细胞表面共同抗原(CD45)免疫磁珠、异硫氰酸荧光素标记的抗人细胞角蛋白(Cytokeratin, CK)抗体(Cytokeratin 8/18/19, pan-CK-FITC)、强磁场磁性细胞分离架MidiMACS Separator/MultiStand购自德国Miltenyi Biotec公司(Bergisch Gladbach, Germany); 抗csVim单克隆抗体(84-1)购自中国台湾Abnova公司; 细胞核染料DAPI、牛血清白蛋白和Histopaque-1077密度梯度介质购自美国Sigma-Aldrich公司(St. Louis, MO, United States); 荧光标记二抗Alexa-488山羊抗小鼠IgG购自美国Invitrogen公司(Carslbad, CA, United States). 倒置相差和Nikon E400荧光显微镜为日本Nikon产品; 胎牛血清购自奥地利PAA公司(Pasching, Austria); Leucosep管购自德国Greiner Bio-One公司(Frickenhausen, Germany).
1.2.1 细胞爬片制备和免疫荧光染色: 无菌玻片放入六孔板中, 每个玻片表面用0.01%的多聚赖氨酸处理30 min, 然后将食管癌KYSE510-pCMV6和KYSE510-PURα细胞悬液1×105/mL加至六孔板中, 混匀, 于37 ℃培养箱培养24 h. 取出六孔板, 将细胞爬片用4 ℃预冷的1×磷酸盐缓冲液(phosphate buffered saline, PBS)洗涤3次, 3 min/次, 2%BSA封闭后加入一抗, 4 ℃孵育过夜后PBS洗涤3次, 3 min/次, 加入二抗, 室温孵育1 h后PBS洗涤3次并用DAPI封片, 显微镜下观察.
1.2.2 外周血CTC免疫磁珠负性富集: 7.5 mL外周血加入等体积1×PBS稀释血样; 取3 mL室温下预热的Histopaque®-1077试剂于Leucosep®管内, 室温下1000 g×30 s离心, 然后将稀释后血样加入Leucosep®管内, 室温1000 g离心10 min, 分离外周血单个核细胞(peripheral blood mononuclear cells, PBMC)转移至新15 mL管内; 用10 mL洗涤缓冲液轻轻重悬细胞, 4 ℃下300 g离心10 min, 弃上清并再重复1次, 获得有核细胞. 按照每1×107白细胞加20 μL抗人CD45免疫磁珠比例加入抗人CD45免疫磁珠, 与PBMC混匀, 4 ℃孵育15 min; 加入1×107白细胞/2 mL缓冲液, 离心后去上清, 加入500 μL缓冲液重悬沉淀, 将细胞悬液加入强磁场环境下的LS柱, 洗脱并收集未与CD45磁珠结合的有核细胞(含CTC), 控制液滴速度1.5-2.0 mL/min; 取3张载玻片, 载玻片中央用专用蜡笔画一直径约2 cm圆圈, 放置干燥; 充分混匀有核细胞上清, 均匀涂布在3张载玻片上制成细胞滴片. 滴片放在超净台中室温放至30 min, 1×PBS洗涤3次, 每次3 min.
1.2.3 CTC免疫荧光分析: 将CTC滴片用含2%BSA的PBS封闭30 min, 然后分别加入2%BSA稀释的抗csVim(1:100)、CK8/18/19-FITC(1:100)和CD45-PE(1:500)抗体, 室温孵育1 h. 用PBS洗涤3次, 3 min/次, 去除未结合的抗体. 与抗csVim抗体孵育的细胞滴片再与Alexa 488标记的荧光二抗(1:500, 2%BSA稀释)室温孵育1 h, PBS洗涤3次, 去除未结合的抗体. 上述染色滴片加7 μL DAPI的封固剂封片, 在荧光显微镜下观察染色结果. 外周血EMT样CTC平均细胞数计数方法为在患者外周血CTC滴片上分别进行抗CK8/18/19、CD45和csVim, 以及DAPI的免疫荧光染色, 分别计算CTC细胞(CK8/18/19+、CD45-和DAPI+)数和EMT样CTC细胞(csVim+、CK8/18/19+、CD45-和DAPI+)数, 统计30例食管癌患者外周血CTC和EMT样CTC细胞含量并统计分析结果.
1.2.4 Western blot检测: 提取细胞全蛋白, 考马斯亮蓝染色法测定蛋白浓度, 用10%SDS-PAGE电泳2-3 h, 然后110 V恒压70 min将蛋白转移到PVDF膜上, 10%脱脂牛奶室温封闭3 h, 加入稀释的一抗, 4 ℃孵育过夜, 洗膜, 并加入相应辣根过氧化物酶标记的二抗, 室温孵育1 h, 洗膜, 加入ECL化学发光试剂显色并用LAS4000图像分析仪采集图像.
统计学处理 采用SPSS19.0软件, 细胞计数结果以mean±SD表示, 并用Mann-Whitney秩和检验比较不同分组中CTC数目的差异, P<0.05为差异具有统计学意义.
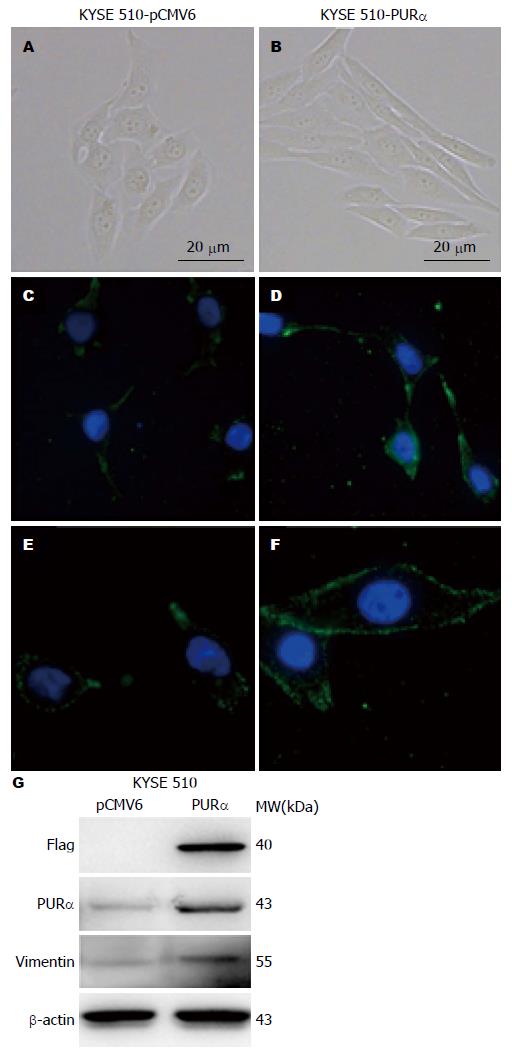
首先, 在实验室前期建立的具有EMT样改变的食管癌细胞KYSE 510-PURα上检测csVim的表达水平和定位[8]. 与对照细胞KYSE 510-pCMV6相比, 过表达PURα基因的食管癌细胞呈现由多边形的上皮样形态(图1A, C, E)转变为纤维样细胞形态(图1B, D, F), 提示PURα可以引起食管癌细胞发生EMT样改变. 在EMT样改变的食管癌KYSE 510-PURα细胞中, 可见csVim的表达水平升高, 主要定位于细胞膜, 发生明显的膜转位(图1D, F). 用Western blot检测了KYSE 510-PURα中vimentin总量的变化, 发现与空载对照相比KYSE 510-PURα中vimentin总量增高(图1G).
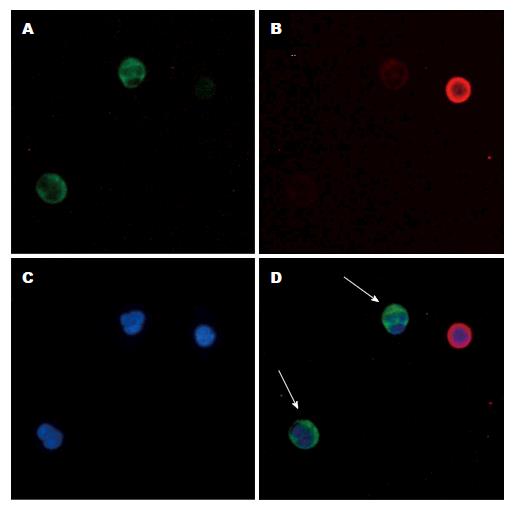
食管癌患者外周血7.5 mL, 经过免疫磁珠负性选择富集后, 富集的细胞均匀涂在玻片上, 联合抗pan-CK(CK8/18/19)抗体和荧光标记二抗染色, 在荧光显微镜下, 依据上皮细胞标记染色和细胞核染色对富集细胞做形态学分析. 荧光显微镜下显示肿瘤细胞体积较大, CTC细胞标志染色为抗上皮细胞表面抗原阳性(CK8/18/19+)、细胞核DAPI染色阳性(DAPI+)并且细胞核直径>8-10 μm, 形状不规则, 抗白细胞标志CD45染色阴性(CD45-), 如图2D绿色荧光标记. 分析30例食管癌患者外周血, CTC检出率为63.3%(19/30).
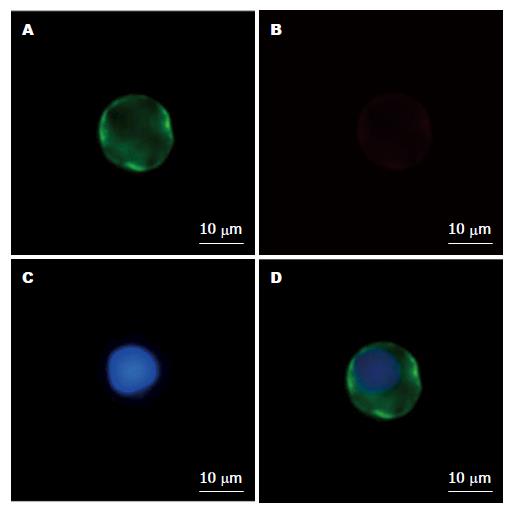
食管癌患者外周血7.5 mL经免疫磁珠负性富集, 富集的细胞均匀涂在载玻片上. 首先经抗pan-CK(CK8/18/19)、DAPI和抗CD45染色, 再经抗csVim染色后, 进一步选择在CTC细胞(CK8/18/19+、DAPI+和CD45-)上观察csVim染色结果, 荧光显微镜下显示肿瘤细胞体积较大, csVim主要定位在CTC的细胞膜上(图3). 统计分析csVim阳性细胞占CTC细胞的比例, CTC计数结果与临床病理参数相关性如表1. 在30例食管癌患者外周血, EMT样CTC检出率为46.7%(14/30), 占CTC检出率的73.7%(14/19). 食管癌无淋巴结转移组外周血EMT样CTC平均细胞数(0.73±1.27, n = 11)和食管癌伴有淋巴结转移组外周血EMT样CTC平均细胞数(2.53±2.70, n = 19)的Mann-Whitney秩和检验分析, 结果表明外周血EMT样CTC含量在2组间具有统计学差异(P = 0.049). EMT样CTC与食管癌淋巴结转移及肿瘤分化程度具有相关性(图4), 提示食管癌患者外周血的EMT样CTC数目有可能作为判断食管癌淋巴结转移状态的潜在标志, 辅助临床监测病情进展和预测预后.
| 临床病理特征 | 数量(n) | CTC数(mean±SD) | P值 | EMT样CTC数(mean±SD) | P值 |
| 年龄 | 0.644 | 0.605 | |||
| <60 | 8 | 3.00±3.59 | 2.25±2.66 | ||
| ≥60 | 22 | 3.50±3.73 | 1.73±2.37 | ||
| 性别 | 0.088 | 0.187 | |||
| 男 | 25 | 3.90±3.76 | 2.10±2.52 | ||
| 女 | 5 | 1.00±1.41 | 0.60±1.34 | ||
| 分化程度 | 0.712 | 0.015 | |||
| 高 | 8 | 2.50±2.98 | 0.38±1.06 | ||
| 中 | 10 | 3.90±3.47 | 1.20±1.55 | ||
| 低 | 12 | 3.67±4.29 | 3.42±2.84 | ||
| TNM分期 | 0.758 | 0.102 | |||
| Ⅰ-Ⅱ | 12 | 3.67±3.68 | 0.92±1.38 | ||
| Ⅲ-Ⅳ | 18 | 3.28±3.71 | 2.50±2.77 | ||
| 淋巴结转移 | 0.531 | 0.049 | |||
| 阴性(N0) | 11 | 2.64±2.84 | 0.73±1.27 | ||
| 阳性(N1-3) | 19 | 3.89±4.03 | 2.53±2.70 |
食管癌是一种高度恶性的消化系肿瘤, 2012年全球食管癌新发病例45.6万人, 发病率居全球第8位; 死亡40万人, 居肿瘤相关死亡第6位[9]. 食管癌的组织类型包括食管鳞状细胞癌和食管腺癌, 我国食管癌的主要病理类型为食管鳞状细胞癌. 由于缺乏早期诊断方法, 通常患者就诊时已为中晚期, 食管癌进展较快, 易发生淋巴结转移, 预后较差, 5年生存率低于10%[10,11]. 目前, 肿瘤的诊断和治疗依赖于肿瘤组织的病理学和分子生物学检测, 但肿瘤组织的获取存在很多限制. 如侵入性高、风险大, 患者接受度低, 无法反复操作等, 而且由于肿瘤具有较高的异质性, 肿瘤发生发展是一个动态过程, 单一活检组织无法全面反映肿瘤的特性[12,13]. 随着对肿瘤诊断的即时性和精准度要求日益提高, 基于外周血的液体活检技术不断完善. 液体活检基于患者血液样本代替肿瘤组织进行病理学和分子生物学检测而获得肿瘤相关信息, 具有侵入性小, 可反复取样等优点, 越来越受到重视. 检测结果有助于认识肿瘤的异质性, 可以系统性地追踪肿瘤基因组的改变, 实现对肿瘤的实时监测[14,15]. 从传统的蛋白质类肿瘤标志物, 到循环肿瘤DNA和CTC以及外泌体等, 液体活检可为肿瘤的诊断和治疗提供重要信息[16].
CTC是进入循环系统的肿瘤细胞, 是肿瘤转移和复发的重要原因之一. 研究证明外周血CTC含量与前列腺癌、肺癌和结肠癌等恶性肿瘤的转移复发进展相关. 检测肿瘤患者外周血CTC已经成为乳腺癌预后相关标志物[17], 2007年CTC被美国临床肿瘤学会推荐为肿瘤标志物, 作为TNM分期的重要补充. 食管癌患者外周血CTC数目与患者预后、无进展生存期相关, 是预测肿瘤复发的独立风险因子[18,19]. 外周血CTC是判断食管癌放化疗临床预后的指标[20]. Qiao等[21]通过对同一食管癌个体长达5年以上的外周血CTC动态监测, 发现随着病情进展外周血CTC数量改变先于临床影像学改变, 外周血CTC数量变化可以提前提示肿瘤进展.
由于CTC在外周血中丰度很低, 属于稀有细胞, 其有效富集和鉴定是CTC分析中的主要技术难点. 以往的检测方法主要是基于EpCAM和CK等上皮性标志分子, 他们通常在上皮来源的肿瘤细胞中表达而在外周血细胞中不表达. 美国食品及药物管理局批准的用于CTC检测的CellSearch系统正是基于EpCAM的鉴定方法, 用于转移性乳腺癌、前列腺癌和结肠癌的CTC检测[22]. 然而, CTC是一种高度异质性的群体, 包含不同亚型, 其中EMT样CTC的数量被证明与乳腺癌的肿瘤进展相关并可能是导致肿瘤转移的主要细胞群体[4,5]. EMT是胚胎发育、组织重建和伤口修复的基础过程, 也是实体肿瘤细胞突破基质束缚, 进入循环系统发生远处转移的机制[23]. 在此过程中上皮细胞丢失其上皮细胞标志如EpCAM和CK, 转而表达间叶细胞标志, 会导致CTC鉴定的假阴性结果[24,25]. 越来越多的研究[26]发现, 经历EMT改变的CTC具有肿瘤干细胞的特征, 而且具有更强的侵袭和转移能力, 对化疗和靶向治疗药物具有更强的耐受性. 然而由于缺乏特异性的检测EMT样CTC的标志分子和检测方法限制了相关的研究.
Vimentin是细胞中间丝的重要组分, 通常在间叶细胞中表达, 作为细胞骨架的主要组成部分在维持细胞完整性、稳定细胞骨架间的相互作用和抵抗机械压力等方面扮演重要角色[27]. 研究表明, vimentin在乳腺癌、中枢神经系统肿瘤、前列腺癌、恶性黑色素瘤和肺癌等多种肿瘤细胞中过表达[28], 还可以在肿瘤细胞和新生血管内皮细胞表面的细胞膜上表达, 提示上皮细胞表面表达的csVim是一种细胞发生EMT样改变的标志[29,30].
Satelli等[31]的研究提示, 细胞表面csVim可以作为一个鉴定肉瘤外周血CTC的广谱性标志物. Mitra等[32]发现csVim可以作为具有干细胞特征的EMT样肝细胞肝癌的标志物. 与传统的基于EpCAM上皮标志分子鉴定外周血CTC相比, 在乳腺癌患者外周血CTC检测中基于csVim的CTC鉴定方法有助与区分乳腺癌患者对化疗的治疗反应[33], 提示csVim可以作为一种新型的EMT样CTC鉴定的标志分子. 近期研究发现, 表达csVim的胶质母细胞瘤(glioblastoma multiforme, GBM)体外克隆形成能力较强, 抗csVim的新型单克隆抗体86C能在体外显著抑制GBM的克隆形成能力, 诱导细胞凋亡, 抑制动物体内肿瘤进展[34], 提示细胞表面表达csVim的上皮样细胞具有EMT样改变和干细胞样特性, 细胞表面csVim也可能是一种肿瘤治疗的潜在靶点.
本实验室前期建立了外周血CTC的负性富集技术, 即去除CD45+的外周血白细胞, 保留剩余的有核细胞, 该方法可以从7.5 mL外周血中有效地富集食管癌、胰腺癌等CTC细胞[35]. 另外我们的前期工作表明, 食管癌细胞过表达PURα可以诱导细胞发生EMT样改变. KYSE 510-PURα细胞E-cadherin表达明显降低, 而N-cadherin、vimentin和snail表达明显增加, 提示PURα过表达促进了食管癌KYSE 510细胞上皮间叶转化[8]. 与对照细胞相比, 本研究首先在PURα过表达并发生了EMT改变的食管癌细胞(KYSE 510-PURα)上检测到了细胞表面定位的csVim表达, 进而在经免疫磁珠负性富集的食管癌外周血CTC(CK8/18/19+、DAPI+和CD45-)滴片细胞上, 检测到细胞表面定位的csVim表达细胞即EMT样CTC(csVim+、CK8/18/19+、DAPI+和CD45-). 结果提示, 食管癌患者外周血CTC具有异质性, 其中存在既表达上皮样标志(CK8/18/19+)又在细胞表面表达csVim的一类EMT样CTC. EMT样CTC数目在伴有淋巴结转移和无淋巴结转移的食管癌患者间具有统计学差异. 本研究建立了基于检测细胞表面csVim的食管癌外周血EMT样CTC的检测方法, 基于小样本分析结果提示检测食管癌患者外周血中EMT样CTC在总CTC细胞数中所占的比例, 有助于认识肿瘤侵袭和转移的潜能, 对监测肿瘤进展具有一定科学意义.
食管鳞状细胞癌是我国常见的恶性肿瘤之一, 易发生淋巴结转移, 预后较差. 外周血循环肿瘤细胞(circulating tumor cells, CTC)的数量和表型与食管癌患者预后、无进展生存期相关, 并可作为预测肿瘤复发和判断食管癌放化疗临床预后的指标.
Vimentin是中间丝的重要组分, 通常在间叶细胞中表达, 最近研究发现定位在细胞膜上的细胞表面vimentin(cell-surface vimentin, csVim)可以作为一种新型的细胞上皮间叶转化(epithelial-mesenchymal transition, EMT)样CTC检测的标志分子, csVim在具有干细胞样特性的细胞表面存在表达, 可能是肿瘤治疗的潜在靶点.
研究发现利用抗csVim的单克隆抗体84-1可以在转移性结肠癌患者外周血中检测到EMT样CTC, 结果具有较高的灵敏度和特异度. 结合患者临床特征分析发现EMT样CTC与肿瘤的治疗预后具有相关性, 提示csVim可以作为EMT样CTC的检测标志物.
既往基于上皮性标志分子的CTC检测方法无法区分不同表型的CTC, 如EMT样的CTC. 本研究通过采用一种识别EMT样CTC的标识分子csVim结合上皮标志分子, 建立了检测EMT样CTC的方法, 动态监测食管癌EMT样CTC的细胞数与表型变化而间接了解肿瘤进展.
本研究建立一种基于csVim的实体肿瘤EMT样CTC检测技术, 动态监测食管癌不同表型CTC的变化与肿瘤进展的关系, 有助于及时调整合适的治疗方案.
EMT样CTC: 具有csVim+、CK8/18/19+、DAPI+和CD45-表型的CTC. CTC是一种高度异质性的群体, 包含不同的表型, 其中经历EMT的CTC丢失其上皮细胞标志如上皮细胞黏附分子和CK, 转而表达间叶细胞标志. EMT样CTC具有肿瘤干细胞的特征, 而且具有更强的侵袭和转移能力, 对化疗和靶向治疗药物具有更强的耐受性.
陈晓, 教授, 副主任医师, 新疆医科大学基础医学院病理学教研室; 李焱, 副研究员, 中山大学肿瘤防治中心实验研究部; 刘尚国, 副教授, 副主任医师, 新乡医学院第一附属医院胸外二科; 周福有, 教授, 主任医师, 硕士生导师, 安阳市肿瘤医院胸外科
本文对具有EMT表型的食管癌细胞KYSE 510-PURα和食管癌患者外周血CTC进行了csVim的免疫荧光分析, 并统计分析不同表型CTC含量与食管癌进展的相关性. 发现KYSE 510-PURα细胞中csVim表达水平升高, 外周血EMT样CTC数目在伴有淋巴结转移的食管癌患者中升高, 研究内容对于监测食管肿瘤有一定的实用价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:胡珊
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 2. | van de Stolpe A, Pantel K, Sleijfer S, Terstappen LW, den Toonder JM. Circulating tumor cell isolation and diagnostics: toward routine clinical use. Cancer Res. 2011;71:5955-5960. [PubMed] [DOI] |
| 3. | Pantel K, Alix-Panabières C. Real-time liquid biopsy in cancer patients: fact or fiction? Cancer Res. 2013;73:6384-6388. [PubMed] [DOI] |
| 4. | Kallergi G, Papadaki MA, Politaki E, Mavroudis D, Georgoulias V, Agelaki S. Epithelial to mesenchymal transition markers expressed in circulating tumour cells of early and metastatic breast cancer patients. Breast Cancer Res. 2011;13:R59. [PubMed] [DOI] |
| 5. | Yu M, Bardia A, Wittner BS, Stott SL, Smas ME, Ting DT, Isakoff SJ, Ciciliano JC, Wells MN, Shah AM. Circulating breast tumor cells exhibit dynamic changes in epithelial and mesenchymal composition. Science. 2013;339:580-584. [PubMed] [DOI] |
| 6. | Zhe X, Cher ML, Bonfil RD. Circulating tumor cells: finding the needle in the haystack. Am J Cancer Res. 2011;1:740-751. [PubMed] |
| 7. | Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010;17:1471-1474. [PubMed] [DOI] |
| 9. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 10. | Weir HK, Thun MJ, Hankey BF, Ries LA, Howe HL, Wingo PA, Jemal A, Ward E, Anderson RN, Edwards BK. Annual report to the nation on the status of cancer, 1975-2000, featuring the uses of surveillance data for cancer prevention and control. J Natl Cancer Inst. 2003;95:1276-1299. [PubMed] [DOI] |
| 11. | Wang LD, Yang HH, Fan ZM, Lü XD, Wang JK, Liu XL, Sun Z, Jiang YN, He X, Zhou Q. Cytological screening and 15 years' follow-up (1986-2001) for early esophageal squamous cell carcinoma and precancerous lesions in a high-risk population in Anyang County, Henan Province, Northern China. Cancer Detect Prev. 2005;29:317-322. [PubMed] [DOI] |
| 12. | McGranahan N, Swanton C. Biological and therapeutic impact of intratumor heterogeneity in cancer evolution. Cancer Cell. 2015;27:15-26. [PubMed] [DOI] |
| 13. | Loughran CF, Keeling CR. Seeding of tumour cells following breast biopsy: a literature review. Br J Radiol. 2011;84:869-874. [PubMed] [DOI] |
| 14. | Crowley E, Di Nicolantonio F, Loupakis F, Bardelli A. Liquid biopsy: monitoring cancer-genetics in the blood. Nat Rev Clin Oncol. 2013;10:472-484. [PubMed] [DOI] |
| 15. | Chan KC, Jiang P, Zheng YW, Liao GJ, Sun H, Wong J, Siu SS, Chan WC, Chan SL, Chan AT. Cancer genome scanning in plasma: detection of tumor-associated copy number aberrations, single-nucleotide variants, and tumoral heterogeneity by massively parallel sequencing. Clin Chem. 2013;59:211-224. [PubMed] [DOI] |
| 16. | Thakur BK, Zhang H, Becker A, Matei I, Huang Y, Costa-Silva B, Zheng Y, Hoshino A, Brazier H, Xiang J. Double-stranded DNA in exosomes: a novel biomarker in cancer detection. Cell Res. 2014;24:766-769. [PubMed] [DOI] |
| 17. | Zhang L, Riethdorf S, Wu G, Wang T, Yang K, Peng G, Liu J, Pantel K. Meta-analysis of the prognostic value of circulating tumor cells in breast cancer. Clin Cancer Res. 2012;18:5701-5710. [PubMed] [DOI] |
| 18. | Sclafani F, Smyth E, Cunningham D, Chau I, Turner A, Watkins D. A pilot study assessing the incidence and clinical significance of circulating tumor cells in esophagogastric cancers. Clin Colorectal Cancer. 2014;13:94-99. [PubMed] [DOI] |
| 19. | Reeh M, Effenberger KE, Koenig AM, Riethdorf S, Eichstädt D, Vettorazzi E, Uzunoglu FG, Vashist YK, Izbicki JR, Pantel K. Circulating Tumor Cells as a Biomarker for Preoperative Prognostic Staging in Patients With Esophageal Cancer. Ann Surg. 2015;261:1124-1130. [PubMed] [DOI] |
| 20. | Matsushita D, Uenosono Y, Arigami T, Yanagita S, Nishizono Y, Hagihara T, Hirata M, Haraguchi N, Arima H, Kijima Y. Clinical Significance of Circulating Tumor Cells in Peripheral Blood of Patients with Esophageal Squamous Cell Carcinoma. Ann Surg Oncol. 2015;22:3674-3680. [PubMed] [DOI] |
| 21. | Qiao YY, Lin KX, Zhang Z, Zhang DJ, Shi CH, Xiong M, Qu XH, Zhao XH. Monitoring disease progression and treatment efficacy with circulating tumor cells in esophageal squamous cell carcinoma: A case report. World J Gastroenterol. 2015;21:7921-7928. [PubMed] [DOI] |
| 22. | Riethdorf S, Fritsche H, Müller V, Rau T, Schindlbeck C, Rack B, Janni W, Coith C, Beck K, Jänicke F. Detection of circulating tumor cells in peripheral blood of patients with metastatic breast cancer: a validation study of the CellSearch system. Clin Cancer Res. 2007;13:920-928. [PubMed] [DOI] |
| 23. | Shook D, Keller R. Mechanisms, mechanics and function of epithelial-mesenchymal transitions in early development. Mech Dev. 2003;120:1351-1383. [PubMed] [DOI] |
| 24. | Gupta GP, Massagué J. Cancer metastasis: building a framework. Cell. 2006;127:679-695. [PubMed] [DOI] |
| 25. | Mikolajczyk SD, Millar LS, Tsinberg P, Coutts SM, Zomorrodi M, Pham T, Bischoff FZ, Pircher TJ. Detection of EpCAM-Negative and Cytokeratin-Negative Circulating Tumor Cells in Peripheral Blood. J Oncol. 2011;2011:1775-1779. [PubMed] [DOI] |
| 26. | Mitra A, Satelli A, Xia X, Cutrera J, Mishra L, Li S. Cell-surface Vimentin: A mislocalized protein for isolating csVimentin(+) CD133(-) novel stem-like hepatocellular carcinoma cells expressing EMT markers. Int J Cancer. 2015;137:491-496. [PubMed] [DOI] |
| 27. | Vuoriluoto K, Haugen H, Kiviluoto S, Mpindi JP, Nevo J, Gjerdrum C, Tiron C, Lorens JB, Ivaska J. Vimentin regulates EMT induction by Slug and oncogenic H-Ras and migration by governing Axl expression in breast cancer. Oncogene. 2011;30:1436-1448. [PubMed] [DOI] |
| 28. | Satelli A, Li S. Vimentin in cancer and its potential as a molecular target for cancer therapy. Cell Mol Life Sci. 2011;68:3033-3046. [PubMed] [DOI] |
| 29. | Huet D, Bagot M, Loyaux D, Capdevielle J, Conraux L, Ferrara P, Bensussan A, Marie-Cardine A. SC5 mAb represents a unique tool for the detection of extracellular vimentin as a specific marker of Sezary cells. J Immunol. 2006;176:652-659. [PubMed] [DOI] |
| 30. | Bhattacharya R, Gonzalez AM, Debiase PJ, Trejo HE, Goldman RD, Flitney FW, Jones JC. Recruitment of vimentin to the cell surface by beta3 integrin and plectin mediates adhesion strength. J Cell Sci. 2009;122:1390-1400. [PubMed] [DOI] |
| 31. | Satelli A, Mitra A, Cutrera JJ, Devarie M, Xia X, Ingram DR, Dibra D, Somaiah N, Torres KE, Ravi V. Universal marker and detection tool for human sarcoma circulating tumor cells. Cancer Res. 2014;74:1645-1650. [PubMed] [DOI] |
| 32. | Mitra A, Mishra L, Li S. EMT, CTCs and CSCs in tumor relapse and drug-resistance. Oncotarget. 2015;6:10697-10711. [PubMed] [DOI] |
| 33. | Satelli A, Brownlee Z, Mitra A, Meng QH, Li S. Circulating tumor cell enumeration with a combination of epithelial cell adhesion molecule- and cell-surface vimentin-based methods for monitoring breast cancer therapeutic response. Clin Chem. 2015;61:259-266. [PubMed] [DOI] |
| 34. | Noh H, Yan J, Hong S, Kong LY, Gabrusiewicz K, Xia X, Heimberger AB, Li S. Discovery of cell surface vimentin targeting mAb for direct disruption of GBM tumor initiating cells. Oncotarget. 2016;7:72021-72032. [PubMed] [DOI] |
| 35. | Ren C, He P, Zhang J, Zheng Z, Qiao Y, Zhao X. Malignant characteristics of circulating tumor cells and corresponding primary tumor in a patient with esophageal squamous cell carcinoma before and after surgery. Cancer Biol Ther. 2011;11:633-638. [PubMed] [DOI] |