修回日期: 2017-09-25
接受日期: 2017-10-17
在线出版日期: 2017-11-08
探讨针对乙型肝炎病毒(hepatitis B virus, HBV)S编码链的反基因锁核酸(anti-gene-locked nucleic acid, Anti-G-LNA)在转基因小鼠体内的抗病毒效果.
将30只HBV转基因小鼠随机分为5组(n = 6), 分别为空白对照组(Control)(5%GLU+脂质体)、无关序列对照组(USQ)、拉米夫定对照组(LAM)、反义锁核酸对照组(Anti-S-LNA)、反基因锁核酸组(Anti-G-LNA). 拉米夫定组用灌胃法; 锁核酸经尾静脉注入小鼠体内. 采用实时荧光定量PCR检测血清乙型肝炎病毒脱氧核糖核酸(HBV DNA); 酶联免疫法检测血清乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg); 逆转录PCR检测肝脏乙型肝炎病毒S基因mRNA(HBV S mRNA)水平; 免疫组织化学检测肝细胞HBsAg水平.
治疗后的第3、5、7天, 反基因锁核酸对HBV DNA抑制率分别为37.18%、50.27%、61.46%, HBsAg抑制率分别为30.17%、44.00%、57.76%, 与给药前比较有统计学意义(P<0.05), 与各对照组比较, 差异均有统计学意义(P<0.05). HBV S基因mRNA的相对表达量为0.33、肝细胞HBsAg阳性细胞率为31%, 与对照组相比有统计学意义(P<0.05); 肝肾功能检查和组织HE染色未发现异常改变.
针对HBV S编码链设计的反基因锁核酸在转基因小鼠体内具有较好的抗病毒效果, 为HBV基因治疗提供理论依据和实验基础.
核心提要: 反基因治疗是在DNA复制水平上的一种治疗策略, 其机制是由外源特定寡聚脱氧核苷酸与病毒双链DNA的特定区域专一性结合, 形成三链DNA分子, 从而阻断靶基因的转录与复制, 实现"反基因"之目的.
引文著录: 肖树荣, 许桂丹, 韦武均, 彭彬, 邓益斌. HBV S编码链的反基因锁核酸对转基因小鼠体内病毒复制与表达的影响. 世界华人消化杂志 2017; 25(31): 2782-2790
Revised: September 25, 2017
Accepted: October 17, 2017
Published online: November 8, 2017
To investigate the antiviral effect of hepatitis B virus (HBV) S gene-specific anti-gene locked nucleic acid (LNA) in transgenic mice.
Thirty HBV transgenic mice were randomly divided into 5 groups (n = 6 each): blank control group, negative control group (unrelated sequence), lamivudine group, antisense-LNA treatment group, and anti-gene LNA treatment group. LNA was injected into transgenic mice via the tail vein, and lamivudine was given by gavage. Serum HBV DNA was tested by real-time PCR; serum hepatitis B surface antigen (HBsAg) was determined by ELISA; the mRNA level of HBV S gene was detected by RT-PCR; and the positive rate of HBsAg in liver cells was detected by immunohistochemistry.
On 3, 5, and 7 d after anti-gene LNA treatment, HBV DNA was reduced by 37.18%, 50.27%, and 61.46%, respectively, and HBsAg was reduced by 30.17%, 44%, and 57.76%, respectively; there was a significant difference in HBV DNA and HBsAg compared with those before administration (P < 0.05) or compared with control groups (blank control, negative control, lamivudine, and antisense-LNA) (P < 0.05). The mRNA level of HBV S gene (0.33) and the HBsAg positive rate of liver cells (31%) were significantly reduced compared with control groups (P < 0.05). The function of liver and kidney tests and tissue HE staining showed no abnormal changes.
Anti-gene LNA targeting the S gene has a strong inhibitory effect on HBV replication and expression in HBV transgenic mice, and this provides experimental basis for gene therapy of HBV.
- Citation: Xiao SR, Xu GD, Wei WJ, Peng B, Deng YB. Antiviral effect of hepatitis B virus S gene-specific anti-gene locked nucleic acid in hepatitis B virus transgenic mice. Shijie Huaren Xiaohua Zazhi 2017; 25(31): 2782-2790
- URL: https://www.wjgnet.com/1009-3079/full/v25/i31/2782.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i31.2782
乙型肝炎病毒(hepatitis B virus, HBV)是一种有包膜的嗜肝DNA病毒, 其感染引起的病毒性乙型肝炎, 是一种传染性较强的疾病, 如果得不到有效控制, 易发展为肝硬化甚至肝癌[1], 对人类的危害已经成为全球性问题, 而中国是重灾区之一. 目前临床上治疗慢性乙型肝炎仍然缺乏特效药物, 其应用最多的药物是核苷酸类似物如拉米夫定、替比夫定、阿德福韦酯或干扰素等药物抑制逆转录酶的活性达到抗病毒治疗效果[2], 但这些药物的长期使用会出现HBV的耐药现象, 最终导致抗病毒药物无法完全清除人体内的病毒载量, 因此需探索一种更有效的策略治疗HBV引起的乙型肝炎[3,4]. 锁核酸(locked nucleic acid, LNA)是一种化学结构较特殊的双环状核苷酸衍生物, 具有提高与杂交双链的亲和性[5-7]和热稳定性[8]、增强抵抗核酸酶降解能力[9]、无毒[10]等优点而被应用于基因治疗[11]. 基因治疗是近年来的研究新热点并取得了一定进展, 其中在RNA转录水平上, 本课题组利用反义LNA在HBV治疗中做了大量的研究并取得了一定的成果[12-16], 结果显示反义LNA能有效抑制HBV的复制和表达. 在DNA复制水平上的反基因治疗, 其机制是由外源特定寡聚脱氧核苷酸与病毒双链DNA的特定区域专一性结合, 形成三链DNA分子, 从而阻断靶基因的转录与复制, 实现"反基因"之目的. 前期体外试验研究结果表明反基因治疗能有效抑制HBV的复制与表达[17-19]. 为了进一步探讨反基因LNA在体内的抗病毒效果, 本文针对HBV S编码链设计的反基因LNA, 用脂质体转染, 经小鼠尾静脉注射将反基因LNA导入肝细胞核内, 观察其在HBV转基因小鼠体内的抗病毒效果.
HBV转基因小鼠30只, 雌雄各半, 体质量19-23 g, 购自广州解放军四五八医院; 反义LNA、反基因LNA交给生工生物工程有限公司(生工)合成; 脂质体转染试剂为Polyplus公司; 贺普丁拉米夫定片购自葛兰素史克制药(苏州)有限公司; 乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)诊断试剂盒购自珠海丽珠试剂股份有限公司; 乙型肝炎病毒核酸定量检测试剂盒(PCR-荧光探针法)购自中山大学达安基因股份有限公司; TRIzol Universal总RNA提取试剂、FastQuant cDNA第一链合成试剂盒、PCR MasterMix为TIANGEN产品; 小鼠抗人HBsAg单克隆抗体、通用二步法检测试剂盒、DAB显色液购自北京中杉金桥生物技术有限公司; 正置荧光显微镜为OLYMPUS.
1.2.1 反基因LNA的设计与合成: 根据基因测序的结果, HBV的病毒亚型为ayw. 针对HBV S编码链利用RNA structure软件设计反基因LNA片段, 利用Walk(步移)功能选择△G37值较小的片段, 经Blast分析序列特征及同源性, 交给工生成并纯化.
1.2.2 脂质体包裹LNA的制备: 依据反基因LNA浓度筛选试验结果, 选择以每克体质量0.2 μg反基因LNA用10%GLU稀释反基因LNA终浓度为5%GLU反基因LNA混合液250 μL; 按脂质体试剂说明书通过反基因LNA计数脂质体的量, 用10%GLU稀释脂质体终浓度为5%GLU脂质体溶液250 μL; 最后两者充分混匀并室温孵育15 min待用.
1.2.3 HBV转基因小鼠的处理: 采用随机分组法将30只HBV转基因小鼠平均分为5组(n = 6), 分别为空白对照组(Control)(5%GLU+脂质体)、无关序列组(USQ)、拉米夫定组(LAM)、反义锁核酸组(Anti-S-LNA)、反基因锁核酸组(Anti-G-LNA). 于1、3、5 d经尾静脉给对应组注射5%GLU、5%GLU-无关序列、脂质体包裹的反义LNA和反基因LNA各500 μL. 拉米夫定组按说明书建议剂量以每天100 mg(100 mg/50 kg)灌胃2次, 连续7 d. 于注射前和注射后1、3、5、7 d经眶静脉采血, 并2 h内用离心机5000 r/min离心5 min, 分离血清到编好号的无菌EP管, 贮存到-20 ℃冰箱备用. 注射后第7天取小鼠肝、肾于RNA保存液和4%多聚甲醛溶液保存.
1.2.4 血清HBV DNA的检测: 采用PCR-荧光探针法检测血清HBV DNA. 分别取30 μL待测样本、阳性定量参考品、质控品加入70 μL DNA提取液, 剧烈振荡15 s, 100 ℃处理10 min, 12000 r/min离心5 min, 备用. 在30 μL配好的PCR反应液中加入提取好的DNA样品20 μL, 8000 r/min离心数秒后转移至扩增检测区, 按以下条件扩增: (1)93 ℃预变性2 min; (2)93 ℃ 45 s, 55 ℃ 1 min, 共10个循环; (3)93 ℃ 30 s, 55 ℃ 45 s, 共30个循环; (4)40 ℃ 20 s. 根据标准曲线计算出各样品HBV DNA的值.
1.2.5 血清HBsAg的检测: 利用酶联免疫吸附试验检测血清HBsAg, 具体操作方法严格按照试剂盒说明书执行, 实验完成后用酶标仪采用450 nm波长读取各孔OD值.
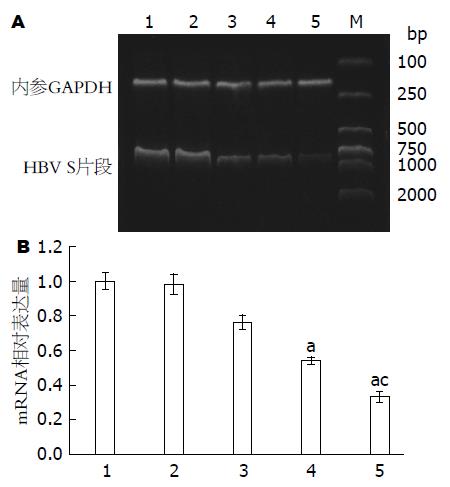
1.2.6 肝脏HBV S基因mRNA的检测: 取给药后第7天小鼠肝脏到RNA保存液保存. 无酶EP管中加入1 mL TRIzol和绿豆大小肝脏迅速匀浆, 室温静置5 min, 4 ℃ 12000 r/min离心10 min, 取上清, 加氯仿并剧烈振荡, 离心后取水相(约500 μL)转移到新的离心管中, 加入等体积异丙醇混匀. 再离心去上清, 加入75%乙醇洗涤沉淀, 最后加入50 μL RNase-Free ddH2O, 充分溶解RNA. 去除RNA提取液中DNA, 然后置于冰上进行反录转, 得到的cDNA放置于冰上. 在PCR扩增体系中加入2×Taq PCR MasterMix 12.5 μL、cDNA 1 μL、针对HBV S区设计的上游引物为5'-CTGCCTCTCCCTTATCGTCA-3', 下游引物为5'-TGGCAAGGACCCATAACTTC-3'各1 μL, 加ddH2O补至25 μL体系. PCR扩增条件为: (1)94 ℃ 3 min; (2)94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min, 共30循环; (3)72 ℃ 5 min, PCR产物长度为830 bp左右. 利用软件计算扩增产物电泳条带与内参GAPDH条带相对强度的比值, 以确定HBV S基因的mRNA在各治疗组中的抑制程度.
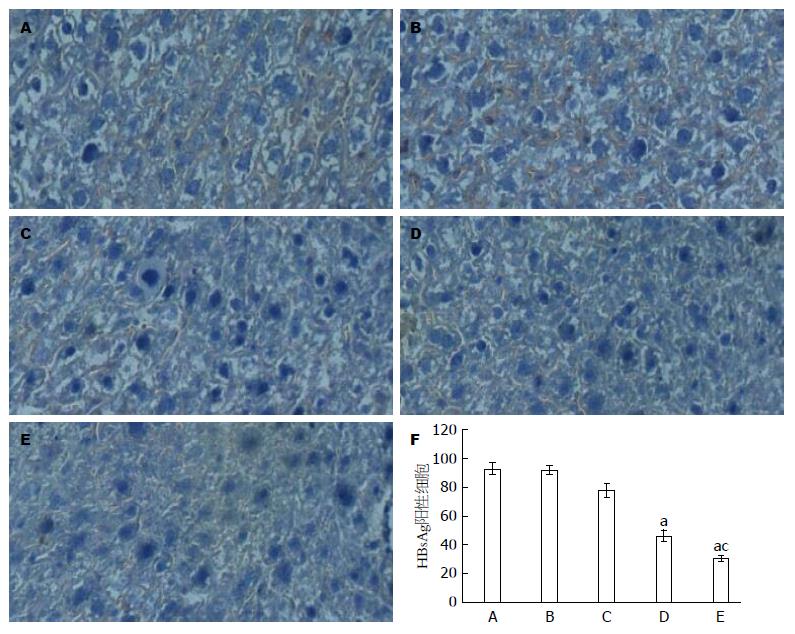
1.2.7 免疫组织化学技术检测小鼠肝脏组织中的HBsAg含量: 于给药后的第7天处死小鼠并取肝脏于4%多聚甲醛溶液固定24 h, 再进一步脱水、石蜡包埋、切片, 采用二步免疫组织化学法操作, 并进行DAB染色, 苏木素复染, 具体按试剂盒说明书操作. 正置荧光显微镜下观察肝组织中HBsAg的着色情况, 以判断反基因LNA对肝细胞内HBsAg的抑制作用.
1.2.8 全自动生化分析仪检测小鼠血清肝、肾等脏器功能: 全自动生化分析仪严格按照SOP文件进行操作, 分析项目每日均做高、中、低值质量控制, 确保在控后方可检测小鼠血清中白蛋白(albnmin, Alb)、谷丙转氨酶(alanine transaminase, ALT)、尿素氮(blood urea nitrogen, BUN)、肌酐(creatinine, Cr)等肝肾功能指标, 以判断脂质体-LNA混合物对小鼠脏器功能的损伤作用.
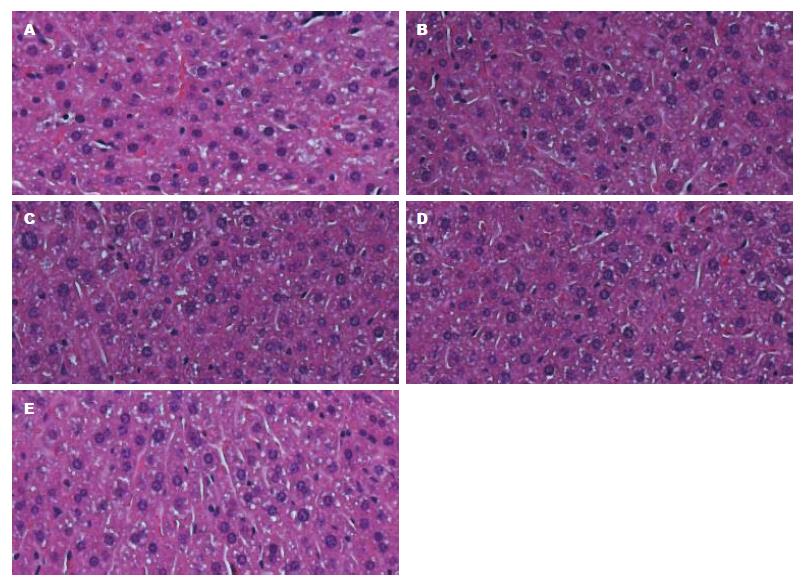
1.2.9 HE染色技术观察小鼠肝、肾等脏器组织细胞结构变化: 小鼠肝、肾组织经石蜡包埋、切片后, 经苏木素、伊红染色, 电子显微镜下观察小鼠各脏器组织、细胞结构的改变情况, 以判断脂质体-LNA混合物对小鼠脏器细胞的损伤作用.
统计学处理 采用SPSS23.0统计学软件分析, 组间比较采用单因素方差分析, 数据用mean±SD表示, 并计算抑制率[(N注射前-N注射后)/N注射前×100%]. P<0.05为差异具有统计学意义.
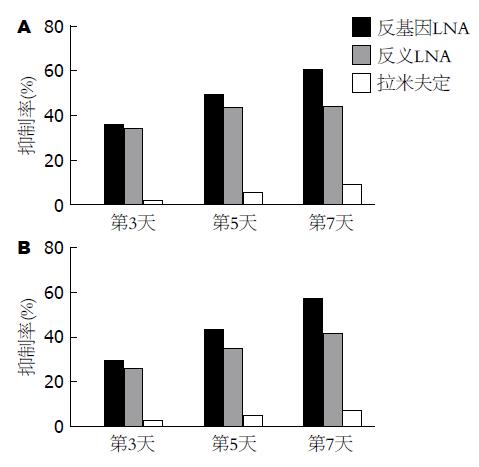
给药后, 反基因LNA对HBV DNA复制的抑制作用比较明显, 第3、5、7天的平均抑制率分别为37.18%、50.27%和61.46%, 与给药前比较有统计学意义(P<0.05); 与空白对照组、无关序列组、拉米夫定组、反义锁核酸组比较, 差异均有统计学意义(P<0.05)(图1A, 表1).
| 分组 | 给药前 | 给药后 | |||
| 第1天 | 第3天 | 第5天 | 第7天 | ||
| Control | 10.21±1.05 | 10.00±0.98 | 10.26±0.85 | 10.16±0.89 | 10.17±1.05 |
| USQ | 11.05±0.79 | 10.85±0.99 | 11.00±0.80 | 11.02±0.79 | 11.05±0.79 |
| LAM | 10.80±1.41 | 10.73±1.42 | 10.42±1.50 | 10.07±1.37 | 9.71±1.27 |
| Anti-S-LNA | 10.62±1.11 | 8.84±0.88 | 6.87±1.16 | 5.88±0.87 | 5.81±0.84 |
| Anti-G-LNA | 11.08±1.45 | 9.25±0.93 | 6.96±1.10ac | 5.51±1.01ac | 4.27±1.23ace |
给药后, 反基因LNA对HBsAg表达的抑制作用较明显, 第3、5、7天的平均抑制率分别为30.17%、44.00%和57.76%, 与给药前比较有统计学意义(P<0.05); 与空白对照组、无关序列组、拉米夫定组、反义LNA组比较, 差异均有统计学意义(P<0.05)(图1B, 表2).
HBV S基因mRNA反转录成cDNA扩增条带如图2所示, 与对照组对比, 反义LNA与反基因LNA均能抑制HBV S基因mRNA的表达(P<0.01), 但反基因LNA的抑制力更强(P<0.05, 图2).
免疫组织化学检测结果显示, 反基因LNA组肝组织切片中HBV HBsAg阳性细胞率(31%±6%)明显少于拉米夫定组(78%±5%)及反义LNA组(47%±8%)(P<0.05, 图3).
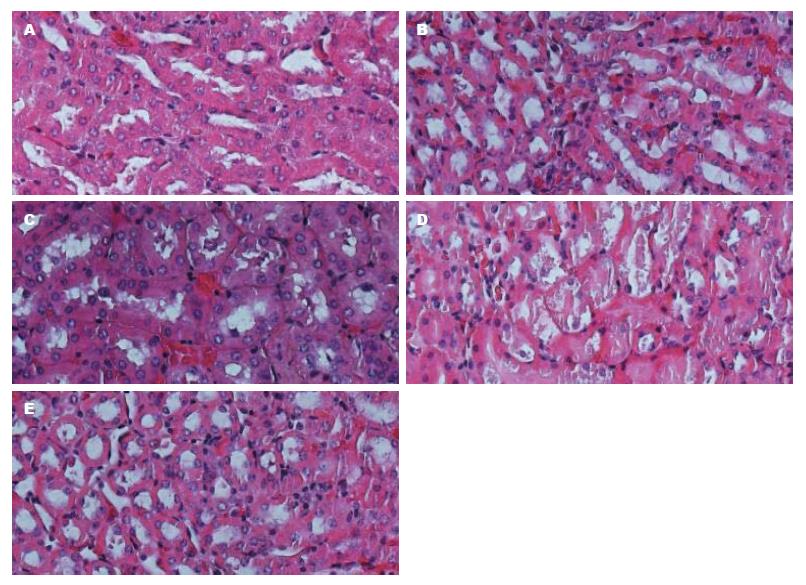
HE切片染色观察各组小鼠肝脏(图4)、肾(图5)组织结构无明显改变, 检测反基因LNA组血清Alb、ALT、BUN、Cr分别为32.2±2.6、103.0±6.7、5.06±0.47、13.0±1.1, 与对照组相比, 差异无统计学意义(P>0.05), 说明反基因LNA对小鼠的肝肾功能及其组织结构均无明显影响.
HBV在病毒分类上属嗜肝DNA病毒科, 是一种小的有包膜的病毒. 目前, HBV可被分为A-J共10种基因型[20,21], 每种基因型又可进一步分为若干个基因亚型. 流行于我国的HBV基因型主要为B和C基因型[22,23], 其中, B型又以B2亚型为主, 主要流行于广西、广东、海南等南方地区; C型主要有C1和C2两种亚型, 主要流行于我国北方地区. 尽管HBV基因型不同, 但基因组结构基本相似, 都是一个由约3.2 kb碱基对组成的相对松驰不完全双链DNA环状分子, 共有4个开放读码区(open reading frame, ORF), 即S区、C区、P区和X区, 其中, S区和C区的序列在各型HBV间是十分保守的, 是HBV的保守区, 也是基因治疗的理想靶位[24,25]. S区包括前S1基因、前S2基因和S基因, 有各自的起始密码ATG, 分别起始于第2848位、3172位和155位核苷酸, 共同终止于第833位核苷酸, 由前S1、前S2和S基因编码的外膜蛋白称为大蛋白, 前S2和S基因编码的外膜蛋白为中蛋白, 由S基因编码的外膜蛋白称为小蛋白, 3种外膜蛋白共同构成HBsAg. C区包括前C和C基因, 两者有各自的起始密码ATG, 分别位于第1814和1901位核苷酸, 共同终止于第2450位核苷酸, 由前C和C基因编码HBeAg, 分泌至细胞外, C基因编码HBcAg, 可自行装配成HBV的核心颗粒. 由此可见, S区和C区编码的蛋白不仅与病毒装配和分泌过程有关, 还与诱导宿主机体免疫应答反应有关[26-28]. 目前认为, 病毒性肝炎发展的"启动或控制点"受病毒和宿主两方面因素影响, 病毒的活性及宿主机体免疫状态变化等均可诱发重症肝炎的发生、发展[29,30]. 一方面, 病毒复制活性增强, 引起病毒抗原(如HBsAg、HBeAg、HBcAg等)表达量增高, 病毒装配、成熟和分泌过程加快, 引起肝细胞弥漫性感染; 另一方面, 病毒抗原诱导宿主特异性细胞免疫应答反应, 导致肝炎病情加重. 由此推测, 抑制病毒保守区S和C区的基因表达, 有可能降低病毒抗原的合成, 进而影响病毒装配、成熟和分泌过程, 最终可能抑制病毒的复制.
本研究针对HBV S基因同聚嘌呤区设计合成反基因LNA分子, 由阳离子脂质体介导转染HBV转基因小鼠, 通过检测血清中的HBV DNA和HBsAg含量等指标来评价其疗效. 结果显示, 给药后第7天HBV DNA、HBsAg抑制率分别达到61.46%和57.76%, 且抑制作用随时间呈递增趋势, 明显高于无关序列组和拉米夫定组, 与反义LNA组(47.83%、42.48%)相比也有较显著差异. 对HBV S基因mRNA、肝组织切片中HBsAg阳性细胞均有明显的抑制作用. 总的来说, 针对HBV S基因同聚嘌呤区设计合成反基因LNA分子在复制、转录和翻译水平上均对HBV有显著的抑制作用, 提示LNA分子能有效通过核孔进入细胞核内, 识别并结合到HBV S基因的同聚嘌呤区形成三链杂交分子, 从而"封闭"病毒基因的转录和表达, 其作用机制有待进一步研究. 与反义治疗相比, 反基因治疗具有从源头阻断病毒基因复制与转录的优势, 有望在肝细胞核内直接干预病毒DNA的复制与转录, 解决反义治疗出现的停药"反弹"问题.
此外, 对反基因LNA治疗后小鼠的肝、肾切片做HE染色, 检测血清肝肾功能指标, 与对照组相比未发生病理改变, 说明反基因LNA对小鼠的肝、肾功能及其组织结构均无明显影响.
总之, 针对S基因同聚嘌呤区的反基因LNA分子, 体内能有效抑制HBV的复制, 既为HBV治疗提供有效靶位, 也为反基因治疗提供理论和实验依据.
感谢邹佳俊老师、右江民族医学院检验中心老师给予的大力帮助.
目前, 世界上乙型肝炎病毒(hepatitis B virus, HBV)携带者约有3.5亿, 而我国约1.3亿, 严重威胁人类健康. 临床上治疗慢性乙型肝炎仍然缺乏特效药物, 长期使用会出现HBV的耐药现象, 无法达到治疗目的, 因此需探索一种更有效的策略治疗HBV引起的乙型肝炎.
锁核酸是一种化学结构较特殊的双环状核苷酸衍生物, 具有提高与杂交双链的亲和性和热稳定性、增强抵抗核酸酶降解能力、无毒等优点而被应用于基因治疗.
本课题组利用反义锁核酸(locked nucleic acid, LNA)在HBV治疗中做了大量的研究, 结果显示反义LNA能有效抑制HBV的复制和表达. 前期反基因LNA体外试验研究, 结果也表明反基因LNA能有效抑制HBV的复制与表达.
本研究用脂质体包裹LNA分子导入针对dsDNA的反基因寡核苷酸分子结构内, 通过增强外源寡核酸分子的稳定性以及寻找有效抑制HBV复制的反基因治疗靶位, 为HBV反基因治疗研究提供理论与实验依据.
本研究针对HBV S基因同聚嘌呤区设计合成反基因LNA分子, 在复制、转录和翻译水平上均对HBV有显著的抑制作用, 有望在肝细胞核内直接干预病毒DNA的复制与转录, 解决反义治疗出现的停药"反弹"问题.
反基因治疗(anti-gene therapy): 由特定寡聚脱氧核苷酸与靶dsDNA同聚嘧啶或同聚嘌呤区专一性结合形成局部三螺旋结构, 阻止靶DNA与聚合酶、转录因子等蛋白结合, 从而实现抑制靶基因复制与表达的目的. 为了跟mRNA单链分子为作用靶位的反义核酸技术相区别, 故称之为反基因技术(或疗法).
黄维亮, 主任检验师, 长沙市第一医院检验科; 汤正好, 上海交通大学附属第六人民医院感染病科; 赵秀英, 副教授, 清华大学北京清华长庚医院检验医学科
本文有较好的创新性与科学性, 课题新颖, 利用反基因锁核酸干扰目的基因的转录与复制, 从而抑制其复制与表达, 利用小鼠进行一系列的实验和验证, 科学严谨, 令人信服.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Okada M, Enomoto M, Kawada N, Nguyen MH. Effects of antiviral therapy in patients with chronic hepatitis B and cirrhosis. Expert Rev Gastroenterol Hepatol. 2017; Aug 7. [Epub ahead of print]. [PubMed] [DOI] |
| 2. | Yu Y, Ai J, Zhang W. Current clinical evidence for nucleos(t)ide analogues in patients with HBV-related hepatocellular carcinoma. Expert Rev Gastroenterol Hepatol. 2017;11:925-937. [PubMed] [DOI] |
| 3. | Lin CL, Yang HC, Kao JH. Hepatitis B virus: new therapeutic perspectives. Liver Int. 2016;36 Suppl 1:85-92. [PubMed] [DOI] |
| 4. | Soriano V, Barreiro P, Benitez L, Peña JM, de Mendoza C. New antivirals for the treatment of chronic hepatitis B. Expert Opin Investig Drugs. 2017;26:843-851. [PubMed] [DOI] |
| 5. | Saito K, Shimada N, Maruyama A. Cooperative enhancement of deoxyribozyme activity by chemical modification and added cationic copolymer. Sci Technol Adv Mater. 2016;17:437-442. [PubMed] [DOI] |
| 6. | Hara T, Kodama T, Takegaki Y, Morihiro K, Ito KR, Obika S. Synthesis and Properties of 7-Deazapurine- and 8-Aza-7-deazapurine-Locked Nucleic Acid Analogues: Effect of the Glycosidic Torsion Angle. J Org Chem. 2017;82:25-36. [PubMed] [DOI] |
| 7. | Nahar S, Singh A, Morihiro K, Moai Y, Kodama T, Obika S, Maiti S. Systematic Evaluation of Biophysical and Functional Characteristics of Selenomethylene-Locked Nucleic Acid-Mediated Inhibition of miR-21. Biochemistry. 2016;55:7023-7032. [PubMed] [DOI] |
| 8. | Xu Y, Villa A, Nilsson L. The free energy of locking a ring: Changing a deoxyribonucleoside to a locked nucleic acid. J Comput Chem. 2017;38:1147-1157. [PubMed] [DOI] |
| 9. | Li M, Hongyan C, Huaxing Z, Wei L, Daru L. Locked nucleic acid couples with Fok I nucleases to target and cleave hepatitis B virus's gene in vitro. Yi Chuan. 2016;38:350-359. [PubMed] [DOI] |
| 10. | Guérard M, Andreas Z, Erich K, Christine M, Martina MB, Christian W, Franz S, Thomas S, Yann T. Locked nucleic acid (LNA): Based single-stranded oligonucleotides are not genotoxic. Environ Mol Mutagen. 2017;58:112-121. [PubMed] [DOI] |
| 11. | Pabon-Martinez YV, Xu Y, Villa A, Lundin KE, Geny S, Nguyen CH, Pedersen EB, Jørgensen PT, Wengel J, Nilsson L. LNA effects on DNA binding and conformation: from single strand to duplex and triplex structures. Sci Rep. 2017;7:11043. [PubMed] [DOI] |
| 12. | Deng YB, Qin HJ, Luo YH, Liang ZR, Zou JJ. Antiviral effect of hepatitis B virus S/C gene loci antisense locked nucleic acid on transgenic mice in vivo. Genet Mol Res. 2015;14:10087-10095. [PubMed] [DOI] |
| 17. | Deng YB, Qin HJ, Luo YH, Liang ZR, Zou JJ. Blocking the expression of the hepatitis B virus S gene in hepatocellular carcinoma cell lines with an anti-gene locked nucleic acid in vitro. Genet Mol Res. 2015;14:5445-5451. [PubMed] [DOI] |
| 20. | Yu H, Yuan Q, Ge SX, Wang HY, Zhang YL, Chen QR, Zhang J, Chen PJ, Xia NS. Molecular and phylogenetic analyses suggest an additional hepatitis B virus genotype "I". PLoS One. 2010;5:e9297. [PubMed] [DOI] |
| 21. | Tatematsu K, Tanaka Y, Kurbanov F, Sugauchi F, Mano S, Maeshiro T, Nakayoshi T, Wakuta M, Miyakawa Y, Mizokami M. A genetic variant of hepatitis B virus divergent from known human and ape genotypes isolated from a Japanese patient and provisionally assigned to new genotype J. J Virol. 2009;83:10538-10547. [PubMed] [DOI] |
| 23. | Li S, Wang Z, Li Y, Ding G. Adaptive evolution of proteins in hepatitis B virus during divergence of genotypes. Sci Rep. 2017;7:1990. [PubMed] [DOI] |
| 24. | Zong L, Qin Y, Jia H, Ye L, Wang Y, Zhang J, Wands JR, Tong S, Li J. Differential regulation of hepatitis B virus core protein expression and genome replication by a small upstream open reading frame and naturally occurring mutations in the precore region. Virology. 2017;505:155-161. [PubMed] [DOI] |
| 25. | Scaglioni PP, Melegari M, Wands JR. Biologic properties of hepatitis B viral genomes with mutations in the precore promoter and precore open reading frame. Virology. 1997;233:374-381. [PubMed] [DOI] |
| 26. | Boeijen LL, Hoogeveen RC, Boonstra A, Lauer GM. Hepatitis B virus infection and the immune response: The big questions. Best Pract Res Clin Gastroenterol. 2017;31:265-272. [PubMed] [DOI] |
| 27. | Peters MG, Locarnini S. New Direct-Acting Antiviral Agents and Immunomodulators for Hepatitis B Virus Infection. Gastroenterol Hepatol (N Y). 2017;13:348-356. [PubMed] |
| 28. | Mormile MDR. Hepatitis B vaccine non response: A predictor of latent autoimmunity? Med Hypotheses. 2017;104:45-47. [PubMed] [DOI] |
| 29. | Morikawa K, Shimazaki T, Takeda R, Izumi T, Umumura M, Sakamoto N. Hepatitis B: progress in understanding chronicity, the innate immune response, and cccDNA protection. Ann Transl Med. 2016;4:337. [PubMed] [DOI] |
| 30. | Malecki M, Putzer E, Quach C, Dodivenaka C, Tombokan X. Novel paradigm for immunotherapy of ovarian cancer by engaging prophylactic immunity against hepatitis B virus. Clin Transl Med. 2016;5:44. [PubMed] [DOI] |