修回日期: 2017-07-26
接受日期: 2017-08-01
在线出版日期: 2017-10-08
慢性胰腺炎(chronic pancreatitis, CP)是各种病因引起胰腺组织和功能不可逆改变的慢性炎症性疾病. 基本病理特征包括胰腺实质慢性炎症损害和间质纤维化、胰腺实质钙化、胰管扩张及胰管结石等. 胰腺纤维化的形成是一个以胰腺星状细胞(pancreatic stellate cells, PSCs)为中心由复杂的信号网络通路所介导, 多种细胞因子与炎症介质参与, 最终以成纤维细胞增生和细胞外基质沉积为特征的复杂的病理发展过程, 但尚无一个较为统一的学说来解释胰腺炎的发病机制. PSCs活化是CP纤维化发生的关键步骤, 因此, PSCs所在微环境的调控在纤维化过程中的作用成为研究热点. 研究纤维化相关的信号因子和通路, 并试图通过这些分子和通路来抑制或者逆转PSCs的激活, 以达到阻止或延缓纤维化进程的目的. 许多新的治疗药物已被尝试用于CP, 但大多数仍处于实验阶段. 作用于PSCs的疗法最有希望在不久的将来转化为临床使患者获益.
核心提要: 胰腺其他类型细胞及基质与胰腺星状细胞(pancreatic stellate cells, PSCs)之间存在相互作用, 共同构成了PSCs所处的微环境, 神经递质、脑肠肽及细胞因子等作为微环境中的信使物质, 是决定PSCs是否激活的关键所在. 纤维化相关的信号因子和信号通路参与PSCs的激活过程, 通过调控这些分子和通路来改变PSCs所在微环境以抑制或者逆转PSCs的激活从而达到阻止或延缓纤维化进程的目的. 作用于PSCs的疗法最有希望在不久的将来转化到临床使患者获益.
引文著录: 向晓辉, 夏时海. 胰腺星状细胞微环境与慢性胰腺炎. 世界华人消化杂志 2017; 25(28): 2518-2527
Revised: July 26, 2017
Accepted: August 1, 2017
Published online: October 8, 2017
Chronic pancreatitis (CP) is a chronic inflammatory disease that is caused by various factors and has irreversible changes in pancreatic tissue and function. The basic pathological features of CP include chronic inflammatory lesions and interstitial fibrosis of the pancreas, calcification of the pancreatic parenchyma, dilatation of the pancreatic duct, and stones in the pancreatic duct. Pancreatic stellate cells (PSCs) play a central role in pancreatic fibrosis that is mediated by a complex signal pathway network including a variety of cytokines and inflammatory mediators. This complex pathological process is characterized by the proliferation of fibroblasts and extracellular matrix deposition. There is no unified theory to explain the pathogenesis of pancreatitis. Since PSC activation is a key step of fibrosis in CP, the study on the microenvironment of PSCs in the regulation of fibrosis process has become a hot topic. Studies on inhibition or reversion of PSC activation have been carried out to prevent or delay the progression of fibrosis through different molecules and pathways. Many new therapies have been tried for CP, most of which are still in the experimental stage. Therapies targeting PSCs are most promising to benefit patients in the near future.
- Citation: Xiang XH, Xia SH. Microenvironment of pancreatic stellate cells in chronic pancreatitis. Shijie Huaren Xiaohua Zazhi 2017; 25(28): 2518-2527
- URL: https://www.wjgnet.com/1009-3079/full/v25/i28/2518.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i28.2518
慢性胰腺炎(chronic pancreatitis, CP)是各种病因引起胰腺组织和功能不可逆改变的慢性炎症性疾病. 基本病理特征包括胰腺实质慢性炎症损害和间质纤维化、胰腺实质钙化、胰管扩张及胰管结石等. 临床主要表现为反复发作的上腹部疼痛和胰腺内、外分泌功能不全[1,2]. CP病程迁延, 临床表现多样, 严重影响患者的日常生活, 且有报道[3]认为CP是胰腺癌的危险因素之一. 研究[4]证实, 在胰腺纤维化过程中, 胰腺星状细胞(pancreatic stellate cells, PSCs)的活化发挥着关键作用. 胰腺纤维化的形成是一个以PSCs活化为中心由复杂的信号网络通路所介导, 多种细胞因子与炎症介质参与, 最终以成纤维细胞增生和细胞外基质(extracellular matrix, ECM)沉积为特征的复杂的病理发展过程[5]. PSCs活化是CP纤维化发生的关键步骤, 因此研究PSCs所在微环境的调控在纤维化过程中的作用, 为治疗慢性胰腺纤维化提供重要理论参考.
PSCs约占组成正常胰腺实质细胞的4%-7%, 在正常的胰腺中分布于胰腺腺泡周围[5]. 静止期的PSCs形态呈星形或梭形, 胞质内存在大量富含维生素A的脂滴. PSCs在正常的胰腺组织中呈静止状态, 可以通过细胞骨架蛋白如胶质原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)、波形蛋白等标记进行辨认, 但α-平滑肌肌动蛋白(alpha-smooth muscle actin, α-SMA)染色阴性. 静息状态的PSCs代谢及功能不活跃, 尚不具备促纤维化作用. 在炎症反应和氧化应激等因素作用下胰腺组织受损及PSCs活化, 具体表现为其细胞形态及功能发生变化. 具体的活化表现如下: (1)细胞体积增大, 代谢及增殖活跃, 细胞内脂滴消失; (2)细胞形态转变为肌成纤维母细胞样表型, 表现为α-SMA阳性, 可表达结蛋白; (3)具备产生多种ECM包括Ⅰ型、Ⅲ型胶原蛋白, 纤维连接蛋白及层黏连蛋白等的能力; (4)PSCs在体外培养时可发生自发活化, 且活化的PSCs具有细胞迁移能力[6]. 正常组织中的PSCs通过调节ECM相关的酶类在胰腺ECM代谢平衡中发挥重要作用. 激活的PSCs同时具有收缩的微丝样结构, 可迁移至组织损伤区并分泌ECM促进胰腺组织修复. 当刺激因子持续存在, ECM的合成超过其降解, 发生胰腺纤维化[6]. 尽管PSCs主要与胰腺外分泌相关, 但最近的一项研究[7,8]报道, PSCs也存在于人和大鼠胰岛中. 胰岛PSCs表现出与传统的PSCs在形态和功能上的差异, 脂滴较少, 增殖率低, 更容易迁移和活化.
细胞培养是研究PSCs的重要手段, 原代大鼠PSCs的成功培养最早见于国外学者Apte、Bachem等的报道. Apte等[9]采用密度梯度离心法成功分离和培养了PSCs, 并与肝星状细胞进行标志物包括结蛋白、GFAP和α-SMA的染色比较, 并用结蛋白作为标记物估计出PSCs占比所有胰腺细胞的4%左右. Bachem等[10]采用组织块法分别分离了人(CP患者的病理组织)和1年生Wistar大鼠的PSCs细胞, 该方法简单易行, 便于操作. 但如想获得足够多的大鼠PSCs需要进行诱导活化, 否则细胞无法移行到组织块外, 所以组织块法获得的PSCs处于活化状态[6]. 组织块法获得的PSCs数量相对较少, 其培养的细胞多为成纤维细胞和活化的PSCs混合体, PSCs的纯化问题没有得到很好的解决. 如需获取大量的大鼠PSCs仍然需要采用密度梯度离心法分离[11]. 贾一韬等[12]对密度梯度离心法分离大鼠PSCs加以改进, 先行胰胆管逆行注射消化酶, 取胰腺组织后再向胰腺实质内注射消化酶, 消化过程采用胶原酶和链霉蛋白酶E联合消化以获得胰腺非实质细胞, 所分离的PSCs的产率、活力及纯度均高于前人报道. Zhao等[11]报告应用导管内灌注胰酶的技术改进PSCs的分离方法, 提高腺体消化程度和细胞产率. 唐元瑜等[13]采用组织块法结合酶消化法进行培养, 在无菌条件下取小鼠正常胰腺组织, 经过剪碎、胰蛋白酶消化后植入培养瓶中贴壁培养, 并予限制性条件培养基进行纯化, 成功分离培养了小鼠PSCs, 具有操作简单, 重复性好, 成功率高的特点. 新分离的PSCs在培养48 h后细胞表型逐渐转化, α-SMA表达逐渐增加, 开始发生迁移[14]. 鉴于分离培养原代PSCs在时间、工作量及细胞活力的限制, 研究者们[11,15,16]尝试进行PSCs的永生化. 但永生化细胞系会出现倍增速度快等问题使得其生理特性可能会有别于原代PSCs, 故一些学者[5]建议在永生化细胞上进行的研究应在原代PSCs上进行结果验证. Bläuer等[17]建立了PSCs间与腺泡细胞间相互作用研究的长期共培养技术, 为研究细胞间通讯提供了便利. 了解PSCs的分离及培养细节将有助于研究者选择合适的细胞模型进行相应研究. 共培养技术的研究策略比单独培养单一细胞更为接近PSCs的在体微环境, 可能会成为今后研究的一个方向.
目前解释胰腺炎发病机制的理论有: 肠道细菌易位学说、氧化应激学说、炎症介质学说、细胞凋亡学说、胰腺腺泡内钙超载学说、自身消化学说等[18]. 肠道细菌易位学说[19]认为: 正常情况下肠道内的常驻细菌由于受到肠黏膜屏障的阻隔而难以移位到肠外组织, 但在细菌过度生长、黏膜屏障破坏及免疫应答受损的情况下可经血循环、淋巴系统、直接进入腹腔、逆行感染等途径发生易位. 易位感染的细菌引起血循环中细胞因子高峰, 共同作用的结果就是引发多脏器损伤, 最终导致多器官功能障碍综合征. 氧化应激学说[20-22]认为: 胰腺自身消化可诱导氧自由基释放, 而氧自由基对腺泡细胞器的损伤亦与腺泡"自身消化"直接有关. 氧化程度超出氧化物的清除, 氧化系统和抗氧化系统失衡, 从而导致组织损伤和胰酶激活, 还可以促使白细胞的黏附, 引起胰腺的微循环紊乱, 导致急性胰腺炎时胰腺损伤的恶性循环[23]. 炎性介质学说[24]认为: 各种原因诱发产生大量促炎因子如肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、白介素(interleukin, IL)-1β、IL-6、IL-8等, 进而激活胰腺内及血管、肺、肝、肾的单核-巨噬细胞系统, 使粒细胞与内皮细胞黏附, 吞噬细胞的功能激活, 释放活性自由基, 以及蛋白酶和水解酶, 还能引起炎性介质的大量释放, 即"瀑布样效应". 这些炎症介质可以使胰腺及其他组织器官血管通透性增高和微循环障碍, 导致胰腺在自身消化的基础上进一步发生炎症、坏死. 细胞凋亡学说[25]认为: 急性胰腺炎的严重程度与胰腺腺泡细胞坏死、凋亡的严重程度及两者的平衡程度密切相关, 凋亡与胰腺炎的严重程度呈负相关. 胰腺腺泡内钙超载学说[26]认为: 胰腺腺泡细胞内钙超载在对胰腺炎的发生发展中起重要作用. 用不同方法诱导的胰腺炎早期均有胰腺腺泡的钙超载, 随后发生胰腺的出血、坏死和腺泡超微结构的损害. 在胰腺纤维化过程中, 离子通道和细胞内钙信号共同参与PSCs与ECM的相互作用[27]. 自身消化学说[28]认为: 任何原因造成酶原被提前激活都是发生胰腺炎的始动因素. 酶原被提前激活所导致自身消化可能是急性重症胰腺炎的终末阶段.
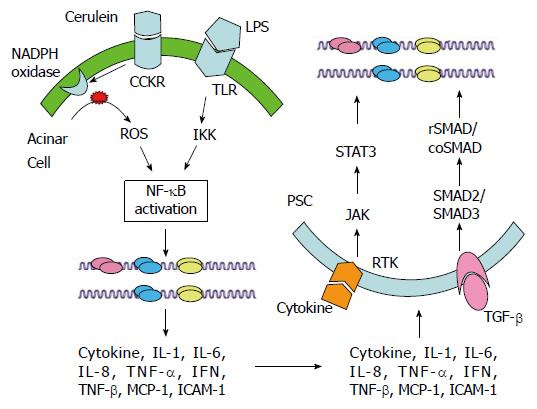
这些学说从某一侧面阐明胰腺炎的发病, 但仍无一个较为统一的学说来解释胰腺炎的发病机制[29]. 多因素整合假说的提出能够较好解释胰腺炎发病机制. 多因素整合假说认为肠道细菌易位和氧化应激可能是胰腺炎发病的主要始动因素, 炎症介质学说、细胞凋亡学说、胰腺腺泡内钙超载学说和自身消化学说所阐述的机制可能是对胰腺炎发病中间环节或终末环节的描述[30]. 可见, 急性胰腺炎的发病机制是CP发病机制的基础, 且二者也存在共通之处. 细菌易位激活天然免疫系统[如Toll样受体(Toll-like receptor, TLR)]所产生的信号分子以及氧化应激(如NADPH氧化酶系统)产生的活性氧可激活其下游的信号分子[如核因子-κB(nuclear factor-κB, NF-κB)], 使得细胞因子和炎性介质得以表达, 细胞因子和炎性介质通过旁分泌或自分泌作用于PSCs相应受体, 通过激活相应的信号通路(如JAK-STAT、Smad通路)激活细胞因子和炎性介质的表达, 这可能是进一步形成正反馈机制基础[31], 如图1所示. 胰腺炎的发病可能存在一个临界值, 如果炎性介质和细胞因子的表达超过某一临界值, 正反馈正式形成, 则发展成为急性胰腺炎. 如果炎性介质和细胞因子的表达没有达到这一临界值, 炎症瀑布未爆发, 但长期的炎性刺激仍然存在, 则可能发展成为CP, 导致胰腺的纤维化. 关于CP的发生和发展过程中, 胰腺纤维化所引起的胰腺结构改变, 如胰腺导管的狭窄及PSCs激活后的肌纤维样运动又是导致胰腺炎急性发作的诱因[18]. 因此, 我们认为"胰腺纤维化"与"胰腺炎症的反复发作"相互Ð同, 从而促进CP的进展, 这一观点也得到相关文献[32]的支持. 特别是在细胞模型炎性研究中, 较难分清楚所用模型是用于解释急性胰腺炎还是CP, 在多因素整合假说的框架下理解胰腺细胞炎性模型有助于解决这一难题.
胰腺是体内具有内外分泌功能的重要器官, 胰腺的细胞学研究提示胰腺组织主要是由腺泡细胞、胰岛细胞、胰腺星状细胞、导管细胞、血管内皮细胞及平滑肌细胞等组成[13]. 越来越多的证据[33]表明, PSCs与其他细胞类型之间的多重相互作用, 包括与胰腺腺泡细胞、胰岛细胞、内皮细胞、炎症细胞、肿瘤细胞、肿瘤干细胞之间的相互作用, 但与导管细胞PSCs的相互作用尚未完全阐明.
影响PSCs活化的因素有多种, 包括细胞因子、乙醇及其代谢产物乙醛、氧化应激、激活素等. 当胰腺受损时, 巨噬细胞、腺泡细胞及血小板被激活, 分别分泌转化生长因子β(transforming growth factor-β, TGF-β)、TNF-α、IL-1/6、血小板源性生长因子(platelet-derived growth factor, PDGF)等因子激活PSCs. PSCs被各种理化因素激活后, 可由细胞旁分泌和自分泌刺激并通过转录事件启动瀑布样细胞连锁反应效应, 进而通过旁分泌、自分泌的细胞因子介导ECM重塑并使PSCs维持活化表型, 具有纤维生成能力. 急性胰腺炎时受损的腺泡细胞释放缓激肽, PSCs表达缓激肽二型受体, 体外实验[34]证实缓激肽通过增加PSCs内钙释放, 导致细胞的活化. 虽然腺泡细胞不表达缓激肽受体, 但缓激肽受体阻滞剂降低乙醇等诱导腺泡坏死程度, 推测缓激肽激活PSCs反过来可导致腺泡损伤. Jakubowska等[35]的研究指出PSC诱导急性胰腺炎腺泡细胞坏死的可能介质是由Ca2+介导的PSCs所产生的一氧化氮, 抑制一氧化氮的产生既可保护PSCs, 也可避免胰腺腺泡细胞的坏死. PSCs表面表达胆囊收缩素受体, 接受胆囊收缩素刺激后释放乙酰胆碱调节胰腺外分泌[33]. 巨噬细胞按照其表型和分泌的细胞因子可以分为2种极化类型, 即经典活化的M1型和选择性活化M2型巨噬细胞(type M2 macrophage, M2). M1型巨噬细胞发挥促炎症作用, 主要在急性胰腺炎时活化. 而M2参与修复过程[36]. 研究表明M2在CP中占主导地位, 限制炎症反应, 刺激PSCs合成胶原和纤维连接蛋白. 最近研究[37]表明, PSCs产生Th2型细胞因子, 使CP中巨噬细胞向M2型转化, 还可通过IL-4/IL-13信号通路募集M2. 反过来, M2产生TGF-β、PDGFβ刺激PSCs产生纤维化[38]. 在CP胰腺中的肥大细胞发生脱颗粒反应, 释放化学介质引发PSCs活化进而导致胰腺纤维化[39]. 因此, PSCs所在微环境的调控在纤维化过程中的作用成为研究热点, PSCs与其他细胞类型间的相互作用是今后研究的重点.
胰腺是集内外分泌部于一体的器官, 传统教科书一直把胰腺内外分泌两部分在形态、机能和病理上分别加以描述. 研究[40]表明, 胰腺微循环功能和结构的基本单位是胰腺小叶, 胰腺内外分泌部之间在微循环上是统一的整体, 构成胰岛-腺泡门脉循环. 胰腺微循环从微动脉到微静脉之间的血液循环经过了内分泌和外分泌两个部分, 血液流向是从内分泌到外分泌部. 血液从小叶内动脉到小叶内静脉, 经过了2级(胰岛毛细血管球-出岛门脉-腺泡毛细血管网)或3级(胰岛毛细血管球-出岛门脉-胰岛毛细血管球-出岛门脉-腺泡毛细血管网)毛细血管网. 糖尿病患者及实验动物的胰腺外分泌部纤维化、萎缩、脂肪浸润及导管上皮形成空泡. 胰岛内分泌激素能显著地增强促胰液素和胆囊收缩素的效应, 从而使腺泡的分泌增加. 胰岛毛细血管间隙神经末梢所释放的神经内分泌物质可引起胰导管系统对碳酸氢盐的分泌[41]. 可见, 胰腺内外分泌部之间存在着机能与病理上的联系, 内分泌部分泌的激素通过门脉系统直接作用于外分泌部, PSCs多分布于胰腺血管和胰腺导管周围, 较高浓度的激素作用于PSCs, 进而发挥调节胰腺血管及导管流量等功能, PSCs还被证明分泌乙酰胆碱可能充当中间调节胆囊收缩素介导胰腺外分泌[42]. 这一特殊的微循环结构在研究内、外分泌功能联系方面值得引起重视.
细胞间相互作用的重要途径是通过细胞因子和炎性介质进行的. 一般来说, 在CP的发病机制中PSCs被认为是细胞因子发挥效应的靶细胞. 胰腺纤维化通常与胰腺损伤及慢性炎性反应有关. 在胰腺纤维化发展过程中, 受到损伤的胰腺实质细胞和炎性细胞等均可释放多种细胞因子, 并通过旁分泌激活PSCs. 其中, 最重要的促纤维化因子是TGF-β1和PDGF. 然而, 星状细胞本身合成的各种细胞因子参与炎症过程的延续. PSCs活化时产生的细胞因子和炎性介质, 包括结缔组织生长因子、TGF-β、IL-1、IL-6、PDGF等. Wang等[43]研究者发现炎性因子IL-6的分泌是P38-和NF-κB信号分子介导的, IL-1β的分泌是NF-κB信号分子介导的, 而细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)1/2、P38和NF-κB可导致IL-8和TNF-α的分泌. 除了IL-1、IL-6、IL-8及TGF-β的表达, 基因分析揭示星状细胞还表达IL-7、IL-15、IL-18和PDGF[16]. 吸烟引起的芳香烃受体配体表达可以通过上调IL-22加重小鼠模型胰腺纤维化, 抗IL-22抗体治疗可减少CP小鼠的胰腺纤维化, 提示IL-22可能是吸烟的CP患者治疗的一个潜在靶点[44]. 目前认为细胞因子在PSCs活化中具有重要作用. 在PSCs的活化过程中, 旁分泌和自分泌细胞因子均起到了调节作用, 共同构成了复杂的调节网络. 此外, ECM、血小板、超氧自由基及周围细胞等也与PSCs的活化密切相关.
正常情况下, PSCs通过调控ECM的合成与降解来维持正常的组织结构. 当胰腺损伤时, PSCs表现为激活表型, 分泌大量的ECM蛋白促进胰腺纤维化形成[6]. 近年来, PSCs生物学研究主要集中于PSC的生物物理特性与ECM相互作用及细胞内钙生理方面. 重要的是, PSCs和ECM之间的相互作用是双向的. 这种过程与CP和胰腺癌的病理纤维化有关, 阻断这些相互作用可能是一种潜在的有效的方法来抑制这些情况下的进行性纤维化[27]. 星状细胞的活化主要与细胞生长的外环境及ECM有关, 活化的时间多以5 d为界限, 如德国学者Jesnowski等[15]观察到胰星状细胞在基质胶包被的培养瓶上能保持静止的未活化状态. PSCs在培养状态下激活后产生大量ECM蛋白, 包括胶原Ⅰ型和Ⅲ型, 纤维连接蛋白和层黏连蛋白[45]. 可见, ECM和星状细胞之间的关系是相互影响的. 因子芯片、蛋白质芯片等高通量研究手段的应用将有助于揭示PSCs与胰腺其他类型细胞及基质间的相互作用机制.
PSCs活化可引起ECM合成与降解失衡, 最终导致胰腺纤维化. PSCs活化与其细胞内的信号转导通路失调相关. 近些年来对PSCs活化的信号转导机制的研究[46,47]逐渐增多, 主要有丝裂素活化蛋白激酶(mitogen-activated protein kinase, MAPK)、过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor-γ, PPAR-γ)、磷脂酰肌醇3激酶/蛋白激酶B通路、TGF-β/Smad和Mad相关蛋白(Smad)、Janus活化激酶/信号换能器和转录激活子、Hedgehog信号通路、Rho/Rho激酶信号通路、Wnt/β-catenin、TLR4/NF-κB信号通路、IL-33/ST2信号通路及活性氧等. 其中TLR4/NF-κB信号通路在胰腺炎中的研究逐渐得到重视.
TLR4信号通路在胰腺炎发生和发展过程中起重要作用[48-51]. Vonlaufen等[30]已经证实TLR4信号转导通路的激活在大鼠酒精性CP炎症发生和纤维化中发挥关键作用. 田珍珍等[52]进一步证实了TLR4信号通路在CP患者胰腺及外周血中均上调, 在CP急性发作期和炎症进展过程中起重要作用. TLR4是Toll样受体家族的成员之一, 是一种模式识别受体. TLR目前被认为是哺乳动物唯一将细胞外抗原识别信息向细胞内传递并且引发炎症反应的关键跨膜蛋白. TLR4与其配体G-菌内毒素LPS结合后, 可以激活髓样分化蛋白88(myeloid differentiation factor88, MyD88)依赖性和MyD88非依赖性信号途径[53]. MyD88依赖性信号通路主要介导NF-κB活化和致炎细胞因子产生, 其基本激活过程如下: TLR4通过TIR域衔接器蛋白与MyD88桥接, 进而诱导IL-1受体相关激酶9磷酸化与MyD88分离并与肿瘤坏死因子受体相关因子6(TNF receptor-associated factor 6, TRAF6)、TGF-β激酶1形成多蛋白复合物, 然后TRAF6被泛素化和降解, 分别使下游的IκB激酶复合物和MAPK活化. IκB泛素化和降解, 使转录因子NF-κB从胞浆转移至细胞核, 进而可诱导致炎细胞因子基因如TNF-α、IL-6、IL-1β等的转录, 参与组织的炎症反应[54]. 其中NF-κB则是一个广泛存在于细胞中具有多向性转录调节作用的蛋白因子, 他能与多种细胞因子、黏附分子基因启动子部位的κB位点结合, 增强这些基因的转录和表达, 导致TNF-α、IL-1β、IL-6、IL-8、ICAM-1、P-selectin等基因的过度表达, 通过抑制NF-κB的活性可以有效抑制下游因子TNF-α、IL-1、ICAM-1的mRNA表达并减轻远隔脏器的炎症损伤程度. 研究[55]发现应用NF-κB拮抗剂或敲除NF-κB基因后大鼠胰腺炎病变程度明显减轻, 许多细胞因子的产生亦得到控制. 提示NF-κB有诱导产生TNF-α等细胞因子的作用, 在胰腺炎病变发展过程中起着重要调控作用, 甚至处于中枢位置. 除了TLR4受体的下游上述分子外, TLR4信号通路还受到上游的microRNAs的调控. 这些microRNAs既可以通过直接靶向TLR4, 也可以通过靶向TLR4信号通路中相关分子蛋白、转录信号因子和调节因子调节TLR4信号通路, 从而调控炎症反应[56,57]. TLR4信号通路诱导多个microRNAs[58], 从而构成了炎性信号分子的精确调控网络. 研究纤维化相关的信号因子和通路, 并试图通过这些分子和通路来抑制或者逆转PSCs的激活, 可以达到阻止或延缓纤维化进程的目的.
PSCs是胰腺纤维化发生过程中的关键细胞, 是各种病因造成的胰腺纤维化发生的共同中心环节. 胰腺的纤维化是CP发病的重要病理生理过程, 纤维化的发病机制尚不清楚, 因此尚无治疗纤维化的有效药物.
近期的研究[59]表明, 最有前途的治疗方式, 包括阻断肾素-血管紧张素系统(renin-angiotensin system, RAS), 激活PPAR-γ, 影响PSC特异的信号通路, 阻断PSC活化后的产物以及应用抗氧化剂, 阻断TLR4信号通路等. 据报道[60], 白蛋白是PPAR-γ的下游效应物, 是一种抑制PSCs激活的核受体. 激活PPAR-γ在胰腺炎的全身炎症反应过程中起重要调节作用, 通过调控相关炎症介质的表达, 改善胰腺及胰外多个器官的损伤. 研究[61]表明, 维生素A的活性代谢产物全反式维甲酸(all-trans retinoic acid, ATRA)可以使激活的PSCs细胞增殖减少, α-SMA的表达下降以及胶原的产生减少, 从而恢复到静息状态. Xiao等[62]研究表明, ATRA治疗抑制由反复注射雨蛙素诱导的CP小鼠模型的纤维化反应. ATRA还可抑制PSC的增殖, 诱导PSC细胞凋亡, 降低ECM的产生. ATRA治疗可能是通过下调Wnt/β-catenin信号通路发挥着关键作用, 这一发现支持ATRA作为胰腺纤维化抑制因子的潜在作用. 大鼠PSCs体外培养实验[63]表明, 洛伐他汀通过抑制甲羟戊酸阻止Ras超家族G蛋白的异戊二烯化, 从而抑制PDGF激活Raf-Ras-ERK通路, 进而抑制PSCs的增殖. 在二氯化二丁基锡引起的实验性胰腺纤维化模型中, 甲磺酸卡莫司他能够抑制体内的星状细胞活化和纤维化, 并在体外实验中抑制星状细胞增殖和单核细胞趋化蛋白1的产生, 但对TGF-β1产生没有影响[64]. 曲匹地尔是PDGF的抑制剂, 抑制PDGF诱导的ERK激活和PSCs的增殖. 可见, 药物治疗CP的胰腺纤维化以抑制或者逆转PSCs的激活为中心, 以达到阻止或延缓纤维化进程的目的.
中药提取物的抗纤维化研究也越来越引起学者的关注. 芹菜素(apigenin)是天然存在的一种黄酮类化合物, 研究发现apigenin可以减少反复注射雨蛙素诱导的CP小鼠模型的纤维化反应. 体外研究[65]表明, apigenin增加PSC凋亡并降低PSCs对甲状旁腺激素相关蛋白刺激响应. 蒿属香豆素(scoparone)是从蒿茵陈提取的中药成分, 研究发现scoparone能通过下调TGF-β/Smad信号通路降低PSC活化抑制由二氯化二丁基锡诱导的CP大鼠模型的胰腺损伤[66]. Lin等[67]研究发现, 天然黄酮甙Eruberin A也可通过体外抑制TGF-β诱导的PSC激活. 研究发现, 多酚类化合物大黄酸、大黄素、姜黄素和白藜芦醇能够对抗TGF-β引起的胰腺纤维化. 大黄酸能有效减轻炎症模型大鼠的组织水肿和自由基产生, 体内和体外实验中均证明其有很强的抗纤维化作用. 在雨蛙肽诱导的CP模型小鼠中, 给予大黄酸能显著降低α-SMA和TGF-β, 提示其在抗胰腺纤维化过程中发挥作用. 体外实验[68]也证实, 大黄酸能够抑制PSC活化, 可能通过抑制Shh/Gli1的信号发挥抗胰腺纤维化作用. 在动物模型中, 姜黄素被证明可抑制PDGF诱导的PSCs增殖, 也能抑制IL-1β和TNF-α诱导的单核细胞趋化蛋白-1的产生[69]. 亚细亚蒿的乙醇提取物DA-9601可以减轻雨蛙素诱导的CP的胰腺纤维化程度, 体外实验表明DA-9601可抑制PSCs中α-SMA和COL-Ⅰ的表达发挥抗炎和抗纤维化作用[70]. Suzuki等[71]发现, 存在水果和坚果中的植物多酚鞣花酸能够抑制胰腺炎小鼠模型PSCs的活化, 能够抑制PSCs中由TGF-β1或PDGF诱导所产生的活性氧. 表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)是茶多酚中最有效的活性成分, 具有强效的抗氧化作用. 在体外, EGCG可以剂量依赖性地抑制PSCs, 消除乙醇引起的细胞膜脂质过氧化, 抑制乙醇诱导的MAPK激活和Ⅰ型前胶原和胶原分泌. 常山酮是中药常山中提取的生物碱. 在雨蛙肽诱导的胰腺炎的实验模型中, 常山酮并不影响TGF-β的水平, 但作用于其下游Smad3影响其磷酸化水平进而抑制PSCs增殖[72].
在过去的二十年中, 许多新的治疗药物已被尝试用于CP, 但大多数仍处于实验阶段. 作用于PSCs的疗法最有希望在不久的将来转化到临床使患者获益. 作用于PSCs的传统中医药治疗CP胰腺纤维化无疑是该领域研究的方向之一.
研究PSCs所在微环境的调控及参与PSCs激活的信号因子和通路, 有助于通过这些分子和通路来抑制或者逆转PSCs的激活以达到阻止或延缓纤维化进程的目的. 作用于PSCs的疗法最有希望在不久的将来转化到临床使患者获益.
慢性胰腺炎(chronic pancreatitis, CP)是各种病因引起胰腺组织和功能不可逆改变的慢性炎症性疾病. 基本病理特征包括胰腺实质慢性炎症损害和间质纤维化、胰腺实质钙化、胰管扩张及胰管结石等改变. 胰腺纤维化的形成是一个以胰腺星状细胞(pancreatic stellate cells, PSCs)活化为中心由复杂的信号网络通路所介导的, 多种细胞因子与炎症介质参与, 最终以成纤维细胞增生和细胞外基质(extracellular matrix, ECM)沉积为特征的复杂的病理发展过程, 但尚无一个较为统一的学说来解释胰腺炎的发病机制.
胰腺其他类型细胞及基质与PSCs之间存在相互作用, 神经递质、脑肠肽及细胞因子等作为信使物质共同构成了PSCs所处的微环境, 是决定PSCs是否激活的关键所在. 胰腺纤维化的形成是一个以PSCs活化为中心由复杂的信号网络通路所介导的, 多种细胞因子与炎症介质参与, 最终以成纤维细胞增生和ECM沉积为特征的复杂的病理发展过程.
PSCs所在微环境的调控在纤维化过程中的作用成为研究热点; PSCs的分离及培养细节将有助于研究者选择合适的细胞模型进行相应研究; 多因素整合假说更能够从PSCs所在微环境角度理解胰腺炎的发病机制; 纤维化相关的信号因子和信号通路参与PSCs的激活过程; 通过调控这些分子和通路来改变PSCs所在微环境以抑制或者逆转PSCs的激活可以达到阻止或延缓纤维化进程的目的.
PSCs所在微环境的调控在纤维化过程中的作用成为研究热点; 共培养技术的研究策略比单独培养单一细胞更为接近在体环境, 可能会成为今后研究的一个方向; 调节纤维化相关的信号因子和通路抑制或者逆转PSCs的激活, 也可影响PSCs所在微环境, 达到阻止或延缓纤维化进程的目的; 许多新的调节PSCs所在微环境的药物已被尝试用于CP, 但大多数仍处于实验阶段, 可能在不久的将来转化到临床使患者获益.
陈晓鹏, 教授, 主任医师, 皖南医学院附属弋矶山医院肝胆外科; 罗和生, 教授, 武汉大学人民医院消化内科
本文以PSCs为中心, 介绍了所在微环境的调控在纤维化过程中的作用, 并分析了目前一些药物特别是中药在该疾病中的研究进展, 内容全面而新颖, 文献信息量大, 具有较好的科学性和先进性.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:杜冉冉
| 2. | Manohar M, Verma AK, Venkateshaiah SU, Sanders NL, Mishra A. Pathogenic mechanisms of pancreatitis. World J Gastrointest Pharmacol Ther. 2017;8:10-25. [PubMed] [DOI] |
| 3. | Issa Y, Bruno MJ, Bakker OJ, Besselink MG, Schepers NJ, van Santvoort HC, Gooszen HG, Boermeester MA. Treatment options for chronic pancreatitis. Nat Rev Gastroenterol Hepatol. 2014;11:556-564. [PubMed] [DOI] |
| 4. | Masamune A, Watanabe T, Kikuta K, Shimosegawa T. Roles of pancreatic stellate cells in pancreatic inflammation and fibrosis. Clin Gastroenterol Hepatol. 2009;7:S48-S54. [PubMed] [DOI] |
| 5. | Apte M, Pirola RC, Wilson JS. Pancreatic stellate cell: physiologic role, role in fibrosis and cancer. Curr Opin Gastroenterol. 2015;31:416-423. [PubMed] [DOI] |
| 6. | Apte M, Pirola R, Wilson J. The fibrosis of chronic pancreatitis: new insights into the role of pancreatic stellate cells. Antioxid Redox Signal. 2011;15:2711-2722. [PubMed] [DOI] |
| 7. | Zha M, Li F, Xu W, Chen B, Sun Z. Isolation and characterization of islet stellate cells in rat. Islets. 2014;6:e28701. [PubMed] [DOI] |
| 8. | Zha M, Xu W, Jones PM, Sun Z. Isolation and characterization of human islet stellate cells. Exp Cell Res. 2016;341:61-66. [PubMed] [DOI] |
| 9. | Apte MV, Haber PS, Applegate TL, Norton ID, McCaughan GW, Korsten MA, Pirola RC, Wilson JS. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut. 1998;43:128-133. [PubMed] [DOI] |
| 10. | Bachem MG, Schneider E, Gross H, Weidenbach H, Schmid RM, Menke A, Siech M, Beger H, Grünert A, Adler G. Identification, culture, and characterization of pancreatic stellate cells in rats and humans. Gastroenterology. 1998;115:421-432. [PubMed] [DOI] |
| 11. | Zhao L, Cai B, Lu Z, Tian L, Guo S, Wu P, Qian D, Xu Q, Jiang K, Miao Y. Modified methods for isolation of pancreatic stellate cells from human and rodent pancreas. J Biomed Res. 2016;30:510-516. [PubMed] [DOI] |
| 14. | Phillips PA, Wu MJ, Kumar RK, Doherty E, McCarroll JA, Park S, Pirola RC, Wilson JS, Apte MV. Cell migration: a novel aspect of pancreatic stellate cell biology. Gut. 2003;52:677-682. [PubMed] [DOI] |
| 15. | Jesnowski R, Fürst D, Ringel J, Chen Y, Schrödel A, Kleeff J, Kolb A, Schareck WD, Löhr M. Immortalization of pancreatic stellate cells as an in vitro model of pancreatic fibrosis: deactivation is induced by matrigel and N-acetylcysteine. Lab Invest. 2005;85:1276-1291. [PubMed] [DOI] |
| 16. | Sparmann G, Hohenadl C, Tornøe J, Jaster R, Fitzner B, Koczan D, Thiesen HJ, Glass A, Winder D, Liebe S. Generation and characterization of immortalized rat pancreatic stellate cells. Am J Physiol Gastrointest Liver Physiol. 2004;287:G211-G219. [PubMed] [DOI] |
| 17. | Bläuer M, Laaninen M, Sand J, Laukkarinen J. Reciprocal stimulation of pancreatic acinar and stellate cells in a novel long-term in vitro co-culture model. Pancreatology. 2016;16:570-577. [PubMed] [DOI] |
| 18. | Bhanot UK, Möller P. Mechanisms of parenchymal injury and signaling pathways in ectatic ducts of chronic pancreatitis: implications for pancreatic carcinogenesis. Lab Invest. 2009;89:489-497. [PubMed] [DOI] |
| 19. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] [DOI] |
| 20. | Chauhan SS, Pannu DS, Forsmark CE. Antioxidants as Adjunctive Therapy for Pain in Chronic Pancreatitis. Practical Gastroenterology. 2012;3:42-49. |
| 21. | Tsai K, Wang SS, Chen TS, Kong CW, Chang FY, Lee SD, Lu FJ. Oxidative stress: an important phenomenon with pathogenetic significance in the progression of acute pancreatitis. Gut. 1998;42:850-855. [PubMed] [DOI] |
| 22. | Leung PS, Chan YC. Role of oxidative stress in pancreatic inflammation. Antioxid Redox Signal. 2009;11:135-165. [PubMed] [DOI] |
| 23. | Schoenberg MH, Birk D, Beger HG. Oxidative stress in acute and chronic pancreatitis. Am J Clin Nutr. 1995;62:1306S-1314S. [PubMed] |
| 24. | Lu J, Getz G, Miska EA, Alvarez-Saavedra E, Lamb J, Peck D, Sweet-Cordero A, Ebert BL, Mak RH, Ferrando AA. MicroRNA expression profiles classify human cancers. Nature. 2005;435:834-838. [PubMed] [DOI] |
| 25. | Baker AH, van Rooij E. miRNA overexpression induces cardiomyocyte proliferation in vivo. Mol Ther. 2013;21:497-498. [PubMed] [DOI] |
| 26. | Nakeeb A, Pitt HA, Sohn TA, Coleman J, Abrams RA, Piantadosi S, Hruban RH, Lillemoe KD, Yeo CJ, Cameron JL. Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors. Ann Surg. 1996;224:463-473; discussion 473-475. [PubMed] [DOI] |
| 27. | Pang TCY, Wilson JS, Apte MV. Pancreatic stellate cells: what's new? Curr Opin Gastroenterol. 2017;33:366-373. [PubMed] [DOI] |
| 28. | Hashimoto D, Ohmuraya M, Hirota M, Yamamoto A, Suyama K, Ida S, Okumura Y, Takahashi E, Kido H, Araki K. Involvement of autophagy in trypsinogen activation within the pancreatic acinar cells. J Cell Biol. 2008;181:1065-1072. [PubMed] [DOI] |
| 30. | Vonlaufen A, Phillips PA, Xu Z, Zhang X, Yang L, Pirola RC, Wilson JS, Apte MV. Withdrawal of alcohol promotes regression while continued alcohol intake promotes persistence of LPS-induced pancreatic injury in alcohol-fed rats. Gut. 2011;60:238-246. [PubMed] [DOI] |
| 31. | Dattaroy D, Seth RK, Das S, Alhasson F, Chandrashekaran V, Michelotti G, Fan D, Nagarkatti M, Nagarkatti P, Diehl AM. Sparstolonin B attenuates early liver inflammation in experimental NASH by modulating TLR4 trafficking in lipid rafts via NADPH oxidase activation. Am J Physiol Gastrointest Liver Physiol. 2016;310:G510-G525. [PubMed] [DOI] |
| 32. | Ahmed Ali U, Issa Y, Hagenaars JC, Bakker OJ, van Goor H, Nieuwenhuijs VB, Bollen TL, van Ramshorst B, Witteman BJ, Brink MA. Risk of Recurrent Pancreatitis and Progression to Chronic Pancreatitis After a First Episode of Acute Pancreatitis. Clin Gastroenterol Hepatol. 2016;14:738-746. [PubMed] [DOI] |
| 33. | Masamune A, Shimosegawa T. Pancreatic stellate cells--multi-functional cells in the pancreas. Pancreatology. 2013;13:102-105. [PubMed] [DOI] |
| 34. | Gryshchenko O, Gerasimenko JV, Gerasimenko OV, Petersen OH. Calcium signalling in pancreatic stellate cells: Mechanisms and potential roles. Cell Calcium. 2016;59:140-144. [PubMed] [DOI] |
| 35. | Jakubowska MA, Ferdek PE, Gerasimenko OV, Gerasimenko JV, Petersen OH. Nitric oxide signals are interlinked with calcium signals in normal pancreatic stellate cells upon oxidative stress and inflammation. Open Biol. 2016;6:pii 160149. [PubMed] [DOI] |
| 36. | Zheng L, Xue J, Jaffee EM, Habtezion A. Role of immune cells and immune-based therapies in pancreatitis and pancreatic ductal adenocarcinoma. Gastroenterology. 2013;144:1230-1240. [PubMed] [DOI] |
| 37. | Xue J, Sharma V, Hsieh MH, Chawla A, Murali R, Pandol SJ, Habtezion A. Alternatively activated macrophages promote pancreatic fibrosis in chronic pancreatitis. Nat Commun. 2015;6:7158. [PubMed] [DOI] |
| 38. | Jagannath S, Garg PK. Novel and Experimental Therapies in Chronic Pancreatitis. Dig Dis Sci. 2017;62:1751-1761. [PubMed] [DOI] |
| 39. | Zimnoch L, Szynaka B, Puchalski Z. Mast cells and pancreatic stellate cells in chronic pancreatitis with differently intensified fibrosis. Hepatogastroenterology. 2002;49:1135-1138. [PubMed] |
| 40. | Zhou Z, Zeng Y, Yang P, Cheng Z, Zhao J, Shu Y, Gao X, Yan L, Zhang Z. [Structure and function of pancreatic microcirculation]. Shengwu Yixue Gongchengxue Zazhi. 2001;18:195-200. [PubMed] |
| 41. | Bockman DE. Nerves in the pancreas: what are they for? American Journal of Surgery. 2007;194:S61-S64. [DOI] |
| 42. | Phillips PA, Yang L, Shulkes A, Vonlaufen A, Poljak A, Bustamante S, Warren A, Xu Z, Guilhaus M, Pirola R. Pancreatic stellate cells produce acetylcholine and may play a role in pancreatic exocrine secretion. Proc Natl Acad Sci USA. 2010;107:17397-17402. [PubMed] [DOI] |
| 43. | Wang W, Deng M, Liu X, Ai W, Tang Q, Hu J. TLR4 activation induces nontolerant inflammatory response in endothelial cells. Inflammation. 2011;34:509-518. [PubMed] [DOI] |
| 44. | Xue J, Zhao Q, Sharma V, Nguyen LP, Lee YN, Pham KL, Edderkaoui M, Pandol SJ, Park W, Habtezion A. Aryl Hydrocarbon Receptor Ligands in Cigarette Smoke Induce Production of Interleukin-22 to Promote Pancreatic Fibrosis in Models of Chronic Pancreatitis. Gastroenterology. 2016;151:1206-1217. [PubMed] [DOI] |
| 45. | Jaster R. Molecular regulation of pancreatic stellate cell function. Mol Cancer. 2004;3:26. [PubMed] [DOI] |
| 46. | Masamune A, Shimosegawa T. Signal transduction in pancreatic stellate cells. J Gastroenterol. 2009;44:249-260. [PubMed] [DOI] |
| 47. | Bynigeri RR, Jakkampudi A, Jangala R, Subramanyam C, Sasikala M, Rao GV, Reddy DN, Talukdar R. Pancreatic stellate cell: Pandora's box for pancreatic disease biology. World J Gastroenterol. 2017;23:382-405. [PubMed] [DOI] |
| 50. | Ding SQ, Li Y, Zhou ZG, Wang C, Zhan L, Zhou B. Toll-like receptor 4-mediated apoptosis of pancreatic cells in cerulein-induced acute pancreatitis in mice. Hepatobiliary Pancreat Dis Int. 2010;9:645-650. [PubMed] |
| 51. | Ding JL, Li Y, Zhou XY, Wang L, Zhou B, Wang R, Liu HX, Zhou ZG. Potential role of the TLR4/IRAK-4 signaling pathway in the pathophysiology of acute pancreatitis in mice. Inflamm Res. 2009;58:783-790. [PubMed] [DOI] |
| 52. | 田 珍珍, 朱 杰, 王 淑华, 李 雅君, 刘 永方, 修 明, 高 润平. 慢性胰腺炎患者胰腺和血清中TLR4信号通路关键因子的检测及其意义. 吉林大学学报(医学版). 2013;39:763-767. |
| 53. | Shaib Y, El-Serag HB. The epidemiology of cholangiocarcinoma. Semin Liver Dis. 2004;24:115-125. [PubMed] [DOI] |
| 54. | Sita-Lumsden A, Dart DA, Waxman J, Bevan CL. Circulating microRNAs as potential new biomarkers for prostate cancer. Br J Cancer. 2013;108:1925-1930. [PubMed] [DOI] |
| 55. | Santoni M, Andrikou K, Sotte V, Bittoni A, Lanese A, Pellei C, Piva F, Conti A, Nabissi M, Santoni G. Toll like receptors and pancreatic diseases: From a pathogenetic mechanism to a therapeutic target. Cancer Treat Rev. 2015;41:569-576. [PubMed] [DOI] |
| 56. | He X, Jing Z, Cheng G. MicroRNAs: new regulators of Toll-like receptor signalling pathways. Biomed Res Int. 2014;2014:945169. [PubMed] [DOI] |
| 57. | Satoh M, Takahashi Y, Tabuchi T, Tamada M, Takahashi K, Itoh T, Morino Y, Nakamura M. Circulating Toll-like receptor 4-responsive microRNA panel in patients with coronary artery disease: results from prospective and randomized study of treatment with renin-angiotensin system blockade. Clin Sci (Lond). 2015;128:483-491. [PubMed] [DOI] |
| 58. | Kalantari P, Harandi OF, Agarwal S, Rus F, Kurt-Jones EA, Fitzgerald KA, Caffrey DR, Golenbock DT. miR-718 represses proinflammatory cytokine production through targeting phosphatase and tensin homolog (PTEN). J Biol Chem. 2017;292:5634-5644. [PubMed] [DOI] |
| 59. | Madro A, Slomka M, Celinski K. Can we expect progress in the treatment of fibrosis in the course of chronic pancreatitis? Adv Med Sci. 2011;56:132-137. [PubMed] [DOI] |
| 60. | Kim N, Choi S, Lim C, Lee H, Oh J. Albumin mediates PPAR-gamma or C/EBP-alpha-induced phenotypic changes in pancreatic stellate cells. Biochem Biophys Res Commun. 2010;391:640-644. [PubMed] [DOI] |
| 61. | Guan J, Zhang H, Wen Z, Gu Y, Cheng Y, Sun Y, Zhang T, Jia C, Lu Z, Chen J. Retinoic acid inhibits pancreatic cancer cell migration and EMT through the downregulation of IL-6 in cancer associated fibroblast cells. Cancer Lett. 2014;345:132-139. [PubMed] [DOI] |
| 62. | Xiao W, Jiang W, Shen J, Yin G, Fan Y, Wu D, Qiu L, Yu G, Xing M, Hu G. Retinoic Acid Ameliorates Pancreatic Fibrosis and Inhibits the Activation of Pancreatic Stellate Cells in Mice with Experimental Chronic Pancreatitis via Suppressing the Wnt/β-Catenin Signaling Pathway. PLoS One. 2015;10:e0141462. [DOI] |
| 63. | Jaster R, Brock P, Sparmann G, Emmrich J, Liebe S. Inhibition of pancreatic stellate cell activation by the hydroxymethylglutaryl coenzyme A reductase inhibitor lovastatin. Biochem Pharmacol. 2003;65:1295-1303. [PubMed] [DOI] |
| 64. | Gibo J, Ito T, Kawabe K, Hisano T, Inoue M, Fujimori N, Oono T, Arita Y, Nawata H. Camostat mesilate attenuates pancreatic fibrosis via inhibition of monocytes and pancreatic stellate cells activity. Lab Invest. 2005;85:75-89. [PubMed] [DOI] |
| 65. | Leung PS. The physiology of a local renin-angiotensin system in the pancreas. J Physiol. 2007;580:31-37. [PubMed] [DOI] |
| 66. | Li HW, Meng Y, Xie Q, Yi WJ, Lai XL, Bian Q, Wang J, Wang JF, Yu G. miR-98 protects endothelial cells against hypoxia/reoxygenation induced-apoptosis by targeting caspase-3. Biochem Biophys Res Commun. 2015;467:595-601. [PubMed] [DOI] |
| 67. | Lin Z, Zheng LC, Zhang HJ, Tsang SW, Bian ZX. Anti-fibrotic effects of phenolic compounds on pancreatic stellate cells. BMC Complement Altern Med. 2015;15:259. [PubMed] [DOI] |
| 68. | Tsang SW, Zhang H, Lin C, Xiao H, Wong M, Shang H, Yang ZJ, Lu A, Yung KK, Bian Z. Rhein, a natural anthraquinone derivative, attenuates the activation of pancreatic stellate cells and ameliorates pancreatic fibrosis in mice with experimental chronic pancreatitis. PLoS One. 2013;8:e82201. [PubMed] [DOI] |
| 69. | Masamune A, Suzuki N, Kikuta K, Satoh M, Satoh K, Shimosegawa T. Curcumin blocks activation of pancreatic stellate cells. J Cell Biochem. 2006;97:1080-1093. [PubMed] [DOI] |
| 70. | Yoo BM, Oh TY, Kim YB, Yeo M, Lee JS, Surh YJ, Ahn BO, Kim WH, Sohn S, Kim JH. Novel antioxidant ameliorates the fibrosis and inflammation of cerulein-induced chronic pancreatitis in a mouse model. Pancreatology. 2005;5:165-176. [PubMed] [DOI] |
| 71. | Suzuki N, Masamune A, Kikuta K, Watanabe T, Satoh K, Shimosegawa T. Ellagic acid inhibits pancreatic fibrosis in male Wistar Bonn/Kobori rats. Dig Dis Sci. 2009;54:802-810. [PubMed] [DOI] |