修回日期: 2017-05-22
接受日期: 2017-06-12
在线出版日期: 2017-07-18
探讨血清胸苷激酶1(thymidine kinase 1, TK1)在肝癌患者中的表达水平、对肝癌诊断价值及其对预后的指导意义.
采用免疫印迹增强化学发光法检测77例肝癌患者(肝癌组)、41例肝硬化患者(肝硬化组)和47例健康对照者(对照组)血清TK1水平, 对肝癌组患者随访观察2年, 以死亡为终点事件. 非正态分布的计量资料, 采用中位数和四分位数间距表示, 各组间比较采用非参数检验的Kruskal Wallis检验. 通过ROC曲线和ROC曲线下面积(area under curve, AUC)评价TK1对肝癌的诊断价值. 采用Kaplan-Meier法进行生存分析, Log Rank法进行差异性检验, 以P<0.05为差异有统计学意义.
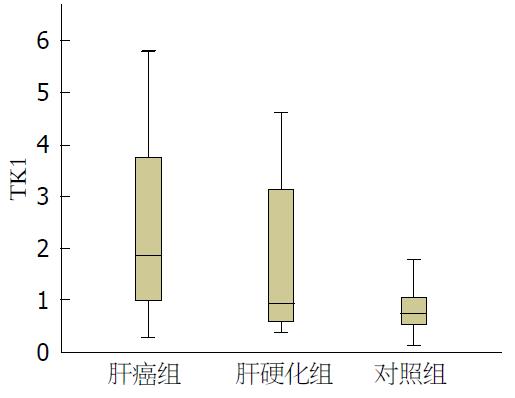
肝癌组患者血清TK1水平为1.85(0.94-3.755)pmol/L, 较肝硬化组的血清TK1水平0.90(0.56-3.13)pmol/L和对照组的血清TK1水平0.72(0.49-1.07)pmol/L明显升高(P<0.05), 肝硬化组和对照组之间TK1水平无差别. 血清TK1对肝癌有诊断价值, AUC为0.739(P<0.05), 诊断界值为1.105, 敏感性为0.714, 特异性为0.693. 血清TK1的水平和患者年龄、谷草转氨酶(aspartate transaminase, AST)、肝功能分级、BCLC分期、血管侵犯、肿瘤大小、肿瘤个数呈正相关(P<0.05). 血清TK1水平在BCLC分期(C+D)期患者高于BCLC(A+B)期患者(P<0.05).
血清TK1在肝癌患者中升高, 可作为诊断肝癌的血清学标志物之一. TK1的水平和肝细胞癌(hepetocellular carcinoma, HCC)患者年龄、AST、肝功能分级、BCLC分期、血管侵犯、肿瘤大小、肿瘤个数正相关. TK1在BCLC(C+D)期患者高于BCLC(A+B)期肝癌患者, 对判断HCC患者的预后有一定指导意义.
核心提要: 胸苷激酶1(thymidine kinase 1, TK1)在肝癌患者中升高表达; 可作为诊断肝癌的血清学标志物之一, 对肝癌的诊断界值为1.105, 敏感性为0.714, 特异性为0.693. TK1在BCLC(C+D)期患者高于BCLC(A+B)期肝癌患者, 对判断肝癌患者预后有一定指导意义.
引文著录: 王芳, 崔舒, 王凤梅, 吕洪敏, 刘辉, 唐飞, 韩涛. 血清胸苷激酶1在肝癌中表达升高和BCLC分期相关. 世界华人消化杂志 2017; 25(20): 1861-1868
Revised: May 22, 2017
Accepted: June 12, 2017
Published online: July 18, 2017
To determine the level of serum thymidine kinase 1 (TK1) in patients with hepatocellular carcinoma (HCC) and analyze its clinical significance in the diagnosis and prognosis of HCC.
Using Western blot with enhanced chemiluminescence detection, we determined the serum level of TK1 in 77 patients with hepatocellular carcinoma (HCC group), 41 patients with cirrhosis (cirrhosis group) and 47 healthy controls (control group). Patients with HCC were followed for 2 years. We defined all-cause mortality as the endpoint event. Measurement data which met the non-normal distribution are described using median and analyzed using non-parametric Kruskal-Wallis test. ROC curve analysis was used to evaluate the diagnostic efficacy of TK1 to identify HCC. Kaplan-Meier method was used to perform survival analysis, and log-rank method was used to test the difference between groups.
Serum TK1 was significantly higher in patients with HCC [1.85 (range, 0.94-3.755) pmol/L] than in patients with cirrhosis [0.90 (range, 0.56-3.13) pmol/L] and in control people [0.72 (0.49-1.07) pmol/L] (P < 0.05), although there was no significant difference between the cirrhosis group and control group. The area under the ROC curve of serum TK1 for the diagnosis of HCC was 0.739 (P < 0.05). With a cut-off value of 1.105 pmol/L, serum TK1 had a sensitivity of 0.714 and a specificity of 0.693. The level of serum TK1 is positively correlated with age, aspartate transaminase (AST), Child-Pugh grade, BCLC stage, vascular invasion, tumor size and tumor number (P < 0.05). Serum TK1 level in patients with BCLC stage C/D HCC was higher than that in patients with BCLC stage A/B HCC (P < 0.05).
Serum TK1 is elevated in patients with HCC and can be used as a serological marker for the diagnosis of HCC. Serum level of TK1 is positively correlated with age, AST, Child-Pugh grade, BCLC stage, vascular invasion, tumor size and tumor number. Serum level of TK1 is higher in patients with advanced-stage HCC, suggesting that it may be associated with prognosis.
- Citation: Wang F, Cui S, Wang FM, Lv HM, Liu H, Tang F, Han T. Serum thymidine kinase 1 is elevated and associated with BCLC stage in patients with hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2017; 25(20): 1861-1868
- URL: https://www.wjgnet.com/1009-3079/full/v25/i20/1861.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i20.1861
肝细胞癌(hepatocellular carcinoma, HCC)因其侵袭性强、进展迅速、死亡率高而著称, 发病率居全球第5位、死亡率在恶性肿瘤中居第2位, 发病及死亡人数中将近一半发生在中国[1]. 同时, HCC发病具有隐匿性特点, 患者被诊断时多已处于进展期或晚期, 治疗手段非常受限[2]. 因此, 对HCC患者的诊断和预后指标的研究一直是人们关注的焦点. 细胞质胸苷激酶也称为胸苷激酶1(thymidine kinase 1, TK1)是评估增殖细胞的增殖度的重要标志, 在多种恶性肿瘤中浓度升高, 临床上正逐渐被用来早期诊断肿瘤、治疗监测并评价预后[3-6]. 本研究通过检测肝癌患者血清TK1的表达水平, 探讨TK1和HCC诊断的价值和预后的关系.
选择天津市第三中心医院消化(肝病)科2014-08-01/2015-07-31的首次入院的HCC患者77例, 其中男性66例, 女性11例, 年龄46-79岁, 平均年龄59.13岁, 其中合并乙型肝炎肝硬化57例, 丙型肝炎肝硬化2例, 乙型肝炎及丙型肝炎重叠感染患者3例, 酒精性肝硬化6例, 原发性胆汁性肝硬化5例, 原发性胆汁性肝硬化合并自身免疫性肝硬化患者1例, 隐源性肝硬化3例. 同期首次入院确诊肝硬化患者41例, 作为阳性对照组. 其中男性20例, 女性21例, 年龄40-83岁, 平均年龄57.93岁, 其中乙型肝炎肝硬化18例; 丙型肝炎肝硬化4例; 酒精性肝硬化5例; 原发性胆汁性肝硬化5例; 自身免疫性肝硬化1例; PBC和AIH的重叠综合征患者3例; 隐源性肝硬化5例. 以同期健康献血员47例作为对照组, 其中男性26例, 女性21例, 年龄45-70岁, 平均年龄56.34岁.
HCC诊断符合2011年我国《原发性肝癌诊疗规范》[7]中HCC的临床诊断标准; 肝硬化诊断符合2015年我国《慢性乙型肝炎防治指南》[8]中肝硬化的诊断标准. 排除标准: (1)合并重症感染患者; (2)合并肝性脑病患者; (3)合并心、肾功能不全患者; (4)合并其他系统肿瘤患者; (5)女性患者月经期前后3 d; (6)近1 mo内献血者; (7)不能配合随访的患者.
1.2.1 随访: 根据患者的具体临床表现, 按照上述肝癌及肝硬化指南要求进行随访, 3-6 mo常规进行血清甲胎蛋白、腹部超声、强化CT和/或核磁共振成像检查. 采用电话随访及门诊随访, 随访的最后时间为2016-07-31, 生存期从检测入组之日开始计算, 终止日期为死亡或随访截止日期. 主要终点事件为患者死亡, 以mo为单位计算. HCC患者的平均随访时间为10.9(0-18.7) mo.
1.2.2 检测方法: 所有患者均采集空腹静脉血2 mL, 均在住院后、进行治疗之前采血, 分离血清, 置于-20 ℃保存备用. TK1的浓度测定采用CIS-1型化学发光数字成像分析仪, 由深圳华瑞同康公司提供.
统计学处理 数据采用SPSS17.0软件进行统计学分析. 非正态分布的计量资料, 采用中位数和四分位数间距表示, 各组间比较采用非参数检验的Kruskal-Wallis检验. 通过ROC曲线和ROC曲线下面积(area under curve, AUC)评价TK1对肝癌的诊断价值. 采用Kaplan-Meier法进行生存分析, Log Rank法进行差异性检验, 以P<0.05为差异有统计学意义.
肝癌患者的血清TK1水平为1.85(0.94-3.755)pmol/L; 肝硬化患者的TK1水平0.90(0.56-3.13)pmol/L; 健康对照组的TK1水平0.72(0.49-1.07)pmol/L. 肝癌组患者血清TK1水平高于肝硬化组和对照组, 差异有统计学意义, P<0.05, 肝硬化组和对照组之间血清TK1水平的差异无统计学意义(P>0.05, 图1, 表1).
| 分组 | n | TK1(pmol/L) |
| 肝癌组 | 77 | 1.850(0.940, 3.755) |
| 肝硬化组 | 41 | 0.900(0.560, 3.130) |
| 对照组 | 47 | 0.720(0.490, 1.070) |
| 总计 | 165 |
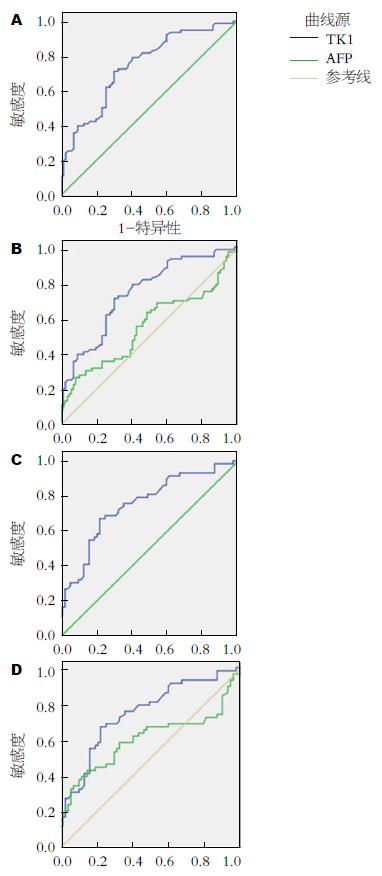
TK1对诊断肝癌的AUC为0.739, P<0.05, 对肝癌的诊断有意义, 诊断界值为1.1050, 敏感性为0.714, 特异性为0.693(图2A); 同时分析了作为HCC重要诊断指标的AFP对HCC的诊断ROC曲线下面积为0.554, P>0.05(P = 0.231), 诊断界值为240.65, 敏感性为0.273, 特异性为0.909(图2B). 本研究中, TK1较AFP对肝癌有更高的诊断效能.
考虑到肝功能进展对TK1可能的影响, 剔除Child-Pugh C级的患者后(n = 125), TK1对肝癌的诊断的AUC为0.748, P<0.05(P = 0.000), 诊断界值为1.1050, 敏感性为0.672, 特异性为 0.776(图2C); 同时AFP对肝癌的诊断的AUC为0.605, P<0.05(P = 0.044), 诊断界值为79.1050, 敏感性为0.431, 特异性为0.851(图2D). 除外Child-Pugh C级的患者后, TK1和甲胎蛋白对肝癌的诊断均有统计学意义, TK1对肝癌的诊断效能进一步提高.
分析TK1的水平与患者性别、年龄、谷丙转氨酶、谷草转氨酶(aspartate transaminase, AST)、肿瘤大小、肿瘤个数、血清HBsAg、血管侵犯、外周转移、AFP水平、BCLC分期和Child-Pugh分级之间的关系. 结果显示, 血清TK1的水平和患者年龄、AST水平、Child-Pugh分级、BCLC分期、血管侵犯、肿瘤大小、肿瘤个数呈正相关(P<0.05, 表2).
| 临床资料 | n | TK1(pmol/L) | r值 | P值 | |
| 性别 | 男 | 66 | 1.620(0.918, 3.628) | 0.174 | 0.131 |
| 女 | 11 | 3.310(1.390, 4.580) | |||
| 年龄(岁) | ≤59 | 41 | 1.420(0.840, 3.280) | 0.297 | 0.009 |
| >59 | 36 | 3.295(1.395, 4.530) | |||
| AFP(ng/mL) | ≤20 | 44 | 2.640(0.975, 4.260) | -0.165 | 0.151 |
| >20 | 28 | 1.420(0.940, 3.350) | |||
| HBsAg | 阴性 | 39 | 1.670(0.840, 3.550) | 0.120 | 0.297 |
| 阳性 | 38 | 2.830(1.050, 3.980) | |||
| ALT(U/L) | ≤40 | 57 | 1.460(0.915, 3.655) | 0.177 | 0.123 |
| >40 | 20 | 2.975(1.573, 3.953) | |||
| AST(U/L) | ≤40 | 48 | 1.440(0.858, 3.325) | 0.290 | 0.011 |
| >40 | 29 | 3.350(1.320, 4.650) | |||
| Child-Pugh分级 | A级 | 40 | 1.175(0.763, 1.938) | 0.507 | 0.000 |
| B级 | 18 | 3.330(1.623, 4.295) | |||
| C级 | 19 | 3.780(2.850, 4.560) | |||
| BCLC分期 | A | 10 | 0.775(0.635, 0.998) | 0.503 | 0.000 |
| B | 24 | 1.175(0.828, 2.003) | |||
| C | 20 | 3.350(1.453, 3.920) | |||
| D | 23 | 3.490(1.540, 4.440) | |||
| 血管侵犯 | 无 | 65 | 1.540(0.875, 3.450) | 0.313 | 0.006 |
| 有 | 12 | 3.760(2.535, 4.848) | |||
| 肝外器官转移 | 无 | 60 | 1.755(0.913, 3.770) | 0.094 | 0.414 |
| 有 | 17 | 1.930(0.310, 3.680) | |||
| 肿瘤大小(cm) | ≤5 | 58 | 1.465(0.830, 3.560) | 0.295 | 0.009 |
| >5 | 19 | 3.310(1.950, 4.010) | |||
| 肿瘤个数 | 单发 | 22 | 0.970(0.780, 3.293) | 0.256 | 0.025 |
| 多发 | 54 | 2.640(1.350, 3.828) |
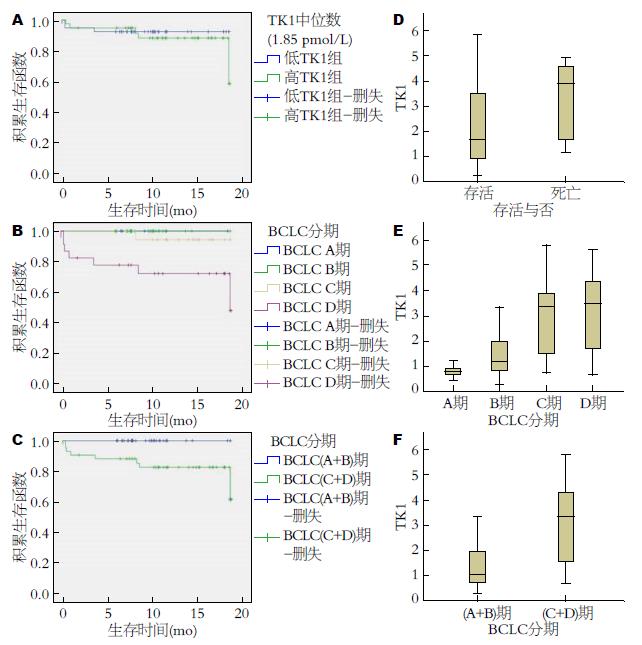
77例患者中有8例死亡, 其中3例死于肝功能衰竭, 另5例死于肝癌及外周多发转移(其中2例死于肺转移癌). 以患者死亡和达到随访终点时间为终点事件, 平均随访10.9(0-18.7) mo. 随访结束时, 以TK1的中位数(1.85 pmol/L)分高低组: 低TK1组(n = 39), 中位生存时间为17.3 mo, 高TK1组(n = 38), 中位生存时间16.6 mo, 但Kaplan-Meier生存分析显示, 高TK1组和低TK1组之间的生存率差异无统计学意义(P = 0.527, 图3A). Mann-Whitney检验分析提示: 肝癌患者中, 血清TK1水平在存活组(n = 69)为1.660(0.915, 3.520) pmol/L, 在死亡组(n = 8)为3.875(1.558, 4.650) pmol/L. TK1在死亡组和存活组的差异无统计学意义(P>0.05), 死亡组的秩均值49.63>存活组秩均值37.77, 如图3D.
BCLC分期是目前将肿瘤分期治疗方案和预期生存相结合的唯一分期系统, Kaplan-Meier生存分析, Log Rank检验显示: 不同的BCLC分级, 生存时间有差别, P<0.05(P = 0.006), 如图3B; 同时BCLC分期(C+D)期和BCLC(A+B)期患者的生存期差别有统计学意义, P<0.05(P = 0.013), 如图3C. Kruskal-Wallis检验分析: TK1的水平在不同的BCLC分期是不同的: BCLC A期患者(n = 10)为0.775(0.635, 0.998)pmol/L; BCLC B期患者(n = 24)为1.175(0.828, 2.003)pmol/L; BCLC C期患者(n = 20)为3.350(1.453, 3.920)pmol/L; BCLC D期患者(n = 23)为3.490(1.540, 4.440)pmol/L, P<0.05(P = 0.000), 如图3E. TK1的水平在BCLC分期(C+D)期患者[n = 43, 3.350(1.540, 4.310)pmol/L]比BCLC分期(A+B)期[n = 34, 1.030(0.700, 1.943)pmol/L]明显升高, 差异有统计学意义, P<0.05(P = 0.000), 如图3F.
胸苷激酶是胸腺嘧啶核苷合成DNA的关键酶之一, 也是嘧啶补救途径中一种细胞周期依赖性酶, 表达于增殖中的细胞中. 在细胞内存在两种形式: 细胞质胸苷激酶(TK1)和线粒体胸苷激酶(TK2), 二者是同工酶, 研究[9-11]表明, TK1无论在人类还是狗等哺乳动物内都是评估增殖细胞的增殖度的重要标志. TK1水平和DNA合成呈正相关, 增殖周期中的细胞的TK1的变化是G0期含量比较低, 到S期后逐渐升高, 至G1期达到最高; 而肿瘤细胞的TK1的变化是在G1/S期交界处开始升高, 持续升高到G2或M期, 因此, TK1的升高与肿瘤细胞生长状态相关[12]. 近年研究[13-16]表明, TK1在肿瘤诊断、监测肿瘤治疗过程、评价预后等方面都有积极意义, 但也有研究[17,18].显示结论不同我国的肝癌多在肝硬化基础上产生, 和其他的实体瘤有明显的区别. 目前TK1在肝癌中的研究报道较少, 因此, 对天津市第三中心医院同期住院的肝硬化及肝癌的患者进行了外周血TK1检测. 本研究中, 我们分析了健康人、肝硬化患者和肝癌患者外周血中血清TK1表达水平的差异、血清TK1对肝癌的诊断效能、血清TK1水平与各临床资料之间的相关性及血清TK1和HCC预后的影响, 主要研究结果分析如下.
在HCC患者外周血中, 血清TK1水平明显升高, 而肝硬化患者和健康献血员之间没有区别. 健康人血清TKl含量极微或检测不到, 而恶性肿瘤患者肿瘤细胞的急剧增殖、细胞DNA合成剧增, 因此TKl水平的升高反映了肿瘤细胞的增殖速率. 研究表明, 血清TK1水平在急慢性淋巴细胞白血病[19]、肺癌[20]、食管癌[21]、乳腺癌[22]及前列腺癌[6]、泌尿系肿瘤[23]的患者中也是明显升高的. HCC患者的TK1水平较肝硬化患者及健康献血员均有明显升高, 说明了肝癌患者的细胞增殖速率和肝硬化状态无关, TK1的升高因肿瘤细胞增殖所致.
TK1可以作为HCC诊断的血清学指标之一. TK1对诊断肝癌的AUC为0.739, 而经典的HCC诊断血清学指标AFP对HCC的诊断的AUC为0.554, 血清TK1较AFP对肝癌有更高的诊断效能. 2010年美国肝病学会肝细胞癌临床指南中[24], AFP不作为肝癌的常规检测, 但是仍有专家建议肝癌的诊断需要监测AFP[24,25], 这从另一方面反映了多种血清学检测指标联合使用的必要性. 同时, 考虑到肝细胞属于暂不增殖细胞或休止细胞(G0期细胞), 进入G1期后不立即转入S期, 在某种刺激下, 如损伤、手术、月经期、献血等, 才进入S期继续增殖. 因此肝功能进展时可能存在肝细胞的增殖, 对TK1水平可能产生影响, 因此我们剔除Child-Pugh C级的患者后进行分析. 结果表明, TK1对肝癌的诊断效能进一步提高, AUC为0.748, 而AFP诊断效率也进一步上升, AUC为0.605. 可见, 肝功能进展对于TK1和AFP的值确有影响, 在应用二者对HCC进行诊断时应该考虑到肝功能分级对他们的影响. 当然, 我们应加大样本量来进一步证实TK1对HCC的诊断效能, 及设计前瞻性的研究来明确是否可通过联合使用TK1和AFP提高HCC血清学诊断的效能.
我们分析了TK1和各临床指标之间的关系, 血清TK1的水平和患者年龄、肝功能分级、BCLC分期、血管侵犯、肿瘤大小、肿瘤个数均呈正相关. 这些指标都是临床常用的评价肿瘤的可获得常用指标, 和肿瘤的分期预后相关, 从而也说明了TK1可能和肿瘤的发生、发展相关. 有研究[26]表明, 在慢性淋巴细胞性白血病患者中TK1可以提示预后, 与性别无关, 与年龄相关, 随年龄的增长而降低. 我们的研究也得到了类似的结论, 与年龄相关, 但随年龄的增殖而TK1升高. 这也是我们进一步需要明确的方向, 是否要建立不同年龄阶段HCC患者的TK1的参考值. 也有研究[21]表明, 在食管癌患者中, 血清TK1水平与TNM分期、肿瘤分化程度和淋巴结转移相关. 本研究拟进一步对同一肝癌患者进行追踪研究, 纵向观察不同疾病发展阶段个体化的TK1的表达.
本研究初步探讨了TK1和HCC预后的关系. 以患者死亡和达到随访终点时间为终点事件, 通过2年的随访, 经生存分析并未得出高TK1组和低TK1组之间的生存率差异; 但差异性分析提示死亡组的秩均值大于存活组秩均值. BCLC分期是目前国际公认的肝癌临床分期系统, 是将肿瘤分期治疗方案和预期生存相结合的唯一分期系统[27-29], 虽然只有2年的随访, 可以看出不同的BCLC分级, 生存时间有差别; 合并分析后显示BCLC分期(C+D)期患者的生存期比BCLC分期(A+B)期明显减低, 而TK1的水平在BCLC分期(C+D)期患者比BCLC分期(A+B)期明显升高, TK1的水平可能预示患者的预后. 其他研究中也有类似的结论: 在食管癌中, 血清TK1水平与患者的全因生存率及无疾病进展生存率相关, 可作为预测患者预后的一个有价值的生物标志物[21]; 在肾癌切除术后或射频治疗术后的患者, 监测TK1的活性可以提示预后[30]. 对肿瘤的生存率来讲, 本研究随访时间尚短, 通过延长观察时间及增大样本量可能会有进一步的发现.
总之, 血清TK1在肝癌患者中升高, 可作为肝癌诊断的血清学标志物之一, 和患者年龄、AST、肝功能分级、BCLC分期、血管侵犯、肿瘤大小、肿瘤个数均呈正相关, 在BCLC(C+D)期的肝癌患者高于BCLC(A+B)期肝癌患者, 可能预示肝癌患者的预后. 本研究的局限在于肝癌患者的样本例数相对较少, 随访时间尚短, 尚需增加样本数, 设计前瞻性的临床研究得出更可靠的研究结果, 为HCC的诊断和预后提供明确、有用的血清学检测指标.
胸苷激酶1(thymi-dine kinase 1, TK1)是评估增殖细胞增殖度的重要标志, 在多种恶性肿瘤中升高表达, 临床上正逐渐被用来早期诊断肿瘤、治疗监测并评价预后.
肝癌起病隐匿, 患者被发现时多已为进展期, 治疗手段有限. 肝癌早诊、预后的指标是研究的热点和重点. TK1反映细胞增殖度, 作为血清学指标方便检测, 如何在肝硬化患者中辅助发现早期肝癌是目前亟待解决的问题.
研究表明, 在食管癌中, 血清TK1水平与患者的全因生存率及无疾病进展生存率相关, 可作为预测患者预后的一个有价值的生物标志物; 在肾癌切除术后或射频治疗术后的患者, TK1的活性和预后相关.
本研究首次表明, 在肝硬化患者中TK1的水平和健康对照人群并无差别, 而肝硬化基础上的肝癌患者中TK1的升高和肿瘤状态相关. 且在本研究的研究范围内, 血清TK1较AFP对肝癌有更高的诊断效能.
TK1可以作为辅助诊断肝癌的方便的血清学指标, 和患者BCLC分期、血管侵犯、肿瘤大小、肿瘤个数等临床肿瘤指标呈正相关, BCLC(C+D)期的肝癌患者高于BCLC(A+B)期肝癌患者, 可能提示患者的预后.
胸苷激酶是胸腺嘧啶核苷合成DNA的关键酶之一, 表达于增殖细胞中. TK1是评估增殖细胞的增殖度的重要标志, 和DNA合成呈正相关. 肿瘤细胞的TK1在G1/S期交界处开始升高, 持续升高到G2或M期, 与肿瘤细胞生长状态相关.
朱小三, 主治医师, 厦门大学附属成功医院消化内科
本研究发现血清TK1在肝癌患者中升高可作为诊断肝癌的血清学标志物之一. TK1的水平和肝细胞癌(hepetocellular carcinoma, HCC)患者年龄、AST、肝功能分级、BCLC分期、血管侵犯、肿瘤大小、肿瘤个数正相关. TK1在BCLC(C+D)期患者高于BCLC(A+B)期肝癌患者, 对判断HCC患者的预后有一定指导意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 2. | Bruix J, Sherman M; Practice Guidelines Committee, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma. Hepatology. 2005;42:1208-1236. [PubMed] [DOI] |
| 3. | Cao X, Wang Y, Yang P, Zhou H, Liu C, Chen Z. Application of serum thymidine kinase 1 of 26 055 cases in health screening for early detection of premalignant/early malignant tumors. Zhongnan Daxue Xuebao Yixueban. 2014;39:1029-1034. [PubMed] [DOI] |
| 4. | Gatt ME, Goldschmidt N, Kalichman I, Friedman M, Arronson AC, Barak V. Thymidine kinase levels correlate with prognosis in aggressive lymphoma and can discriminate patients with a clinical suspicion of indolent to aggressive transformation. Anticancer Res. 2015;35:3019-3026. [PubMed] |
| 5. | Guo Q, Zhu D, Bu X, Wei X, Li C, Gao D, Wei X, Ma X, Zhao P. Efficient killing of radioresistant breast cancer cells by cytokine-induced killer cells. Tumour Biol. 2017;39:1010428317695961. [PubMed] [DOI] |
| 6. | Jagarlamudi KK, Hansson LO, Eriksson S. Breast and prostate cancer patients differ significantly in their serum Thymidine kinase 1 (TK1) specific activities compared with those hematological malignancies and blood donors: implications of using serum TK1 as a biomarker. BMC Cancer. 2015;15:66. [PubMed] [DOI] |
| 7. | 原发性肝癌诊疗规范(2011年版). 临床肝胆病杂志 2011: 1141-1159. |
| 8. | 王 贵强, 王 福生, 成 军, 任 红, 庄 辉, 孙 剑, 李 杰, 李 兰娟, 孟 庆华, 赵 景民. 慢性乙型肝炎防治指南(2015年版). 中国肝脏病杂志(电子版). 2015;1-18. |
| 9. | Jagarlamudi KK, Moreau L, Westberg S, Rönnberg H, Eriksson S. A New Sandwich ELISA for Quantification of Thymidine Kinase 1 Protein Levels in Sera from Dogs with Different Malignancies Can Aid in Disease Management. PLoS One. 2015;10:e0137871. [PubMed] [DOI] |
| 10. | Sala R, Nguyen QD, Patel CB, Mann D, Steinke JH, Vilar R, Aboagye EO. Phosphorylation status of thymidine kinase 1 following antiproliferative drug treatment mediates 3'-deoxy-3'-[18F]-fluorothymidine cellular retention. PLoS One. 2014;9:e101366. [PubMed] [DOI] |
| 11. | Jagarlamudi KK, Westberg S, Rönnberg H, Eriksson S. Properties of cellular and serum forms of thymidine kinase 1 (TK1) in dogs with acute lymphocytic leukemia (ALL) and canine mammary tumors (CMTs): implications for TK1 as a proliferation biomarker. BMC Vet Res. 2014;10:228. [PubMed] [DOI] |
| 12. | Zhou J, He E, Skog S. The proliferation marker thymidine kinase 1 in clinical use. Mol Clin Oncol. 2013;1:18-28. [PubMed] [DOI] |
| 13. | Nisman B, Nechushtan H, Biran H, Gantz-Sorotsky H, Peled N, Gronowitz S, Peretz T. Serum thymidine kinase 1 activity in the prognosis and monitoring of chemotherapy in lung cancer patients: a brief report. J Thorac Oncol. 2014;9:1568-1572. [PubMed] [DOI] |
| 14. | Xu Y, Liu B, Shi QL, Huang PL, Zhou XJ, Ma HH, Lu ZF, Bo Y, Eriksson S, He E. Thymidine kinase 1 is a better prognostic marker than Ki-67 for pT1 adenocarcinoma of the lung. Int J Clin Exp Med. 2014;7:2120-2128. [PubMed] |
| 15. | Chen Z, Guan H, Yuan H, Cao X, Liu Y, Zhou JI, He E, Skog S. Serum thymidine kinase 1 is a reliable maker for the assessment of the risk of developing malignancy: A case report. Oncol Lett. 2015;10:1669-1673. [PubMed] [DOI] |
| 16. | Qin Z, Chen J, Zeng J, Niu L, Xie S, Wang X, Liang Y, Wu Z, Zhang M. Effect of NK cell immunotherapy on immune function in patients with hepatic carcinoma: A preliminary clinical study. Cancer Biol Ther. 2017;18:323-330. [PubMed] [DOI] |
| 17. | Fiala O, Pesek M, Finek J, Benesova L, Minarik M, Bortlicek Z, Topolcan O. The role of neuron-specific enolase (NSE) and thymidine kinase (TK) levels in prediction of efficacy ofEGFR-TKIs in patients with advanced-stage NSCLC [corrected]. Anticancer Res. 2014;34:5193-5198. [PubMed] |
| 18. | López-Martínez B, Vilchis Ordoñez A, Salazar Garcia M, Klünder-Klünder M, Parra-Ortega I, Dorantes-Acosta E, Angeles-Floriano T. Thymidine Kinase: A Biomarker for Recently Diagnosed Acute Leukemia in Pediatric Patients According to the Cell Line Involved. Arch Med Res. 2015;46:630-634. [PubMed] [DOI] |
| 19. | Hagag AA, Saad MA, Mohamed SA. Clinical significance of thymidine kinase in Egyptian children with acute lymphoblastic leukemia. South Asian J Cancer. 2015;4:72-74. [PubMed] [DOI] |
| 20. | Alegre MM, Weyant MJ, Bennett DT, Yu JA, Ramsden MK, Elnaggar A, Robison RA, O'Neill KL. Serum detection of thymidine kinase 1 as a means of early detection of lung cancer. Anticancer Res. 2014;34:2145-2151. [PubMed] |
| 21. | Ji Y, Wu XB, Chen JY, Hu B, Zhu QK, Zhu XF, Zheng MF. Serum thymidine kinase 1 levels correlate with clinical characteristics of esophageal squamous cell carcinoma. Int J Clin Exp Med. 2015;8:12850-12857. [PubMed] |
| 22. | Chen F, Tang L, Xia T, He E, Hu G, Li Y, Zhang M, Zhou J, Eriksson S, Skog S. Serum thymidine kinase 1 levels predict cancer-free survival following neoadjuvant, surgical and adjuvant treatment of patients with locally advanced breast cancer. Mol Clin Oncol. 2013;1:894-902. [PubMed] [DOI] |
| 23. | Rausch S, Hennenlotter J, Teepe K, Kuehs U, Aufderklamm S, Bier S, Mischinger J, Gakis G, Stenzl A, Schwentner C. Muscle-invasive bladder cancer is characterized by overexpression of thymidine kinase 1. Urol Oncol. 2015;33:426.e21-426.e29. [PubMed] [DOI] |
| 24. | Bruix J, Sherman M; American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma: an update. Hepatology. 2011;53:1020-1022. [PubMed] [DOI] |
| 25. | Marrero JA, El-Serag HB. Alpha-fetoprotein should be included in the hepatocellular carcinoma surveillance guidelines of the American Association for the Study of Liver Diseases. Hepatology. 2011;53:1060-1061 author reply 1061-1062. [PubMed] [DOI] |
| 26. | Szánthó E, Bhattoa HP, Csobán M, Antal-Szalmás P, Újfalusi A, Kappelmayer J, Hevessy Z. Serum thymidine kinase activity: analytical performance, age-related reference ranges and validation in chronic lymphocytic leukemia. PLoS One. 2014;9:e91647. [PubMed] [DOI] |
| 27. | Addissie BD, Roberts LR. Classification and staging of hepatocellular carcinoma: an aid to clinical decision-making. Clin Liver Dis. 2015;19:277-294. [PubMed] [DOI] |
| 28. | Lo GH. Updated management of hepatocellular carcinoma. Hepatology. 2011;54:1113. [PubMed] [DOI] |
| 29. | Llovet JM, Brú C, Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis. 1999;19:329-338. [PubMed] [DOI] |
| 30. | Nisman B, Appelbaum L, Yutkin V, Nechushtan H, Hubert A, Uziely B, Pode D, Peretz T. Serum Thymidine Kinase 1 Activity Following Nephrectomy for Renal Cell Carcinoma and Radiofrequency Ablation of Metastases to Lung and Liver. Anticancer Res. 2016;36:1791-1797. [PubMed] |