修回日期: 2016-11-09
接受日期: 2016-11-30
在线出版日期: 2017-01-18
利用小分子干扰RNA(small interfering RNA, siRNA)技术探究体外沉默Krüppel样因子17(Krüppel like factor 17, KLF17)的基因表达对结直肠癌细胞株SW480细胞增殖和迁移的影响, 为抑制结直肠癌复发转移奠定理论基础.
使用基因重组方法构建KLF17的siRNA真核质粒表达载体, 用电转染法转染至人结直肠癌SW480细胞中. 使用荧光定量PCR检测KLF17、E-钙黏素(E-cadherin)和波形蛋白(Vimentin)的基因表达水平; 用Western blot检测KLF17的蛋白表达以及细胞转移相关蛋白E-cadherin和Vimentin的表达. 用四甲基偶氮唑蓝法检测细胞增殖活性.
与对照组相比, 转染siRNA后的SW480细胞培养48 h后增殖能力受到显著抑制, 且细胞形态由圆形或多边形变成梭形并向外伸出多个细胞突起; 转染siRNA后KLF17和E-cadherin蛋白表达以及基因表达水平显著降低, Vimentin的蛋白表达水平和基因表达水平显著升高.
抑制KLF17的表达可以通过诱导结直肠癌细胞发生上皮-间质转化而促进其细胞的增殖以及转移.
核心提要: 本文中干扰Krüppel样因子17(Krüppel like factor 17, KLF17)表达, SW480细胞形态发生变化与波形蛋白(Vimentin)的上调表达相符合. 说明干扰KLF17的表达可以通过诱导Vimentin的上调表达, 使肿瘤细胞形态发生变化, 从而促进肿瘤细胞上皮-间质转化的发生, 引发肿瘤细胞发生侵袭和转移.
引文著录: 瞿紫微, 孟庆彬, 肖新波, 陈华涛, 赵春翔, 张红芬. siRNA靶向干扰KLF17对结直肠癌细胞株SW480增殖和迁移的影响. 世界华人消化杂志 2017; 25(2): 122-128
Revised: November 9, 2016
Accepted: November 30, 2016
Published online: January 18, 2017
To inhibit Krüppel like factor 17 (KLF17) gene expression in human colorectal carcinoma SW480 cells by small interfering RNA (siRNA) technique, and thereby observe the effect of KLF17 gene silencing on the proliferation and migration of SW480 cells, in order to provide the theoretical foundation for inhibiting the recurrence and metastasis of colorectal cancer.
A KLF17 siRNA eukaryotic plasmid expression vector was constructed using genetic recombination, which was then transfected into SW480 cells by electroporation. Fluorescence quantitative PCR was used to detect the mRNA expression levels of KLF17, E-cadherin and Vimentin, while the protein expression of KLF17, E-cadherin and Vimentin was detected by Western blot. The proliferative activity of SW480 cells was assayed by MTT assay.
Compared with the control group, the proliferation ability of siRNA-transfected SW480 cells was significantly suppressed, and the cell morphology changed from round or polygonal to fusiform and cells developed many projections. After siRNA transfection, the mRNA and protein expression levels of KLF17 and E-cadherin were significantly decreased, and the levels of Vimentin mRNA and protein expression were significantly increased in the siRNA interference group.
Down-regulation of KLF17 expression in human colorectal carcinoma SW480 cells may promote cell proliferation and enhance cell migration by inducing epithelial-mesenchymal transition.
- Citation: Qu ZW, Meng QB, Xiao XB, Chen HT, Zhao CX, Zhang HF. Effect of siRNA-mediated inhibition of KLF17 expression on cell proliferation and migration in human colon cancer cell line SW480. Shijie Huaren Xiaohua Zazhi 2017; 25(2): 122-128
- URL: https://www.wjgnet.com/1009-3079/full/v25/i2/122.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i2.122
Krüppel样因子(Krüppel like factors, KLFs)指一类在羧基端有3个C2H2锌指结构的转录因子, 在细胞增殖、分化和凋亡过程中具有广泛调控作用[1]. KLFs不仅能够调控正常细胞的各种生理功能, 还可参与肿瘤细胞多项生理功能的调控. Krüppel样因子17(Krüppel like factor 17, KLF17)是近年新发现的KLF家族成员, 在肺癌和肝癌等恶性肿瘤中表达比较低, 且在肿瘤的分化、增殖和凋亡中发挥重要作用, 常被作为抑癌基因[1-3]. 已有研究[4]证实KLF17在结直肠癌组织中的表达显著低于癌旁正常组织. 结直肠癌作为威胁人类身体健康的第3大肿瘤疾病, 近些年发病率和死亡率都呈现出逐年上升的趋势[4]. 研究[5]表明癌细胞转移是结直肠癌难以治愈以及导致患者死亡的主要原因. 细胞上皮-间质转化(epithelial-mesenchymal transition, EMT)是调控细胞侵袭和转移的重要生理过程, 因此研究肿瘤细胞EMT发生机制对寻找癌症治疗靶点有巨大意义. E-钙黏素(E-cadherin)是一种具有细胞黏附特性的钙依赖性转膜糖蛋白, 是一种肿瘤转移抑制蛋白. 波形蛋白(Vimentin)是细胞EMT间质性标志分子, 是一种细胞骨架结构调节蛋白. E-cadherin和Vimentin作为细胞EMT的主要调控蛋白, 对肿瘤细胞侵袭和转移有重要调节作用. 发生EMT的肿瘤细胞中E-cadherin的表达升高和Vimentin下降, 且肿瘤易发生转移[6,7]. 本实验通过小分子干扰RNA(small interfering RNA, siRNA)靶向干扰结直肠癌细胞株SW480中KLF17的表达, 检测干扰后细胞增殖活性以及E-cadherin和Vimentin在基因水平和蛋白水平的表达, 探究KLF17对结直肠癌细胞侵袭和转移的影响.
人结直肠癌细胞株SW480由本实验室提供; KLF17抗体购自Santa Cruz公司; E-cadherin和Vimentin抗体购自Thermo公司; RNA TRIzol提取试剂盒购自Takara公司; RIPA蛋白裂解液试剂盒购自碧云天公司; 电转杯购自Bio-Rad公司.
1.2.1 人结直肠癌细胞株: SW480培养于含10%胎牛血清的DMEM培养液中, 37 ℃, 5%的CO2条件下培养; 0.3%胰酶消化和传代, 取对数生长期细胞备用.
1.2.2 siRNA的合成和真核表达载体的构建: 根据人KLF17基因序列(Gnen Bank基因数据库No: 173484.3 GI: 104294873)设计KLF17引物, 正向: UUCUGAAUGAAUGUAGAACUU反向: GUUCUACAUUCAUUCAGAAAA. 质粒KLF17-siRNA, 目标序列: AAGTTCTACATTC-ATTCAGAAAA. 载体构建由武汉华联科生物技术有限公司完成.
1.2.3 质粒转染: 使用电转法将经鉴定后的重组表达质粒进行转入SW480细胞. 转染前24 h将细胞进行分瓶传代, 然后用0.25%胰酶消化, PBS缓冲液冲洗3次, 显微镜下细胞计数并调至浓度为2×106/30 μL, 置冰上待用. 将质粒和细胞悬液加入4 mm电转杯中, 混合均匀, 冰浴5-10 min. 电压450 V, 电容500 mu电转条件行电穿孔. 电转完毕后, 将电转杯取出并冰浴5-10 min, 然后将细胞转移到24孔培养板中, 每孔加入含10%胎牛血清的DMEM培养液1 mL, 37 ℃, 5%的CO2条件下培养. 48 h后在倒置荧光显微镜下观察表达绿色荧光蛋白基因的阳性细胞数、强度和分布, 若胞质内荧光强度均匀明亮, 认为转染效率最高, 取此时的细胞进行实验. 以未转染的SW480细胞作为对照, 转染空载质粒作为阴性对照, 将实验分为对照组、阴性对照组和siRNA干扰组.
1.2.4 荧光定量PCR检测基因表达水平: 使用TRIzol法提取细胞总RNA, 用分光光度计检测RNA的浓度和质量. 使用PrimeScriptTM II 1st Strand cDNA Synthesis Kit(Takara公司)进行cDNA合成反应. 采用20 μL反应体系(2×SYBR Premix Ex TaqTM 9 μL, 上游引物0.5 μL, 下游引物0.5 μL, cDNA溶液1 μL, DEPC H2O 9 μL))进行定量聚合酶链反应(quantitative polymerase chain reaction, qPCR)反应, 95 ℃预变性30 s, 95 ℃ 20 s, 60 ℃ 15 s, 72 ℃ 20 s, 40个循环. 各基因qPCR引物序列如表1.
| 基因 | 上游引物(5'-3') | 下游引物(5'-3') |
| KLF17 | TAGTAAAGGGGATGGTGCGA | CTCACACCCTAGCCAAAGCC |
| E-cadherin | TTGTGGAAGGAATGGAGGAGTC | ACCTGGAATTGGGCAAATGTG |
| Vimentin | AGATGGCCCTTGACATTGAG | TGGAAGAGGCAGAGAAATCC |
| GAPDH | CGACCACTTTGTCAAGCTCA | AGGGGTCTACATGGCAACTG |
1.2.5 Western blot检测蛋白含量: 收集转染组和对照组、阴性对照组细胞并用细胞裂解液裂解. 取20 μL裂解样品液进行SDS-PAGE电泳, 表达产物电转移至硝酸纤维素膜上进行反应; 以磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase, GAPDH)作为定量分子质量标志物(Maker), 通过BandScan5.0软件对杂交图像进行分析; 同管中蛋白与GAPDH条带积分光密度值之比作数据分析(RV值), 以反映蛋白的表达程度.
1.2.6 四甲基偶氮唑蓝法检测细胞增殖: 将实验组、对照组和阴性对照组的SW480细胞分别用含10%小牛血清的培养液配成单个细胞悬液并调整细胞密度为1×104个/mL, 然后分别接种于96孔细胞培养板中, 于37 ℃, 50 mL/L CO2培养箱中培养. 每间隔12 h取一批细胞进行细胞增殖检测. 每孔加四甲基偶氮唑蓝(methyl thiazolyl tetrazolium, MTT)溶液(5 mg/mL)20 μL继续培养4 h后除去上清液, 每孔加100 μL二甲亚砜, 震荡15 min使结晶充分溶解; 用酶联免疫仪检测波长540 nm各孔光密度值, 连续检测3 d, 以时间为横坐标, 光密度值为纵坐标绘制生长曲线, 评估细胞的增殖情况.
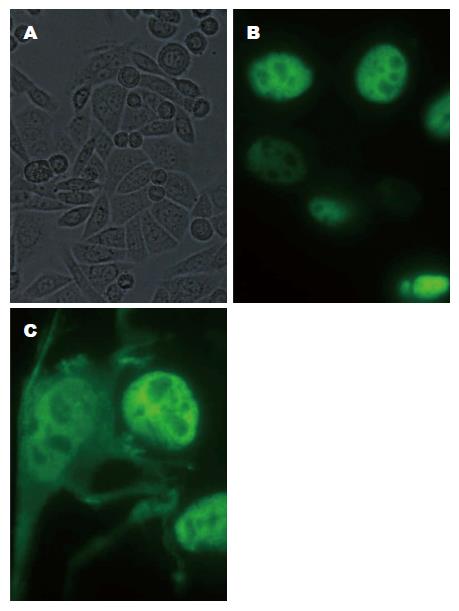
1.2.7 转染前后细胞形态的检测: siRNA干扰KLF17基因转染前后SW480细胞形态检测. 因重组质粒含有编码增强型绿色荧光蛋白的基因, 转染细胞后能发出绿色荧光, 转染48 h后可在倒置荧光显微镜下观察SW480细胞的形态学变化.
统计学处理 使用SPSS18.0统计软件进行数据分析, 分析结果以mean±SD表示, 实验结果使用单因素方差分析进行组间均数的两两比较, 方差齐时选择LSD法, 方差不齐时选择Dunnett T3法, P<0.05或P<0.01表示差异具有统计学意义.
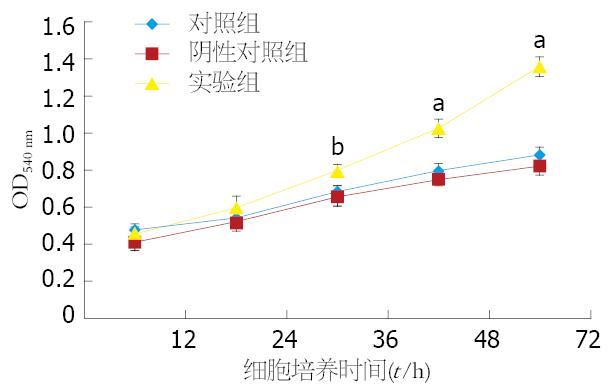
MTT检测实验组和对照组的吸光值如表2和图1所示. siRNA干扰KLF17表达后, 12 h后实验组SW480细胞活性和生长情况开始显著高于对照组和阴性对照组(P<0.05), 48 h组和72 h组SW480细胞活性和生长情况更加优于对照组和阴性对照组(P<0.01).
如图2所示, 对照组和转染空载质粒组的SW480细胞形态呈典型的圆形或多边形. 转染siRNA质粒后SW480细胞变成梭形并且向外伸出多个突起的间充质细胞样.
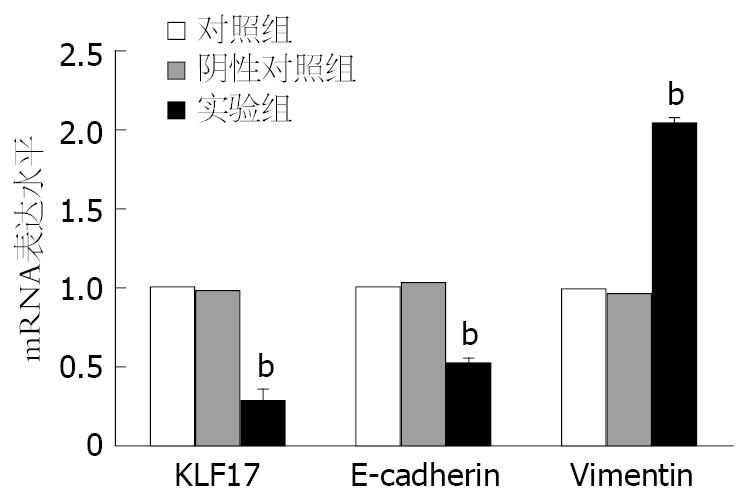
qPCR检测各基因表达结果如图3所示. 转染siRNA的SW480细胞中, KLF17的基因表达水平显著低于对照组和阴性对照组(P<0.01). 实验组E-cadherin基因表达水平显著低于对照组和阴性对照组(P<0.01), 但Vimentin的mRNA水平显著高于对照组和阴性对照组(P<0.01).
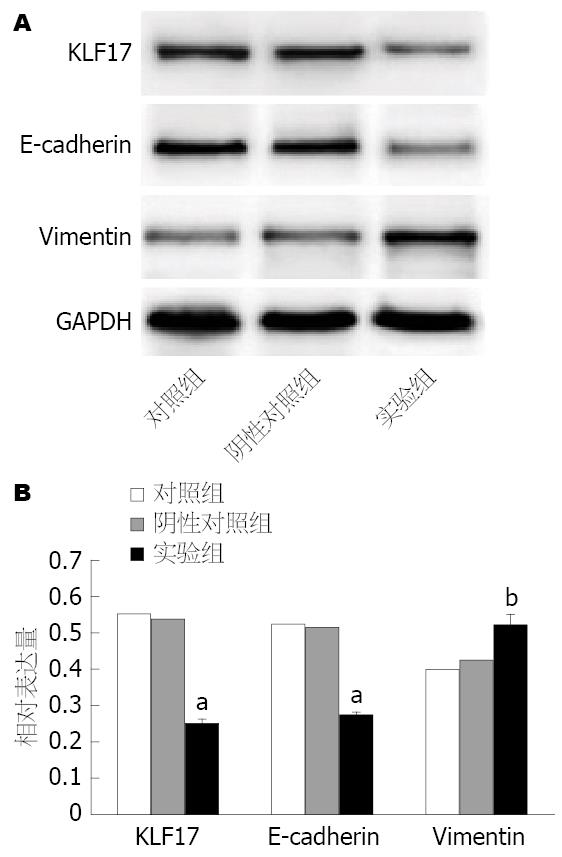
Western blot检测结果如图4所示, KLF17和E-cadherin在siRNA干扰的SW480细胞中的表达显著低于对照组和阴性对照组(P<0.015). 实验组细胞中Vimentin的蛋白表达显著高于对照组和阴性对照组(P<0.01).
本实验通过siRNA干扰人结直肠癌细胞株SW480中KLF17的表达, 通过检测细胞EMT标志物E-cadherin和Vimentin基因和蛋白的表达, 探究KLF17对SW480细胞的增殖活性和侵袭转移能力的影响, 研究KLF17对结直肠癌发生和转移的调控机制, 为探索靶点治疗结直肠癌奠定理论基础.
KLF17属于特化蛋白/KLFs锌指蛋白家族, 具有不同功能的转录因子, 它们可以通过结合不同的启动子或蛋白, 刺激或者抑制细胞的各种生命活动. 近年来研究[2,8,9]显示, KLF17在诸多肿瘤细胞中的表达水平低于正常组织中的表达水平, 如肺癌、肝癌和乳腺癌等. KLF17在肿瘤细胞中的下调表达参与肿瘤细胞发生的多种生物学过程, 如细胞的侵袭转移和生长等, 且对治疗肿瘤的预后效应有重要影响. 本研究结果显示, 转入siRNA的人结直肠癌SW480细胞的增殖活性显著高于对照组中未转染细胞, 说明抑制KLF17的表达可以促进肿瘤细胞的增殖. 通过细胞形态学观察发现, siRNA干扰后SW480细胞形态变化显著, 由典型的圆形变成梭形并伸出多个突起的间充质细胞样, 呈现出典型的EMT形态学改变. 在对乳腺癌和肝癌的研究中也证实, KLF17表达水平降低可以促进肿瘤细胞的侵袭和转移[3,9]. Cai等[2]在对肺癌的研究中表明抑制KLF17能够促进肺癌细胞的生长且对肺癌预后产生不良影响. Liu等[10]在对乳腺癌细胞的研究中发现KLF17与肿瘤的发生存在负相关, 这与本实验中抑制KLF17的表达可以促进结直肠癌细胞增殖是一致的.
E-cadherin作为一种黏附蛋白, 在细胞黏附聚集以及维持细胞的形态完整中有着非常重要作用. Stefanou等[11]研究表明, 多种恶性肿瘤的发生和转移与E-cadherin基因表达的下调相关. E-cadherin的表达下调是细胞发生EMT的重要指标. 细胞发生EMT可以使细胞之间黏着力降低, 促进细胞的转移. 本实验结果显示, siRNA干扰KLF17的表达引起E-cadherin基因mRNA表达和蛋白表达均显著低于对照组. E-cadherin基因显著下调, 使细胞间的黏附作用变弱, 细胞之间失去连接, 细胞的形态发生变化, 导致细胞的侵袭和转移能力增强[12]. 说明干扰KLF17的表达可以通过降低E-cadherin的表达水平增强结直肠癌细胞的侵袭和转移能力. E-cadherin的低表达导致肿瘤细胞间黏附作用降低, 肿瘤细胞极易从原发部位脱落, 并沿淋巴管、血管外膜、神经束外衣组织及组织间隙浸润, 破坏邻近正常组织并继续生长, 最终导致肿瘤的浸润性生长与转移[13].
Vimentin是一种中间丝蛋白, 对于维持细胞骨架蛋白形态和结构稳定具有重要作用. 研究证明, Vimentin蛋白的异常表达会导致细胞骨架蛋白结构发生变化, 由原来的立方形转变为纺锤形, 易于细胞的游动和转移[14]. 在本实验中, 实验组的SW480细胞中, Vimentin的基因表达和蛋白表达显著高于对照组. 关于Vimentin的上调表达可以促进肿瘤细胞的侵袭和转移, 在多种恶性肿瘤中均有报到[15-17]. 本研究中干扰KLF17表达, SW480细胞形态发生变化与Vimentin的上调表达相符合. 说明干扰KLF17的表达可以通过诱导Vimentin的上调表达, 使肿瘤细胞形态发生变化, 从而促进肿瘤细胞EMT的发生, 引发肿瘤细胞发生侵袭和转移. E-cadherin和Vimentin是肿瘤细胞发生EMT的重要标志, 在本研究中干扰KLF17的表达可以促进E-cadherin的表达降低和Vimentin的表达升高, 说明KLF17可以诱导结直肠癌SW480细胞发生EMT, 从而促进肿瘤细胞的侵袭和转移.
总之, KLF17作为重要的抑癌基因在癌症治疗和预后均有非常重要的作用. 但目前KLF17对结直肠癌作用机制仍处于探索阶段. 本研究通过siRNA干扰KLF17的表达, 可以增强肿瘤细胞的增殖活性以及使肿瘤细胞形态发生变化. 通过基因水平和蛋白水平检测发现siRNA干扰KLF17表达可以诱导Vimentin的上调表达以及E-cadherin的下调表达, 符合肿瘤细胞EMT的发生机制, 从而可以得出干扰KLF17的表达可以促进肿瘤细胞发生侵袭和转移.
Krüppel样因子(Krüppel like factors, KLFs)在细胞增殖、分化和凋亡过程中具有广泛调控作用. KLFs不仅能够调控正常细胞的各种生理功能, 还可参与肿瘤细胞多项生理功能的调控. Krüppel样因子17(Krüppel like factor 17, KLF17)是近年新发现的KLF家族成员, 在肿瘤的分化、增殖和凋亡中发挥重要作用, 常被作为抑癌基因.
本文通过小分子干扰RNA(small interfering RNA, siRNA)干扰人结直肠癌细胞株SW480中KLF17的表达, 检测KLF17对SW480细胞的增殖活性和侵袭转移能力的影响, 探究KLF17对结直肠癌发生和转移的调控作用. 为探索靶点治疗结直肠癌奠定理论基础.
KLF17是近年新发现的KLF家族成员, 在肺癌和肝癌等恶性肿瘤中表达比较低, 且在肿瘤的分化、增殖和凋亡中发挥重要作用, 常被作为抑癌基因. E-钙黏素(E-cadherin)、波形蛋白(Vimentin)是细胞上皮-间质转化(Epithelial-mesenchymal transition, EMT)间质性标志分子, 是一种细胞骨架结构调节蛋白. E-cadherin和Vimentin作为细胞EMT的主要调控蛋白, 对肿瘤细胞侵袭和转移有重要调节作用.
本文通过siRNA靶向干扰结直肠癌细胞株SW480中KLF17的表达, 检测干扰后细胞增殖活性以及E-cadherin和Vimentin在基因水平和蛋白水平的表达, 探究KLF17对结直肠癌细胞侵袭和转移的影响.
KLF17作为重要的抑癌基因在癌症治疗和预后均有非常重要的作用. 通过siRNA干扰KLF17的表达, 可以增强肿瘤细胞的增殖活性以及使肿瘤细胞形态发生变化, 为结直肠癌的治疗提供了一条思路.
上皮-间质转化(EMT): 是指上皮细胞在特定的生理和病理情况下向间质细胞转化的现象, 其主要特征是上皮细胞表型的缺失及间质特性的获得.
崔莲花, 教授, 青岛大学医学院公共卫生系; 高英堂, 研究员, 天津市第三中心医院; 司富春, 教授, 河南中医学院中医药分子生物学实验室
本文运用siRNA技术体外沉默KLF17基因并转染至人结直肠癌细胞中, 探究KLF17对结直肠癌发生和转移的调控作用. 研究内容对于进一步阐释KLF17在结直肠癌等肿瘤发生发展中的作用具有一定的创新性和较好的科学价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | van Vliet J, Crofts LA, Quinlan KG, Czolij R, Perkins AC, Crossley M. Human KLF17 is a new member of the Sp/KLF family of transcription factors. Genomics. 2006;87:474-482. [PubMed] [DOI] |
| 2. | Cai XD, Zhou YB, Huang LX, Zeng QL, Zhang LJ, Wang QQ, Li SL, Feng JQ, Han AJ. Reduced expression of Krüppel-like factor 17 is related to tumor growth and poor prognosis in lung adenocarcinoma. Biochem Biophys Res Commun. 2012;418:67-73. [PubMed] [DOI] |
| 3. | Liu FY, Deng YL, Li Y, Zeng D, Zhou ZZ, Tian DA, Liu M. Down-regulated KLF17 expression is associated with tumor invasion and poor prognosis in hepatocellular carcinoma. Med Oncol. 2013;30:425. [PubMed] [DOI] |
| 5. | 曾 元凤, 肖 移生, 罗 小江, 胡 国柱, 路 名芝, 吴 晓牧, 辛 洪波. FMNL3基因转染对结直肠癌SW480细胞EMT和体外侵袭能力的影响. 重庆医学. 2014;43:1460-1462. |
| 7. | 李 智, 庄 競, 韩 广森, 李 永刚, 黄 涛. 人结直肠癌组织中E-cadherin、整合素α5β1的表达. 郑州大学学报(医学版). 2005;40:880-882. |
| 8. | Gumireddy K, Li A, Gimotty PA, Klein-Szanto AJ, Showe LC, Katsaros D, Coukos G, Zhang L, Huang Q. KLF17 is a negative regulator of epithelial-mesenchymal transition and metastasis in breast cancer. Nat Cell Biol. 2009;11:1297-1304. [PubMed] [DOI] |
| 9. | Ismail IA, Kang HS, Lee HJ, Kim JK, Hong SH. DJ-1 upregulates breast cancer cell invasion by repressing KLF17 expression. Br J Cancer. 2014;110:1298-1306. [PubMed] [DOI] |
| 10. | Liu CY, Shi JH, Zhou JS, Zeng QL, Zhang LJ, Wang QQ, Li SL, Feng JQ, Han AJ. Mechanism of TNFα regulation KIF4 expression in breast cancer cells SK-BR-3. Zhongliu Fangzhi Yanjiu. 2015;42:117-120. |
| 11. | Stefanou D, Goussia AC, Arkoumani E, Agnantis NJ. Expression of vascular endothelial growth factor and the adhesion molecule E-cadherin in non-small cell lung cancer. Anticancer Res. 2003;23:4715-4720. [PubMed] |
| 12. | Graziano F, Arduini F, Ruzzo A, Bearzi I, Humar B, More H, Silva R, Muretto P, Guilford P, Testa E. Prognostic analysis of E-cadherin gene promoter hypermethylation in patients with surgically resected, node-positive, diffuse gastric cancer. Clin Cancer Res. 2004;10:2784-2789. [PubMed] [DOI] |
| 13. | Shiozaki H, Oka H, Inoue M, Tamura S, Monden M. E-cadherin mediated adhesion system in cancer cells. Cancer. 1996;77:1605-1613. [PubMed] [DOI] |
| 14. | Singh S, Sadacharan S, Su S, Belldegrun A, Persad S, Singh G. Overexpression of vimentin: role in the invasive phenotype in an androgen-independent model of prostate cancer. Cancer Res. 2003;63:2306-2311. [PubMed] |
| 15. | Colomiere M, Findlay J, Ackland L, Ahmed N. Epidermal growth factor-induced ovarian carcinoma cell migration is associated with JAK2/STAT3 signals and changes in the abundance and localization of alpha6beta1 integrin. Int J Biochem Cell Biol. 2009;41:1034-1045. [PubMed] [DOI] |
| 16. | 田 茗源, 王 林辉, 张 雄, 罗 红池, 李 昱. 肺癌组织中E-cadherin和Vimentin的表达及其与上皮-间质转化的相关性. 中国生物制品学杂志. 2011;24:1068-1071. |
| 17. | Rismanchi S, Yadegar O, Muhammadnejad S, Amanpour S, Taghizadeh-Jahed M, Muhammadnejad A. Expression of vimentin filaments in canine malignant mammary gland tumors: A simulation of clinicopathological features of human breast cancer. Biomed Rep. 2014;2:725-728. [PubMed] [DOI] |