修回日期: 2017-04-11
接受日期: 2017-05-02
在线出版日期: 2017-06-08
探讨氢质子磁共振波谱(1H magnetic resonance spectroscopy, 1H MRS)分析胰腺癌瘤体与瘤旁导管上皮内瘤变(pancreatic duct intraepithelial neoplasia, Pan IN)病变及肿瘤不同分化程度的代谢物差异.
病理确诊为胰腺导管腺癌的患者47例(低分化17例、中分化30例), 术前均行1H MRS检查, 使用呼吸门控的抑水点分辨波谱序列对肿瘤的瘤体、瘤旁组织进行1H MRS检测. 分析出每个1H MRS数据的胆碱峰(choline-containing metabolites, CCM)/脂肪峰(lipid, Lip)、胆固醇及不饱和脂肪酸峰(cholesterol and unsaturated fatty acids, Chol+Unsat)/Lip、Chol+Unsat/CCM的峰下面积比, 采用配对样本t检验比较瘤体和瘤旁组织的代谢物差异, 用独立样本t检验比较胰腺导管腺癌低分化组和中分化组的代谢物差异.
同时获得瘤体和瘤旁数据共24例, 瘤体组织的CCM/Lip高于瘤旁组织(0.266±0.084 vs 0.200±0.081), 瘤体组织的Chol+Unsat/Lip高于瘤旁组织(0.324±0.109 vs 0.258±0.092), 差异均有统计学意义(P<0.05), 瘤体和瘤旁组织的Chol+Unsat/CCM无统计学差异; 胰腺低分化和中分化导管腺癌的CCM/Lip、Chol+Unsat/Lip、Chol+Unsat/CCM无统计学差异.
1H MRS对鉴别胰腺癌与瘤旁Pan IN病变具有一定意义, 但不可预测其肿瘤分化程度.
核心提要: 探讨氢质子磁共振波谱(1H magnetic resonance spectroscopy, 1H MRS)分析胰腺癌瘤体与瘤旁导管上皮内瘤变(pancreatic duct intraepithelial neoplasia, Pan IN)病变及肿瘤不同分化程度的代谢物差异. 研究发现瘤体组织的胆碱峰/脂肪峰(lipid, Lip)、胆固醇及不饱和脂肪酸峰/Lip高于瘤旁组织, 1H MRS对鉴别胰腺癌与瘤旁Pan IN病变具有一定意义, 但不可预测其肿瘤分化程度.
引文著录: 方旭, 边云, 陈士跃, 陆建平, 王莉. 氢质子磁共振波谱对胰腺癌分析及其分化程度相关性研究. 世界华人消化杂志 2017; 25(16): 1454-1460
Revised: April 11, 2017
Accepted: May 2, 2017
Published online: June 8, 2017
To assess the difference in the metabolites of tumor and peritumoral pancreatic duct intraepithelial neoplasia (PanIN) tissues and assess tumor differentiation in pancreatic cancer by 1H magnetic resonance spectroscopy (1H MRS).
Forty-seven patients with histopathologically confirmed pancreatic duct adenocarcinoma, including 17 with poorly differentiated tumors and 30 with moderately differentiated tumors, were included in this study. Before operation, respiration-triggered water suppression point-resolved spectroscopy (PRESS) sequence of 1H MRS was used for detection of metabolites in tumor and peritumoral PanIN tissues to calculate the ratio of choline-containing metabolites (CCM) peak area to lipid (Lip) peak area (CCM/Lip), the ratio of cholesterol and unsaturated fatty acids (Chol+Unsat) peak area to Lip peak area (Chol+Unsat/Lip), and the ratio of Chol+Unsat peak area to CCM peak area (Chol+Unsat/CCM). The paired sample t test was used for comparing metabolites in tumors and peritumoral PanIN tissues. The independent sample t test was used for comparing metabolites in poorly and moderately differentiated tumors of pancreatic duct adenocarcinoma.
1H MRS data of tumor and peritumoral PanIN tissues were both obtained in 24 patients. The ratios of CCM/Lip and Chol+Unsat/Lip were significantly higher in tumors than in peritumoral PanIN tissues (0.266 ± 0.084 vs 0.200 ± 0.081, 0.324 ± 0.109 vs 0.258 ± 0.092, P < 0.05), but the ratio of Chol+Unsat/CCM had no statistical difference between tumor and peritumoral Pan IN tissues. The ratios of CCM/Lip, Chol+Unsat/Lip, and Chol+Unsat/CCM had no statistical differences between poorly and moderately differentiated tumors of pancreatic duct adenocarcinoma.
1H MRS can be used to distinguish tumor and peritumoral PanIN tissues in pancreatic cancer, but cannot be used to assess tumor differentiation.
- Citation: Fang X, Bian Y, Chen SY, Lu JP, Wang L. 1H magnetic resonance spectroscopy for differentiation of tumor tissue from peritumoral pancreatic duct intraepithelial neoplasia and assessment of tumor differentiation in pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2017; 25(16): 1454-1460
- URL: https://www.wjgnet.com/1009-3079/full/v25/i16/1454.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i16.1454
胰腺癌(pancreatic cancer, PC)是一种临床表现隐匿, 早期诊断困难、发展迅速和预后极差的消化系恶性肿瘤. 针对PC特别是早期PC有效的筛查方法迄今仍未找到. 氢质子磁共振波谱(1H magnetic resonance spectroscopy, 1H MRS)分析是最具潜力的方法之一[1,2]. MRS分析是一种利用核磁共振现象和化学位移作用对一系列特定原子核及其化合物进行分析的方法, 能无创的研究活体器官、组织能量代谢、生化改变及化合物定量分析[3]. MRS已在中枢神经系统和前列腺疾病取得一定研究成果[4-7]. 国内外学者也在PC与慢性胰腺炎、正常胰腺等研究[8-10]中发现代谢物的差异性. 胰腺导管上皮内瘤变(pancreatic duct intraepithelial neoplasia, Pan IN)是最重要的PC癌前病变[11], 其中Adsay等[12]发现约82%的PC周围发现Pan IN病变. 本文旨在通过对比PC瘤体与瘤旁组织, 以及不同分化程度的PC在1H MRS的代谢物差异, 分析1H MRS对PC的临床应用价值.
选择2015-05/2016-08在上海长海医院手术及病理确诊的47例胰腺导管腺癌患者, 男性27例, 女性20例, 年龄为40-77岁, 平均年龄为60岁; 中分化导管腺癌30例, 低分化导管腺癌17例; 胰头癌30例, 胰体尾癌17例. 所有患者均在术前1 wk内行1H MRS检查. 病例纳入标准: (1)临床资料提示PC可能性大且准备行手术切除; (2)增强计算机断层扫描或磁共振成像检查胰腺发现乏血供实性肿块, 且病灶直径≥2.0 cm; (3)病理诊断瘤体为胰腺导管腺癌, 瘤旁为Pan IN; (4)无磁共振检查相关禁忌, 生命体征平稳; (5)术前未行放化疗.
1.2.1 1H MRS扫描: 采用美国GE Signa Excite 3.0T超导型MR仪进行扫描, 嵌入式线圈用于信号激发, 8通道体部相控阵线圈用于信号接收. 所有患者于MR检查前4 h禁食禁水, 训练呼吸, 尽量减少扫描伪影. 先进行胰腺常规横断面T1WI、T2WI、冠状位T2WI和2D MRCP、DWI扫描, 再进行1H MRS分析, 最后多期增强扫描.
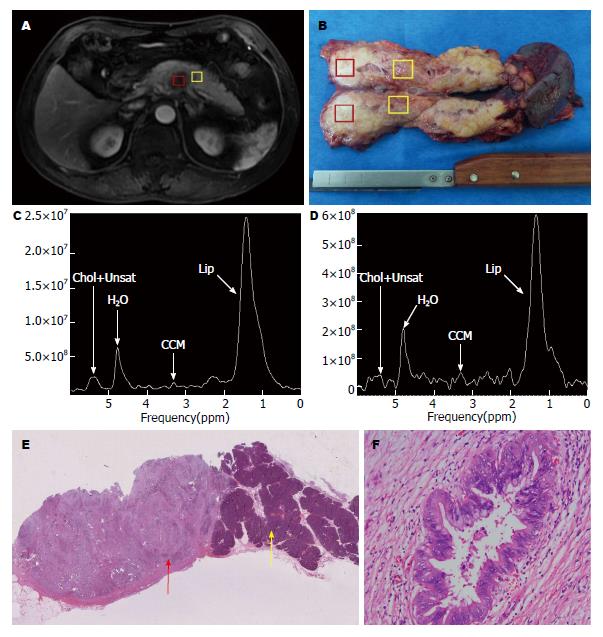
1H MRS分析使用呼吸门控的单体素点分辨波谱(point-resolved spectroscopy, PRESS)序列采集模式, TR3333ms, TE144ms. 选取肿块内部相对均匀的部分作为感兴趣区容积(volume of interest, VOI), 在进行三平面VOI选取时需结合胰腺T1WI、T2WI图像, 大小至少需2 cm×2 cm×2 cm, 并且避开肿瘤坏死囊变区和周围血管、肠管和胰胆管区. 为了避免周围组织对VOI的影响, 还需加用上、下、前、后、左、右共计6个方向的饱和带, 如图1. 定位完成后进行预扫描和匀场, 当水峰半高度<25且抑水率>80%后启动1H MRS采集, 时间约3 min 7 s.
1.2.2 瘤旁组织选取和病理取材: 在瘤旁1H MRS的定位一般选取距胰腺肿块边缘周围3 cm之内相对均匀的部分作为VOI(图2A), 其余要求均与瘤体定位相同. 手术后对胰腺标本进行大切片制作, 根据1H MRS定位的位置和病理大切片标本一一对照, 对瘤体和瘤旁组织切片取材、HE染色和病理诊断(图2E).
1.2.3 统计方法: 使用GE工作站软件(Function 6.3.13, GE ADW4.4, United States)所带的SAGE软件包对数据进行后处理, 分别测量PC瘤体和瘤旁两个VOI的1H MRS数据, 恒定出现的代谢物包括位于5.4-5.6 ppm的胆固醇及不饱和脂肪酸峰(cholesterol and unsaturated fatty acids, Chol+Unsat)、4.7 ppm残余水峰、3.2 ppm胆碱代谢物峰(choline-containing metabolites, CCM)及1.3 ppm脂肪峰(lipid, Lip), 如图2. 分析出各代谢物峰下面积, 计算出每个1H MRS数据的CCM/Lip、Chol+Unsat/Lip、Chol+Unsat/CCM的峰下面积比值.
统计学处理 采用SPSS20.0统计软件进行数据分析, 对所有计量资料进行正态检验和方差齐性检验, 计量资料连续性变量若符合正态分布以mean±SD表示. 使用配对样本t检验对PC瘤体和瘤旁组织的CCM/Lip、Chol+Unsat/Lip、Chol+Unsat/CCM的峰下面积比进行两两比较; 使用独立样本t检验对低分化和中分化导管腺癌瘤体组织的CCM/Lip、Chol+Unsat/Lip、Chol+Unsat/CCM的峰下面积比进行两两比较. P<0.05为差异有统计学意义.
由于PC特殊的生长方式, 多数胰头、体癌上游胰管扩张, 瘤旁组织萎缩, 导致VOI过小无法采集数据, 所以同时获取瘤体和瘤旁组织1H MRS数据的患者仅共24例. PC瘤体组织的CCM/Lip、Chol+Unsat/Lip比值明显高于瘤旁组织(均P<0.05), 差异有统计学意义(表1); 瘤体和瘤旁组织的Chol+Unsat/CCM比值, 无统计学意义.
| CCM/Lip | Chol+Unsat/Lip | Chol+Unsat/CCM | |
| 瘤体 | 0.266±0.084 | 0.324±0.109 | 0.132±0.066 |
| 瘤旁 | 0.200±0.081 | 0.258±0.092 | 0.164±0.079 |
| t值 | 3.16 | 2.37 | -0.80 |
| P值 | 0.004 | 0.027 | 0.43 |
大多数PC诊断明确时已属中晚期, 并且其发病率在全球范围内呈上升趋势[13,14]. 大量的文献资料表明, PC的手术切除率<20%, 大多患者确诊时已失去手术机会, 术后5年生存率<5%[15,16], 由此可见, 早期发现、早期手术治疗是改善预后的关键. 1H MRS可通过无创性检测分析出活体组织的代谢物改变, 但在胰腺疾病中仍处于研究阶段. 国内外多位学者使用1H MRS研究胰腺疾病的对象大多数是异体对比, 本研究对象为同体的PC瘤旁Pan IN病变与瘤体组织, 避免了个体差异性的影响.
1H MRS限制其广泛运用于临床的因素较多, 如解剖位置深、周围脏器影响、患者呼吸配合等. 为了提高MRS采集成功率, 检查前受检者禁食禁水6 h至关重要, 防止肠内容物影响成像质量. 准确的采集VOI, 而不被VOI以外的信号污染, 是1H MRS成功的前提, 一定要避开肿瘤坏死囊变区和周围血管、肠管和胰胆管区. 本研究VOI勾绘的体积最小为2 cm×2 cm×2 cm, 肿瘤较大时可增加为2.5 cm×2.5 cm×2.5 cm, VOI过小时组织信息量少, VOI过大则产生容积效应, 并在VOI周围施加多个饱和带可进一步防止周围组织影响, 起到"双保险"作用. 随着3.0T场强磁共振在临床的广泛运用, 大部分1H MRS的研究均采用单体素PRESS序列, 可提高信噪比. 胰腺1H MRS采集前需行抑水处理, 因水的浓度是其他代谢产物浓度的10000-100000倍, 若不采用抑水处理, 其他代谢物的峰会被掩盖, 所以当匀场抑水率>80%后扫描, 才可获得较好谱线数据. 受检患者大多数为中老年人, 身体基本情况较差, 屏气不佳, 所有扫描时采用呼吸触发技术而不采用屏气技术.
1H MRS的数据含有多个代谢物的信号, 其代谢物的定量分析为相对定量, 并非绝对定量, 所以需使用各个代谢物峰下面积之比来进行相对定量分析, 在脑肿瘤研究中常以肌酸为参照物, 其他代谢物与之面积比值相比, 但在胰腺肿瘤中仍未发现较稳定的参照代谢物. 很多胰腺1H MRS研究在非抑制水的条件下, 用其他代谢物与水峰下面积之比进行相对定量分析, 但前文提到水的含量过多会大大掩盖其他代谢物峰值, 影响测量准确性. 因此, 本研究经过抑水处理后, 进行CCM/Lip、Chol+Unsat/Lip、Chol+Unsat/CCM的峰下面积比的比较.
CCM是细胞膜磷脂合成(如肿瘤细胞增殖)的重要代谢成分, 胆碱含量升高反应了细胞膜成分增加和细胞增殖加快[17]. 目前在前列腺、乳腺、脑等研究中被认为是恶性肿瘤的标志物[18-20], 在评价肿瘤细胞增殖活性和恶性度中起首要作用[21]. 何新红等[22]在大鼠正常胰腺组织和PC比较研究中, 发现大鼠PC的CCM峰强度比正常胰腺组织增加. Kaplan等[8]发现CCM在PC中含量增高. 但是, 黄文才等[9]研究得出PC的CCM/Glx小于正常胰腺组织和肿块型胰腺炎. 马霄红等[23]在非抑水、以水峰为参照物对比33例PC组和正常胰腺30例对照组, 也发现PC的胆碱含量较正常组减低. 以上研究结论存在较大差异, 我们推测PC中CCM升高或降低取决于病灶区域肿瘤组织和纤维组织所占的比例, 从病理特点考虑[24], PC的肿瘤区域以大量纤维结缔组织增生性间质反应为主, 散在分布小的细胞或细胞团, 肿瘤细胞密度比非肿瘤的胰腺导管细胞密度低, 所以瘤体的胆碱量低. 本研究得出瘤体的CCM/Lip明显高于瘤旁(0.266±0.084 vs 0.200±0.081), 可能原因是Lip含量的比较更有意义.
胰腺正常腺体内含有较多的脂肪组织, 并且随着年龄增加, 胰腺脂肪会逐渐沉积增多. 由于Chol+Unsat含量与Lip含量呈正相关, 所以Chol+Unsat不会影响Chol+Unsat/Lip的结果. 苏天昊等[25]和姚秀忠等[26]发现PC中Chol+Unsat/Lip较正常胰腺增高. 黄文才等[9]发现PC的脂质峰降低. Wang等[27]发现PC较肿块型胰腺炎及正常组织的Lip含量低. 本研究同样得出PC瘤体的Chol+Unsat/Lip高于瘤旁组织(3.24±1.09 vs 2.58±0.92). 从病理特点分析, PC瘤体由肿瘤细胞、纤维成分、慢性炎症细胞组成, 瘤体组织广泛纤维化和肿瘤细胞浸润, 慢慢取代了含有Lip成分的瘤旁组织, 导致低于Lip含量降低.
关于1H MRS分析胰腺导管腺癌分化程度相关性研究, 至今国内外未见报道, 若能发现其代谢物含量与分化程度有一定相关性, 这将是影像病理学的重大突破. 本研究不足之处: (1)很可惜本研究目前也未发现低分化和中分化导管腺癌之间代谢物差异, 可能是样本量较少的原因, 有待进一步更大样本研究; (2)瘤体和瘤旁对照样本量小, 由于PC多发生在胰头部, 多导致瘤旁组织萎缩, VOI过小无法采集数据, 这也是MRS技术的局限性; (3)缺少正常胰腺组织对照, 肿瘤阻塞胰管伴发远端胰腺阻塞性炎症, 正常胰腺组织较少, 所以想同时获得同体的瘤体、瘤旁Pan IN病变、正常组织对照, 难度较大, 需继续积攒病例, 深入研究.
总之, 本研究进一步证实了3.0T 1H MRS在PC研究的可行性, 相对于瘤旁的Pan IN病变, 瘤体组织的CCM/Lip、Chol+Unsat/Lip之比较高, 对鉴别胰腺的癌前病变、早期诊断具有一定的参考价值.
大多数胰腺癌诊断明确时已属中晚期. 大量的文献资料表明, 手术切除率<20%, 大多患者确诊时已失去手术机会, 多于诊断后1年内死亡, 术后5年生存率<5%, 平均生存期仅15-19 mo. 由此可见, 早期诊断改善预后的关键. 通过对比胰腺癌瘤体与瘤旁组织代谢物差异, 为早期诊断提供依据.
如何对胰腺癌做出早期诊断及鉴别诊断仍是研究的热点和难点. 到目前为止, 除了多层螺旋计算机断层扫描(computed tomography, CT)、常规磁共振成像(magnetic resonance imaging, MRI)序列、正电子发射计算机断层成像、超声内镜等检查对胰腺癌早期诊断及鉴别诊断仍有较大局限性, 因此探索新的诊断方法是今后面临的挑战.
近年来磁共振波谱已在中枢神经系统和前列腺疾病等方面广泛运用, 并且取得一定研究成果, 在胰腺疾病诊断的相关研究报道也越来越多, 并得出具有特征性的代谢产物.
本研究是目前唯一能无创性观察胰腺癌组织代谢及生化变化的技术, 是生物代谢研究的重要工具, 有望成为早期诊断胰腺癌、跟踪肿瘤的变化、观察治疗效果的一种全新、敏感、准确的诊断方法, 对胰腺癌做更深层次的影像学评估.
胰腺癌诊断现今常规使用多层螺旋CT或者常规MRI, 但是对于胰腺癌早期诊断及鉴别诊断仍有一定局限性. 本文介绍的磁共振波谱从生化代谢组学角度诊断及鉴别胰腺癌, 为临床诊断提供更精准的检查方式, 值得推广.
磁共振波谱: 是一种利用核磁共振现象和化学位移作用对一系列特定原子核及其化合物进行分析的方法, 能无创的研究活体器官、组织能量代谢、生化改变及化合物定量分析, 是检测活体组织器官生理或病理过程中的化学变化的一种无创的技术, 是生物代谢研究的重要工具.
唐哲, 教授, 主任医师, 郑州大学第一附属医院普外科; 王雅棣, 教授, 主任医师, 北京军区总医院放疗科; 张海蓉, 教授, 主任医师, 昆明医科大学第一附属医院消化内科
本文选题新颖, 该研究用特殊的磁共振波谱手段分析与手术病理的"金标准"对比, 来佐证判断等正确性, 是一个不错的研究.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Condon B. Magnetic resonance imaging and spectroscopy: how useful is it for prediction and prognosis? EPMA J. 2011;2:403-410. [PubMed] [DOI] |
| 2. | An L, Willem van der Veen J, Li S, Thomasson DM, Shen J. Combination of multichannel single-voxel MRS signals using generalized least squares. J Magn Reson Imaging. 2013;37:1445-1450. [PubMed] [DOI] |
| 3. | Gilles FH, Bluml S, Panigraliy A. MR Spectroscopy of Pediatric Brain Disorders. New York: Springer 2013; . |
| 4. | Bulik M, Jancalek R, Vanicek J, Skoch A, Mechl M. Potential of MR spectroscopy for assessment of glioma grading. Clin Neurol Neurosurg. 2013;115:146-153. [PubMed] [DOI] |
| 5. | Levin BE, Katzen HL, Maudsley A, Post J, Myerson C, Govind V, Nahab F, Scanlon B, Mittel A. Whole-brain proton MR spectroscopic imaging in Parkinson's disease. J Neuroimaging. 2014;24:39-44. [PubMed] [DOI] |
| 6. | Caivano R, Cirillo P, Balestra A, Lotumolo A, Fortunato G, Macarini L, Zandolino A, Vita G, Cammarota A. Prostate cancer in magnetic resonance imaging: diagnostic utilities of spectroscopic sequences. J Med Imaging Radiat Oncol. 2012;56:606-616. [PubMed] [DOI] |
| 7. | Tiwari P, Kurhanewicz J, Madabhushi A. Multi-kernel graph embedding for detection, Gleason grading of prostate cancer via MRI/MRS. Med Image Anal. 2013;17:219-235. [PubMed] [DOI] |
| 8. | Kaplan O, Kushnir T, Askenazy N, Knubovets T, Navon G. Role of nuclear magnetic resonance spectroscopy (MRS) in cancer diagnosis and treatment: 31P, 23Na, and 1H MRS studies of three models of pancreatic cancer. Cancer Res. 1997;57:1452-1459. [PubMed] |
| 10. | Cho SG, Lee DH, Lee KY, Ji H, Lee KH, Ros PR, Suh CH. Differentiation of chronic focal pancreatitis from pancreatic carcinoma by in vivo proton magnetic resonance spectroscopy. J Comput Assist Tomogr. 2005;29:163-169. [PubMed] [DOI] |
| 11. | Haugk B. Pancreatic intraepithelial neoplasia-can we detect early pancreatic cancer? Histopathology. 2010;57:503-514. [PubMed] [DOI] |
| 12. | Adsay NV, Basturk O, Cheng JD, Andea AA. Ductal neoplasia of the pancreas: nosologic, clinicopathologic, and biologic aspects. Semin Radiat Oncol. 2005;15:254-264. [PubMed] [DOI] |
| 13. | 赵 平, 王 成峰. 胰腺癌分册. 北京: 人民卫生出版社 2011; 24-56. |
| 14. | 谢 德荣, 马 林, 林 显敢. 胰腺癌临床实践-争论与共识. 广州: 广东科技出版社 2009; 371-373. |
| 15. | DeSantis CE, Lin CC, Mariotto AB, Siegel RL, Stein KD, Kramer JL, Alteri R, Robbins AS, Jemal A. Cancer treatment and survivorship statistics, 2014. CA Cancer J Clin. 2014;64:252-271. [PubMed] [DOI] |
| 16. | Schnelldorfer T, Ware AL, Sarr MG, Smyrk TC, Zhang L, Qin R, Gullerud RE, Donohue JH, Nagorney DM, Farnell MB. Long-term survival after pancreatoduodenectomy for pancreatic adenocarcinoma: is cure possible? Ann Surg. 2008;247:456-462. [PubMed] [DOI] |
| 17. | Sardanelli F, Fausto A, Di Leo G, de Nijs R, Vorbuchner M, Podo F. In vivo proton MR spectroscopy of the breast using the total choline peak integral as a marker of malignancy. AJR Am J Roentgenol. 2009;192:1608-1617. [PubMed] [DOI] |
| 18. | Bartella L, Huang W. Proton (1H) MR spectroscopy of the breast. Radiographics. 2007;27 Suppl 1:S241-S252. [PubMed] [DOI] |
| 19. | Faria JF, Goldman SM, Szejnfeld J, Melo H, Kater C, Kenney P, Huayllas MP, Demarchi G, Francisco VV, Andreoni C. Adrenal masses: characterization with in vivo proton MR spectroscopy--initial experience. Radiology. 2007;245:788-797. [PubMed] [DOI] |
| 20. | Loening NM, Chamberlin AM, Zepeda AG, Gonzalez RG, Cheng LL. Quantification of phosphocholine and glycerophosphocholine with 31P edited 1H NMR spectroscopy. NMR Biomed. 2005;18:413-420. [PubMed] [DOI] |
| 21. | Qayyum A. MR spectroscopy of the liver: principles and clinical applications. Radiographics. 2009;29:1653-1664. [PubMed] [DOI] |
| 22. | 何 新红, 陆 建平, 方 芳, 廖 专, 陆 靖, 邓 惠文, 余 亦华, 汪 剑, 李 兆申. 大鼠慢性胰腺炎离体组织块高分辨氢质子磁共振波谱分析. 中华胰腺病杂志. 2008;8:393-396. |
| 23. | 马 霄虹, 欧阳 汉, 赵 心明, 孙 非, 张 红梅, 周 纯武, 申 皓, 赵 燕风. 3.0TMR在体氢质子波谱分析对胰腺癌代谢特征的半定量研究. 实用放射学杂志. 2012;28:1040-1044. |
| 24. | 武 忠弼译. 里德病理学. 上海: 上海科学技术出版社 2007; 737-740. |
| 27. | Wang AS, Lodi A, Rivera LB, Izquierdo-Garcia JL, Firpo MA, Mulvihill SJ, Tempero MA, Bergers G, Ronen SM. HR-MAS MRS of the pancreas reveals reduced lipid and elevated lactate and taurine associated with early pancreatic cancer. NMR Biomed. 2014;27:1361-1370. [PubMed] [DOI] |