修回日期: 2017-03-05
接受日期: 2017-03-13
在线出版日期: 2017-04-28
探讨肾素-血管紧张素系统(renin angiotensin system, RAS)在肝癌组织中的表达及血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)刺激肝癌细胞发生上皮间质转换现象.
搜集56例肝癌手术标本, 组织标本石蜡切片, 免疫组织化学法测定血管紧张素转化酶1(angiotensin converting enzyme 1, ACE1)、ACE2、vimentin、ecadherin蛋白表达定量; 将细胞分组, 用AngⅡ刺激肝癌细胞系, 比较不同分组细胞系vimentin、ecadherin蛋白表达差异.
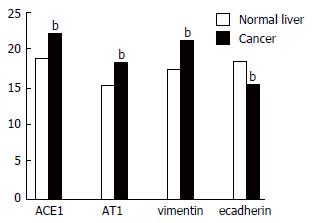
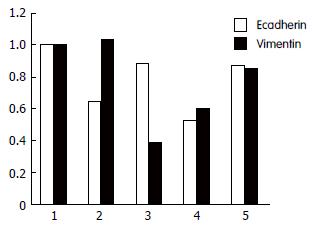
与正常组织相比, 肝癌组织ACE1、AT1表达上升, 上皮间质转化(epithelial mesenchymal transition, EMT)标志物vimentin蛋白表达均上升, ecadherin均下降. AngⅡ刺激下, SSMC7721细胞系的vimentin基因和蛋白表达均上升, ecadherin下降; 加入AngⅡ的抑制剂Ang1-7后, 这种变化受到抑制; 加入Ang1-7的抑制剂A779后, 再次出现vimentin上升, ecadherin表达下降. 单独加入A779与对照组差别不大.
AngⅡ可能通过刺激肝癌细胞发生EMT对肝癌的转移起到促进作用.
核心提要: 肝癌的复发和转移是影响肝癌预后的重要因素. 早期研究发现血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)可以促进肝癌转移, 本论文探讨了AngⅡ通过刺激肝癌细胞发生上皮间质转化促进肝癌转移的分子机制, 从而探讨血管紧张素转化酶抑制剂或血管紧张素受体抑制剂类药物的临床前景, 提供了较新的研究角度.
引文著录: 齐明华, 刘吉奎, 叶静, 李明华, 万汇涓, 漆正宇, 尹耀新, 欧希, 余光银. AngⅡ通过刺激肝癌细胞发生上皮间质转换促进肝癌转移. 世界华人消化杂志 2017; 25(12): 1103-1109
Revised: March 5, 2017
Accepted: March 13, 2017
Published online: April 28, 2017
To detect the expression of molecules of the renin-angiotensin system (RAS) in hepatocellular carcinoma (HCC) and explore whether angiotensin Ⅱ (Ang Ⅱ) induces epithelial-mesenchymal transition (EMT) in SSMC7721 cells.
Fifty-six HCC tissues were collected, and immunohistochemistry and Western blot were used to assess the expression of angiotensin converting enzyme 1 (ACE1), ACE2, vimentin, E-cadherin proteins in these tissues. Ang II was then used to stimulate SSMC7721 cells to detect whether EMT markers such as vimentin and E-cadherin were induced.
Compared with normal tissues, the expression of ACE1 and AT1 in HCC tumor tissues were higher. Ang II up-regulated the expression of vimentin but down-regulated the expression of E-cadherin in SSMC7721 cells.
The RAS may play a role in HCC metastasis.
- Citation: Qi MH, Liu JK, Ye J, Li MH, Wan HJ, Qi ZY, Yin YX, Ou X, Yu GY. Angiotensin Ⅱ induces epithelial-mesenchymal transition in hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2017; 25(12): 1103-1109
- URL: https://www.wjgnet.com/1009-3079/full/v25/i12/1103.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i12.1103
肾素-血管紧张素系统(rennin angiotensin system, RAS)是体内一个重要的神经-体液调节系统, 其中血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)是主要的效应分子. 近年来发现AngⅡ不仅存在于循环系统中, 而且在局部组织, 特别是肿瘤组织中表达明显, 对于肿瘤的发生、发展、转移起到了重要的作用[1]. 原发性肝细胞癌(hepatatocellular carcinoma, HCC)是严重危害人类健康的恶性肿瘤, 患病率为世界第5位, 且有逐年上升趋势, 在男性癌症相关致死原因中位居第3, 每年导致全球约50万人死亡. 高死亡率的原因是因为发现晚, 手术和介入治疗之后复发率很高(有报道[2]称3年的复发率达50%). 因此, 如何防止复发, 并寻找新的治疗手段是一个值得深入探索和需要逐步解决的科学问题.
肝癌复发转移是一个多步骤、多环节的过程. 近年发现上皮间质转化(epithelial mesenchymal transition, EMT)现象与肝癌转移有关. 我们的研究想从AngⅡ为切入点, 研究AngⅡ刺激肝癌细胞发生EMT的现象, 为抑制EMT发生, 从而抑制肿瘤转移提供新的临床治疗的靶点.
56例切片来自2010-2011北京大学深圳医院手术标本. 年龄22-65岁, 所有切片由病理医师诊断明确. 所有病例为初次手术, 未接受过放化疗. 本研究经北京大学深圳医院伦理委员会批准.
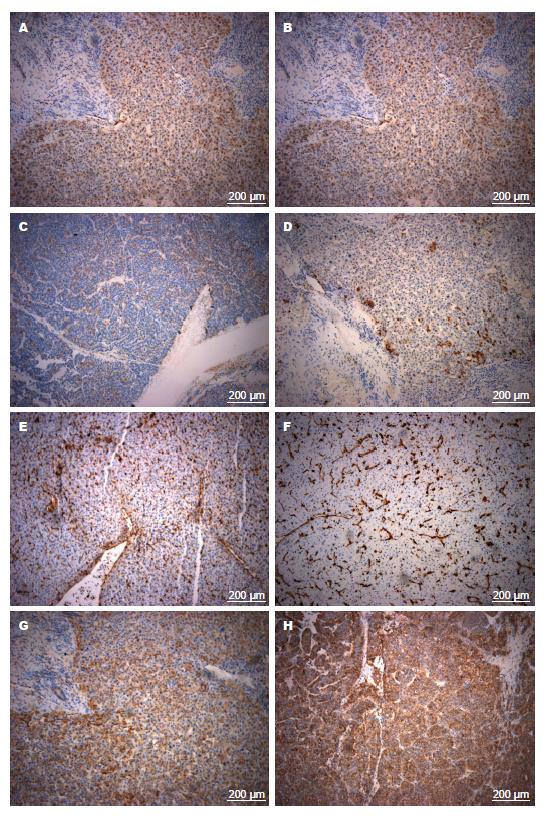
1.2.1 肝脏免疫组织化学实验: 组织由石蜡包埋, 切片, 伊红染色, 光镜观察. 使用血管紧张素转化酶1(angiotensin converting enzyme 1, ACE1)和AT1单抗检测检测RAS主要组分的表达, 使用钙黏蛋白和波形蛋白抗体检测EMT相关蛋白的表达(Novus Biologicals, LLC, Co). 随机拍照10个视野, 使用Imagepro Plus软件分析.
1.2.2 新鲜标本的RNA检测: 100 mg新鲜肝癌组织使用TRIzol法提取总RNA. 使用高效逆转录cDNA试剂盒(First Strand cDNA Synthesis Kit, K1612). ACE1、ACE2、vimentin、ecadherin基因使用ABI-Prism 7500(Applied Biosystems)扩增, 目的基因表达水平使用HPRT法(ΔCtsample = Cttarget gene-Ctreference gene), 并使用2-ΔΔCt法相对定量. 18sRNA由上海生工合成后作为内参.
1.2.3 药物、抗体和细胞培养及分组: 所有药物, 除非特殊说明, 均购自Sigma公司(Sigma化学公司, 路易斯安娜州); 细胞分为6组: 对照组; AngⅡ(10-7 mol/L)组; AngⅡ+Ang1-7(10-5 mol/L)组; AngⅡ+Ang1-7+A779组; Ang1-7+A779组; A779组.
1.2.4 细胞实验中RNA分离及RT-PCR实验: 用TRIzol法提取细胞中的总RNA. 使用合成试剂盒First Strand cDNA Synthesis Kit 1612(Fermantas)合成cDNA. 使用actin作为内参, 引物序列: 5'-GGAAGGTGGACAGCGAGGCC-3', 3'-GTGACGTGGACATCCGCAAAG-5'. vimentin和ecadherin的基因表达使用ABI-Prism 7500仪器(Applied Biosystems). 靶基因mRNA的表达水平使用HPRT来计算(ΔCtsample = Cttarget gene-Ctreference gene), 使用2-ΔΔCt相对定量.
1.2.5 Western blot分析: 细胞由RIPA缓冲液裂解, 加入新鲜消化酶和磷脂酶抑制剂, 后冰上孵育30 min, 4 ℃ 13000 g离心30 min. 取上清, 蛋白浓度测定使用BCA法(Pierce). 细胞裂解, 煮沸, 电泳分离目的蛋白. 转移蛋白至硝酸纤维素膜. 蛋白封闭后, 使用抗vimentin(Novus), 抗ecadherin(Novus), 抗β-actin抗体(Santa Cruz)4 ℃ 1 h孵育. 冲洗, 之后孵育辣根过氧化物酶结合的二抗. TBST冲洗3遍, 加入显影剂和定影剂, 使胶片显影.
统计学处理 采用SPSS13.0软件处理, 数值变量使用mean±SD, 组间比较使用t检验, 多重比较使用方差分析, P<0.05为差异有统计学意义.
结果提示, 与正常组织相比, 肝癌组织ACE1、AT1表达上升, EMT标志基因vimentin表达上升, ecadherin下降, 差异有统计学意义(P<0.01, 图1).
与正常肝组织相比, ACE1、AT1、vimentin在癌巢中的表达较高, ecadherin在癌巢中的表达较低. 差异均具有统计学意义(P<0.001, 表1, 图2).
AngⅡ刺激下, vimentin上升, ecadherin下降; 加入AngⅡ的抑制剂Ang1-7后, 这种变化受到抑制; 加入Ang1-7的抑制剂A779后, 再次出现vimentin上升, ecadherin表达下降. 单独加入A779与对照组差别不大(表2, 图3).
RAS组分中, ACE1-AngⅡ-AT1受体轴和ACE2-Ang1-7-MAS受体轴相互作用, 调控肿瘤的发生、增殖和转移. ACE1-AngⅡ-AT1受体轴促进肿瘤发生、增殖和转移; ACE2-Ang1-7-MAS受体轴抑制肿瘤发生、增殖和转移. 1998年在Lancet上发表的论文是最早的关于血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors, ACEI)和肿瘤转移关系的论著, 研究回顾性调查了5207例长期使用ACEI的患者, 结果提示服用该药物可能降低乳腺癌、肺癌的发生率[3], 之后越来越多的研究开始探讨RAS同乳腺肿瘤、膀胱癌、肝癌和胃肠道肿瘤的关系[4]. 结果表明AngⅡ可以促进肿瘤生长, 血管形成和肿瘤转移, 并且抑制凋亡. 另一方面, Ang1-7、ACEI和血管紧张素受体抑制剂(angiotensin receptor blocker, ARB)类药物可以抑制肿瘤生长, 延长患者生存期[5].
近期的研究主要集中在AT1受体表达和AT1受体同癌症的关系方面. 研究发现AT1在许多癌症中表达异常, 包括前列腺癌、卵巢癌、胰腺癌及胃肠道肿瘤. AT1原本在这些正常组织中都有表达, 在肿瘤中, 表达量有变化[6]. Ang1-7已经进入临床研究, 有好的临床应用前景[7]. 本文提示与正常组织相比, ACE1、AT1和vimentin在肿瘤组织中比正常组织中表达量高, 而且ACE1可能通过AT1起作用. AT1在肿瘤的发生、生长和转移中有表达异常. 研究[8]发现, 大约10%-20%的乳腺癌可以看到AT1高表达, 也许与肿瘤处于增长期有关. 例如, AT1在原位和进展期表达较高, 在转移阶段表达较低[9]. 我们的研究发现AT1在癌巢的表达达高于周围肝组织. 血管紧张素转化酶AngⅡ/AT1通过促进星状细胞增殖加速肝纤维化及肝癌的发生; 通过内皮生长因子受体(epithelial growth factor receptor, EGFR)介导促进肝癌细胞增殖.
这些研究虽然发现Ang Ⅱ/AT1通路对肝脏纤维化, 肝癌血管形成起到促进作用, 但对于Ang Ⅱ/AT1对肝癌转移的其他方面的促进作用研究不多. 近些年, 有学者关注到Ang Ⅱ/AT1对肝癌细胞EMT/MET的调控作用. 传统的细胞理论认为, 所有细胞都从祖细胞分化而来, 但是从20世纪以来, 人们发现除了常规分化以外, 上皮细胞在特定情况下, 可以表现出可塑性, 由一种形态转化为另一种形态. 这些上皮细胞, 与某些介质相互作用后, 逐渐丧失某些上皮细胞的特征, 比如极性, 细胞间连接, 并逐渐获得间质细胞的特征, 比如侵袭能力和迁移能力. 这种现象称之为EMT, 相反的过程称之为间质上皮转换(mesenchymal epithelial transition, MET)[10]. 为了方便研究, 根据发生时情况的不同, 2007年召开的国际EMT大会, 将EMT分为3种类型: Ⅰ型在受精卵种植、胚胎形成、器官形成中发生; Ⅱ型在创伤愈合, 组织重建和纤维化过程中发生; Ⅲ型在肿瘤侵袭和转移中发生. 原发灶的肿瘤细胞可以通过EMT转化为间质细胞, 侵入基底膜, 进入血管发生血行转移, 再通过MET转化为上皮细胞, 形成远处的次级灶.
以往的研究[4]发现, AngII通过AT1受体使得TGF-β表达增强, 从而诱导肝癌细胞发生EMT, 表现为ecadherin下降, vimentin上升; 此外, 还可以使ERK通路及smad通路活化, 表现为ERK蛋白表达升高, smad2蛋白表达升高, 用siRNA干扰抑制AT1表达, 可以导致AT1表达下降, 从而ERK及smad2蛋白表达也下降, TGF-β表达量降低, 而细胞的迁移能力和侵袭能力也降低. 说明, AngⅡ/AT1是可以通过多种通路影响细胞EMT, 从而影响细胞的迁移和侵袭能力的. 研究[4]发现, 予以AT1受体拮抗剂, 比如血管紧张素受体抑制剂类药物(angiotensin receptor blocker, ARB)抑制细胞, 可发现, 细胞的侵袭能力下降, EMT现象减弱; TGF-β表达量下降. 本研究探讨了AngⅡ, 这个居于RAS核心地位的物质, 如何诱导HCC发生EMT, EMT相关蛋白, 如ecadherin和vimentin是如何变化的? 我们的研究发现, AngⅡ刺激下肝癌细胞系表达的EMT相关蛋白会发生变化, 表现为上皮标志物表达下降(cadherin表达物下降), 间质标志物表达上升(vimentin表达物上升). 在临床标本和细胞水平证实了AngⅡ可以刺激肝癌细胞发生EMT.
那么, ACE2/Ang1-7这个轴对肝癌的作用如何呢? 既往的研究发现, AngⅡ/AT1和ACE2/Ang1-7这两个不同的轴对肝癌细胞的转移和迁徙是起到方向相反的调控作用. 对AngⅡ有抑制作用的Ang1-7可以抑制EMT现象, 而这种抑制作用可以被A779解除[11-15]. ACE2/Ang1-7可以抑制多种细胞发生EMT, 如肾小管上皮细胞, 肺癌细胞发生EMT, 表现为细胞迁移和侵袭能力下降, ecadherin上升, vimentin下降, α平滑机动蛋白表达下降. 而加入Ang1-7的抑制剂A779后, EMT又得到部分恢复. 说明, A779及其类似物可以作为潜在的抑制肿瘤转移, 包括肝癌转移的药物, 有一定临床应用的前景. 涉及的信号通路比较多, 包括JNK、ERK和p38等[7]. 本实验中, 我们发现, 在AngⅡ刺激下的肝癌细胞系的EMT同样受到Ang1-7的抑制, 这种抑制作用可以被A779解除.
今后的研究, 我们将进入信号通路的探讨, 深入研究AngⅡ/AT1和ACE2/Ang1-7这两个不同的轴调控EMT的分子机制.
血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)可以刺激肿瘤细胞发生转移, 其机制尚不明确. 上皮间质转化(epithelial mesenchymal transition, EMT)是近些年肿瘤转移机制中的热点问题, 肝癌的转移中研究也较多. 阐明AngⅡ刺激肿瘤中涉及EMT现象的可能性是较为新颖的科研问题.
肝癌转移中的治疗, 比如靶向治疗需要较为精准的分子靶点, 目前差强人意. 需要从多个可能的通路研究. EMT是肿瘤转移中的现象之一, 其机制不清, 抑制EMT的发生, 可能可以抑制肝癌的转移.
肝癌的转移中, 确实出现EMT现象, 转化生长因子β通路, SMAD通路被证实参与了EMT的进程. AngⅡ作为肝脏微环境中的组分, 是否能够刺激肝癌细胞发生EMT, 此类报道不多.
本文从临床标本和细胞水平探讨了AngⅡ刺激肝癌细胞发生EMT的可能性.
本文为血管紧张素受体抑制剂及血管紧张素转化酶抑制剂类药物运用到肝癌转移中的可能性做了基础部分的研究.
上皮间质转换(EMT): 上皮细胞在特定情况下, 可以表现出可塑性, 由一种形态转化为另一种形态. 这些上皮细胞, 与某些介质相互作用后, 逐渐丧失某些上皮细胞的特征, 比如极性, 细胞间连接, 并逐渐获得间质细胞的特征, 比如侵袭能力和迁移能力. 这种现象称之为EMT, 相反的过程称之为间质上皮转换.
范学工, 教授, 中南大学湘雅医院感染病科; 赵春华, 副主任医师, 湖北省宜昌市夷陵医院感染性疾病科
本文总体立题新颖, 内容详实, 结论可信, 具有一定的参考价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Zong H, Yin B, Zhou H, Cai D, Ma B, Xiang Y. Loss of angiotensin-converting enzyme 2 promotes growth of gallbladder cancer. Tumour Biol. 2015;36:5171-5177. [PubMed] [DOI] |
| 2. | Hallas J, Christensen R, Andersen M, Friis S, Bjerrum L. Long term use of drugs affecting the renin-angiotensin system and the risk of cancer: a population-based case-control study. Br J Clin Pharmacol. 2012;74:180-188. [PubMed] [DOI] |
| 3. | Lanas A, Alcedo González J. Chemoprevention in adenocarcinoma of the esophagus. Acta Gastroenterol Latinoam. 2007;37:37-48. [PubMed] |
| 4. | Santhekadur PK, Akiel M, Emdad L, Gredler R, Srivastava J, Rajasekaran D, Robertson CL, Mukhopadhyay ND, Fisher PB, Sarkar D. Staphylococcal nuclease domain containing-1 (SND1) promotes migration and invasion via angiotensin II type 1 receptor (AT1R) and TGFβ signaling. FEBS Open Bio. 2014;4:353-361. [PubMed] [DOI] |
| 5. | Liu Y, Li B, Wang X, Li G, Shang R, Yang J, Wang J, Zhang M, Chen Y, Zhang Y. Angiotensin-(1-7) Suppresses Hepatocellular Carcinoma Growth and Angiogenesis via Complex Interactions of Angiotensin II Type 1 Receptor, Angiotensin II Type 2 Receptor and Mas Receptor. Mol Med. 2015;21:626-636. [PubMed] [DOI] |
| 7. | Zhou L, Xue H, Wang Z, Ni J, Yao T, Huang Y, Yu C, Lu L. Angiotensin-(1-7) attenuates high glucose-induced proximal tubular epithelial-to-mesenchymal transition via inhibiting ERK1/2 and p38 phosphorylation. Life Sci. 2012;90:454-462. [PubMed] [DOI] |
| 8. | Itinteang T, Marsh R, Davis PF, Tan ST. Angiotensin II causes cellular proliferation in infantile haemangioma via angiotensin II receptor 2 activation. J Clin Pathol. 2015;68:346-350. [PubMed] [DOI] |
| 9. | Mack JM, Henken EM, Spencer RP. Nuclear medicine studies of aging--VII. Humeral deltoid tuberosity on bone scans and radiographs. Int J Rad Appl Instrum B. 1989;16:469-472. [PubMed] [DOI] |
| 10. | Arrieta O, Villarreal-Garza C, Vizcaíno G, Pineda B, Hernández-Pedro N, Guevara-Salazar P, Wegman-Ostrosky T, Villanueva-Rodríguez G, Gamboa-Domínguez A. Association between AT1 and AT2 angiotensin II receptor expression with cell proliferation and angiogenesis in operable breast cancer. Tumour Biol. 2015;36:5627-5634. [PubMed] [DOI] |
| 11. | Zhao Y, Chen X, Cai L, Yang Y, Sui G, Fu S. Angiotensin II/angiotensin II type I receptor (AT1R) signaling promotes MCF-7 breast cancer cells survival via PI3-kinase/Akt pathway. J Cell Physiol. 2010;225:168-173. [PubMed] [DOI] |
| 12. | Feng Y, Wan H, Liu J, Zhang R, Ma Q, Han B, Xiang Y, Che J, Cao H, Fei X. The angiotensin-converting enzyme 2 in tumor growth and tumor-associated angiogenesis in non-small cell lung cancer. Oncol Rep. 2010;23:941-948. [PubMed] |
| 13. | Yang X, Zhang Y, Yang Y, Lim S, Cao Z, Rak J, Cao Y. Vascular endothelial growth factor-dependent spatiotemporal dual roles of placental growth factor in modulation of angiogenesis and tumor growth. Proc Natl Acad Sci USA. 2013;110:13932-13937. [PubMed] [DOI] |
| 14. | Kosaka T, Miyajima A, Shirotake S, Kikuchi E, Hasegawa M, Mikami S, Oya M. Ets-1 and hypoxia inducible factor-1alpha inhibition by angiotensin II type-1 receptor blockade in hormone-refractory prostate cancer. Prostate. 2010;70:162-169. [PubMed] [DOI] |
| 15. | Cao Y. VEGF-targeted cancer therapeutics-paradoxical effects in endocrine organs. Nat Rev Endocrinol. 2014;10:530-539. [PubMed] [DOI] |