修回日期: 2016-10-28
接受日期: 2016-11-07
在线出版日期: 2017-01-08
观察其受抑制后对二硫键A氧化还原酶样蛋白(disulfide-bond A oxidoreductase-like protein, DsbA-L)和高分子量(high molecular weight, HMW)脂联素表达的影响.
利用短发夹RNA(short hairpin RNA, shRNA)构建慢病毒载体, 沉默3T3-L1细胞的叉头状转录因子O1(fork head box transcription factor O1, FoxO1)基因, 建立携带shRNA-FoxO1的慢病毒载体, 用qPCR和Western blot法从基因和蛋白水平筛选出最佳干扰效果的shRNA-FoxO1慢病毒载体. 在后续实验中利用此FoxO1-shRNA慢病毒载体沉默3T3-L1 FoxO1基因, 通过Western blot检测DsbA-L、HMW脂联素的表达.
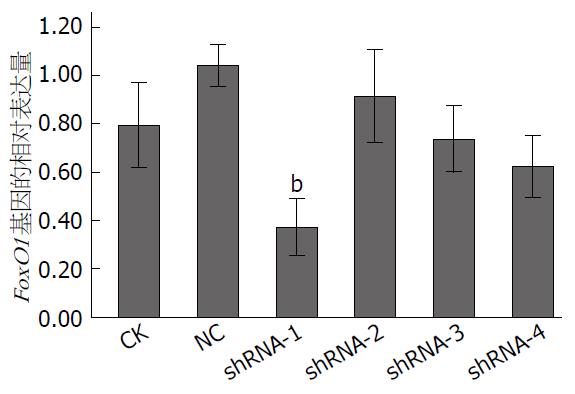
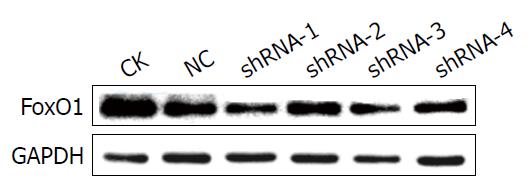
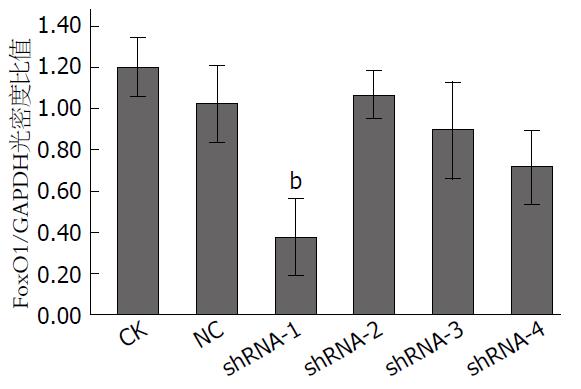
在3T3-L1细胞中筛选出shRNA-1组对FoxO1基因的表达的沉默效果最佳, 抑制率达到60%以上(与对照组相比, 基因相对表达量1.04±0.04 vs 0.37±0.05, P<0.001); 在后续实验选用shRNA-1干预3T3-L1细胞, 用Western blot检测, 并与对照组比较, 结果FoxO1蛋白表达显著减少(与GAPDH光密度比值分别是1.02±0.08和0.38±0.08, P<0.001), 而DsbA-L和HMW表达明显增加(DsbA-L与GAPDH光密度比值分别是0.28±0.06和0.53±0.07, P = 0.009; HMW脂联素与GAPDH光密度比值分别是0.05±0.02和0.11±0.03, P = 0.043).
在3T3-L1细胞中, 沉默FoxO1基因后可促进DsbA-L和HMW脂联素的表达.
核心提要: 脂联素是现在发现的体内对非酒精性脂肪性肝病唯一有益的细胞因子, 主要有脂肪细胞分泌合成. FoxO1是脂肪细胞中重要的信号分子, 作者发现, 利用短发夹RNA构建慢病毒载体, 沉默3T3-L1脂肪细胞的FoxO1后, 可促进二硫键A氧化还原酶样蛋白和高分子量脂联素的表达.
引文著录: 沈震, 刘旭东, 赵晓芳. 3T3-L1细胞中FoxO1基因沉默对高分子量脂联素表达的影响. 世界华人消化杂志 2017; 25(1): 56-63
Revised: October 28, 2016
Accepted: November 7, 2016
Published online: January 8, 2017
To observe the effect of fork head box transcription factor O1 (FoxO1) gene silencing on the expression of disulfide-bond A oxidoreductase-like protein (DsbA-L) and high molecular weight (HMW) adiponectin.
Lentiviral vector carrying short hairpin RNAs (shRNAs) targeting the FoxO1 gene was constructed, and the shRNA with the highest inhibition of FoxO1 expression (shRNA-FoxO1) in 3T3-L1 fat cells was selected by real-time quantitative PCR and Western blot and used for subsequent experiments. The expression of DsbA-L and HMW adiponectin in 3T3-L1 fat cells was determined by Western blot after infection with lentiviral vector carrying shRNA-FoxO1.
The lentiviral vector carrying the shRNA-FoxO1 had the most significant effect on the expression of FoxO1 in 3T3-L1 cells. The inhibition rate reached over 60%, and the relative expression levels of FoxO1 gene between the shRNA-FoxO1 and control groups were 0.37 ± 0.05 and 1.04 ± 0.04, respectively (P < 0.001). Western blot analysis showed that compared with the control group, the expression of FoxO1 was significantly inhibited (1.02 ± 0.08 vs 0.38 ± 0.08, P < 0.001), but the expression of DsbA-L and HMW adiponectin was significantly increased (0.28 ± 0.06 vs 0.53 ± 0.07, P = 0.009; 0.05 ± 0.02 vs 0.11 ± 0.03, P = 0.043) in the shRNA-FoxO1 group.
In 3T3-L1 cells, silencing FoxO1 gene promotes the expression of DsbA-L and HMW adiponectin.
- Citation: Shen Z, Liu XD, Zhao XF. Silencing FoxO1 expression promotes expression of high molecular weight adiponectin in 3T3-L1 cells. Shijie Huaren Xiaohua Zazhi 2017; 25(1): 56-63
- URL: https://www.wjgnet.com/1009-3079/full/v25/i1/56.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i1.56
叉头状转录因子O1(fork head box transcription factor O1, FoxO1)属于Fox转录因子亚家族的重要成员, 具有调节细胞的氧化应激、增殖及凋亡等多种生理作用, 与生物体的生长发育、代谢及肿瘤形成均有关[1]. FoxO1基因广泛表达于成人各个组织器官中, 在胚胎时期主要表达于肌肉组织, 成年后主要表达于脂肪组织. 其在白色脂肪及褐色脂肪组织中含量最丰富, 在肝脏可促进脂肪酸合成, 并在脂肪细胞分化和转录级联反应中发挥重要作用[2]. 已有研究[2,3]表明FoxO1基因与脂联素的表达关系密切. 而高分子量(high molecular weight, HMW)脂联素的表达和合成主要在脂肪细胞中进行, 且受分子伴侣二硫键A氧化还原酶样蛋白(disulfide-bond A oxidoreductase-like protein, DsbA-L)的调控. 非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD), HMW脂联素作为唯一有益的细胞因子发挥重要作用, 且FoxO1在NAFLD脂代谢中起重要的作用. 阐明FoxO1基因对HMW脂联素的作用, 可能对NAFLD及脂肪代谢紊乱性疾病的治疗有一定的理论意义.
本实验采用短发夹RNA(short hairpin RNA, shRNA)慢病毒沉默FoxO1基因的表达, 在3T3-L1细胞中观察了对DsbA-L和HMW脂联素表达水平的影响, 为阐明FoxO1在NAFLD中的作用提供理论依据.
1.1.1 实验材料及试剂: 慢病毒载体质粒使用pll3.7, 购自美国Invitrogen公司; DH5α感受态细胞(9057), T4连接酶(2011), 限制性内切酶HpaⅠ(1064)和XhoⅠ(1094)均购自TAKARA公司, Lipofectamine 2000 Transfection Reagent(11668-019)购自美国Invitrogen公司, 3T3-L1细胞购自南京科佰生物有限公司(3582F); 胎牛血清FBS(C2027050)和DMEM(C12430-062)培养基购自美国invitrogen公司; Polybrene购自SIGMA公司(H9268); 动物总RNA快速提取试剂盒购自上海捷瑞生物工程有限公司; qPCR试剂盒RealMasterMix购自TIANGEN公司; PrimeScript RT Master Mix购自TAKARA公司(RR036A); FoxO1抗体购自CST公司(2880S); GAPDH抗体购自BIOWORLD(AP0063); DsbA-L抗体购自美国Abcam公司(ab92819); HMW脂联素抗体购自美国Bioworld公司(bs-0471R); P-FoxO1购自CST公司(9461S); 二抗Goat anti-Rabbit抗体购自联科公司(GAR0072), shRNA及引物等由Invitrogen公司合成.
1.1.2 主要使用的设备: 超微量高精度分光光度计(Nanodrop ND-2000, 美国Thermo公司); 定量PCR仪(CFX Connect Real-Time System 96孔), 配套使用的分析软件为BIO-RAD CFX Manager; 酶标仪(SPECTRA max Plus 384, Molecular Devices公司); 电泳系统(Mini-Proten Tetra System, Bio-RAD公司); 凝胶成像仪(ChemiDoc XRS+ System, Bio-RAD公司).
1.2.1 FoxO1-shRNA慢病毒载体构建: 我们用pll3.7慢病毒载体质粒构建FoxO1-shRNA慢病毒载体. 根据FoxO1sequence设计shRNA, 在3'端引入XhoⅠ酶切位点, 5'端引入HpaⅠ酶切位点, 从invitrogen公司合成shRNA片段, 合成序列如表1. 分别用ddH2O充分溶解合成的DNA片段至100 μmol/L. 各取1 μL正反(F/R)向引物片段, 加入至48 μL退火Buffer中, 充分混匀, 100 ℃水浴5 min, 自然冷却至室温. 载体pll3.7用限制性内切酶XhoⅠ和HpaⅠ37 ℃酶切过夜, 1%琼脂糖电泳, 切取大片段, 琼脂糖凝胶回收试剂盒回收骨架载体片段. 质粒pll3.7酶切回收片段与FOXO1-shRNA退火产物用T4DNA连接酶连接(根据试剂说明书操作), 将连接产物转化DH5a感受态细胞接种在LB平板, 分别挑取6个单菌落接种于含500 μL, 100 μg/mL Ampicillin抗性的LB培养液中, 250 r/min, 37 ℃恒温摇床培养4 h, 进行PCR鉴定. PCR引物序列为: F: 5'-TAGGCTTGGATTTCTATAAG-3', R: 5'-GGAACCCTTAATATAACTTCGT-3'. 挑取鉴定正确的阳性菌测序, 测序引物为U6-S: 5'-CAGTGCAGGGGAAAGAATAGTAGAC-3'.
| 名称 | 序列 |
| NC | F: 5'-TTTCTCCGAACGTGTCACGTTTCAAGAGAACGTGACACGTTCGGAGAATTTTTTC-3' |
| NC | R: 5'-TCGAGAAAAAATTCTCCGAACGTGTCACGTTCTCTTGAAACGTGACACGTTCGGAGAAA-3' |
| FoxO1-shRNA-1 | F: 5'-TGACTTTGATAACTGGAGTATTCAAGAGATACTCCAGTTATCAAAGTCTTTTTTC-3' |
| FoxO1-shRNA-1 | R: 5'-TCGAGAAAAAAGACTTTGATAACTGGAGTATCTCTTGAATACTCCAGTTATCAAAGTCA-3' |
| FoxO1-shRNA-2 | F: 5'-TGCCCTGGGTCTCACAGCAATTCAAGAGATTGCTGTGAGACCCAGGGCTTTTTTC-3' |
| FoxO1-shRNA-2 | R: 5'-TCGAGAAAAAAGCCCTGGGTCTCACAGCAATCTCTTGAATTGCTGTGAGACCCAGGGCA-3' |
| FoxO1-shRNA-3 | F: 5'-TGGAGAACCTTCTGGATAATTTCAAGAGAATTATCCAGAAGGTTCTCCTTTTTTC-3' |
| FoxO1-shRNA-3 | R: 5'-TCGAGAAAAAAGGAGAACCTTCTGGATAATTCTCTTGAAATTATCCAGAAGGTTCTCCA-3' |
| FoxO1-shRNA-4 | F: 5'-TGAGGATTGAACCAGTATAATTCAAGAGATTATACTGGTTCAATCCTCTTTTTTC-3' |
| FoxO1-shRNA-4 | R: 5'-TCGAGAAAAAAGAGGATTGAACCAGTATAATCTCTTGAATTATACTGGTTCAATCCTCA-3' |
1.2.2 FoxO1-shRNA慢病毒载体包装: 培养293T细胞, 待细胞生长至70%密度时即可开始转染. 转染前1 h换成无血清培养基, 取10 μg FoxO1-shRNA质粒及3种包装质粒各5 μg用500 μL 无血清培养基稀释, 充分混匀, 制成 DNA 稀释液, 再取50 μL Lipofectamine 2000 加入到DNA稀释液中, 充分混匀, 室温静置15 min后将转染复合物逐滴加入到含有细胞和培养基的平皿中, 轻柔混匀. 将细胞置于含50 mL/L CO2的37 ℃培养箱中孵育4-6 h后换液. 转染48 h后观察转染效率并拍照记录; 收集病毒上清; 离心去除细胞碎片及其他杂质; 0.22 μm针式滤头过滤, 得到的慢病毒液即可用于后续细胞感染.
1.2.3 3T3-L1细胞复苏、传代与铺板: 取对数生长期的3T3-L1细胞接种于10 cm培养皿中, 置于培养箱37 ℃、50 mL/L CO2培养箱内培养; 待细胞生长成均匀单层细胞并达90%汇集度时传代, 于37 ℃、50 mL/L CO2培养箱内继续培养, 待细胞重新生长至一定密度时进行计数. 计数后, 调整细胞密度按2×105 cell/孔细胞接种于6孔板中, 置于37 ℃、50 mL/L CO2培养箱内培养24 h.
1.2.4 实验分组: 为筛选出最佳FoxO1沉默效果的shRNA, 实验分为CK(空白3T3-L1细胞组)、NC(3T3-L1感染干扰病毒对照组)、shRNA-1(3T3-L1感染干扰病毒FoxO1-shRNA-1组)、shRNA-2(3T3-L1感染干扰病毒FoxO1-shRNA-2组)、shRNA-3(3T3-L1感染干扰病毒FoxO1-shRNA-3组)、shRNA-4(3T3-L1感染干扰病毒FoxO1-shRNA-4组).
1.2.5 FoxO1-shRNA慢病毒感染3T3-L1细胞: DMEM完全培养基+终浓度8 μg/mL Polybrene进行病毒感染前换液, 换液后按NC组、shRNA-1组、shRNA-2组、shRNA-3组、shRNA-4组每孔各自加入500 μL病毒上清液, 轻柔混匀, CK组不做处理, 再将全部细胞置于含50 mL/L CO2的37 ℃培养箱中继续孵育24 h后换液, 48 h后拍照记录.
1.2.6 qPCR筛选FoxO1-shRNA感染3T3-L1后FoxO1基因的表达: TRIzol法提取3T3-L1细胞总RNA, 详细操作严格按照说明书进行. 通过Nanodrop ND-2000鉴定RNA的浓度及纯度. 按RNA 1 μg, 5×PrimeScript RT Master Mix 4 μL, RNase-free H2O 15 μL配置后混匀, 37 ℃干浴15 min; 85 ℃干浴5 s终止反应; cDNA置于-20 ℃保存. 引物序列采用Primer 5.0软件设计(表2), 按顺序加入96孔PCR板中, 设置污染质控、阴性对照. qPCR反应体系包括: 2×SuperReal PreMix Plus 10 μL、Forward Primer(10 μmol/L)0.5 μL、Reverse Primer(10 μmol/L)0.5 μL、RNase-free H2O 4 μL、cDNA模板5 μL. 反应条件: 95 ℃预变性15 min; 95 ℃ 10 s, 60 ℃ 35 s, 40个循环. CFX Connect Real-Time System进行定量PCR. 采用△△Ct 计算各组基因相对表达量.
| 基因名称 | 引物序列 |
| Mus Actin | 上游引物: GGCTGTATTCCCCTCCATCG |
| Mus Actin | 下游引物: CAGTTGGTAACAATGCCATGT |
| Mus FoxO1 | 上游引物: CTCATCACCAAGGCCATCGAG |
| Mus FoxO1 | 下游引物: CCATGGACGCAGCTCTTCTC |
1.2.7 Western blot筛选FoxO1-shRNA感染3T3-L1后FoxO1蛋白的表达: 3T3-L1细胞感染48 h后提取细胞总蛋白, BCA法蛋白定量, 根据标准曲线计算样品的蛋白浓度. 取300 μg蛋白进行10%SDS-PAGE凝胶电泳, 电泳结束后转移蛋白至PVDF膜, 将PVDF膜浸入含5%脱脂奶粉的封闭液中, 置摇床上缓慢摇动, 室温封闭过夜后加入一抗, 室温孵育2 h; 浸于1×TBST缓冲液中, 于摇床上洗涤3次后加入二抗, 于室温摇床上孵育1 h; 将PVDF膜浸于1×TBST缓冲液中, 于摇床上洗涤3次后置于保鲜膜上, 取适量ECL试剂盒中等体积的A液和B液混合, 混匀后加在膜的表面, 移入ChemiDoc XRS+System凝胶成像分析仪中, 化学光敏模式曝光显影. QUANTITY One4.5.0分析软件定量分析各组FoxO1及内参蛋白GAPDH的OD值, 以相对积分光密度OD值进行比较, 每组实验重复3次.
1.2.8 Western blot检测FoxO1-shRNA感染3T3-L1后DsbA-L、HMW脂联素的表达: 根据筛选出最佳的FoxO1-shRNA慢病毒, 感染3T3-L1细胞, Western blot检测3T3-L1 细胞中DsbA-L和HMW脂联素的表达情况. 具体操作同前一步骤.
统计学处理 用SPSS13.0进行统计分析, 数据以mean±SD表示, 组间差异用t检验分析, P<0.05认为有统计学差异.
CK、NC、shRNA-1、shRNA-2、shRNA-3和shRNA-4组基因的相对表达量分别为0.79±0.07、1.04±0.04、0.37±0.05、0.92±0.08、0.74±0.06和0.62±0.05. shRNA-1组的FoxO1基因的相对表达量较其他各组明显降低, 对FoxO1基因的抑制超过60%, 与其他各组相比均P<0.001(图1).
CK、NC、shRNA-1、shRNA-2、shRNA-3和shRNA-4组与GAPDH的光密度比值分别是1.20±0.06、1.02±0.08、0.38±0.08、1.07±0.05、0.90±0.09和0.72±0.07, 其中shRNA-1与其余各组相比, 均P<0.01, 其敲低效率可达到60%以上, 故选择shRNA-1完成后续实验(图2, 3).
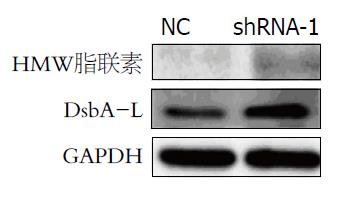
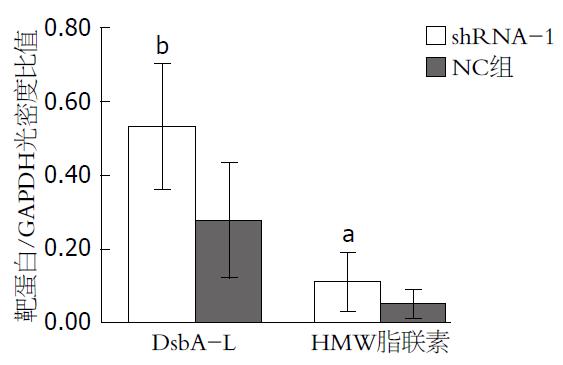
DsbA-L和HMW脂联素是已知的受FoxO1调控的下游基因, 本实验通过检测sh-FoxO1对DsbA-L和HMW表达活性的影响, 来确定shRNA-FoxO1的生物学活性. 参照前面实验的结果, 加入shRNA-1病毒液48 h后, 裂解细胞, 取上清检测DsbA-L和HMW脂联素的活性. 结果与NC组比较, DsbA-L和HMW的表达水平明显升高, DsbA-L/GAPDH光密度比值, NC与shRNA-1组分别是0.28±0.06和0.53±0.07(P = 0.009), HMW脂联素/GAPDH光密度比值, NC与shRNA-1组分别是0.11±0.03、0.05±0.02(P = 0.043)(图4, 5).
随着生活水平不断提高, 我国NAFLD的发病率呈逐年上升的趋势. 研究[4-6]表明, NAFLD患者极易发生高脂血症、糖尿病、高血压、冠心病、脑卒中等, 严重威胁到人民的身体健康. 然而, NAFLD的发病机制至今仍未完全阐明.
脂联素作为脂肪组织分泌的一种主要脂肪因子, 与非酒精性脂肪肝的发病有很重要的关系. 其通过在肝脏和肌肉细胞中激活AMPK通路和以及激活PPARα抑制肝脏脂肪合成, 增加脂肪酸氧化分解[7,8], 并且其主要抑制炎症因子TNF-α减轻肝脏炎症[9,10], 还可通过抑制Kupffer细胞而减少肝星状细胞活化, 改善肝纤维化[11-14]. 脂联素在血液循环中至少以3种复合物的形式存在, 包括三聚物、六聚物和包含18-36个单体的HMW形式[15]. 研究[16]表明, 发挥脂联素生物学作用并不在于总的脂联素水平, 而在于HMW形式所占总脂联素的比例多少. 脂联素的多聚化与DsbA-L关系又是密切相关的. DsbA-L是近年来发现的一个新的伴侣分子, 在不同的组织中均有所表达, 如肝脏、肾脏、胰腺、心脏, 但是在脂肪组织中表达量最高(脂联素也从这里被合成和分泌)[17]. 在3T3-L1脂肪细胞中, 用RNAi抑制DsbA-L后, 不仅减少了脂联素的分泌, 也减少了脂联素, 特别是HMW脂联素在细胞内的表达; 而用腺病毒载体过表达DsbA-L后增加了脂联素的细胞内水平和他的分泌, 这说明了在脂肪细胞中DsbA-L是一个脂联素复合物生成和分泌的重要组件[18].
FoxO1属于Fox转录因子家族, 是胰岛素信号通路磷脂酰肌醇3-激酶/蛋白激酶(PI3K/Akt)信号通路的下游因子. FoxO1广泛表达于胰岛素作用的靶器官(如胰腺、肝脏、骨骼肌、脂肪组织), 并且通过其乙酰化水平的不同发挥不同的能量调节作用[19,20].
FoxO1不仅能够抑制前脂肪细胞系的分化[21], 同时还能够上调脂肪细胞中抵抗素的基因表达从而抑制脂肪细胞的分化成熟[22]. 沉默信息调节因子1(SIRT1)和沉默信息调节因子2(SIRT2)这2种NAD依赖的去乙酰化酶, 可将FoxO1去乙酰化并促进其从细胞核内转运到细胞质失去其生物活性, 即为P-FoxO1, 这一过程会调节一些细胞因子的表达水平[23,24], 从而影响脂肪细胞的分化. HMW脂联素是体内对NAFLD唯一有益的细胞因子, 但并不知道其表达是否与FoxO1有关. 理清FoxO1和脂联素的关系, 是明确FoxO1作用机制的一个重要方向, 同时也为研究治疗NAFLD及相关代谢性疾病提供帮助.
本实验采用的shRNA是根据siRNA 靶序列, 构建了的靶向FoxO1的siRNA慢病毒载体, 其转录产物可在细胞内形成一个具有反向重复序列的茎环结构的发夹样RNA, 该RNA随后被加工成siRNA, 可通过降解FoxO1的mRNA阻断FoxO1基因表达的目的, 其干扰效果等同于siRNA, 而且能够解决siRNA干扰时间短的缺点. 最终qPCR及Western blot法证实, 实验中所选取的4条shRNA均能有效抑制FoxO1基因的表达, 最好的一条抑制率达到60%以上.
已有研究[25]表明, 用Akt特异性阻断剂AKTi VIII来处理3T3-L1细胞后, 可同时阻断Akt和FoxO1的磷酸化, 并同时伴随着DsbA-L和脂联素表达的增加. 从而说明Akt/FoxO1信号通路与DsbA-L和脂联素的表达调节均有关. 本实验进一步证明, 在3T3-L1脂肪细胞中采用shRNA直接沉默FoxO1基因, 结果导致FoxO1表达的减少, 同时伴随着DsbA-L和HMW脂联素表达的增加, 由此证明了FoxO1信号通路与DsbA-L和HMW脂联素的表达调节均有关, 这可能为今后治疗NAFLD及脂肪代谢障碍相关疾病的奠定部分理论基础.
非酒精性脂肪性肝病中(non-alcoholic fatty liver disease, NAFLD), 高分子量脂联素作为唯一有益的细胞因子发挥重要作用. 其表达和合成主要在脂肪细胞中进行, 且受分子伴侣二硫键A氧化还原酶样蛋白(disulfide-bond A oxidoreductase-like protein, DsbA-L)的调控. 而叉头状转录因子O1(fork head box transcription factor O1, FoxO1)在NAFLD脂代谢中起重要的作用. 阐明FoxO1基因对高分子量(high molecular weight, HMW)脂联素的作用, 可能对NAFLD及脂肪代谢紊乱性疾病的治疗有一定的理论意义.
NAFLD作为一种脂代谢异常的疾病, 发病率越来越高, 其可发展为肝硬化、肝癌等. 寻求抑制疾病进展的治疗方法和基础研究成为一个热点. 高分子量脂联素是对NAFLD有益的细胞因子, 围绕他进行的研究正日益深入. 其中, 明确怎么促进他表达是亟待解决的研究问题.
Liu等发现脂肪特异的DsbA-L过表达促进了脂联素的多聚化, 在糖尿病模型中对胰岛素抵抗有保护作用. 该研究为大家以后在NAFLD中开展相关研究奠定了基础.
本文发现了在脂肪细胞中沉默FoxO1, 可促进高分子量脂联素的表达. 这可能是一个较新的发现, 对于在脂肪细胞中建立二者的联系有重要意义.
FoxO1信号通路与DsbA-L和HMW脂联素的表达调节均有关, 这可能为今后治疗NAFLD及脂肪代谢障碍相关疾病的奠定部分理论基础.
潘光栋, 主任医师, 柳州市人民医院肝胆外科; 张新晨, 教授, 主任医师, 哈尔滨医科大学附属第二医院普通外科六病房
文章题目清晰, 说明了研究的主要问题. 文笔简练、引言详实、实验方法先进. 对照设计合理、统计方法恰当. 结果可靠, 讨论条理清晰, 具有一定的科学性. 参考文献引用较新, 恰当并充分.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Daitoku H, Fukamizu A. FOXO transcription factors in the regulatory networks of longevity. J Biochem. 2007;141:769-774. [PubMed] [DOI] |
| 2. | Nakae J, Kitamura T, Kitamura Y, Biggs WH, Arden KC, Accili D. The forkhead transcription factor Foxo1 regulates adipocyte differentiation. Dev Cell. 2003;4:119-129. [PubMed] |
| 3. | Nakae J, Cao Y, Oki M, Orba Y, Sawa H, Kiyonari H, Iskandar K, Suga K, Lombes M, Hayashi Y. Forkhead transcription factor FoxO1 in adipose tissue regulates energy storage and expenditure. Diabetes. 2008;57:563-576. [PubMed] [DOI] |
| 4. | Süsleyici-Duman B, Zengin K, Kayhan FE, Koldemir M, Dağıstanlı FK, Cağatay P, Oztürk M, Taşkın M. FTO mRNA expression in extremely obese and type 2 diabetic human omental and subcutaneous adipose tissues. Obes Surg. 2011;21:1766-1773. [PubMed] [DOI] |
| 5. | Danaei G, Finucane MM, Lin JK, Singh GM, Paciorek CJ, Cowan MJ, Farzadfar F, Stevens GA, Lim SS, Riley LM. National, regional, and global trends in systolic blood pressure since 1980: systematic analysis of health examination surveys and epidemiological studies with 786 country-years and 5·4 million participants. Lancet. 2011;377:568-577. [PubMed] [DOI] |
| 6. | Bashiardes S, Shapiro H, Rozin S, Shibolet O, Elinav E. Non-alcoholic fatty liver and the gut microbiota. Mol Metab. 2016;5:782-794. [PubMed] [DOI] |
| 7. | Kubota N, Yano W, Kubota T, Yamauchi T, Itoh S, Kumagai H, Kozono H, Takamoto I, Okamoto S, Shiuchi T. Adiponectin stimulates AMP-activated protein kinase in the hypothalamus and increases food intake. Cell Metab. 2007;6:55-68. [PubMed] [DOI] |
| 8. | You M, Considine RV, Leone TC, Kelly DP, Crabb DW. Role of adiponectin in the protective action of dietary saturated fat against alcoholic fatty liver in mice. Hepatology. 2005;42:568-577. [PubMed] [DOI] |
| 9. | Zhou M, Xu A, Tam PK, Lam KS, Chan L, Hoo RL, Liu J, Chow KH, Wang Y. Mitochondrial dysfunction contributes to the increased vulnerabilities of adiponectin knockout mice to liver injury. Hepatology. 2008;48:1087-1096. [PubMed] [DOI] |
| 10. | Thakur V, Pritchard MT, McMullen MR, Nagy LE. Adiponectin normalizes LPS-stimulated TNF-alpha production by rat Kupffer cells after chronic ethanol feeding. Am J Physiol Gastrointest Liver Physiol. 2006;290:G998-1007. [PubMed] [DOI] |
| 11. | Park PH, Thakur V, Pritchard MT, McMullen MR, Nagy LE. Regulation of Kupffer cell activity during chronic ethanol exposure: role of adiponectin. J Gastroenterol Hepatol. 2006;21 Suppl 3:S30-S33. [PubMed] [DOI] |
| 12. | Abenavoli L, Peta V. Role of adipokines and cytokines in non-alcoholic fatty liver disease. Rev Recent Clin Trials. 2014;9:134-140. [PubMed] |
| 13. | Kumar R, Prakash S, Chhabra S, Singla V, Madan K, Gupta SD, Panda SK, Khanal S, Acharya SK. Association of pro-inflammatory cytokines, adipokines & amp; oxidative stress with insulin resistance & amp; non-alcoholic fatty liver disease. Indian J Med Res. 2012;136:229-236. [PubMed] |
| 14. | Jarrar MH, Baranova A, Collantes R, Ranard B, Stepanova M, Bennett C, Fang Y, Elariny H, Goodman Z, Chandhoke V. Adipokines and cytokines in non-alcoholic fatty liver disease. Aliment Pharmacol Ther. 2008;27:412-421. [PubMed] [DOI] |
| 15. | Pajvani UB, Du X, Combs TP, Berg AH, Rajala MW, Schulthess T, Engel J, Brownlee M, Scherer PE. Structure-function studies of the adipocyte-secreted hormone Acrp30/adiponectin. Implications fpr metabolic regulation and bioactivity. J Biol Chem. 2003;278:9073-9085. [PubMed] [DOI] |
| 16. | Waki H, Yamauchi T, Kamon J, Ito Y, Uchida S, Kita S, Hara K, Hada Y, Vasseur F, Froguel P. Impaired multimerization of human adiponectin mutants associated with diabetes. Molecular structure and multimer formation of adiponectin. J Biol Chem. 2003;278:40352-40363. [PubMed] [DOI] |
| 17. | Ladner JE, Parsons JF, Rife CL, Gilliland GL, Armstrong RN. Parallel evolutionary pathways for glutathione transferases: structure and mechanism of the mitochondrial class kappa enzyme rGSTK1-1. Biochemistry. 2004;43:352-361. [PubMed] [DOI] |
| 18. | Liu M, Xiang R, Wilk SA, Zhang N, Sloane LB, Azarnoush K, Zhou L, Chen H, Xiang G, Walter CA. Fat-specific DsbA-L overexpression promotes adiponectin multimerization and protects mice from diet-induced obesity and insulin resistance. Diabetes. 2012;61:2776-2786. [PubMed] [DOI] |
| 19. | Zhou X, Zeng XY, Wang H, Li S, Jo E, Xue CC, Tan M, Molero JC, Ye JM. Hepatic FoxO1 acetylation is involved in oleanolic acid-induced memory of glycemic control: novel findings from Study 2. PLoS One. 2014;9:e107231. [PubMed] [DOI] |
| 20. | Susanti VY, Sasaki T, Yokota-Hashimoto H, Matsui S, Lee YS, Kikuchi O, Shimpuku M, Kim HJ, Kobayashi M, Kitamura T. Sirt1 rescues the obesity induced by insulin-resistant constitutively-nuclear FoxO1 in POMC neurons of male mice. Obesity (Silver Spring). 2014;22:2115-2119. [PubMed] [DOI] |
| 21. | Pang WJ, Yu TY, Bai L, Yang YJ, Yang GS. Tissue expression of porcine FoxO1 and its negative regulation during primary preadipocyte differentiation. Mol Biol Rep. 2009;36:165-176. [PubMed] [DOI] |
| 22. | Liu CW, Yang SY, Lin CK, Liu HS, Ho LT, Wu LY, Lee MJ, Ku HC, Chang HH, Huang RN. The forkhead transcription factor FOXO1 stimulates the expression of the adipocyte resistin gene. Gen Comp Endocrinol. 2014;196:41-51. [PubMed] [DOI] |
| 23. | Jing E, Gesta S, Kahn CR. SIRT2 regulates adipocyte differentiation through FoxO1 acetylation/deacetylation. Cell Metab. 2007;6:105-114. [PubMed] [DOI] |
| 24. | Liu X, Liu G, Tan X, Zhao H, Cheng H, Wan F, Wu N, Song E. Gene expression profiling of SIRT1, FoxO1, and PPARγ in backfat tissues and subcutaneous adipocytes of Lilu bulls. Meat Sci. 2014;96:704-711. [PubMed] [DOI] |
| 25. | Wang A, Liu M, Liu X, Dong LQ, Glickman RD, Slaga TJ, Zhou Z, Liu F. Up-regulation of adiponectin by resveratrol: the essential roles of the Akt/FOXO1 and AMP-activated protein kinase signaling pathways and DsbA-L. J Biol Chem. 2011;286:60-66. [PubMed] [DOI] |