修回日期: 2016-02-18
接受日期: 2016-02-22
在线出版日期: 2016-03-28
目的: 探讨腹腔高压动物模型肝脏的继发改变.
方法: 实验兔30只, 分为ACS1组、ACS2组、对照组, 每组10只. 水囊法制作ACS动物模型, 调整腹腔压力维持在20-25 cmH2O. ACS1组观察时限3 d, ACS2组观察时限7 d, 完成观察时间后, 抽血行肝脏功能检查, 即刻处死各组实验动物, 完整取出兔肝脏, 固定后在生物光学显微镜下观察.
结果: 与对照组相比: ACS1组谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、碱性磷酸酶(alkaline phosphatase, AKP)显著升高(P<0.05, P<0.01, P<0.01), γ-谷氨酰转肽酶(γ-glutamyl transpeptidase, GGT)无明显改变(P>0.05); ACS2组ALT、AST、AKP、GGT显著升高(P<0.01, P<0.01, P<0.01, P<0.05), 而且ALT、AST、AKP显著高于ACS1组(P<0.01, P<0.05, P<0.01), GGT无明显升高(P>0.05). 病理变化: ACS1组: 肝脏结构存在, 可见正常肝小叶, 可见中央静脉、肝索、肝窦及汇管区. 肝细胞气球样变性, 脂褐素沉积, 部分血管内布满淡红染无结构物质, 汇管区少许炎细胞浸润. ACS2组: 肝脏结构存在, 肝细胞弥漫重度气球样变性, 细胞增生, 大片脂褐素沉积, 间质轻度纤维化, 汇管区血管扩张、充血, 胆管增生, 炎细胞浸润, 肝细胞内淤胆.
结论: 腹腔高压可引起肝脏出现明显的酶学和细胞学变化, 随着持续时间的延长, 损害加重.
核心提示: 临床多种疾病可引起腹腔压力升高, 严重者导致腹腔间隔室综合征, 继发引起胸腹腔脏器功能的损害, 甚至脏器功能衰竭. 本组实验证实腹腔高压可引起肝脏出现明显的酶学和细胞学变化, 随着持续时间的延长, 损害加重.
引文著录: 王宏业, 尉继伟. 腹腔高压动物模型肝脏的继发改变. 世界华人消化杂志 2016; 24(9): 1393-1397
Revised: February 18, 2016
Accepted: February 22, 2016
Published online: March 28, 2016
AIM: To analyze the secondary liver changes in an animal model of intra-abdominal hypertension.
METHODS: Thirty rabbits were equally divided into an Abdominal compartment syndrome 1 (ACS1) group, an ACS2 group and a control group. ACS was induced in animals by the water sac method, and the abdominal cavity pressure was adjusted at 20-25 cmH2O. The observation time was 3 d for the ACS1 group was 3 d, and 7 d for the ACS2 group. After observation, liver function was detected. Animals were then sacrificed to remove the rabbit liver tissue for pathological examination.
RESULTS: Compared with the control group, alanine transaminase (ALT), aspartate transaminase (AST), and alkaline phosphatase (AKP) in the ACS1 group were significantly (P < 0.05, P < 0.01, P < 0.01), and γ-glutamyl transpeptidase (GGT) showed no significant change (P > 0.05). ALT, AST, AKP, and GGT were significantly higher in the ACS2 group than in the control group (P < 0.01, P < 0.01, P < 0.01, P < 0.05). ALT, AST, and AKP were significantly higher in the ACS2 group than in the ACS1 group (P < 0.01, P < 0.05, P < 0.01), although GGT showed no significant difference (P > 0.05). In the ACS1 group, hepatic lobule, hepatic cords, central vein, hepatic sinus and portal area were all visible; hepatocytes showed ballooning degeneration; there was lipofuscin deposit; part of blood vessels were filled with pink dye materials; and some inflammatory cells appeared in the portal area. In the ACS2 group, hepatocytes showed severe ballooning degeneration; cells proliferated significantly; there were lots of lipofuscin deposit; mild fibrosis occurred; vasodilation and congestion appeared in the portal area; and there was inflammatory cell infiltration.
CONCLUSION: Intra-abdominal hypertension can cause significant liver enzymological and cytological changes, and with the extension of duration, the damage is aggravating.
- Citation: Wang HY, Yu JW. Secondary liver changes in an animal model of intra-abdominal hypertension. Shijie Huaren Xiaohua Zazhi 2016; 24(9): 1393-1397
- URL: https://www.wjgnet.com/1009-3079/full/v24/i9/1393.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i9.1393
腹腔间隔室综合征(abdominal compartment syndrome, ACS)可引起心、肺、肾等多脏器功能衰竭, 死亡率高, 目前越来越受到临床重视. 最常见的原因包括重症急性胰腺炎[1]、腹腔感染[2]、肠梗阻、休克的液体复苏[3]、腹腔内或腹膜后大量出血、恶性肿瘤继发大量腹水[4], 腹腔高压引起继发肝脏病变在临床讨论较少. 本研究采用水囊法[5], 建立ACS动物模型, 观察肝脏的继发改变.
健康成年新西兰兔30只, 体质量2.6-3.3 kg, 雌雄不限, 由大同大学动物中心提供, 30只分为3组: 分别为ACS1组、ACS2组、对照组, 每组10只, 加压水囊的制作: 使用8号无菌手套, 将Foley三腔球囊导尿管1根前端约6-8 cm置入8号无菌手套中, 在手套根部以1号线结扎, 常规水囊的制作: 消毒安全套内注入200 mL生理盐水后封口. 测压仪的制作: 将长度为100 cm的T型直尺垂直固定于手术床上, 将无菌输液管沿长轴固定于T型直尺上. 测压方法: 将三腔导尿管侧口与输液管相连, 输液管内液平与实验动物腋中线水平差为腹内压.
1.2.1 ACS动物模型的制作: 采用生理盐水水囊腹腔置入法制作兔模型. 麻醉: 使用丙泊酚注射液麻醉, 2.0-2.5 mg/kg耳缘静脉推注麻醉, 再以2 mg/(kg•h)缓慢静推维持. ACS动物模型的制作: 将实验兔仰卧于操作台, 固定四肢及头部, 麻醉满意后, 将腹部使用脱毛剂脱毛, 在中腹部沿中线切开4.0 cm小口, 预置6根缝线, 先置入空瘪的加压水囊, 再置入常规水囊3个(共计600 mL), 无张力下缝线打结关腹. 再经过三腔导尿管向加压水囊中注入生理盐水, 每注入50 mL后测压1次以调节腹腔内压力(intra-abdominal pressure, IAP), 压力确定后, 关闭并固定导尿管, 完成动物模型制作. ACS动物模型腹腔压力调整维持在20-25 cmH2O. 观察时限: ACS1组3 d, ACS2组7 d.
1.2.2 染色观察: 完成观察时间后, 心脏穿刺法抽取心脏血液5 mL, 行肝脏功能检查. 即刻耳缘静脉推注空气法处死各组实验动物, 完整取出兔肝脏, 用40 g/L甲醛溶液固定24 h后常规石蜡包埋, 切片, HE染色, 在生物光学显微镜下观察.
统计学处理 采用SPSS16.0软件进行分析. 共设立对照组、ACS1组、ACS2组, 对ALT、AST、AKP、GGT行ACS1组与对照组、ACS2组与对照组、ACS2组与ACS1组之间样本均数比较, 检验方法使用t检验, P<0.05为差异有统计学意义.
与对照组相比: ACS1组ALT、AST、AKP显著高于对照组(P<0.05, P<0.01, P<0.01), GGT无明显改变(P>0.05); ACS2组ALT、AST、AKP、GGT显著高于对照组(P<0.01, P<0.01, P<0.01, P<0.05), 而且ALT、AST、AKP显著高于ACS1组(P<0.01, P<0.05, P<0.01), GGT无明显升高(P>0.05)(表1).
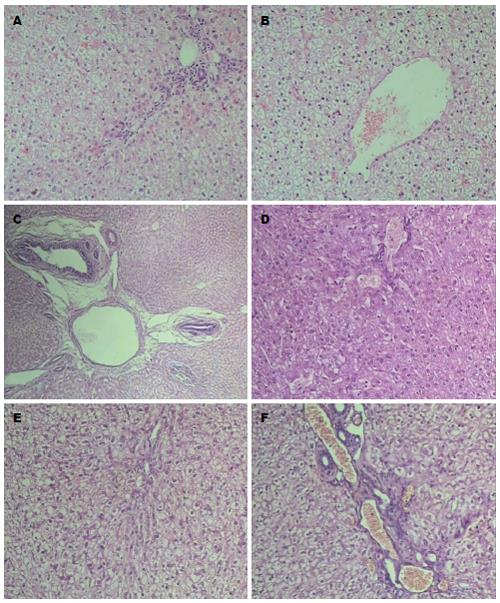
对照组肝小叶结构正常, 肝小叶内部分区域肝细胞疏松、肿胀, 汇管区有少量炎细胞浸润(图1A, B). ACS1组肝脏结构存在, 可见正常肝小叶, 可见中央静脉、肝索、肝窦及汇管区. 肝细胞气球样变性, 脂褐素沉积, 部分血管内布满淡红染无结构物质, 汇管区少许炎细胞浸润(图1C, D). ACS2组肝脏结构存在, 肝细胞弥漫重度气球样变性, 细胞增生, 大片脂褐素沉积, 间质轻度纤维化, 汇管区血管扩张、充血, 胆管增生, 炎细胞浸润, 肝细胞内淤胆(图1E, F).
IAP在正常情况下为零[6], 但多种病理情况可引起腹腔压力的升高, 持续一定时间后可引起全身多个脏器功能不全, 甚至衰竭, 称ACS[7], 在临床表现为重度的腹胀、通气障碍、难治性高碳酸血症及肾功能障碍等, 如不能及时处理, 死亡率极高[8]. 腹腔压力升高对所有的腹腔内器官均会造成影响, 空腔器官的缓冲余地相对较大, 而对于肝脏等实质性器官的影响更加明显, 目前临床对于高腹压引起的肝脏损伤探讨较少.
IAP升高从多角度对肝脏造成影响: (1)入肝及出肝的血流量的减少引起肝脏微循环血流量的减少; (2)肝脏表面压力向内传导造成肝实质细胞的损伤; (3)胆道压力逆向传导引起肝脏泌胆功能的下降和肝细胞的损害. 维持正常入肝及出肝的血流量才能保证肝脏功能的正常, IAP升高时, 入肝的肝动脉、门静脉血流量均出现进行性减少[9], 肝微循环的血流量明显不足, 肝静脉压力升高, 出肝的血流量下降. IAP升高对于肝动脉血流形成较大的阻力致使肝动脉血流减少出现较早, IAP达到10 mmHg时, 肝动脉血流即明显减少, IAP升高达到20 mmHg时, 即使循环血压维持正常水平, 肝动脉血流灌注仍显著下降, 不足正常的45%[10]; IAP升高时时, 受到压力传导门静脉压力随之升高, 二者有很好的相关性, 但血流量反常显著下降[11], 出现特殊的高压低灌现象, 胃肠道及脾脏受高腹压影响致使灌注压下降、回流量减少是门脉血流量下降的主要原因, 而肝脏内压力升高致使门脉压与肝内压压差减少是造成门脉高压低灌的另一重要原因, 门静脉受压后血管口径减小, 加重了高压低灌现象. 当腹内压>20 mmHg时, 门静脉血流下降超过35%[12]. 高腹压同时对肝静脉回流造成影响, 肝静脉压力升高、肝脏机械性压迫以及肝静脉穿过膈肌处的解剖性狭窄, 均使肝静脉血流量降低. 入肝血流的血流量下降导致肝脏灌注血量的下降和出肝血流的流量减少, 加重肝脏微循环血量的下降, 当腹内压>20 mmHg时, 肝脏微循环血流下降30%. 同时, 全身循环血流不足致心输出量下降也是引起肝脏灌注减少的重要原因[13]. 肝脏为腹腔内最大的实质性器官, IAP升高时, 肝脏难以被压缩, 发生形变的比例极为有限, 腹腔压力直接沿肝脏表面向内传导, 造成肝细胞的挤压, 引起肝实质细胞的损伤. 同时, 向内传导的压力增加了肝脏血液循环的阻力. 腹压增高对胆道造成影响, 升高的腹腔压力沿胆道逆向传导, 造成胆道高压, 引起肝脏泌胆功能的下降和肝细胞的损害. 肝细胞肿胀、变性可继发酶学改变, 肝酶发生异常升高[14,15].
在本组实验中: 腹腔高压持续3 d(ACS1组), ALT、AST、AKP显著高于对照组, GGT无明显升高, 病理检查出现肝细胞气球样变性, 脂褐素沉积, 部分血管内布满淡红染无结构物质, 汇管区少许炎细胞浸润等表现. 腹腔高压持续7 d(ACS2组), ALT、AST、AKP、GGT显著高于对照组, 而且ALT、AST、AKP显著高于ACS1组, GGT无明显升高. 病理检查显示肝细胞出现弥漫重度气球样变性, 细胞增生, 大片脂褐素沉积, 间质轻度纤维化, 汇管区血管扩张、充血, 胆管增生, 炎细胞浸润, 肝细胞内淤胆. 以上酶学改变和病理改变提示: 腹腔高压早期对于肝脏的损害以肝细胞损害为主, 出现肝细胞气球样变性, ALT、AST的显著升高, 胆管细胞损害较轻, AKP显著升高, GGT无明显改变; 随着腹腔高压的持续, 肝细胞出现弥漫重度气球样变性, 伴发反常的汇管区血管扩张、充血, 胆管增生, 炎细胞浸润, 肝细胞内淤胆等, ALT、AST、AKP继续升高, GGT也出现明显升高. 本组实验证实: 腹腔高压可引起肝脏出现明显的酶学和细胞学变化, 随着持续时间的延长, 损害加重.
腹腔间隔室综合征(abdominal compartment syndrome, ACS), 死亡率高达30%-60%, 目前在临床已越来越受到重视, 探索高腹压状况下相关脏器的病理变化情况, 有利于判断疾病的发生、发展过程, 本组实验证实高腹压可引起肝脏的严重损害.
庄林, 主任医师, 昆明市第三人民医院肝病科; 吴君, 主任医师, 贵阳医学院附属医院感染科
在ACS研究上, 判断腹压升高的程度、高腹压对胸腹腔脏器功能的影响, 动物模型制作方法的探讨以及减压的时机均为研究的热点, 设计更符合人类疾病发展过程的动物模型制作方法是亟待研究的问题.
恶性肿瘤继发腹水快速增长, 可引起ACS, 行早期腹腔减压可有效降低腹压, 逆转由于高腹压造成的心肺肾功能衰竭, 设计新的水囊法制作腹腔高压动物模型可观察疾病的发生发展过程及相关病理改变.
采用水囊法建立腹腔高压动物模型, 观察肝脏的继发病理改变, 证实高腹压可引起肝脏的酶学变化和病理学变化, 而且这种变化随着高腹压的延续时间而逐渐加重, 甚至引起肝脏功能衰竭.
在临床出现ACS时, 心肺肾的改变相对明显, 肝脏的继发改变相对隐性, 在临床未受到足够的重视, 在临床治疗过程中, 如患者存在肝脏的基础疾病, 则可引起肝功能损害的加重, 甚至衰竭.
ACS: 定义为持续性的IAP>20 mmHg(伴或不伴腹腔灌注压<60 mmHg)并有新发生的器官功能不全或衰竭; 腹内压: 是指腹腔内的稳态压力.
本文通过制作腹腔高压动物模型、观察在高腹压状态下、肝脏的继发酶学变化和病理学变化, 证实高腹压对肝脏有显著的损害, 对于指导临床工作中ACS的治疗有积极的意义.
编辑: 于明茜 电编:都珍珍
| 1. | 余 枭, 陈 晓建, 陈 道瑾, 李 小荣, 李 永国, 黄 生福, 王 群伟, 李 青龙. 暴发性急性胰腺炎并发腹腔室隔综合征临床诊治进一步探讨. 中华普通外科杂志. 2007;2:582-585. |
| 13. | 沈 璟, 田 亚萍, 张 勤. 腹腔高压时的血流动力学监测. 中国现代普通外科进展. 2013;16:998-1000. |