修回日期: 2016-01-26
接受日期: 2016-02-18
在线出版日期: 2016-03-18
目的: 研究柴胡皂苷d(saikosaponin-d, SSd)对活化的HSC-T6细胞内基质金属蛋白酶(matrix metalloproteinase-1, MMP-1)、基质金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase-1, TIMP-1)表达的影响及其相关分子机制, 探讨植物雌激素对肝纤维化的作用机制, 为临床应用植物雌激素提供理论依据.
方法: 体外培养大鼠肝星状细胞系HSC-T6, 细胞用含10%胎牛血清的DMEM高糖培养基培养种板, 细胞贴壁后加入雌激素受体阻断剂(1 μmol/L)或P38 MAPK阻断剂SB203580(50 μmol/L)预处理1 h后, 加入SSd(5 μmol/L)或雌二醇(1 μmol/L)孵育24 h. 采用ELISA法检测细胞培养上清液中的一型胶原(collagen type 1, COL-1)、MMP-1、TIMP-1的含量, Western blot法检测细胞MMP-1、TIMP-1、P38、PP38的表达.
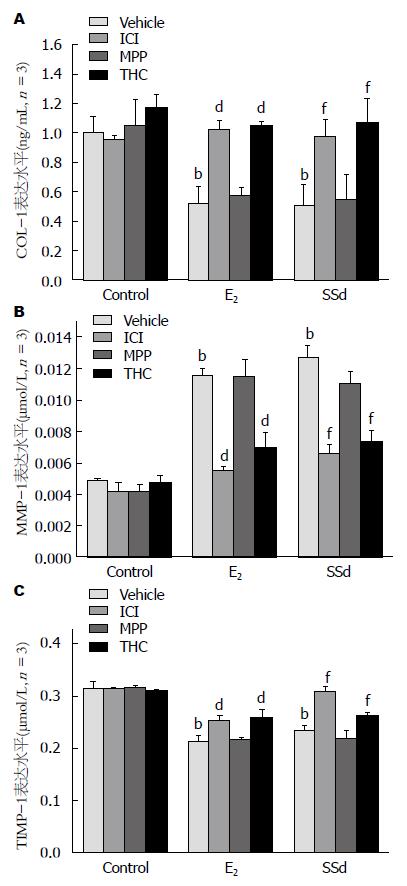
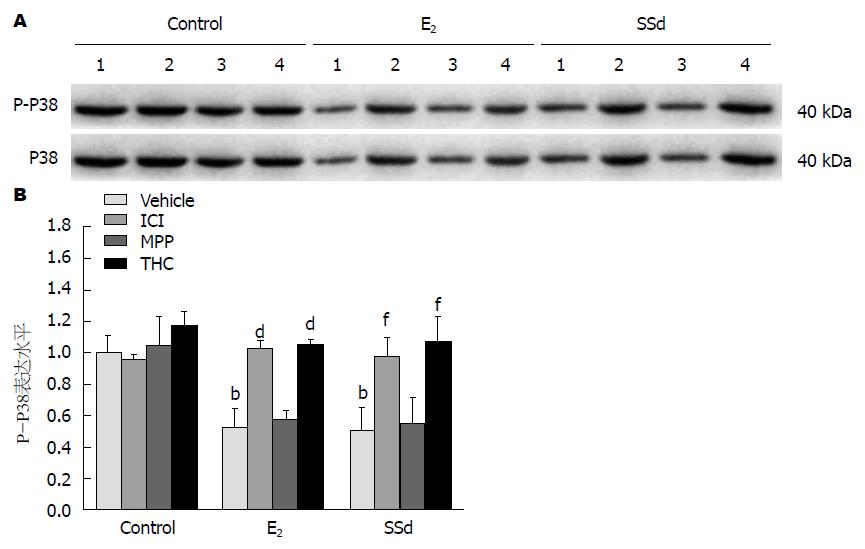
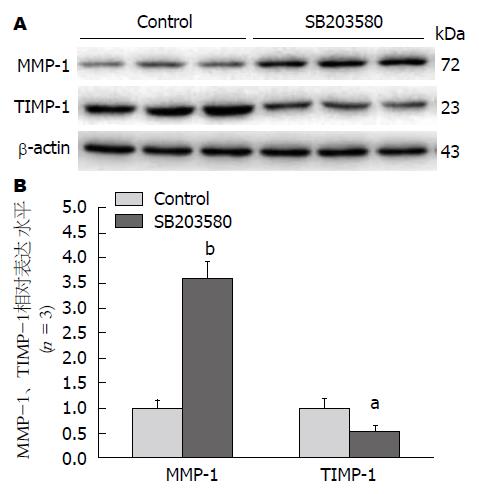
结果: 与对照组(Control)比较, SSd、E2单独给药组COL-1(140.95±12.14, 143.58±4.81 vs 198.98±15.08)、TIMP-1(0.23±0.01, 0.21±0.01 vs 0.31±0.01)、P-P38(0.51±0.14, 0.52±0.12 vs 1.00+0.11)明显降低(P<0.01), MMP-1明显升高(0.0127±0.0008, 0.0116±0.0004 vs 0.0049±0.0001, P<0.01). 抑制剂组COL-1、TIMP-1、P-P38较SSd、E2单独给药组明显升高(P<0.01), MMP-1明显降低(P<0.01). 我们采用P38阻断剂SB203580处理细胞, 药物作用24 h后, SB203580组与对照组相比, MMP-1蛋白表达明显增高(3.58±0.35 vs 1.00±0.15, P<0.01), TIMP-1蛋白表达明显降低(0.52±0.14 vs 1.00±0.18, P<0.05).
结论: SSd能够通过ERβ介导的效应抑制P38 MAPK的激活, 进而调节其下游的MMP-1、TIMP-1的表达, 促进细胞外基质的降解, 达到抗纤维化的作用.
核心提示: 本研究探讨了柴胡皂苷d(saikosaponin-d, SSd)对活化HSC-T6细胞内基质金属蛋白酶(matrix metalloproteinase-1)、基质金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase-1)表达的影响及其与P38/MAPK信号通路的关联, 并引入雌激素受体阻断剂, 进一步发掘SSd药理作用的受体机制. 确立了SSd的类雌激素样作用, 为临床应用SSd替代雌激素治疗肝纤维化提供了理论依据.
引文著录: 林柳兵, 阙任烨, 刘进锴, 沈艳婷, 陶智会, 李勇. 柴胡皂苷d对活化的HSC-T6细胞MMP-1、TIMP-1表达的影响及其分子机制. 世界华人消化杂志 2016; 24(8): 1159-1165
Revised: January 26, 2016
Accepted: February 18, 2016
Published online: March 18, 2016
AIM: To investigate the effect of saikosaponin-d (SSd) on the expression of tissue inhibitor of metalloproteinase-1 (TIMP-1) and matrix metalloproteinase-1 (MMP-1) in activated HSC-T6 cells and the underlying mechanism, and to explore the mechanism of action of phytoestrogens on liver fibrosis to provide a theoretical basis for their clinical application.
METHODS: Rat hepatic stellate cell line HSC-T6 was used. Cells were seeded into cell culture plates with DMEM high glucose medium containing 10% fetal bovine serum for 24 h. After 1 h pretreatment with estrogen receptor (ER) antagonist (1 µmol/L) or P38 MAPK antagonist SB203580 (50 µmol/L), cells were incubated with SSd (5 µmol/L) or estradiol (E2) (1 µmol/L) for 24 h. ELISA was used to detect the contents of type I collagen (COL-I), MMP-1, and TIMP-1 in cell culture supernatants. Western blot analysis was used to detect the expression of MMP-1, TIMP-1, P38 and PP38 in HSC-T6 cells.
RESULTS: Compared with the control group, SSd or E2 treatment significantly decreased COL-1 (140.95 ± 12.14, 143.58 ± 4.81 vs 198.98 ± 15.08) and TIMP-1 contents (0.23 ± 0.01, 0.21 ± 0.01 vs 0.31 ± 0.01) in cell culture supernatants and P-P38 expression (0.51 ± 0.14, 0.52 ± 0.12 vs 1.00 ± 0.11), and significantly elevated MMP-1 content (0.0127 ± 0.0008, 0.0116 ± 0.0004 vs 0.0049 ± 0.0001, P < 0.01). In the inhibitor group, the expression levels of COL-1, TIMP-1 and P-P38 increased (P < 0.01) and MMP-1 content decreased (P < 0.01). MMP-1 expression was significantly increased in cells treated with P38 inhibitor SB203580 for 24 h compared with the control group (3.58 ± 0.35 vs 1.00 ± 0.15, P < 0.01), and TIMP-1 expression was significantly decreased (0.52 ± 0.14 vs 1.00 ± 0.18, P < 0.05).
CONCLUSION: The anti-fibrotic effect of SSd may be attributed to its inhibition of P38/MAPK activation and modulation of downstream molecules MMP-1 and TIMP-1 expression, which can promote the degradation of extracellular matrix via stimulating ERβ.
- Citation: Lin LB, Que RY, Liu JK, Shen YT, Tao ZH, Li Y. Effect of saikosaponin-d on expression of matrix metalloproteinase-1 and tissue inhibitor of metalloproteinase-1 in activated HSC-T6 cells: Underlying mechanism. Shijie Huaren Xiaohua Zazhi 2016; 24(8): 1159-1165
- URL: https://www.wjgnet.com/1009-3079/full/v24/i8/1159.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i8.1159
柴胡历来是中药中治疗肝病的最常用药物之一. 目前研究表明柴胡皂苷d(saikosaponin-d, SSd)是柴胡提取物中活性最强的成分之一, 具有解热镇痛、抗炎保肝和抗纤维化等药理作用. 我们的前期研究[1]证实, SSd作为一种植物雌激素可抑制HSC-T6增殖与活化, 调节雌激素受体的表达, 但并没有很好的阐释其抗纤维化的具体分子机制. 因此, 本研究拟通过采用HSC-T6细胞, 进一步观察SSd对调节细胞外基质的关键分子基质金属蛋白酶(matrix metalloproteinase-1, MMP-1)、基质金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase-1, TIMP-1)表达及一型胶原(collagen type 1, COL-1)含量影响; 并且观察SSd作用于细胞后, 对细胞内P38丝裂原活化蛋白激酶(P38/MAPK)信号通路的影响, 进一步探讨该信号通路的激活与MMP-1和TIMP-1表达的相关性, 以阐明SSd的作用机制; 最后采用雌激素受体阻断剂, 观察SSd的抗纤维化作用是否与激活雌激素受体及其下游通路有关.
大鼠肝星状细胞株HSC-T6细胞由上海第二军医大学长征医院消化科惠赠, 其表型为活化的HSC. SSd购自中国药品生物制品检定所, 批号110778-201409, 纯度≥99%; 雌二醇(17Beta-Estradiol)购自美国Sigma公司, 批号: D0005215; 雌激素受体完全拮抗剂ICI-182.780、雌激素受体α特异性拮抗剂MPP、雌激素受体β特异性拮抗剂THC购自英国TOCRIS公司, 批号: S119108、4C/144820、5A/138659. 大鼠COL-1、TIMP-1、MMP-1 ELISA试剂盒, 上海西唐生物有限公司产品, 批号: 201410; MMP-1一抗(兔抗大鼠IgG多克隆抗体), Abnova公司, 批号: 1105-828; TIMP-1一抗(兔抗大鼠IgG多克隆抗体), Santa Cruz公司, 批号: F0313; ECL化学发光试剂盒, 批号: 1115702, 美国Millipore公司; DMEM高糖培养基, 批号: NZH1209, 美国Thermo Scientific公司; 胎牛血清(fetal bovine serum, FBS), 批号: A10106-0455, 奥地利PAA公司; 牛血清白蛋白(bovine serum albumin, BSA), 批号: 201410, 美国Amresco公司; 蛋白质分子量预染Marker, Pierce公司产品产品, 批号: 27681; 山羊抗兔 HRP 标记二抗, Cell Signaling公司产品, 批号: 8176; SB203580(P38 MAPK抑制剂)购自美国Selleck公司, 批号: S107604; P38一抗(兔抗大鼠IgG多克隆抗体)购自美国CST公司, 批号: 8690P; PP38一抗(兔抗大鼠IgG多克隆抗体)购自美国CST公司, 批号: 4511P.
1.2.1 细胞培养: HSC-T6细胞用含有10%热灭活胎牛血清的DMEM完全培养基在37 ℃、体积分数为50 mL/L CO2、完全饱和湿度条件下常规培养, 每48 h更换培养基, 细胞生长铺满培养瓶底80%后, 用0.25%胰蛋白酶联合0.02% EDTA消化传代, 实验选用对数生长期细胞.
1.2.2 ELISA检测: 取对数生长期的HSC-T6细胞, 接种于96孔培养板中, 1×104/(200 µL•孔); 24 h后分别采用ICI-182.780、MPP或THC预处理, 1 h后分别加入SSd(5 μmol/L)或E2(1 μmol/L), 24 h后收获上清, 冻存于-20 ℃, 待测; 按照试剂盒说明检测.
1.2.3 Western blot检测: 将药物处理后的细胞弃去培养液, PBS洗涤细胞3次后, 将6孔板置于冰上. 向培养板中加入150 μL细胞裂解液(含蛋白酶抑制剂1:100), 置于摇床上30 min(冰上), 用细胞刮刀将细胞刮下后, 将细胞悬液移入EP管内, 超声, 离心12000 r/min, 20 min, 取上清. 按照1:4体积比加入4×loading buffer, 100 ℃水浴10 min, 使蛋白变性. 分装, -20 ℃保存备用. 配制PAGE胶, 分离胶的浓度为8%, 积层胶为5%. 上样10 μL预染的SDS-GAGE蛋白分子量Marker, 以确定所检测蛋白带的位置. 初始电压为60 V, 溴酚蓝电泳至积层胶和分离胶分界面后加大至100 V, 至凝胶底部时停止电泳. 将蛋白从SDS-PAGE胶上转移至相同大小的NC膜(Millipore公司)上, 转膜条件为电压100 V, 90 min. 使用5%的脱脂奶粉封闭1-2 h后, 加入按比例稀释的一抗, 4 ℃过夜, 使用TBST洗膜以后, 加入二抗, 即1:1000稀释的山羊抗小鼠或兔抗体(Proteintech), 室温慢摇1 h, TBST洗膜后, 在条带上滴加100 μL的荧光液, 使用ChemiDocTMXRS+凝胶成像分析系统进行半定量分析, 以积分光密度值(integral optical density, IOD)表示, 以目的蛋白/内参蛋白表示蛋白表达的相对水平.
统计学处理 数据均用mean±SD表示, 采用SPSS16.0软件用one way-ANOVA进行处理, P<0.05表示差异有统计学意义.
ELISA检测细胞上清液COL-1、MMP-1和TIMP-1实验结果显示, 与空白对照组比较, E2、SSd单独给药组COL-1、TIMP-1水平明显降低(P<0.01), MMP-1水平明显升高(P<0.01)(图1), 表明单独给药后, 药物作用时可抑制活化的HSC-T6细胞中COL-1、TIMP-1的产生. 拮抗剂ICI-182.780和THC可抑制E2、SSd这种作用. 上述结果表明, SSd对HSC-T6的活化具有抑制作用.
与空白对照组比较, E2、SSd单独给药组P-P38水平明显降低(P<0.01)(图2), 表明单独给药后, 药物作用时可抑制活化的HSC-T6细胞中P38/MAPK通路的激活作用, 限制P38磷酸化. 拮抗剂ICI-182.780和THC可抑制E2、SSd这种作用.
我们采用P38阻断剂SB203580处理细胞, 药物作用24 h, 检测MMP-1与TIMP-1蛋白表达. 与空白对照组相比, SB203580组MMP-1蛋白表达明显增高(P<0.01), TIMP-1蛋白表达明显降低(P<0.05)(图3).
肝纤维化是各种慢性肝病向肝硬化发展的必然过程. 其主要病理特征为肝细胞外基质(extracellular matrix, ECM)的堆积, 最终破坏肝组织结构和损坏肝功能. 导致肝ECM堆积的原因主要表现为在肝纤维化过程中ECM合成过多, 降解的减少[2-6]. 近年来, 就影响ECM合成与降解的细胞因子MMPs和TIMPs的研究越来越引起大家的重视.
在肝脏纤维化过程中, ECM大量沉积, 以Ⅰ型和Ⅲ型胶原增多为主, 其中Ⅰ型胶原含量多达肝脏胶原总量的70%以上[7,8], ECM的沉积主要是因胶原合成增多和/或分解减少造成, 而由于大量ECM沉积而形成肝纤维化. 在众多MMPs中MMP-l是肝脏中分解Ⅰ型及Ⅲ型胶原的主要胶原酶[9-11], 是参与ECM降解的主要酶家族, 几乎可降解除多糖以外的全部ECM. TIMP-1是一种能特异抑制MMPs的糖蛋白, 肝纤维化过程中, 打破了ECM合成和分解的动态平衡, 致使TIMP-1表达增加, 抑制MMPs活性, 进而ECM降解不足, 因此, MMPs及TIMP-1在肝纤维化进程中发挥重要作用[12-14]. 我们采用ELISA实验法, 检测经E2和SSd诱导的HSC-T6细胞上清液中MMP-1和TIMP-1的含量, 结果显示, 空白组细胞MMP-1含量较少, TIMP-1含量较高, 通过E2、SSd诱导后, 前者含量明显增加, 后者含量明显减少.
MAPK信号传导通路在调节细胞核内基因的表达方面, 发挥着重要作用. 其可以调控一些关键的细胞功能, 如细胞增殖、分化、迁移和凋亡; 参与很多疾病过程, 如炎症和肿瘤. 在MAPK家族中, 特定氨基酸序列的磷酸化对于每条MAPK通路的激活都是必需的. 一些刺激因子, 如细胞因子, 可以启动MAPK通路的级联反应, 导致相应的MAPK通路的磷酸化和激活, 进而调节基因的转录[15-18]. 有研究证实P38/MAPK参与体外培养的星形胶质细胞缺氧/复氧损伤过程, 通过其阻断剂SB203580抑制作用, P38/MAPK信号途径降低缺氧复氧损伤后星形胶质细胞引起的炎性因子升高趋势. MAPK是外界刺激因子开启HSC-T6细胞信号转导级联反应中的重要一环[19-21].
柴胡始载于《神农本草经》, 具有抗炎、保肝、解热、镇痛等功效, 临床上多用于治疗少阳症、肝郁气结所致头痛, 妇科月经不调, 感冒, 消化系溃疡, 胆结石, 胆汁反流性胃炎等[22-25]. 柴胡中主要提取成份是柴胡皂苷, 文献报道分离鉴定的皂苷为43个, 主要有柴胡皂苷a, 柴胡皂苷b, 柴胡皂苷c, SSd等, 其中活性最强的成分之一是SSd[26-30]. 本课题组前期实验已经证实, SSd在体内外具有类雌激素作用, 是一种植物雌激素[31]. 那么, SSd是否是通过其雌激素样作用发挥抗肝纤维化作用的呢? 目前未见相关文献报道. 因此, 本研究首先通过Western blot法观察SSd是否对肝星状细胞雌激素受体具有调节作用. 结果发现通过E2、SSd诱导后, MMP-1含量明显增加, TIMP-1含量明显减少. 此种作用可被ER完全拮抗剂ICI182.780和ERβ抑制剂拮抗. 提示SSd可以通过抑制HSC-T6细胞的活化, 从而起到抑制ECM合成的作用, 是ECM各组分之间保持动态的平衡, 这种作用可能以ERβ调控为主. 另外SSd通过激活MAPK信号通路, 调节细胞合成MMP-1、TIMP-1, 药物作用于氧化应激细胞24 h后, 检测MMP-1和TIMP-1蛋白表达, E2、SSd可使HSC-T6细胞MMP-1蛋白表达水平增高, TIMP-1蛋白表达水平降低, 阻断剂ICI182.780和MPP通过抑制MAPK通路激活, 则能抑制这种作用, 提示SSd可通过MAPK通路, 调节细胞基质金属蛋白酶及其抑制酶的水平.
本实验研究显示SSd具有类雌激素样作用, 这种作用可能通过增强靶细胞内ER诱导激活的作用而实现的; SSd具有抗肝纤维化作用, 主要通过ERβ受体转录激活作用, 调控MAPK信号通路, 促进P38磷酸化, 抑制细胞因子的表达, 这些信号通路是外界刺激因子开启肝纤维化反应信号转导级联反应中的重要一环, 进而抑制HSC-T6活化, 起到抗肝纤维化作用. 提示SSd可能是柴胡的调经、改善绝经前后诸症, 又能保肝、治疗肝纤维化等多种药理作用的物质基础. SSd具有多途径防治肝病药理作用, 但许多研究工作要进一步深化. 比如其他方面的药理活性, 有无长期的不良反应, 及其吸收、分布、代谢及排泄等各个环节进行深入细致的研究, 寻找活性代谢物, 更好地揭示其发挥药效的作用机制及物质基础, 从而为其在临床上的推广应用提供可靠的依据.
肝纤维化是细胞外基质(extracellular matrix, ECM)合成降解失调引起异常沉积. 肝星状细胞是合成ECM的主要细胞. 雌激素对肝星状细胞有抑制作用, 因不良反应大而应用受限. 目前一些植物雌激素具有抗肝纤维化效应, 如柴胡皂苷, 白藜芦醇、槲皮素等, 其不良反应小, 可考虑使用.
贾永森, 副教授, 华北理工大学中医学院基础教学部
肝纤维化主要由TGF-β1/Smad、丝裂原活化的蛋白激酶以及核因子-κB(nuclear factor-κB, NF-κB)等信号传导通路共同控制. 柴胡皂苷d(saikosaponin-d, SSd)为该病的常用药物, 具有抗癌、保肝、抗炎、免疫抑制、雌激素样等药理作用. 雌激素因不良反应大而应用受限, 故需寻找替代药物.
Abe等发现四氯化碳引起肝纤维化的大鼠模型中, SSd有明显的抗脂质过氧化作用. Dang等发现SSd在四氯化碳诱导的肝纤维化大鼠模型中可能是下调肝脏肿瘤坏死因子-α、IL-6和NF-κB p65的表达以及增加I-κBα在肝脏中的活性而发挥抗纤维化作用.
前期研究发现SSd是一种植物雌激素. 在此基础上, 本研究观察SSd对肝星状细胞的影响, 并探讨其信号通路机制.研究中还引入雌激素受体α、β的特异性拮抗剂, 首次发现了SSd对HSC-T6抑制作用与其调节雌激素受体β的作用相关.
本文研究发现SSd可以通过抑制HSC-T6细胞的活化, 从而起到促进ECM降解的作用. 研究结果不仅发现SSd可能是柴胡保肝、治疗肝纤维化等多种药理作用的共同物质基础, 也为临床应用诸如SSd等多种植物雌激素治疗肝纤维化提供了一定的实验依据.
MAPK信号通路: 即有丝分裂原活化蛋白激酶信号传导通路, 其在调节细胞核内基因的表达方面, 发挥着重要作用. 其可以调控一些关键的细胞功能, 如细胞增殖、分化、迁移和凋亡; 参与很多疾病过程, 如炎症和肿瘤.
以柴胡为代表对肝纤维化的临床疗效肯定. 本文探讨了有效性的分子机制, 有望对临床应用提供有力实验证据. 研究设计合理, 数据可信. 关于信号通路的研究引入了通路抑制剂, 结果可信, 结论有说服力, 提供了有用信息.
编辑: 郭鹏 电编: 闫晋利
| 1. | 沈 艳婷, 刘 进锴, 阙 任烨, 陶 智会, 林 柳兵, 李 勇. 柴胡皂苷d对氧化应激诱导的HSC-T6活化细胞内AP-1、NF-κB表达的影响及其雌激素受体机制. 江苏中医药. 2015;47:81-84. |
| 2. | 洪 峰. H2O2诱导的肝星状细胞凋亡以及凋亡后细胞外基质代谢的变化. 石家庄: 河北医科大学 2008; . |
| 7. | Birukawa NK, Murase K, Sato Y, Kosaka A, Yoneda A, Nishita H, Fujita R, Nishimura M, Ninomiya T, Kajiwara K. Activated hepatic stellate cells are dependent on self-collagen, cleaved by membrane type 1 matrix metalloproteinase for their growth. J Biol Chem. 2014;289:20209-20221. [PubMed] [DOI] |
| 8. | Tang N, Zhang YP, Ying W, Yao XX. Interleukin-1β upregulates matrix metalloproteinase-13 gene expression via c-Jun N-terminal kinase and p38 MAPK pathways in rat hepatic stellate cells. Mol Med Rep. 2013;8:1861-1865. [PubMed] |
| 9. | Bae MJ, Karadeniz F, Ahn BN, Kong CS. Evaluation of Effective MMP Inhibitors from Eight Different Brown Algae in Human Fibrosarcoma HT1080 Cells. Prev Nutr Food Sci. 2015;20:153-161. [PubMed] [DOI] |
| 10. | Bi Y, Mukhopadhyay D, Drinane M, Ji B, Li X, Cao S, Shah VH. Endocytosis of collagen by hepatic stellate cells regulates extracellular matrix dynamics. Am J Physiol Cell Physiol. 2014;307:C622-C633. [PubMed] [DOI] |
| 11. | 张 素梅. 基质金属蛋白酶抑制因子-1基因的RNAi载体构建及其抑制效应. 西安: 第四军医大学 2013; . |
| 13. | 俞 芹. 化浊解毒调肝方对免疫性肝纤维化大鼠MMP-1、TIMP-1表达的影响. 石家庄: 河北医科大学 2010; . |
| 14. | 王 宇. 基质金属蛋白酶及其抑制因子基因表达调控在治疗肝纤维化中作用的实验研究. 广州: 第一军医大学 2000; . |
| 15. | 张 玉姣. 肝星状细胞和枯否细胞在肝纤维化过程中的相互作用. 长春: 吉林大学 2015; . |
| 18. | 付 玲珠, 郑 婷, 张 永生. TGF-β/Smad信号转导通路与肝纤维化研究进展. 中国临床药理学与治疗学. 2014;19:1189-1195. |
| 19. | Chen L, Li L, Chen J, Li L, Zheng Z, Ren J, Qiu Y. Oleoylethanolamide, an endogenous PPAR-α ligand, attenuates liver fibrosis targeting hepatic stellate cells. Oncotarget. 2015;6:42530-42540. [PubMed] |
| 20. | Wang R, Ding Q, Yaqoob U, de Assuncao TM, Verma VK, Hirsova P, Cao S, Mukhopadhyay D, Huebert RC, Shah VH. Exosome Adherence and Internalization by Hepatic Stellate Cells Triggers Sphingosine 1-Phosphate-dependent Migration. J Biol Chem. 2015;290:30684-30696. [PubMed] [DOI] |
| 21. | Aher JS, Khan S, Jain S, Tikoo K, Jena G. Valproate ameliorates thioacetamide-induced fibrosis by hepatic stellate cell inactivation. Hum Exp Toxicol. 2015;34:44-55. [PubMed] [DOI] |
| 22. | 王 志超, 张 博, 杨 小龙, 李 瑞芳. 柴胡皂苷防治肝病机制研究进展. 河南科技大学学报(医学版). 2011;29:316-318. |
| 23. | 田 耕, 于 皆平. 雌激素的抗肝纤维化作用. 国外医学(内科学分册). 2000;27:390-392, 398. |
| 24. | 王 伟红. 雌二醇代谢产物对肝星状细胞增殖和TGF-β1、CTGF表达的影响. 长沙: 中南大学 2008; . |
| 26. | 李 忻, 王 琛, 于 文明, 李 平, 王 泰龄, 潘 琳, 陈 玉武, 李 克明, 郭 景珍. 柴胡皂苷d预防实验大鼠肝纤维化的作用观察. 中日友好医院学报. 2006;20:192, 225-228. |
| 30. | 刘 进锴. 柴胡皂苷d对大鼠肝星状细胞HSC-T6的增殖活化及雌激素受体表达的影响. 上海: 第二军医大学 2014; . |