修回日期: 2016-01-18
接受日期: 2016-01-23
在线出版日期: 2016-02-28
目的: 研究丁酸钠(sodium butyrate, BTR)对大鼠肠缺血/再灌注(ischemia-reperfusion, I/R)后小肠损伤的保护作用.
方法: ♂SD大鼠50只, 随机分为假手术组(sham组), 肠I/R 1 h组和4 h组(I/R1组和I/R4组), BTR干预1 h组和4 h组(BTR1组和BTR4组), 每组10只. 丁酸钠组和肠I/R组夹闭大鼠肠系膜上动脉30 min, 恢复灌流后观察4 h, 制备肠I/R模型; 假手术组仅开腹不夹闭动脉. BTR组于术后立即行皮下注射BTR(400 mg/kg), 假手术组和肠I/R组皮下注射等量生理盐水. 于I/R 1 h和4 h后, 测定小肠黏膜血流量, 取血浆检测血浆肿瘤坏死因子(tumor necrosis factor-α, TNF-α)水平和二胺氧化酶(diamine oxidase, DAO)活性, 取小肠组织检测髓过氧化物酶(myeloperoxidase, MPO)、脂质过氧化物丙二醛(malondialdehyde, MDA)活性和血管内皮生长因子(vascular endothelial growth factor, VEGF)含量, 检测小肠微血管通透性和含水率, HE染色观察小肠病理变化.
结果: 肠I/R致小肠损伤组血浆TNF-α、DAO及小肠组织含水率、微血管通透性、MDA、MPO、VEGF明显高于假手术组(P<0.05), 小肠黏膜血流量明显降低(P<0.05), 小肠损伤明显. 与对应时间点I/R组相比, BTR治疗后血浆TNF-α、DAO及小肠组织含水率、微血管通透性、MDA、MPO、VEGF明显降低(P<0.05), 小肠黏膜血流量升高(P<0.05), 小肠损伤减轻.
结论: BTR减轻大鼠肠I/R后小肠微血管通透性、组织水肿, 增高小肠黏膜血流量, 具有一定的小肠保护作用. 其保护机制与清除氧自由基, 减轻炎症反应和降低小肠VEGF表达有关.
核心提示: 丁酸钠(sodium butyrate)能够降低丙二醛(malondialdehyde)的含量和血管内皮生长因子(vascular endothelial growth factor)的表达, 减轻炎症反应, 从而降低肠缺血/再灌注后肠道损伤的风险, 为临床常见肠道损伤的预防和治疗提供了新的解决途径.
引文著录: 唐富波, 张文华, 李雨梦, 胡森, 白晓东. 丁酸钠在大鼠肠缺血/再灌注小肠损伤中的作用. 世界华人消化杂志 2016; 24(6): 851-857
Revised: January 18, 2016
Accepted: January 23, 2016
Published online: February 28, 2016
AIM: To investigate the effect of sodium butyrate (BTR) on small intestinal injury following intestinal ischemia-reperfusion (I/R) in rats.
METHODS: An intestinal I/R model was developed by superior mesenteric artery (SMA) occlusion. Fifty SD rats were randomly divided into five groups: a sham group, an intestinal I/R 1 h (I/R1) group, an intestinal I/R 4 h (I/R4) group, an I/R + BTR 1 h (BTR1) group, and an I/R + BTR 4 h (BTR4) group. After induction of intestinal I/R, BTR (400 mg/kg) or normal saline was subcutaneously injected respectively. At 1 h and 4 h after I/R, intestinal mucosal blood flow (IMBF) was measured by Doppler ultrasound, and blood samples were taken for measurement of tumor necrosis factor-α (TNF-α) and diamine oxidase (DAO) activity. The samples of intestinal tissues were harvested for measurement of microvascular permeability, tissue water content, and levels of myeloperoxidase (MPO), malondialdehyde (MDA) and vascular endothelial growth factor (VEGF). The pathological changes of intestinal tissues were also observed.
RESULTS: Plasma levels of TNF-α and DAO, tissue water content, microvascular permeability, and the intestinal levels of VEGF, MPO, and MDA were significantly elevated and IMBF reduced in the I/R1 and I/R4 groups compared with the sham group. The levels of above parameters were significantly reversed in the BTR1 and BTR4 groups compared with the I/R1 and I/R4 groups after I/R injury.
CONCLUSION: Sodium butyrate inhabits increased inflammatory mediators and high microvascular permeability and protects against I/R induced gut injury in rats.
- Citation: Tang FB, Zhang WH, Li YM, Hu S, Bai XD. Effect of sodium butyrate on small intestinal injury following intestinal ischemia-reperfusion in rats. Shijie Huaren Xiaohua Zazhi 2016; 24(6): 851-857
- URL: https://www.wjgnet.com/1009-3079/full/v24/i6/851.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i6.851
肠缺血/再灌注损伤(ischemia-reperfusion, I/R)普遍存在于创伤、休克、肠梗阻、腹腔手术等过程中[1]. 肠损伤常引起全身炎症反应综合征及多器官功能障碍综合征, 目前认为其损伤机制与缺氧后氧自由基大量释放, 导致组织器官脂质过氧化有重要关系[2-6]. 因此, 早期采取措施抑制肠I/R损伤在临床上具有重要意义. 研究[7-9]表明, 组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors, HDACIs)丁酸钠(sodium butyrate, BTR), 可以抑制炎症反应, 减轻I/R后心肌损伤. 但BTR对I/R后小肠损伤是否具有保护作用研究甚少. 本研究采用大鼠肠I/R所引起的小肠损伤模型, 探讨BTR对大鼠肠I/R所致小肠损伤的保护作用及其可能机制.
清洁级♂SD大鼠50只(北京华阜康生物科技股份有限公司), 60-70日龄, 体质量250 g±10 g, 适应性饲养2 wk, 实验前禁食12 h、禁饮4 h. BTR和荧光标志物葡聚糖购自美国Sigma公司; 荧光酶标仪购自美国Dynex公司; 肿瘤坏死因子(tumor necrosis factor-α, TNF-α)和血管内皮生长因子(vascular endothelial growth factor, VEGF)试剂盒购自北京华奥森科技有限公司; 二胺氧化酶(diamine oxidase, DAO)、髓过氧化物酶(myeloperoxidase, MPO)和丙二醛(malondialdehyde, MDA)试剂盒购自南京建成科技有限公司; 激光多普勒血流仪购自瑞典PERIMED公司.
1.2.1 分组及模型制备: 随机分为5组: 假手术组(Sham组)、肠I/R 1 h组(I/R1组)、肠I/R 4 h组(I/R4组)、BTR干预1 h组(BTR1组)和BTR干预4 h组(BTR4组), 每组10只. 戊巴比妥钠注射液(50 mg/kg)腹腔注射麻醉后行腹部备皮. BTR组和肠I/R组采用无菌手术开腹后, 用动脉夹夹闭大鼠肠系膜上动脉30 min后松夹观察1 h和4 h, 制备肠I/R模型, 伤后立即皮下注射BTR(400 mg/kg)或等体积生理盐水. 假手术组仅开腹不夹闭肠系膜上动脉. 于再灌注后1 h和4 h腹主动脉取血, 处死大鼠取小肠组织, 进行指标检测.
1.2.2 小肠微血管内皮通透性检测: 再灌注后1 h和4 h时间点, 处死动物前30 min向颈静脉注入FITC标记的葡聚糖(2.5 mg), 经心脏灌洗生理盐水冲尽小肠组织血液后, 收集组织样本, 制成组织匀浆, 5000 r/min离心10 min, 取上清液通过荧光酶标仪(发射光480 nm, 接收光560 nm)测定小肠组织内葡聚糖含量. 根据标准曲线, 计算葡聚糖含量, 所得结果用于反映血管通透性的变化.
1.2.3 小肠组织含水率检测: 干湿质量法检测大鼠小肠组织含水率. 取适量小肠组织, 用滤纸将组织表面液体吸干, 迅速将其放置于电子天平准确称质量, 将组织放入电烤箱中80 ℃烘烤72 h, 称质量烘干后的组织并记录, 3次测量确定其恒质量. 小肠组织含水率 = (烘干前质量-烘干后质量)/烘干前质量×100%.
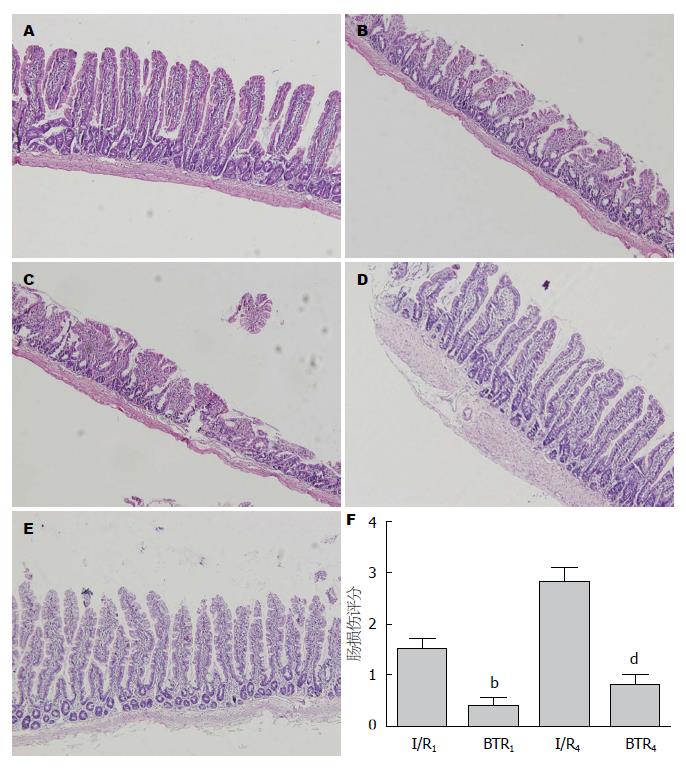
1.2.4 小肠组织HE染色观察: 每只大鼠取小肠组织1块, 使用40 g/L中性甲醛液固定, 脱水、透明, 石蜡包埋, 切片(5 μm). HE染色后, 结果于Olympus显微镜(放大倍数×200)下观察、拍照, 观察肠I/R后大鼠小肠组织病理变化情况. 每张切片随机选取3张照片, 按照肠道评分系统进行评分, 共分5级: 0-正常, 无损伤; 1-轻度损伤, 局部上皮水肿; 2-中度损伤, 小肠绒毛弥漫性肿胀及坏死; 3-重度损伤, 黏膜下层噬中性粒细胞弥漫性渗出; 4-较重损伤, 广泛损伤伴大量噬中性粒细胞渗出和出血.
1.2.5 血浆TNF-α、DAO水平检测: 采用ELISA试剂盒检测血浆TNF-α、DAO水平. 腹主动脉取血, 4 ℃冰箱保存过夜后, 1000 r/min离心30 min. 取上清液后储存于-80 ℃冰箱备用. 严格按照ELISA试剂盒说明书进行TNF-α和DAO测定.
1.2.6 小肠组织髓过氧化物酶(myeloperoxidase, MPO)、MDA和VEGF检测: 每只大鼠称取0.1 g小肠组织, 加入0.9 mL冰生理盐水制成10%组织匀浆, 3000 r/min离心10 min, 取上清液置于-80 ℃冰箱待测. MPO、MDA、VEGF严格按照相应试剂盒说明书进行测定.
1.2.7 小肠黏膜血流量检测: 肠黏膜的血流量采用激光多普勒血流仪检测, 沿大鼠腹白线无菌开腹, 选择暴露小肠黏膜的部位, 镊子使其平铺, 防止扭转. 红外探头的中心移至肠黏膜表面, 自动监测血流量, 时间约45 s, 仪器自动输出血流量平均值. 血流灌注单位为BPU, BPU表示数码信号.
统计学处理 应用SPSS13.0统计软件处理, 指标检测所得的数据结果均以mean±SD表示, 采用多组间比较的方差分析及组间两两比较的SNK法进行统计学分析. P<0.05为差异有统计学意义.
假手术组大鼠小肠组织未见明显异常变化. 肠I/R后, 肠道损伤较重, 表现为大量绒毛受损, 尖端有少量上皮坏死、脱落, 肠绒毛顶端变钝、塌陷, 内皮下出血, 中性粒细胞弥散. BTR治疗后, 表现为上皮绒毛结构清晰、完整, 绒毛充盈无缺损, 无上皮脱落或碎屑形成(图1).
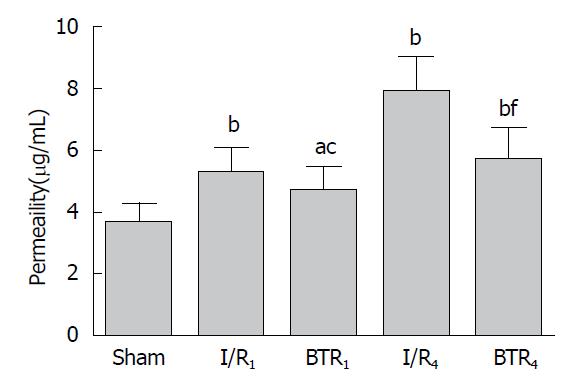
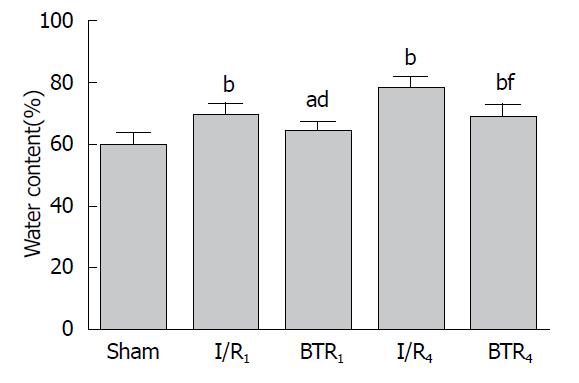
与假手术组比较, 肠I/R 1 h组和4 h组小肠微血管通透性和组织含水率增高(P<0.05). 与肠I/R组对应时间点比较, BTR治疗1 h和4 h后小肠微血管通透性和组织含水率明显降低(P<0.05)(图2, 3).
假手术组大鼠小肠黏膜血流量丰富, 血浆TNF-α含量和DAO活性为正常值范围. 肠I/R致小肠损伤后, 小肠黏膜血流量下降, 血浆TNF-α水平和DAO活性明显上升, 各对应时间点与假手术组比较均有显著差异(P<0.05). 与肠I/R组各对应时间点比较, BTR治疗1 h和4 h后小肠黏膜血流量升高, 血浆TNF-α水平和DAO活性均明显降低(P<0.05)(表1).
与假手术组比较, 肠I/R 1 h组和4 h组小肠组织MPO、MDA和VEGF水平均明显增高(P<0.05). 与肠I/R组对应时间点比较, BTR治疗1 h和4 h后小肠组织MPO和VEGF水平均明显降低(P<0.05), 治疗4 h后MDA水平降低(P<0.05)(表2).
肠道不仅具有消化和吸收营养物质功能, 也是体内和体外相联系的最大空腔脏器, 含有数量、种类繁多的细菌, 是人体最大的"细菌储存库"[10,11]. 这些细菌形成较为稳定的微生态系统, 在生理条件下对机体无明显损害. 肠损伤后, 肠道屏障功能障碍, 导致大量细菌和内毒素经门静脉和淋巴系统进入体循环, 造成细菌移位和内毒素血症, 甚至全身炎症反应综合征及多器官功能障碍综合征[12-14]. 因此, 减轻肠I/R小肠损伤对于临床治疗工作十分重要. 本实验结果显示, 肠I/R 1 h后, 小肠组织即出现损伤; 再灌注4 h后, 损伤更为明显. 与肠缺血组比较, BTR组在再灌注1 h和4 h后, 均能显著减少小肠损伤. 说明BTR对肠I/R后小肠损伤具有一定的保护作用.
HDACIs是近年来缺氧和休克后保护药物的研究热点, HDACIs通过提高机体细胞的抗缺氧及抗炎等能力, 有效保护各脏器功能[15-18]. BTR是一种组蛋白去乙酰化酶抑制剂, 可以抑制中性粒细胞浸润和炎症反应, 保护脏器功能[19-21]. 创伤后肠道屏障功能损害的主要机制都可归于肠组织缺血、缺氧及再灌注损伤, 导致氧自由基产生增加, 出现脂质过氧化损伤及过度炎症反应[22,23]. 脂质过氧化酶MDA用以反映机体内脂质过氧化程度[24]. DAO是肠绒毛上皮细胞内的标记酶, 检测血浆DAO活性的变化, 能反映小肠黏膜的损伤情况[25]. 肠I/R后1 h和4 h, 血浆TNF-α、小肠组织MDA、MPO水平升高, 血浆DAO活性增强. BTR治疗后, 与肠缺血组相比, 血浆TNF-α、小肠组织MDA、MPO水平明显降低, 血浆DAO活性有所减弱. 说明BTR能够抑制肠I/R后小肠炎症反应, 降低小肠脂质过氧化, 减轻小肠损伤.
VEGF是一种高度特异性的血管内皮有丝分裂素, 由肿瘤细胞、血管内皮细胞和巨噬细胞所合成, 并通过自分泌/旁分泌方式特异地作用于血管内皮细胞上的受体, 在血管内皮通透性调节中起到重要作用[26-29], HDACI可以抑制VEGF的表达[30-32]. 本实验中发现, 肠I/R后, 小肠组织VEGF水平在1 h和4 h时均有所增高; 利用荧光标志物葡聚糖检测小肠组织微血管通透性, 发现再灌注1 h和4 h时, 微血管通透性增加; 同时, 再灌注1 h和4 h后, 小肠组织含水率逐渐增高. BTR治疗后, 小肠组织VEGF水平、微血管通透性和含水率均明显降低. 同时, 肠I/R后1 h和4 h, 小肠黏膜血流量迅速减少, BTR治疗后小肠黏膜血流量明显增加. 说明VEGF在调节肠I/R后小肠组织微血管通透性、含水率和小肠黏膜血流量中起着重要作用, BTR可能通过抑制VEGF的表达, 降低肠I/R后小肠微血管通透性和含水率, 提高小肠黏膜血流量, 保护小肠功能.
总之, BTR减轻大鼠肠I/R后小肠微血管通透性、组织水肿, 增加小肠黏膜血流量, 具有一定的小肠保护作用, 其保护机制可能与清除氧自由基, 减轻炎症反应, 降低小肠组织VEGF表达有关.
腹腔肠道相关手术的日益增多, 使得肠损伤的风险逐渐增加. 研究肠缺血/再灌注损伤(ischemia-reperfusion, I/R)后肠道保护药物是目前的热点. 丁酸钠(sodium butyrate, BTR)具有抗炎、抗缺氧等作用, 能够保护心、脑、肺等脏器功能, 本课题是基于其脏器保护作用而进行的I/R所致肠损伤的保护作用研究.
肖卫东, 副教授, 副主任医师, 中国人民解放军第三军医大学附属新桥医院普通外科; 郑曙云, 副教授, 主任医师, 南京医科大学第三临床医学院(南京医科大学附属南京医院)重症医学科(ICU)
肠I/R后氧自由基的释放和炎症因子的活化, 是造成肠道损伤的主要因素. 肠损伤后其屏障功能的破坏, 继而造成肠道细菌扩散至全身, 引起多种并发症. 如何减少氧自由基的释放、炎症因子的活化以及保护肠道屏障功能, 是亟待解决的重要问题.
近年来已经有研究明确, BTR对心、肝、脑等I/R后损伤具有保护作用, 抗炎、抗氧化等功能是脏器保护作用的关键. 但鲜有BTR对肠I/R后肠道损伤的保护作用及相关机制的研究报道.
本研究通过BTR治疗肠I/R模型, 不仅发现BTR具有与其他肠道保护药物类似的抗氧自由基、抗炎症等作用, 还发现BTR具有抑制I/R引起的肠道微血管内皮通透性升高和肠水肿的作用. 这一发现为预防肠源性菌血症和脓毒症提供了新的思路.
本研究证实BTR对肠I/R后肠损伤具有保护作用, 为临床上减轻创伤、休克、肠梗阻、腹腔手术等引起的肠道损伤提供了一种新的药物和治疗方案.
本文紧贴临床实际需求, 提出相应科学问题, 证明了BTR对肠道I/R后肠损伤的保护作用及相关机制, 具有一定的科学性和创新性, 课题设计合理, 文章结构层次清晰, 对临床上休克、肠梗阻、腹腔手术及小肠移植等情况下肠保护有一定临床意义.
编辑: 郭鹏 电编:闫晋利
| 1. | 胡 晓敏, 吕 阳, 姚 尚龙. 丙泊酚对大鼠肠缺血再灌注损伤的影响. 华中科技大学学报(医学版). 2007;37:210-213. |
| 2. | Okudan N, Belviranlı M, Gökbel H, Oz M, Kumak A. Protective effects of curcumin supplementation on intestinal ischemia reperfusion injury. Phytomedicine. 2013;20:844-848. [PubMed] [DOI] |
| 3. | Fan Z, Jing H, Yao J, Li Y, Hu X, Shao H, Shen G, Pan J, Luo F, Tian X. The protective effects of curcumin on experimental acute liver lesion induced by intestinal ischemia-reperfusion through inhibiting the pathway of NF-κB in a rat model. Oxid Med Cell Longev. 2014;2014:191624. [PubMed] [DOI] |
| 4. | Zhang F, Li ZL, Xu XM, Hu Y, Yao JH, Xu W, Jing HR, Wang S, Ning SL, Tian XF. Protective effects of icariin-mediated SIRT1/FOXO3 signaling pathway on intestinal ischemia/reperfusion-induced acute lung injury. Mol Med Rep. 2015;11:269-276. [PubMed] [DOI] |
| 6. | Wang G, Chen Z, Zhang F, Jing H, Xu W, Ning S, Li Z, Liu K, Yao J, Tian X. Blockade of PKCβ protects against remote organ injury induced by intestinal ischemia and reperfusion via a p66shc-mediated mitochondrial apoptotic pathway. Apoptosis. 2014;19:1342-1353. [PubMed] [DOI] |
| 7. | Sun J, Wang F, Li H, Zhang H, Jin J, Chen W, Pang M, Yu J, He Y, Liu J. Neuroprotective Effect of Sodium Butyrate against Cerebral Ischemia/Reperfusion Injury in Mice. Biomed Res Int. 2015;2015:395895. [PubMed] [DOI] |
| 8. | Hu X, Zhang K, Xu C, Chen Z, Jiang H. Anti-inflammatory effect of sodium butyrate preconditioning during myocardial ischemia/reperfusion. Exp Ther Med. 2014;8:229-232. [PubMed] |
| 10. | Magnotti LJ, Deitch EA. Burns, bacterial translocation, gut barrier function, and failure. J Burn Care Rehabil. 2005;26:383-391. [PubMed] |
| 12. | Liu XH, Yang YW, Dai HT, Cai SW, Chen RH, Ye ZQ. Protective role of adiponectin in a rat model of intestinal ischemia reperfusion injury. World J Gastroenterol. 2015;21:13250-13258. [PubMed] [DOI] |
| 13. | 范 加维, 杨 森, 杨 拯, 黄 宏达, 陈 勇, 宋 强, 罗 兰, 梁 杰, 张 婷, 黄 倩. 原花青素对脑缺血再灌注损伤后肠道功能的保护作用. 中国康复理论与实践. 2015;21:1138-1144. |
| 14. | Sarsu SB, Ozokutan BH, Tarakcioglu M, Sarı I, Bağcı C. Effects of Leptin on Intestinal Ischemia-Reperfusion Injury. Indian J Surg. 2015;77:351-355. [PubMed] [DOI] |
| 15. | Fessler EB, Chibane FL, Wang Z, Chuang DM. Potential roles of HDAC inhibitors in mitigating ischemia-induced brain damage and facilitating endogenous regeneration and recovery. Curr Pharm Des. 2013;19:5105-5120. [PubMed] |
| 16. | Granger A, Abdullah I, Huebner F, Stout A, Wang T, Huebner T, Epstein JA, Gruber PJ. Histone deacetylase inhibition reduces myocardial ischemia-reperfusion injury in mice. FASEB J. 2008;22:3549-3560. [PubMed] [DOI] |
| 17. | Gonzales ER, Chen H, Munuve RM, Mehrani T, Nadel A, Koustova E. Hepatoprotection and lethality rescue by histone deacetylase inhibitor valproic acid in fatal hemorrhagic shock. J Trauma. 2008;65:554-565. [PubMed] [DOI] |
| 18. | Cianciolo Cosentino C, Skrypnyk NI, Brilli LL, Chiba T, Novitskaya T, Woods C, West J, Korotchenko VN, McDermott L, Day BW. Histone deacetylase inhibitor enhances recovery after AKI. J Am Soc Nephrol. 2013;24:943-953. [PubMed] [DOI] |
| 20. | 丁 泽君, 孙 明洁, 刘 佳, 姜 远旭, 尚 游, 袁 世荧. 丁酸钠对脂多糖诱导的急性肺损伤大鼠的肺保护研究. 国际麻醉学与复苏杂志. 2013;34:779-782. |
| 21. | Liang X, Wang RS, Wang F, Liu S, Guo F, Sun L, Wang YJ, Sun YX, Chen XL. Sodium butyrate protects against severe burn-induced remote acute lung injury in rats. PLoS One. 2013;8:e68786. [PubMed] [DOI] |
| 25. | Li YM, Wang HB, Zheng JG, Bai XD, Zhao ZK, Li JY, Hu S. Dimethyl sulfoxide inhibits zymosan-induced intestinal inflammation and barrier dysfunction. World J Gastroenterol. 2015;21:10853-10865. [PubMed] [DOI] |
| 26. | Bates DO, Harper SJ. Regulation of vascular permeability by vascular endothelial growth factors. Vascul Pharmacol. 2002;39:225-237. [PubMed] |
| 27. | Feng D, Nagy JA, Brekken RA, Pettersson A, Manseau EJ, Pyne K, Mulligan R, Thorpe PE, Dvorak HF, Dvorak AM. Ultrastructural localization of the vascular permeability factor/vascular endothelial growth factor (VPF/VEGF) receptor-2 (FLK-1, KDR) in normal mouse kidney and in the hyperpermeable vessels induced by VPF/VEGF-expressing tumors and adenoviral vectors. J Histochem Cytochem. 2000;48:545-556. [PubMed] |
| 28. | Bates DO. Vascular endothelial growth factors and vascular permeability. Cardiovasc Res. 2010;87:262-271. [PubMed] [DOI] |
| 29. | Jiang S, Xia R, Jiang Y, Wang L, Gao F. Vascular endothelial growth factors enhance the permeability of the mouse blood-brain barrier. PLoS One. 2014;9:e86407. [PubMed] [DOI] |
| 30. | Yang B, Yu D, Liu J, Yang K, Wu G, Liu H. Antitumor activity of SAHA, a novel histone deacetylase inhibitor, against murine B cell lymphoma A20 cells in vitro and in vivo. Tumour Biol. 2015;36:5051-5061. [PubMed] [DOI] |
| 31. | Chan N, He S, Spee CK, Ishikawa K, Hinton DR. Attenuation of choroidal neovascularization by histone deacetylase inhibitor. PLoS One. 2015;10:e0120587. [PubMed] [DOI] |
| 32. | Kaiser M, Zavrski I, Sterz J, Jakob C, Fleissner C, Kloetzel PM, Sezer O, Heider U. The effects of the histone deacetylase inhibitor valproic acid on cell cycle, growth suppression and apoptosis in multiple myeloma. Haematologica. 2006;91:248-251. [PubMed] |