修回日期: 2015-12-25
接受日期: 2016-01-06
在线出版日期: 2016-02-18
目的: 研究早期结直肠癌局部切除术与根治性术后患者生存期的差异.
方法: 回顾性分析1998/2008年SEER数据库中符合筛选条件的患者, 根据手术方式分为局部切除组和根治性手术组, 并根据肿瘤部位分为结肠癌亚组和直肠癌亚组, 通过绘制Kaplan-Meier生存曲线, 比较两组患者的生存期差异及独立预后因素.
结果: 本研究共入组13795例患者, 根治性切除的共13647例, 其中结肠癌10389例, 直肠癌3258例; 局部切除的共148例, 其中结肠癌62例, 直肠癌86例. T1期更倾向于接受局部切除, 而T2期则更倾向于接受根治性切除(P<0.001). 单因素生存分析结果显示: T1期结肠癌根治性手术组与局切手术组患者的5年和10年生存率有统计学差异(P = 0.0069); T2期两组并无统计学差异(P = 0.278). T1和T2期直肠癌根治性手术组与局切手术组患者的5年和10年生存率均无统计学差异(P = 0.253, 0.975). 多生存因素分析结果显示: 性别、年龄、种族、肿瘤大小、肿瘤分化程度和手术方式是影响预后的独立因素, 但结直肠癌有各自的特点.
结论: 对于T1、T2期直肠癌, 行局部切除可以达到根治性手术的效果, 获得同等的生存率; T1期结肠癌, 根治性切除比局部切除能获得更好的生存率; T2期结肠癌有待增加样本量后进一步对比分析.
核心提示: 在肿瘤的治疗中, 局部切除术存在的诸多风险和不足, 确保患者能够获得长期生存才是硬道理, 切不可为了"微创"和"功能"而违反治疗原则. 对于早期结肠癌, 由于局部切除手术的局限性和本身淋巴结转移的特性, 施行根治性手术才能使更多的患者获得长期生存.
引文著录: 曹益晟, 葛海燕. 早期结直肠癌局部切除与根治性术后生存比较. 世界华人消化杂志 2016; 24(5): 801-807
Revised: December 25, 2015
Accepted: January 6, 2016
Published online: February 18, 2016
AIM: To compare the overall survival after local excision or radical resection for early-stage colorectal cancer.
METHODS: Patients who met the criteria were screened from the SEER database between 1998 and 2008, and they were divided into a local excision group and a radical resection group according to the mode of surgery. Each group was further divided into colon or rectal cancer subgroup according to the location of tumor. Kaplan-Meier analysis was performed to determine the overall survival between the two groups and independent prognostic factors.
RESULTS: A total of 13975 cases were included in the study. Of 13647 cases receiving radical resection, 10389 had colon cancer and 3258 had rectal cancer. Of 148 cases receiving local excision, 62 had colon cancer and 86 had rectal cancer. Tumors at T1 stage tended to receive local excision, while tumors at T2 stage were more inclined to accept radical resection (P < 0.001). Univariate survival analysis showed that there were statistical differences between the two groups in 5-year and 10-year survival rates of patients with stage T1 colon cancer, althougn no significant differences were noted in patients with stage T2 colon cancer and those with both stages T1 and T2 rectal cancer. Multivariate survival factor analysis showed that gender, age, race, tumor size, tumor differentiation and mode of surgery were independent prognostic factors, but both colon cancer and rectal cancer had their own characteristics.
CONCLUSION: Local excision can obtain the same survival rate as radical surgery in patients with stages T1 and T2 rectal cancer. Compared to local excision, radical resection can offer better overall survival in patients with stage T1 colon cancer, while more cases are needed to analyze the difference in patients with stage T2 colon cancer.
- Citation: Cao YS, Ge HY. Survival after local excision or radical resection for early-stage colorectal cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(5): 801-807
- URL: https://www.wjgnet.com/1009-3079/full/v24/i5/801.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i5.801
经腹或腹腔镜下的结直肠癌根治术是大肠癌手术治疗的金标准, 手术通过完整切除肿瘤、足够的远近端正常组织, 以及可能发生转移的血管和淋巴结引流途径, 以达到根治目的. 然而由于手术范围和手术创伤大, 对比局部切除, 根治手术有着较高的术后并发症和死亡率[1]. 特别是低位直肠癌行根治性切除往往伴随着永久性结肠造瘘, 给患者身心带来较大的伤害. 随着早癌筛查的普及, 大肠癌早期诊断率不断提高, 局部切除的应用逐年增加. 相比根治性手术, 局部切除仅单纯切除原发病灶, 没有清扫区域淋巴结, 担忧可能存在较高的局部复发率和淋巴结转移率. 本研究通过对SEER数据库中符合筛选条件的患者的病例资料进行回顾性分析研究, 比较根治性手术和局部切除对早期结直肠癌患者生存的影响.
收集1998/2008年SEER数据库中诊断为结肠癌和直肠癌, 并接受根治性或局部切除的患者, 入组要求包括: (1)年龄≥20周岁; (2)T1-T2期肿瘤; (3)肿瘤大小0-30 mm; (4)病理类型为腺癌、黏液腺癌或印戒细胞癌. 排除因素包括: (1)肿瘤浸润深度超过肌层; (2)伴有远处转移; (3)术前或术后接受过放化疗或未知; (4)病理或临床提示淋巴结转移或未知; (5)种族、肿瘤分级或肿瘤位置不详. 符合条件的共有13795例患者, 详细病例特征如表1. 本研究分析可能影响生存的临床病理指标包括: 性别、年龄、种族、肿瘤大小、T分期、病理分级和手术方式.
| 分组 | 结肠癌 | 直肠癌1 | ||||
| 根治性切除 | 局部切除 | P值 | 根治性切除 | 局部切除 | P值 | |
| 中位随访时间(mo) | 79 | 55.5 | 0.03750 | 87 | 77 | 0.02298 |
| 性别 | 1.00000 | 0.76580 | ||||
| 男 | 5109(49.2) | 30(48.4) | 1777(54.5) | 45(52.3) | ||
| 女 | 5280(50.8) | 32(51.6) | 1481(45.5) | 41(47.7) | ||
| 病理类型 | 0.72550 | 0.57000 | ||||
| 高分化 | 2164(20.9) | 10(16.1) | 471(14.5) | 17(19.8) | ||
| 中分化 | 7380(71.0) | 47(75.8) | 2503(76.8) | 63(73.2) | ||
| 低分化 | 812(7.8) | 5(8.1) | 270(8.3) | 6(7.0) | ||
| 未分化2 | 33(0.3) | 0(0.0) | 14(0.4) | 0(0.0) | ||
| 肿瘤大小(cm) | 0.14750 | <0.00100 | ||||
| ≤1.0 | 2610(25.1) | 22(35.5) | 585(17.9) | 29(33.7) | ||
| >1.0且≤2.0 | 4068(39.2) | 19(30.6) | 1283(39.4) | 28(32.6) | ||
| >2.0且≤3.0 | 3711(35.7) | 21(33.9) | 1390(42.7) | 29(33.7) | ||
| T分期 | 0.01588 | <0.00100 | ||||
| T1 | 6962(67.0) | 51(82.3) | 2136(65.6) | 76(88.4) | ||
| T2 | 3427(33.0) | 11(17.7) | 1122(34.4) | 10(11.6) | ||
根据手术方式分为局部切除组和根治性手术组, 并根据肿瘤部位分为结肠癌亚组和直肠癌亚组, 通过绘制Kaplan-Meier生存曲线, 比较两组患者的生存期差异及独立预后因素.
统计学处理 应用R3.1.3软件(http://www.R-project.org)进行统计分析. 计量资料组间比较采用Wilcoxon秩和检验, 计数资料用构成比表示, 组间比较采用χ2或Fisher精确检验. 总体生存率(overall survival, OS)组间比较用Kaplan-Meier方法获得, 并通过多因素COX回归分析得出独立预后因素. 检验水准α = 0.05, P<0.05为差异具有统计学意义.
本研究共入组13795例患者, 其中男性6961例(50%), 女性6834例(50%); T1期9225例(67%), T2期4570例(33%). 病理类型为一般腺癌13094例, 黏液腺癌669例, 印戒细胞癌32例. 全组患者接受根治性切除的共13647例, 接受局部切除148例; 其中T1期肿瘤接受根治性切除9098例, 接受局部切除127例; T2期肿瘤中, 接受根治性切除4549例, 接受局部切除21例.
亚组分析: T1期结肠癌患者中, 共有6962例接受根治性切除, 51例接受局部切除; T2期结肠癌患者中, 共有3427例接受根治性切除, 11例接受局部切除; 结肠癌患者中T1期别更倾向于接受局部切除, 而T2期则更倾向于接受根治性切除(P<0.001). 类似的结果在直肠肿瘤中也被发现(表1). 此外, 我们发现直径较小的直肠肿瘤更容易接受局部切除(P<0.001), 而术者在对待不同大小的结肠肿瘤的手术方式选择上无明显倾向性(P>0.05).
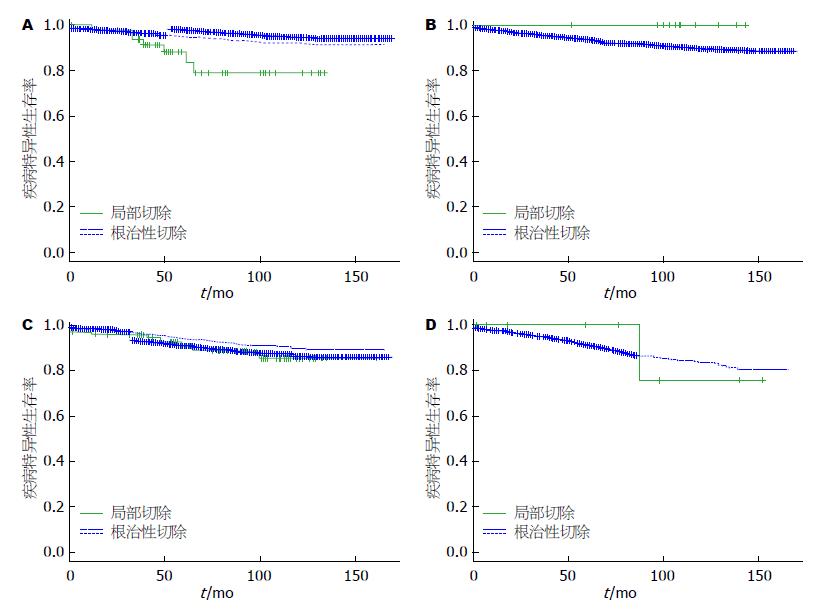
全组患者中位随访时间为81 mo(0-167 mo), 共有1050例在随访过程中死亡. 单因素生存分析结果显示: T1期结肠癌患者中, 根治性手术组的5年和10年生存率分别为95.0%和91.9%, 局部切除手术组5年和10年生存率分别为88.4%和79.1%, 两者有统计学差异(P = 0.0069); T2期结肠癌患者中, 根治性手术组5年和10年生存率分别为93.8%和89.1%, 局切手术组5年和10年生存率均为100%, 但两组并无统计学差异(P = 0.278). T1期直肠癌患者中, 根治性手术组的5年和10年生存率分别为94.4%和89.9%, 局切手术组5年和10年生存率分别为91.0%和85.4%, 两者无统计学差异(P = 0.253); T2期直肠癌患者中, 根治性手术组5年和10年生存率分别为91.0%和83.0%, 局切手术组5年和10年生存率分别为100%和75.0%, 两者无统计学差异(P = 0.975)(图1, 表2).
| 手术方式 | 结肠 | 直肠 | ||||
| 5年 | 10年 | P值 | 5年 | 10年 | P值 | |
| T1期 | 0.0069 | 0.253 | ||||
| 局部切除 | 0.8840 | 0.7908 | 0.9096 | 0.8538 | ||
| 根治性切除 | 0.9500 | 0.9190 | 0.9440 | 0.8993 | ||
| T2期 | 0.2780 | 0.975 | ||||
| 局部切除 | 0.9380 | 0.8910 | 1.0000 | 0.7500 | ||
| 根治性切除 | 1.0000 | 1.0000 | 0.9100 | 0.8298 | ||
多生存因素分析结果显示: 结肠癌患者中, 男性、高龄(>70岁)、黑人、较大的肿瘤、差的肿瘤分化程度和局部切除是独立的预后危险因素. 直肠癌患者中, 高龄(>70岁)、黑人、浸润深度越深(T2)、差的分化程度是独立的预后危险因素(表3).
| 因素 | 结肠 | 直肠 | ||||
| P值 | HR | 95%CI | P值 | HR | 95%CI | |
| 性别(ref. = 女性) | ||||||
| 男性 | 0.015016 | 1.19993 | 1.0360-1.3898 | |||
| 年龄(ref. = <70岁) | ||||||
| >70岁 | <0.001000 | 2.66210 | 2.2638-3.1304 | 2.4852 | 1.9942-3.0971 | |
| 种族(ref. = 黑人) | ||||||
| 其他 | <0.001000 | 0.51900 | 0.3530-0.7631 | 0.01043 | 0.2998-0.8520 | |
| 白人 | 0.001968 | 0.68729 | 0.5420-0.8715 | 0.00405 | 0.3738-0.8302 | |
| 肿瘤大小(ref. = <10mm) | ||||||
| 11-20mm | 0.701448 | 0.96090 | 0.7835-1.1784 | |||
| 21-30mm | 0.046398 | 1.22160 | 1.0032-1.4876 | |||
| T分期(ref. = T1) | ||||||
| T2 | <0.00100 | 1.6568 | 1.3327-2.0598 | |||
| 病理分级(ref. = I) | ||||||
| Ⅱ | 0.025785 | 1.26010 | 1.0283-1.5441 | <0.00100 | 1.4100 | 1.2400-1.6000 |
| Ⅲ | 0.000805 | 1.65910 | 1.2339-2.2309 | 0.32700 | 0.9500 | 0.8600-1.0500 |
| Ⅳ | 0.741891 | 1.26500 | 0.3122-5.1251 | |||
| 手术类型(ref. = 局部切除) | ||||||
| 根治性切除 | 0.053339 | 0.47960 | 0.2276-1.0106 | 0.38100 | 0.4796 | 0.9300-1.2200 |
局部切除用于治疗早期结直肠癌, 较根治性手术有着更低的并发症发生率和死亡率[1,2], 特别是低位直肠癌, 局部切除不但可以最大程度地保留括约肌功能, 减少术后由于盆神经损伤引起的尿潴留、勃起功能障碍等并发症[3], 还可以使部分患者避免永久性结肠造瘘, 加速术后生理和心理的康复. 由于局部切除仅单纯切除原发病灶, 没有清扫区域淋巴结, 可能存在较高的复发率和淋巴结转移率, 因此对于早期结直肠癌患者, 局部切除能否获得与根治性手术相同的生存时间, 哪些患者可以仅通过局部切除这种最小的创伤来获得与根治性手术相同的效果, 是外科医生关注的重点. 有研究报道[2,4-6], 局部切除术后的局部复发率明显高于根治性切除, 淋巴结转移的发生率也要高于根治性手术[7], 也有的研究[8]发现接受局部切除的患者中有相当一部分是全身情况较差, 无法耐受根治性手术, 或预期生存期不长而放弃根治性手术, 因而局切患者的总体生存时间要少于传统根治性手术. 刘宝华[9]认为, 决定局部切除能否达到根治目的的重点是把握手术适应证, 他通过汇总国内多篇相关报道得出, 肿瘤的大小、分化程度、浸润深度和有无淋巴结转移是预后的重要相关因素. 我们的研究将淋巴结转移、远处转移或接受放化疗的患者排除在外, 仅入选Ⅰ期肠癌(参照AJCC第七版)患者, 力求将其中的偏倚降到最低. 通过绘制生存曲线我们发现, 在直肠癌亚组中, T1和T2期肿瘤行局部切除的患者的生存率与接受根治性切除的患者一致, 就是说根治性切除并不能给患者带来更高的生存率, 这一结果与诸多研究[10,11]一致. 虽然局部切除术后复发率较根治性手术增加(P<0.05), 然而无病生存率却无显著差异[12], 这是由于局部复发的患者可通过再次手术以达到根治目的. 然而也有不少学者在对T2期直肠癌患者两种不同手术方式的比较中得出了显著性差异的结果. Kajiwara等[13]提出, 低分化癌、黏液腺癌、淋巴血管侵犯是T2期结直肠癌出现淋巴结转移的重要独立危险因素. 熊国文[14]报道T2期患者局部切除术后肿瘤复发率较高, 建议辅以放、化疗降低肿瘤复发率和提高生存率. Lezoche等[15]认为, T2期直肠癌行新辅助治疗后再行局部切除术, 可获得良好的效果. 手术完整彻底地切除病灶, 切断其可能的转移途径, 对于预防术后复发具有重要意义.
早期直肠癌局部切除手段包括内镜下黏膜剥离术(endoscopic mucosal resection, EMR)、内镜下黏膜下切除术(endoscopic submucosal dissection, ESD)、经肛直视下直肠肿瘤切除术、经肛内镜直肠肿瘤微创手术(transanal endoscopic microsurgery, TEM)等. 前两种为内镜下治疗, 切除的完整性和彻底性与操作医师的经验密切相关, 内镜医师往往需要通过黏膜下注射并观察抬举征来间接判断肿瘤的浸润深度[16]. 有时为了操作方便而采取分片切除(endoscopic piecemeal mucosal resection, EPMR)的办法, 可能会对肿瘤范围、基底切缘的判断产生影响; 为了减少治疗后并发症, 操作医师会尽可能避免因全层切除而引起的肠穿孔, 由此可能失去彻底切除残留肿瘤的机会. 经肛直视下直肠肿瘤切除术用于治疗早期中低位直肠癌, 肿瘤多位于腹膜返折下方, 手术医师在直视下切除肿瘤往往可深达肌层, 甚至全层切除后修补缝合肠壁缺损, 根治效果较好. 而TEM更具有内镜下放大的优势, 可以更加清晰地观察肿瘤范围和基底切缘, 切除后缝合也较内镜下治疗简单可靠. 据统计, 超过10%的患者接受了内镜切除后, 必须经过追加根治手术以防止局部复发和淋巴结转移[17,18], 而行TEM术后的局部复发率仅为5%[19]. 因此, 不同的局部切除方式会对患者的生存率产生一定的影响, 遗憾的是SEER数据库并没有提供具体的局切方式.
在结肠癌亚组中, T1期肿瘤行局部切除术后的生存率较根治性手术患者低, 两者具有统计学差异. 这一结果与Bhangu等[20]的发现一致. 由于早期肠癌往往已经侵犯了富含血管和淋巴管的黏膜下层, 就存在出现早期脉管转移的可能. 结肠癌局部切除的主要手段是EMR和ESD, 在切除方式上存在一定的局限性. 随着肿瘤浸润肠壁深度增加, 淋巴结转移率明显增高, 向近端、中枢方向淋巴结转移的机会随之增加. 有报道显示, T1期结肠癌的淋巴结转移率高达14.3%[21], 而同期的直肠癌淋巴结累及率为5.7%-14.3%[22]. 因此, 对早期结肠癌患者应该行根治性手术使患者能够最大获益. 值得探讨的是, 我们的研究得出T2期结肠癌相关生存率比较无统计学差异, 这一结果不仅与同亚组T1期的结果相悖, 也与国内外多数学者的研究结果不符. 究其原因可能为, 入组病例中仅有11例T2期结肠癌患者接受局部切除, 样本量与病例数之间巨大的差距导致了分析结果的偏倚, 因此有待于进一步增加随访病例数再行分析研究.
我们的多生存因素分析显示, 早期结、直肠癌患者中, 高龄(>70岁)、黑人、差的分化程度是共同的独立预后危险因素, 但又有各自的特点. 对于结肠癌, 男性、较大的肿瘤和局部切除是预后危险因素, 而直肠癌患者中, 性别和肿瘤大小与肿瘤预后无显著相关, 浸润深度(T2)是独立预后危险因素. 这为不同的患者选择最佳的手术方式提供了流行病学依据.
在肿瘤的治疗中, 局部切除术存在的诸多风险和不足, 确保患者能够获得长期生存才是硬道理, 切不可为了"微创"和"功能"而违反治疗原则. 经过精确的术前分期和合理选择适应证的前提下, T1N0M0期直肠癌行局部切除术既可以保留肛门及其功能, 避免永久性造瘘的可能, 又可以获得与根治性手术相当的生存率, 并且大大减少了手术并发症和死亡率, 是治疗的首选. 但对于早期结肠癌, 由于局部切除手术的局限性和本身淋巴结转移的特性, 特别是对于男性、高龄(>70岁)、黑人、肿瘤较大、分化较差的患者, 施行根治性手术才能使更多的患者获得长期生存.
局部切除用于治疗早期结直肠癌, 较根治性手术有着更低的并发症发生率和死亡率, 特别是低位直肠癌. 但是由于局部切除仅单纯切除原发病灶, 没有清扫区域淋巴结, 可能存在较高的复发率和淋巴结转移率, 因此对于早期结直肠癌患者, 局部切除能否获得与根治性手术相同的生存时间, 哪些患者可以仅通过局部切除这种最小的创伤来获得与根治性手术相同的效果, 是外科医生关注的重点.
蔡建春, 教授, 主任医师, 厦门大学附属中山医院胃肠外科; 罗素霞, 主任医师, 河南省肿瘤医院消化内科二病区
熊国文报道T2期患者局部切除术后肿瘤复发率较高, 建议辅以放、化疗降低肿瘤复发率和提高生存率; Lezoche等认为, T2期直肠癌行新辅助治疗后再行局部切除术, 可获得良好的效果. 手术完整彻底地切除病灶, 切断其可能的转移途径, 对于预防术后复发具有重要意义.
本文对比不同手术方式对结直肠癌早期患者生存的影响, 有一定的临床意义. 文章思路清晰, 结构合理, 病例数较多, 数据基本可靠.
本文对比不同手术方式对结直肠癌早期患者生存的影响, 有一定的临床意义. 文章思路清晰, 结构合理, 病例数较多, 数据基本可靠.
编辑: 于明茜 电编:都珍珍
| 1. | Lee W, Lee D, Choi S, Chun H. Transanal endoscopic microsurgery and radical surgery for T1 and T2 rectal cancer. Surg Endosc. 2003;17:1283-1287. [PubMed] [DOI] |
| 2. | You YN, Baxter NN, Stewart A, Nelson H. Is the increasing rate of local excision for stage I rectal cancer in the United States justified?: a nationwide cohort study from the National Cancer Database. Ann Surg. 2007;245:726-733. [PubMed] [DOI] |
| 3. | Engel J, Kerr J, Schlesinger-Raab A, Eckel R, Sauer H, Hölzel D. Comparison of breast and rectal cancer patients' quality of life: results of a four year prospective field study. Eur J Cancer Care (Engl). 2003;12:215-223. [PubMed] [DOI] |
| 4. | Bentrem DJ, Okabe S, Wong WD, Guillem JG, Weiser MR, Temple LK, Ben-Porat LS, Minsky BD, Cohen AM, Paty PB. T1 adenocarcinoma of the rectum: transanal excision or radical surgery? Ann Surg. 2005;242:472-477; discussion 472-477. [PubMed] [DOI] |
| 5. | Endreseth BH, Myrvold HE, Romundstad P, Hestvik UE, Bjerkeset T, Wibe A. Transanal excision vs. major surgery for T1 rectal cancer. Dis Colon Rectum. 2005;48:1380-1388. [PubMed] [DOI] |
| 6. | Nascimbeni R, Nivatvongs S, Larson DR, Burgart LJ. Long-term survival after local excision for T1 carcinoma of the rectum. Dis Colon Rectum. 2004;47:1773-1779. [PubMed] [DOI] |
| 7. | Kobayashi H, Mochizuki H, Kato T, Mori T, Kameoka S, Shirouzu K, Saito Y, Watanabe M, Morita T, Hida J. Is total mesorectal excision always necessary for T1-T2 lower rectal cancer? Ann Surg Oncol. 2010;17:973-980. [PubMed] [DOI] |
| 8. | Hazard LJ, Shrieve DC, Sklow B, Pappas L, Boucher KM. Local Excision vs. Radical Resection in T1-2 Rectal Carcinoma: Results of a Study From the Surveillance, Epidemiology, and End Results (SEER) Registry Data. Gastrointest Cancer Res. 2009;3:105-114. [PubMed] |
| 10. | Kim E, Hwang JM, Garcia-Aguilar J. Local excision for rectal carcinoma. Clin Colorectal Cancer. 2008;7:376-385. [PubMed] [DOI] |
| 11. | Zaheer S, Pemberton JH, Farouk R, Dozois RR, Wolff BG, Ilstrup D. Surgical treatment of adenocarcinoma of the rectum. Ann Surg. 1998;227:800-811. [PubMed] [DOI] |
| 12. | Peng J, Chen W, Venook AP, Sheng W, Xu Y, Guan Z, Cai G, Cai S. Long-term outcome of early-stage rectal cancer undergoing standard resection and local excision. Clin Colorectal Cancer. 2011;10:37-41. [PubMed] [DOI] |
| 13. | Kajiwara Y, Ueno H, Hashiguchi Y, Mochizuki H, Hase K. Risk factors of nodal involvement in T2 colorectal cancer. Dis Colon Rectum. 2010;53:1393-1399. [PubMed] [DOI] |
| 15. | Lezoche G, Baldarelli M, Guerrieri M, Paganini AM, De Sanctis A, Bartolacci S, Lezoche E. A prospective randomized study with a 5-year minimum follow-up evaluation of transanal endoscopic microsurgery versus laparoscopic total mesorectal excision after neoadjuvant therapy. Surg Endosc. 2008;22:352-358. [PubMed] [DOI] |
| 18. | Lemmens VE, Dassen AE, van der Wurff AA, Coebergh JW, Bosscha K. Lymph node examination among patients with gastric cancer: variation between departments of pathology and prognostic impact of lymph node ratio. Eur J Surg Oncol. 2011;37:488-496. [PubMed] [DOI] |
| 19. | Moore JS, Cataldo PA, Osler T, Hyman NH. Transanal endoscopic microsurgery is more effective than traditional transanal excision for resection of rectal masses. Dis Colon Rectum. 2008;51:1026-130; discussion 1026-1030. [PubMed] [DOI] |
| 20. | Bhangu A, Brown G, Nicholls RJ, Wong J, Darzi A, Tekkis P. Survival outcome of local excision versus radical resection of colon or rectal carcinoma: a Surveillance, Epidemiology, and End Results (SEER) population-based study. Ann Surg. 2013;258:563-569; discussion 563-569. [PubMed] |
| 21. | 桑 温昌, 李 兆德, 王 琰珉, 尚 文周, 朱 绍亮. 无浆膜浸润结肠癌患者淋巴结转移规律及其临床意义. 中华普外科手术学杂志(电子版). 2014;8:231-234. |