修回日期: 2016-01-05
接受日期: 2016-01-11
在线出版日期: 2016-02-18
目的: 针对目前尚缺理想的肿瘤细胞提取方案, 探寻分离纯化肝癌细胞培养液中外泌体的新方法.
方法: 连续适应无血清培养肝癌SMMC-7721细胞, 收集细胞上清液, 采用改良超速离心法分离、纯化培养上清液中肝癌细胞外泌体; 透射电镜观察其形态, Nanosight技术分析粒径; Western blot分析其特异蛋白Alix、CD63、CD9的表达并利用SDS-PAGE电泳分析肝癌细胞和外泌体的蛋白谱.
结果: 透射电镜观察到的肝癌细胞外泌体, 外形呈圆形或椭圆形; Nanosight技术分析颗粒直径峰值为122 nm, 直径30-150 nm之间颗粒占72.16%; Western blot证实在细胞培养上清液和外泌体提取液中均能检测到Alix、CD63、CD9的蛋白表达; SDS-PAGE电泳清晰显示外泌体中高丰度大分子结构蛋白明显少于肝癌细胞.
结论: 利用连续适应无血清细胞培养结合改良超速离心法能提取高纯度的外泌体, 为肝癌细胞外泌体标志物研究奠定基础.
核心提示: 连续适应无血清细胞培养结合改良超速离心法是一种全新的外泌体提取方案. 本研究选取肝癌细胞, 通过多种技术, 多角度展示该方法的提取效果, 并利用SDS-PAGE电泳清晰显示蕴含的蛋白, 为肝癌细胞外泌体标志物的研究奠定基础.
引文著录: 陈加贵, 邓敬桓, 何敏. 肝癌细胞外泌体的分离与鉴定. 世界华人消化杂志 2016; 24(5): 737-743
Revised: January 5, 2016
Accepted: January 11, 2016
Published online: February 18, 2016
AIM: To seek a new method for isolating and purifying exosomes from the supernatants of cultured human hepatocellular carcinoma cells.
METHODS: Human hepatocellular carcinoma cells SMMC-7721 were cultured to adapt to continuous serum-free culture, and the culture supernatants were collected. Exosomes derived from SMMC-7721 were isolated and purified from the supernatants by improved ultracentrifugation. Transmission electron microscopy (TEM) was used to observe the morphology of isolated exosomes. Particle size of exosomes was detected with Nanosight technology. Western blot analysis was used to examine CD63, CD9, and Alix exosomal protein expression and SDS-PAGE was used for exosomal protein analysis.
RESULTS: The isolated exosomes were round or oval in shape under TEM. The peak diameter of exosomes was 122 nm, and particles with a diameter between 30-150 nm accounted for 72.16%. The expression of Alix, CD63 and CD9 could be detected in the supernatants of cultured cells and isolated exosomes. SDS-PAGE showed that the abundant macromolecular structure proteins were significantly less in exosomes than in SMMC-7721 cells.
CONCLUSION: Continuous adaptation to serum-free culture combined with improved ultracentrifugation can be used to isolate and purify exosomes efficiently. This is helpful for further study of exosome markers of hepatocellular carcinoma cells.
- Citation: Chen JG, Deng JH, He M. Isolation and identification of exosomes of hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2016; 24(5): 737-743
- URL: https://www.wjgnet.com/1009-3079/full/v24/i5/737.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i5.737
外泌体(exosomes)是由细胞内多泡体(multivesicular body, MVB)与细胞膜融合后释放到细胞外隙或生物学体液中的膜性囊泡, 包含有蛋白质、RNA、microRNA和DNA片段等多种成分, 参与人体许多重要的生理或病理过程, 在细胞通讯、细胞迁移、血管新生、免疫反应和肿瘤细胞生长等方面起了重要的作用, 影响疾病的发生发展[1]. 因此, 外泌体的生物学研究受到普遍关注, 而寻找到与其相适应的提取方法是展开相关研究的前提. 目前离心法是最常用和有效的提取方法, 但由于外泌体是纳米级的囊泡结构, 其提取的纯度和生物活性易受到离心力、离心时间等外因的影响[2], 故如何保证提取外泌体的纯度和生物活性, 是摆在诸多研究者面前亟待解决的问题, 本研究利用肝癌SMMC-7721细胞探讨适合肝癌细胞外泌体提取的新方案.
肝癌细胞SMMC-7721(广州吉妮欧生物科技有限公司). RPMI-1640基础培养基、胎牛血清(FBS)(美国Gibco); 磷酸盐缓冲液(PBS)(武汉博士德生物工程公司); UltraCUL TURE无血清培养基(瑞士LONZA); BCA蛋白浓度测定试剂盒、RIPA裂解液(碧云天生物技术研究所); 超滤管及0.22 μm滤器(美国Millipore); 兔抗人Alix、CD9、CD63单克隆抗体, 荧光标记羊抗兔二抗IgG(H+L)(美国SBI公司); 371细胞培养箱、酶标检测仪(美国Thermo公司); Beckman XL-100K超高速离心机(美国Beckman Coulter), ODYSSEY双色红外成像系统(美国LICOR公司), Nanosight NS300纳米颗粒跟踪分析仪(英国马尔文仪器有限公司), 透射电子显微镜(日本日立集团), 全自动凝胶成像仪(美国Bio-Rad公司), 尼康Ti-s倒置荧光显微镜(日本尼康集团).
1.2.1 连续适应无血清培养肝癌SMMC-7721细胞: 将肝癌细胞用含10%FBS的RPMI-1640完全培养基, 置于37 ℃、50 mL/L CO2中培养, 48 h换液1次, 待细胞融合度达到80%时, 去培养液, 用20 mL 0.01 mol/L PBS冲洗3次, 加入0.5 mL 0.25%胰蛋白酶, 置于37 ℃培养箱消化2 min. 当镜下发现细胞质回缩、细胞间隙增大后, 加2-3 mL完全培养液终止消化, 1000 r/min、离心5 min, 去上清. 配制7.5%FBS的混合培养液(10%FBS的RPMI-1640完全培养基:无血清培养基 = 3:1), 取0.5-1.0 mL重悬细胞后, 接种于无菌培养瓶内, 加4 mL 7.5%FBS混合培养基继续培养. 待细胞生长状态良好后, 传代2-3次. 同上操作, 依次转5.0%、2.5%、1.0%FBS混合培养基培养. 最后用20 mL 0.01 mol/L PBS冲洗至少3次, 转完全无FBS培养基培养48 h, 收集细胞培养上清液, -80 ℃保存备用.
1.2.2 改良超速离心法分离纯化外泌体: 将收集的肝癌细胞培养上清200 mL分装于4个50 mL离心管, 4 ℃ 3000 g离心15 min去除细胞和细胞碎片; 第1次110000 g离心70 min, 去上清留5 mL管底液, 重悬并轻轻吹打管底液体; 第2次110000 g离心70 min, 离心后可见管底淡黄色沉淀, 去上清剩1 mL管底液, 用PBS重悬并补足至离心管规定体积; 第3次110000 g离心70 min, 小心去上清, 将收集到的外泌体转移到1.5 mL的Eppendorf管中, -80 ℃冰箱中保存备用.
1.2.3 外泌体的形态学分析: 用PBS重悬提取的外泌体, 取悬液20 μL滴于孔径2 nm的载样铜网上, 室温静置2 min, 用滤纸从滤网侧边吸干液体, 用3%磷钨酸溶液30 μL在室温下负染5 min, 滤纸吸干负染液, 室温晾干, 透射电镜观察拍照.
1.2.4 Nanosight检测外泌体粒径: 将收集的外泌体用PBS稀释至颗粒浓度为106/mL, 用1 mL注射器注入纳米颗粒跟踪分析仪进行分析, 并保存分析数据.
1.2.5 Western blot检测外泌体特异标志蛋白: 收集肝癌细胞、外泌体提取液、提取前和后细胞培养上清, 加入RIPA裂解液裂解, 采用BCA法测定蛋白浓度. 分别取30 μg蛋白行SDS-PAGE电泳. 蛋白分离后将其转移至硝酸纤维素膜上, 室温下用含5%脱脂牛奶封闭液封闭处理1 h. 经1×TBST缓冲液洗脱后, 分别加入一抗(Alix、CD63和CD9单克隆抗体), 于4 ℃条件下反应过夜. 经再次洗脱后, 室温下避光加入荧光标记的二抗反应1 h. 再用1×TBST缓冲液洗膜, 在ODYSSEY双色红外成像系统中扫描显像.
1.2.6 SDS-PAGE电泳凝胶成像分析蛋白: 根据BCA蛋白定量结果, 取裂解后外泌体及细胞裂解蛋白各30 μg, 加入5 μL 5×上样缓冲液, 95 ℃加热5 min, 上样. SDS-PAGE凝胶电泳, 5%浓缩胶恒压80 V 30 min, 10%分离胶恒压100 V, 60 min. 电泳结束后, 0.25%考马斯亮蓝染液染色1 h, 脱色液脱色2 h, 使用全自动凝胶成像仪进行拍照.
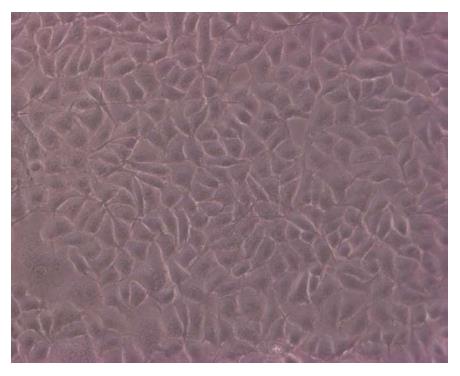
经连续适应无血清细胞培养法培养肝癌SMMC-7721细胞48 h, 倒置荧光显微镜观察肝癌细胞生长状况良好(图1). 镜下可见细胞贴壁生长, 外形呈花瓣状, 胞膜完整, 排列规则, 分布密集.
透射电镜观察, 结果显示肝癌SMMC-7721细胞外泌体大小不一, 外形呈圆形或椭圆形, 直径100 nm左右, 可见明显的膜性结构, 有单个分布, 也聚集成群, 背景较为清晰, 污染物少(图2).
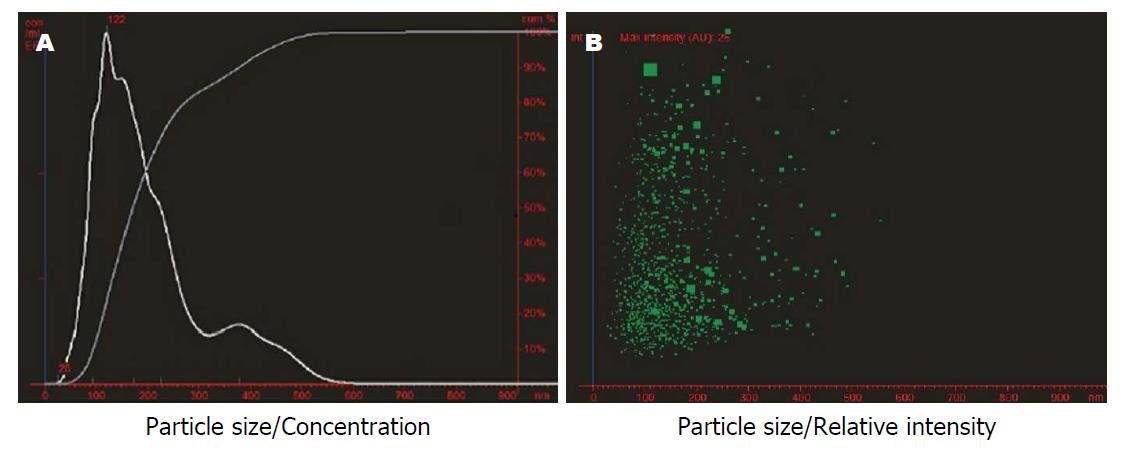
所提外泌体沉淀经PBS稀释10000倍方达到上机检测浓度(106/mL), 说明提取的颗粒数多. 检测报告中MODE曲线线性流畅, 表明所含杂质少, 粒径峰值122 nm与理论外泌体大小值相符(图3A); 颗粒散点图提示外泌体直径大小较为集中, 大部分介于30-150 nm间(图3B); 颗粒直径区间累计百分比数据显示: 0-30 nm、30-150 nm和>150 nm的颗粒数占总粒数的百分比分别为: 1.10%、72.16%和26.74%(表1). 再次证实大部分提取物的粒径分布在30-150 nm, 偏离范围的小部分可能与颗粒间黏着有关.
| 粒径(nm) | 浓度(106/mL) | 该粒径颗粒数累计百分比(%) |
| 10 | 0.000 | 0.000 |
| 30 | 6.179 | 1.101 |
| 50 | 17.111 | 4.150 |
| 70 | 31.612 | 9.783 |
| 90 | 72.361 | 22.677 |
| 110 | 91.801 | 39.035 |
| 130 | 99.994 | 56.853 |
| 150 | 92.070 | 73.259 |
| 170 | 51.725 | 82.476 |
| 190 | 34.581 | 88.638 |
| 210 | 18.654 | 91.962 |
| 230 | 9.630 | 94.145 |
| 250 | 8.485 | 95.657 |
| 270 | 6.314 | 96.778 |
| 290 | 5.359 | 97.733 |
| 310 | 2.385 | 98.158 |
| 330 | 1.543 | 98.233 |
| 350 | 1.263 | 98.458 |
| 370 | 1.431 | 98.713 |
| 390 | 1.207 | 98.928 |
| 410 | 1.094 | 99.123 |
| 430 | 0.813 | 99.268 |
| 450 | 0.707 | 99.394 |
| 470 | 0.645 | 99.509 |
| 490 | 0.617 | 99.619 |
| 510 | 0.572 | 99.721 |
| 530 | 0.533 | 99.816 |
| 550 | 0.471 | 99.900 |
| 570 | 0.370 | 99.966 |
| 590 | 0.179 | 99.998 |
| 610 | 0.011 | 100.000 |
| 630 | 0.000 | 100.000 |
| 650 | 0.000 | 100.000 |
| 670 | 0.000 | 100.000 |
| 690 | 0.000 | 100.000 |
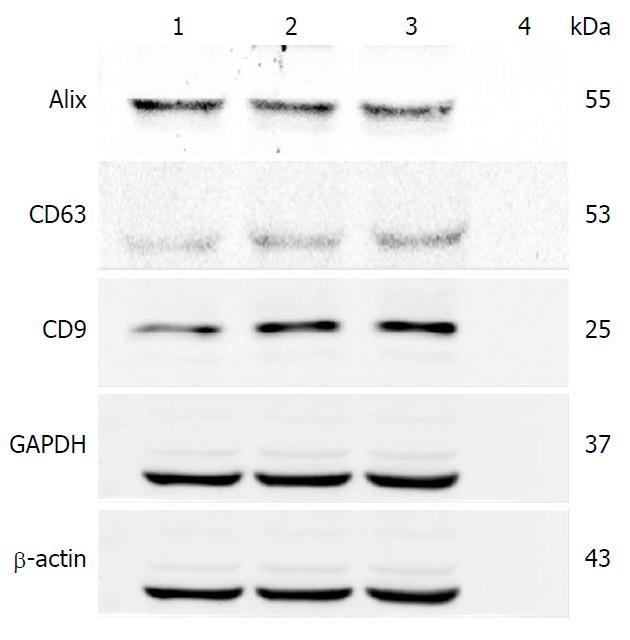
以肝癌细胞为参照, Western blot检测外泌体特异性标志蛋白, 结果显示提取前的培养上清液及外泌体提取液均表达Alix、CD63、CD9蛋白, 而提取后的培养液上清未显示3种外泌体特异性标志蛋白(图4). 提示改良超速离心法分离到较为完全肝癌细胞外泌体.
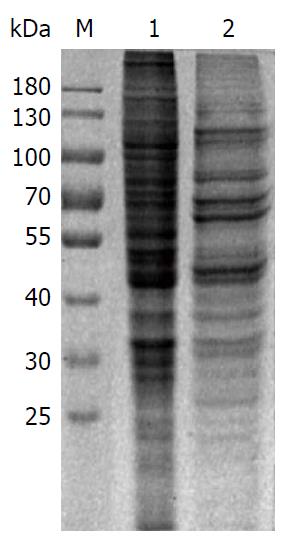
SDS-PAGE电泳分析肝癌细胞及其外泌体蛋白谱(图5), 电泳显示两者蛋白条带清晰, 提示蛋白上样量合适, 所提外泌体未受细胞培养液中的杂蛋白干扰, 纯化效果佳. 从显示的蛋白谱看, 外泌体蛋白谱中高丰度大分子结构蛋白明显少于肝癌细胞, 提示外泌体可能有利于小分子标志物研究.
外泌体是由细胞内多泡体与胞浆膜融合后, 释放到胞外的一种脂质双分子层结构的囊泡, 直径介于30-150 nm, 存在于人体大多数体液中如血液、尿液、唾液等[3]. 最初其被认为是细胞向外排放的"垃圾"[4], 此后发现该囊泡可携带多种蛋白质、RNA、microRNA和DNA片段, 具有功能活性[5-7]. 有研究报道其内含RNA可进入细胞质后被翻译成蛋白质, microRNA则可定向调节mRNA的功能. 由此可见, 外泌体通过释放内容物影响受体细胞和远端细胞的生长状况, 介导疾病的发生和发展.
尽管外泌体的研究取得了很大的进展, 但就总体而言还处于研究的初始阶段, 其中一个需要迫切解决的便是寻找到一种能在含量、纯度及生物活性方面均较为理想的细胞外泌体提取方法. 目前认为细胞外泌体的提取效果常受细胞的培养和提取方法两方面因素的影响. 首先关于细胞培养, 由于细胞生长的状况会直接影响外泌体分泌的质量, 所以培养好细胞是提取的前提条件, 而一些细胞如肿瘤细胞具有较强的嗜血性, 需要加入一定量的血清(如小牛血清)才能存活生长, 但血清中会含有一定量的外泌体, 研究者常常会采取两种方式去除干扰. 一种是经血清常规培养后, 用PBS清洗3次直接转无血清培养(普通饥饿法), 另外一种是通过离心去除血清中外泌体. 这两种方法均不尽人意. 前者培养的细胞生长状况很差, 后者会出现血清外泌体去除不完全的现象, 如离心力和离心时间把握不好, 势必影响到培养的效果. 其次关于外泌体提取的方法, 目前主要有离心法、过滤离心法、密度梯度离心法、免疫磁珠法、色谱法和新兴试剂法等. 但这些方法各有利弊, 均不能同时满足在含量、纯度和生物活性上的研究需求[8,9].
基于此现状, 本研究选取具有较强嗜血性的肝癌SMMC-7721细胞, 采用连续适应无血清细胞培养法进行培养, 使细胞在血清梯度递减的过程中逐渐降低对血清的依赖, 最后适应无血清培养. 用倒置荧光显微镜观察到该细胞在无血清中培养48 h, 生长状况仍良好(普通饥饿法一般不会超过48 h). 这说明新的培养方法能有效延长细胞在无血清培养基中的存活时间. 收集到的细胞培养上清, 用改良超速离心法提取外泌体, 该离心法只需设置两次离心力, 其中第2个离心力需要进行3次(也可酌情增加离心次数), 分别起浓缩、分离、纯化作用. 较传统多步离心法, 操作更简便. 透射电镜观察提取物, 发现背景杂质少, 颗粒外观符合外泌体典型特征. 用目前较为先进的纳米技术对所提颗粒进行分析, 结果显示: 颗粒数量多、纯度高, 粒径集中, 且大部分颗粒直径介于30-150 nm, 与外泌体直径理论值相符, 少部分颗粒超出该范围, 可能是由于彼此黏着造成粒径增大. 根据已有报道[10], 跨膜蛋白CD63、CD9在所有的外泌体中均呈现阳性, Alix在上皮源性细胞外泌体中高表达, 因此这3个蛋白可作为肝癌细胞外泌体存在的标志物. 本研究利用Western blot验证外泌体这3个标志蛋白, 结果显示提取前肝癌细胞培养液上清和提取液均表达这3种标志蛋白, 而提取后的培养液上清液呈阴性. 这说明所获得的提取物为肝癌SMMC-7721细胞释放的外泌体, 且提取较为完全.
通过SDS-PAGE电泳分析蛋白谱, 发现肝癌SMMC-7721细胞外泌体内富含不同分子量的蛋白, 大分子结构蛋白明显少于肝癌细胞裂解液, 凝胶图上清晰显示出分子量介于25-180 kDa之间的蛋白条带, 因此, 外泌体蛋白可能更有利于小分子量标志物的研究. 由于外泌体体积较小, 相对于细胞而言, 更易于流动, 所携带的蛋白分子不但参与泡体的形成, 而且介导诸多重要的生物学功能[11-15]. Park等[16]实验证实肿瘤细胞在缺氧微环境中可以分泌外泌体, 其携带的跨膜蛋白和Alix蛋白有促血管形成作用, 为肿瘤转移提供条件. 因此, 通过对肝癌细胞外泌体内含蛋白的研究, 有利于揭示肝癌发生发展的机制.
总之, 连续适应无血清细胞培养结合改良超速离心法是一种简单、有效的肝癌细胞外泌体提取方案. 外泌体作为一种新型的分子实体, 蕴含丰富的生物信息, 对于肝癌的诊断、治疗和预后判断具有重要的研究价值和广阔的应用前景.
外泌体的分离和纯化是开展外泌体功能研究的前提条件, 但目前尚未有一种方法能同时保证提取外泌体的含量、纯度、生物活性. 特别是肿瘤细胞, 由于其培养方式的特殊性, 增加了外泌体分离和纯化的难度, 阻碍了相关研究的发展.
刘树业, 主任技师, 天津市第三中心医院医学检验中心
外泌体能携带多种蛋白质、RNA、microRNA和DNA片段, 参与疾病的发生发展, 引起诸多研究者的兴趣. 如何提取到量多、纯度高且具有活性的外泌体是亟待研究解决的问题.
以往研究认为外泌体只是细胞排泄的"废物", 但随着研究的不断深入, 实验者发现外泌体能携带许多重要的蛋白质、RNA、microRNA和DNA片段, 且具有一定的生物活性, Mario等利用体外实验揭示了外泌体中的RNA、microRNA介导细胞间的通讯过程, 进一步证实外泌体在机体的生理病理活动中发挥着重要的作用.
外泌体的分离和纯化一直是该研究领域中的热点和难点, 特别是肿瘤细胞外泌体的提取, 但目前相关文献报道多集中在分离技术上的讨论, 未兼顾前期细胞培养过程的研究. 本研究将细胞培养与分离技术同时优化, 并运用多种技术包括最先进纳米检测技术, 对优化后的提取效果进行更科学的检验和评价.
虽然传统离心法步骤繁琐, 但仍然是外泌体提取最常用的方法, 也是学术界所公认纯化外泌体的最佳手段. 本研究通过优化传统离心法, 获得良好的提取效果, 有利于该方法更好地被推广和使用.
Nanosight检测技术: 纳米颗粒分析技术是一种高分辨率, 实时动态跟踪纳米颗粒检测技术, 他不但能测得颗粒的真实浓度, 还可以精准分析出微观样品体系中纳米级颗粒物的真实情况, 如颗粒粒型, 数量变化, 种类, 分散性好坏等, 是目前较为先进的纳米级颗粒检测技术; 外泌体: 是由细胞内的多泡小体与细胞膜融合后以外分泌的形式释放到细胞外的一种囊泡, 直径介于30-150 nm, 他与微泡组成细胞外囊泡.
本文研究思路清晰, 研究方法在前人研究的基础上有一定的创新性.
编辑: 郭鹏 电编:都珍珍
| 2. | Zhu L, Qu XH, Sun YL, Qian YM, Zhao XH. Novel method for extracting exosomes of hepatocellular carcinoma cells. World J Gastroenterol. 2014;20:6651-6657. [PubMed] [DOI] |
| 5. | 刘 长红, 武 明花, 李 桂源. 肿瘤细胞来源的外泌体与恶性肿瘤的进展及化疗. 中国生物化学与分子生物学报. 2014;30:526-532. |
| 6. | Lim JW, Mathias RA, Kapp EA, Layton MJ, Faux MC, Burgess AW, Ji H, Simpson RJ. Restoration of full-length APC protein in SW480 colon cancer cells induces exosome-mediated secretion of DKK-4. Electrophoresis. 2012;33:1873-1880. [PubMed] [DOI] |
| 7. | Shin SJ, Smith JA, Rezniczek GA, Pan S, Chen R, Brentnall TA, Wiche G, Kelly KA. Unexpected gain of function for the scaffolding protein plectin due to mislocalization in pancreatic cancer. Proc Natl Acad Sci U S A. 2013;110:19414-19419. [PubMed] [DOI] |
| 10. | Théry C, Amigorena S, Raposo G, Clayton A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. 2006;Chapter 3:Unit 3.22. [PubMed] [DOI] |
| 11. | Hoshino A, Costa-Silva B, Shen TL, Rodrigues G, Hashimoto A, Tesic Mark M, Molina H, Kohsaka S, Di Giannatale A, Ceder S. Tumour exosome integrins determine organotropic metastasis. Nature. 2015;527:329-335. [PubMed] [DOI] |
| 12. | Fontana S, Saieva L, Taverna S, Alessandro R. Contribution of proteomics to understanding the role of tumor-derived exosomes in cancer progression: state of the art and new perspectives. Proteomics. 2013;13:1581-1594. [PubMed] [DOI] |
| 13. | Umezu T, Ohyashiki K, Kuroda M, Ohyashiki JH. Leukemia cell to endothelial cell communication via exosomal miRNAs. Oncogene. 2013;32:2747-2755. [PubMed] [DOI] |
| 14. | Casazza A, Di Conza G, Wenes M, Finisguerra V, Deschoemaeker S, Mazzone M. Tumor stroma: a complexity dictated by the hypoxic tumor microenvironment. Oncogene. 2014;33:1743-1754. [PubMed] [DOI] |
| 15. | 吴 永兵, 徐 建军. 四跨膜蛋白超家族与肿瘤侵袭和转移. 南昌大学学报(医学版). 2013;53:89-93. |
| 16. | Park JE, Tan HS, Datta A, Lai RC, Zhang H, Meng W, Lim SK, Sze SK. Hypoxic tumor cell modulates its microenvironment to enhance angiogenic and metastatic potential by secretion of proteins and exosomes. Mol Cell Proteomics. 2010;9:1085-1099. [PubMed] [DOI] |