修回日期: 2015-12-29
接受日期: 2016-01-06
在线出版日期: 2016-02-18
目的: 研究人参皂苷Rg3联合索拉非尼对裸鼠肝癌移植瘤生长及血管生成的影响及其机制.
方法: 构建裸鼠人肝癌移植瘤模型LCI-D20, 将造模的26只裸鼠随机分成人参皂苷组(R组): 人参皂苷Rg3 5 mg/kg, 腹腔注射, 1次/d; 索拉非尼组(S组): 索拉非尼30 mg/kg, 灌胃, 1次/d; 联合组: 人参皂苷Rg3 5 mg/kg+索拉非尼30 mg/kg; 对照组: 生理盐水腹腔注射, 1次/d. 治疗2 wk剥离瘤体称质量, 计算抑瘤率; 免疫组织化学法检测移植瘤组织微血管密度(microvascular density, MVD); ELISA法、Western blot法检测血管内皮生长因子(vascular endothelial growth factor, VEGF)、低氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)和VEGFR-2的表达.
结果: 人参皂苷Rg3组的抑瘤率为20.6%, 索拉非尼组的抑瘤率为34.74%, 联合组的抑瘤率为48.64%, 根据Weeb系数计算方法, 人参皂苷Rg3与索拉非尼联合用药后肿瘤的生长率为51.36%, 低于预期值51.81%, 两者表现为协同作用. 免疫组织化学法测定显示, 3组的MVD均较对照组明显降低(P<0.01), 但3组间差异不明显(P>0.05). ELLISA法结果显示: R组、S组及联合组血清VEGF水平均低于对照组(P<0.01、P<0.05及P<0.01), 联合组较S组水平更低(P<0.05); R组及联合组血清HIF-1α水平明显低于对照组(P<0.01), S组仅有降低的趋势(P>0.05); 联合组与S组间有明显差异(P<0.05); 3组血清VEGFR-2水平与对照组比较差异不明显(P>0.05). Western blot法结果显示: 3组VEGF、HIF-1α和VEGFR-2蛋白的表达均低于生理盐水组(P<0.05), 但联合组与R、S组之间均无明显差异(P>0.05).
结论: 人参皂苷Rg3联合索拉非尼对裸鼠肝移植瘤生长有明显的抑制作用, 两者联合具有协同增效作用; 其机制可能与调控血管生成相关因子HIF-1α、VEGF、VEGFR-2的表达密切相关.
核心提示: 本文以裸鼠肝癌移植瘤模型为观察对象, 发现人参皂苷Rg3与索拉非尼有协同抗肝癌生长和血管生成的作用, 其机制可能与下调血管生成相关因子血管内皮生长因子(vascular endothelial growth factor, VEGF)、低氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)和VEGFR-2的表达有关, 其中对HIF-1α表达的下调可能是两药发挥协同作用的主要机制.
引文著录: 郑侠, 高舒, 华海清, 杨爱珍, 秦叔逵. 人参皂苷Rg3联合索拉非尼对裸鼠肝癌移植瘤生长和血管生成的调控作用. 世界华人消化杂志 2016; 24(5): 670-677
Revised: December 29, 2015
Accepted: January 6, 2016
Published online: February 18, 2016
AIM: To observe the effect of ginsenoside Rg3 combined with sorafenib in inhibiting tumor growth and neovascularization in nude mice with in situ transplanted human hepatocellular carcinoma xenografts and to explore the possible mechanism.
METHODS: Twenty-six nude mice with highly metastatic human hepatocellular carcinoma transplanted in situ (LCI-D20) were randomly divided into an R group treated with ginsenoside Rg3 (5 mg/kg, qd), an S group treated with sorafenib (30 mg/kg, qd), a combination group treated with both ginsenoside Rg3 (5 mg/kg, qd) and sorafenib (30 mg/kg, qd), and a control group treated with saline. After 2 wk of treatment, all mice were killed to collect orbital blood samples. The tumors were peeled off and weighed to calculate the tumor inhibition rate. Immunohistochemical method was used to detect the micro-vessel density (MVD) in the tumors. The expression of vascular endothelial growth factor (VEGF), hypoxia inducible factor-1α (HIF-1α), and VEGF receptor 2 (VEGFR-2) in tumors was detected by ELISA and Western blot.
RESULTS: The tumor inhibition rates of the R group, S group and combination group were 20.60%, 34.74% and 48.64%, respectively. According to the Weeb coefficient algorithm, the combination group showed a synergistic effect in inhibiting the tumor growth in nude mice. The MVD of each treatment group was significantly lower than that of the control group (P < 0.01), although there were no significant differences between the combination group and the R or S group (P > 0.05). ELISA results showed that serum VEGF levels were significantly lower in the R, S and combination groups than in the control group (P < 0.01, P < 0.05 and P < 0.01), and in the combination group than in the S group (P < 0.05), but there was no significant difference between the combination group and R group (P > 0.05). Compared with the control group, the level of HIF-1α was significantly lower in all treatment groups (P < 0.05) except the S group (P > 0.05), and the decrease was more significant in the combination group than in the S group (P < 0.05). The level of VEGFR-2 had no significant difference in the four groups (P > 0.05). Western blot showed decreased expression of VEGF, HIF-1α and VEGFR-2 in the three treatment groups (P < 0.05), although there were no significant differences between the combination group and R or S group (P > 0.05).
CONCLUSION: Ginsenoside Rg3 combined with sorafenib shows a synergistic effect in inhibiting tumor growth in nude mice, via mechanisms possibly associated with regulating the expression of angiogenesis factors VEGF, HIF-1α, and VEGFR-2.
- Citation: Zheng X, Gao S, Hua HQ, Yang AZ, Qin SK. Effect of ginsenoside Rg3 combined with sorafenib in inhibiting tumor growth and neovascularization in nude mice with in situ transplanted human hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2016; 24(5): 670-677
- URL: https://www.wjgnet.com/1009-3079/full/v24/i5/670.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i5.670
原发性肝癌(primary liver cancer, PLC)是临床上常见的恶性肿瘤, 恶性程度高, 全球死亡率居第2位, 其发病率呈逐年上升趋势[1], 其中90%病理类型为肝细胞癌(hepatocellular carcinoma, HCC). 研究[2]表明, 过度新生血管形成是HCC的主要特点, 因此通过抗血管生成治疗有可能控制肝癌的生长. 索拉非尼是一种具有抗血管生成作用的靶向药物, 目前已被多个国家批准用于HCC的治疗, 但疗效不高, 多数肝癌患者仅服用索拉非尼并不能控制疾病进展, 因此在开发新药的同时, 研究索拉非尼联合其他药物治疗肝癌是一条新的途径. 人参皂苷Rg3是中药人参的提取物, 是现代抗肿瘤中药参一胶囊的有效成分. 我们采用裸鼠肝癌高转移模型LCI-D20为研究对象, 观察了人参皂苷Rg3联合索拉非尼抗肝癌生长及血管生成的作用, 现将结果报告如下.
♂荷瘤裸鼠由复旦大学肝癌研究所提供. 实验动物质量合格证编号: SCXK(沪)2012-0002. 人参皂苷Rg3注射液干粉: 吉林亚泰制药股份有限公司产品; 索拉非尼(多吉美): 德国拜耳医药保健股份公司产品; 血管内皮生长因子(vascular endothelial growth factor, VEGF)、低氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)、血管内皮生长因子受体-2(vascular endothelial growth factor receptor 2, VEGFR-2)ELISA检测试剂盒: 上海恒远生物科技有限公司产品; VEGF、HIF-1α、VEGFR-2和β-actin一抗购自美国Santa Cruz公司. 全蛋白抽提试剂盒、线粒体蛋白提取试剂盒、Braford蛋白含量检测试剂盒、预染蛋白分子量、丽春红染色液购自江苏碧云天公司; 5×SDS-PAGE蛋白上样缓冲液、SDS-PAGE凝胶配制试剂盒、10×Tris-甘氨酸蛋白电泳缓冲液、ECL检测试剂盒购自南京凯基生物科技发展有限公司.
1.2.1 人肝癌高转移模型的建立: 选取复旦大学肝癌研究所构建的高转移人肝癌裸鼠模型瘤原, 浸入生理盐水, 剪成约2 mm×1 mm直径碎块. 以戊巴比妥钠45 mg/kg腹腔注射麻醉裸鼠, 手术野皮肤消毒, 左上腹横切口进腹, 暴露肝脏, 斜行切开肝表面, 植入瘤块, 缝合固定于肝左叶实质内, 全层关腹, SPF级饲养.
1.2.2 分组及给药: 26只荷瘤裸鼠随机分成3组, 分别为R组(6只), S组(6只), 联合组(8只)和生理盐水组(6只), 分笼饲养, 肿瘤接种第11天开始给药, 根据我们前期的研究, 药物用法如下: R组: 人参皂苷Rg3 5 mg/kg, 腹腔注射, 1次/d; S组: 索拉非尼30 mg/kg, 灌胃, 1次/d; 联合组: 人参皂苷Rg3 5 mg/kg腹腔注射, 同时予索拉非尼30 mg/kg灌胃, 1次/d, 对照组: 生理盐水腹腔注射, 1次/d. 各组连用14 d. 停药后, 裸鼠眼眶取血并处死裸鼠, 在无菌条件下完整剥取肝移植瘤备用.
1.2.3 瘤质量抑制率的计算: 取肝移植瘤, 称质量, 根据公式计算瘤质量抑制率, 瘤质量抑制率 = (1-R组平均瘤质量/生理盐水对照组平均瘤质量)×100%. 选用Weeb系数[3]来判定联合应用后的药物相互作用, 采用以下公式, 预估效应C = A×B, 其中A、B分别指两种药物作用后的肿瘤生长率. 当实际生长率<C时, 联合应用即表现为协同作用; 当C≤实际生长率<A和B时, 联合应用即表现出相加作用; 当实际生长率>A和B时, 联合应用表现为拮抗作用.
1.2.4 检测裸鼠血清中VEGF、HIF-1α和VEGFR-2的表达: 采用双抗体夹心ABC-ELISA法, 将特异性抗体包被与固相载体上, 形成固相抗体; 加入含待测抗原的样品使之与固相抗体结合; 再加入生物素化的二抗, 形成免疫复合物. 辣根过氧化物HIF-1α、VEGFR-2酶标记的strepavidin与生物素结合; 然后加入酶底物OPD, 出现黄色, 加入终止液硫酸, 颜色变深, 在450 nm处测A值, 反应颜色的深浅与标本中待测抗原的浓度成正比, 可通过绘制标准曲线求出标本中待测抗原的浓度.
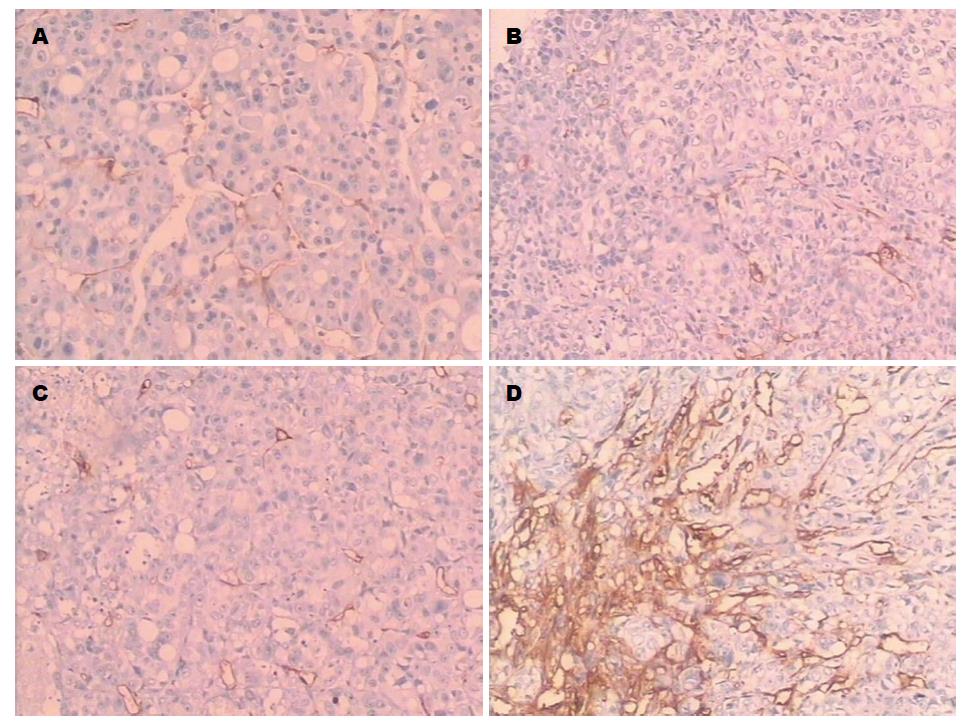
1.2.5 免疫组织化学法检测瘤组织中微血管密度: (1)按参考文献[4]步骤进行: 移植瘤组织标本经甲醛固定, 脱水, 石蜡包埋, 切片, 烤片, 修复, 滴加一抗、二抗, DAB溶液显色, 苏木素复染, 盐酸分化, 乙醇脱水、二甲苯透明、中性树胶封片. 以CD34标记血管内皮细胞, 呈棕色或棕黄色染色为阳性. 首先在低倍视野下(×40)扫视整张石蜡切片, 每张切片找出5个微血管密集区, 然后在高倍视野下(×200)记数. 每张切片共计数5个视野, 取其平均值定义为该例微血管密度(microvascular density, MVD)值.
1.2.6 Western blot法检测瘤组织中VEGF、HIF-1α和VEGFR-2蛋白表达: 参考文献[5]步骤进行: 提取制备蛋白样本, 制备SDS-PAG, 样本准备和上样电泳, 湿电转移, 封闭, 抗体与靶蛋白结合, 显影, 通过AlphaImage图像处理软件获取VEGF、HIF-1α和VEGFR-2的光密度值(A), 并与其相对应的β-actin的A值计算比值.
统计学处理 采用SPSS17.0统计学软件对相关数据进行分析, 所有数据均用mean±SD表示, 两样本均数比较采用成组t检验, 计数资料的比较用卡方检验. P<0.05为差异有统计学意义.
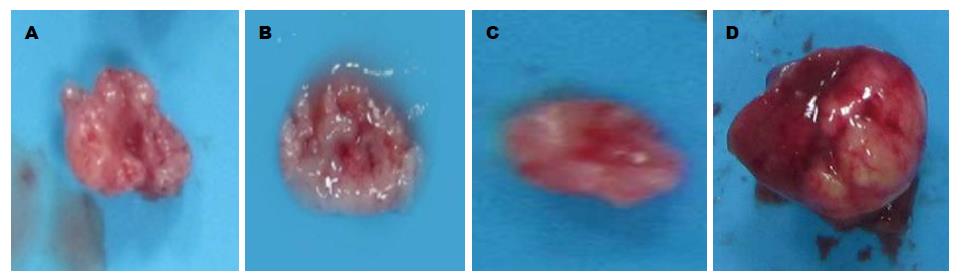
实验结果表明, 人参皂苷Rg3组的抑瘤率为20.60%, 索拉非尼组的抑瘤率为34.74%, 联合组的抑瘤率为48.64%, 根据Weeb系数计算方法, 人参皂苷Rg3与索拉非尼联合用药后肿瘤的生长率为51.36%, 低于预期值51.81%, 两者表现为协同作用(表1, 图1). 免疫组织化学法检测结果表明, R组、S组及联合组MVD均较对照组降低(P<0.01), 但3组之间无明显差异(P>0.05)(表1, 图2).
ELLSA法结果显示: R组、S组及联合组血清VEGF水平均低对照组(P<0.01, P<0.05及P<0.01), 联合组较S组水平更低(P<0.05); R组及联合组血清HIF-1α水平明显低于对照组(P<0.01), S组仅有降低的趋势(P>0.05); 联合组与S组间有差异(P<0.05); 3组血清VEGFR-2水平与对照组比较均无明显差异(P>0.05)(表2).
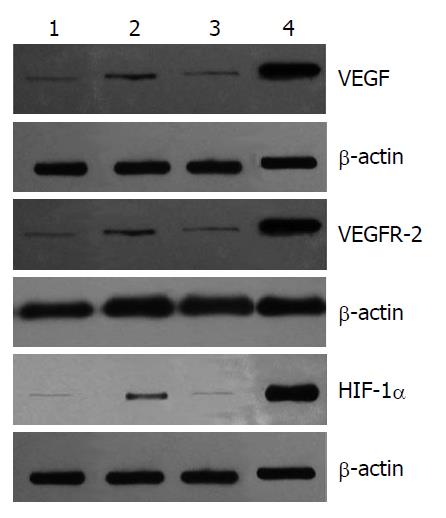
Western blot法结果显示: 3组VEGF、HIF-1α和VEGFR-2蛋白的表达均低于生理盐水组(P<0.05), 但联合组与R、S组之间差异不明显(P>0.05)(表3, 图3).
1971年, Folkman教授提出了肿瘤生长与血管生成相关性的理论, 揭示了肿瘤与血管生成之间的依赖关系, 揭开了肿瘤抗血管生成治疗的帷幕. HCC作为一种"富血管"肿瘤, 其生长、发展、转移、复发等生物学特性与新生血管之间关系更加密切, 正是由于HCC丰富的血供, 决定了该病的恶性程度高, 临床疗效差, 预后不佳[6]. 肝癌的血管生成是一个复杂的过程, 与许多血管生成因子相关, 其中包括: VEGF、血管生成因子(Ang-1和Ang-2)、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、环氧合酶-2(cyclooxygenase-2, COX-2)以及血小板源性内皮细胞生长因子(platelet derived growth factor, PDGF)等. 其中VEGF是公认血管生成过程最主要的刺激因子, VEGF的表达在肝癌的发生及发展过程中起重要作用, 临床研究[7]发现, 血清VEGF高水平HCC患者预后不佳. VEGF能促进增强人肝癌细胞的迁移、侵袭能力和血管拟态形成(VM)能力, 与肝癌的恶性程度密切相关[8]. VEGFR-2是主要分布在肿瘤组织中的巨噬细胞及血管内皮细胞膜上VEGF受体, 在众多VEGFR中, 该受体与血管形成的关系最为密切. VEGF与VEGFR-2结合后, 通过蛋白激酶C(protein kinase C, PKC)或ras信号传导通路, 激活促丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)系统, 引起血管内皮细胞增殖和迁移, 并使血管通透性增加, 从而促进肝癌生长和转移[9]. 导致VEGF高表达因素很多, 抑癌基因p53、炎性反应中COX-2等均能影响VEGF的表达, 其中, 肿瘤细胞缺氧是主要因素, 在实体瘤生长过程中, 缺氧是普遍特征, 缺氧刺激可增加HIF-1α分子的稳定性, HIF-1α与细胞核内的HIF-1β结合成二聚体HIF-1, HIF-1通过调节VEGF的转录活性和升高VEGF mRNA的稳定性直接上调VEGF的表达[10], 促进血管生成.
HCC的富血管特点决定了抗血管生成治疗有效, 目前唯一批准用于HCC的分子靶向药物索拉非尼是一种口服的多靶点、多激酶抑制剂, 既可以通过抑制Raf/MEK/ERK信号传导通路, 直接抑制肿瘤细胞的生长, 又可以抑制VEGFR和PDGFR发挥抗血管生成作用[11]. 该药的两项国际多中心临床研究[12,13]结果表明, 索拉非尼能延缓HCC的进展, 延长患者的生存期, 故索拉非尼已经获得包括我国在内的全球80多个国家和地区的药政管理部门批准, 用于治疗无法手术或远处转移的HCC. 上市后的GIDEON研究[14]再次充分证明了索拉非尼治疗HCC安全有效. 在本实验中, 索拉非尼对人肝癌移植瘤的生长有较好的抑制作用, 同时经过索拉非尼治疗的裸鼠MVD明显低于生理盐水组, VEGF、HIF-1α和VEGFR-2表达水平也明显降低, 证实了索拉非尼能抑制肝癌在裸鼠体内的生长, 同时能下调VEGF、HIF-1α和VEGFR-2的表达发挥抗血生成作用. 虽然索拉非尼对肝细胞癌显示出一定的疗效, 但临床显示其有效率低、不良反应多、且价格昂贵, 如何进一步提高索拉非尼的疗效成为目前研究的一个重要课题. 有研究表明, 索拉非尼联合肝动脉化疗栓塞术[15-19]、联合射频消融[20,21]治疗可以提高中晚期肝癌的疗效, 索拉非尼耐药的患者联合系统化疗可以获益[22,23], 已有研究证实索拉非尼联合中药可以产生协同作用, 提高疗效[24].
人参皂苷Rg3来源于名贵中药材人参, 是人参的的有效成分之一, 祖国医学认为人参具有大补元气、补脾益肺、生津、安神益智等作用, 用人参皂苷Rg3制成的中药制剂名参一胶囊, 被我国SFDA批准用于肺癌、肝癌等恶性肿瘤的辅助治疗. 研究发现人参皂苷Rg3能抑制肝癌细胞的增殖和诱导细胞凋亡[25], 抗肝癌细胞侵袭和转移[26]和抗血管生成[26]. 我们的前期研究[27-29]表明, 人参皂苷Rg3联合索拉非尼发挥协同抑制多种肝癌细胞株增殖作用. 但在动物实验尤其是应用裸鼠作为研究对象研究其协同效应的报道极少. 为此本研究以裸鼠人肝癌细胞移植瘤LD-20为观察对象, 探索两种药物联合应用对裸鼠肝癌移植瘤生长及抗血管生成的作用, 结果发现两药联合后加强了抑制肿瘤生长的作用, 人参皂苷Rg3单药的抑瘤率为20.6%, 索拉非尼组的抑瘤率为34.74%, 而两药联合后抑瘤率可以达到48.64%, 两药可发挥明显的协同增效作用, 研究还显示, 人参皂苷Rg3可增强索拉非尼抗裸鼠肝癌移植瘤血管生成作用, 联合后对血管生成因子VEGF、HIF-1α及VEGFR-2的表达抑制作用明显增强, 尤其是对HIF-1α的抑制作用更为明显. 有研究[30]发现, 索拉非尼的敏感性与缺氧有关, 人参皂苷Rg3联合索拉非尼是否是通过抑制HIF-1α的表达, 关闭HIF-1α与核内HIF-2α结合的途径. 阻滞缺氧引起的VEGF的转录, 从而扭转缺氧导致索拉非尼敏感性的降低, 最终提高抗肝癌的疗效, 还有待今后做深入的研究.
总之, 人参皂苷Rg3和索拉非尼均有一定的抗肝癌作用, 两者联合能发挥较好协同增效作用, 其机制可能与加强对血管生成因子VEGF、HIF-1α和VEGFR-2的表达抑制, 尤其是对HIF-1α的抑制作用有关. 两药如何在临床科学合理地联合应用则有待于今后做进一步的研究和探索.
索拉非尼是目前晚期肝细胞癌(hepatocellular carcinoma, HCC)全球范围内获批准的唯一药物, 但其有效率和疾病控制率低, 不良反应多, 远远不能满足HCC治疗的需要. 近年来, 多项晚期HCC药物临床试验均遭失败, 索拉非尼联合其他疗法仍是目前晚期HCC治疗的主要临床策略, 探索与索拉非尼具有协同作用的药物对提高肝癌临床疗效具有重要意义.
肖江卫, 主任医师, 川北医学院附属医院胃肠外科
肿瘤抗血管生成治疗是目前研究的热点, 血管内皮生长因子(vascular endothelial growth factor, VEGF)、低氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)和VEGFR-2是重要促血管生成因子, 与HCC的预后密切相关. HIF-1α是调控HCC血管生成的重要因子, 在缺氧条件下该因子过度表达, 通过与细胞核中的HIF-1β结合, 调控VEGF的高表达, 目前研究发现HIF-1α的高表达可降低索拉非尼的疗效, 甚至参与其耐药, 降低HIF-1α的表达可增加索拉非尼的疗效, 但目前尚无针对HIF-1α靶向治疗的药物.
三峡大学第一临床医学院宜昌市中心人民医院的尹天翔与王燕燕以人肝癌细胞株HepG2、QGY细胞以及人成纤维细胞系HEL细胞为研究对象, 发现人参皂苷Rg3可抑制HepG2、QGY细胞的增殖、黏附、侵袭转移, 并诱导细胞凋亡, 其机制与人参皂苷Rg3下调CD44和VEGF的表达相关.
本文首次以裸鼠肝癌移植瘤模型为观察对象来研究人参皂苷Rg3与索拉非尼抗HCC的协同作用, 首次发现了人参皂苷Rg3对肝癌HIF-1α表达具有明显的抑制作用, 与索拉非尼具有良好的协同效应, 进一步揭示了两药联用的作用机制.
人参皂苷Rg3是抗肿瘤药参一胶囊的有效成分, 该药已经批准用于多种恶性肿瘤的临床治疗, 其抗肿瘤作用温和, 与多种药物联用可发挥协同抗癌作用, 本研究发现该药有一定的抗肝癌细胞增殖的作用, 与索拉非尼联合有明显的协同作用; 临床初步研究亦发现, 两者联用可以提高临床疗效, 值得临床进一步研究.
本文对临床有一定的指导和参考意义.
编辑: 郭鹏 电编:都珍珍
| 1. | Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin. 2014;64:9-29. [PubMed] [DOI] |
| 2. | Zhu AX, Duda DG, Sahani DV, Jain RK. HCC and angiogenesis: possible targets and future directions. Nat Rev Clin Oncol. 2011;8:292-301. [PubMed] [DOI] |
| 3. | 司徒 镇强, 吴 军正. 细胞培养. 西安: 世界图书出版有限公司. 2007;200. |
| 4. | 薛 亚峰, 仇 松. 肝细胞肝癌组织中B细胞淋巴瘤因子9的表达及临床意义. 南通大学学报(医学版). 2015;35:45-47. |
| 7. | Guan Q, Gu J, Zhang H, Ren W, Ji W, Fan Y. Correlation between vascular endothelial growth factor levels and prognosis of hepatocellular carcinoma patients receiving radiofrequency ablation. Biotechnol Biotechnol Equip. 2015;29:119-123. [PubMed] |
| 8. | 李 蕊. VEGF对人肝癌细胞体外形成血管生成拟态能力的影响. 天津: 天津医科大学 2012; . |
| 9. | Shibuya M. Vascular Endothelial Growth Factor (VEGF) and Its Receptor (VEGFR) Signaling in Angiogenesis: A Crucial Target for Anti- and Pro-Angiogenic Therapies. Genes Cancer. 2011;2:1097-1105. [PubMed] [DOI] |
| 10. | Xiao H, Tong R, Ding C, Lv Z, Du C, Peng C, Cheng S, Xie H, Zhou L, Wu J. γ-H2AX promotes hepatocellular carcinoma angiogenesis via EGFR/HIF-1α/VEGF pathways under hypoxic condition. Oncotarget. 2015;6:2180-2192. [PubMed] |
| 12. | Llovet JM, Ricci S, Mazzaferro V, Hilgard P, Gane E, Blanc JF, de Oliveira AC, Santoro A, Raoul JL, Forner A. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359:378-390. [PubMed] [DOI] |
| 13. | Cheng AL, Kang YK, Chen Z, Tsao CJ, Qin S, Kim JS, Luo R, Feng J, Ye S, Yang TS. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol. 2009;10:25-34. [PubMed] [DOI] |
| 14. | Lencioni R, Kudo M, Ye SL, Bronowicki JP, Chen XP, Dagher L, Furuse J, Geschwind JF, Ladrón de Guevara L, Papandreou C. First interim analysis of the GIDEON (Global Investigation of therapeutic decisions in hepatocellular carcinoma and of its treatment with sorafeNib) non-interventional study. Int J Clin Pract. 2012;66:675-683. [PubMed] |
| 15. | Park JW, Koh YH, Kim HB, Kim HY, An S, Choi JI, Woo SM, Nam BH. Phase II study of concurrent transarterial chemoembolization and sorafenib in patients with unresectable hepatocellular carcinoma. J Hepatol. 2012;56:1336-1342. [PubMed] [DOI] |
| 16. | Bai W, Wang YJ, Zhao Y, Qi XS, Yin ZX, He CY, Li RJ, Wu KC, Xia JL, Fan DM. Sorafenib in combination with transarterial chemoembolization improves the survival of patients with unresectable hepatocellular carcinoma: a propensity score matching study. J Dig Dis. 2013;14:181-190. [PubMed] [DOI] |
| 17. | Zhao Y, Wang WJ, Guan S, Li HL, Xu RC, Wu JB, Liu JS, Li HP, Bai W, Yin ZX. Sorafenib combined with transarterial chemoembolization for the treatment of advanced hepatocellular carcinoma: a large-scale multicenter study of 222 patients. Ann Oncol. 2013;24:1786-1792. [PubMed] [DOI] |
| 18. | Zhou L, Li J, Ai DL, Fu JL, Peng XM, Zhang LZ, Wang JY, Zhao Y, Yang B, Yu Q. Enhanced therapeutic efficacy of combined use of sorafenib and transcatheter arterial chemoembolization for treatment of advanced hepatocellular carcinoma. Jpn J Clin Oncol. 2014;44:711-717. [PubMed] [DOI] |
| 19. | Han G, Yang J, Shao G, Teng G, Wang M, Yang J, Liu Z, Feng G, Yang R, Lu L. Sorafenib in combination with transarterial chemoembolization in Chinese patients with hepatocellular carcinoma: a subgroup interim analysis of the START trial. Future Oncol. 2013;9:403-410. [PubMed] [DOI] |
| 20. | Feng X, Xu R, Du X, Dou K, Qin X, Xu J, Jia W, Wang Z, Zhao H, Yang S. Combination therapy with sorafenib and radiofrequency ablation for BCLC Stage 0-B1 hepatocellular carcinoma: a multicenter retrospective cohort study. Am J Gastroenterol. 2014;109:1891-1899. [PubMed] [DOI] |
| 21. | Kan X, Jing Y, Wan QY, Pan JC, Han M, Yang Y, Zhu M, Wang Q, Liu KH. Sorafenib combined with percutaneous radiofrequency ablation for the treatment of medium-sized hepatocellular carcinoma. Eur Rev Med Pharmacol Sci. 2015;19:247-255. [PubMed] |
| 22. | Petrini I, Lencioni M, Ricasoli M, Iannopollo M, Orlandini C, Oliveri F, Bartolozzi C, Ricci S. Phase II trial of sorafenib in combination with 5-fluorouracil infusion in advanced hepatocellular carcinoma. Cancer Chemother Pharmacol. 2012;69:773-780. [PubMed] [DOI] |
| 23. | Shao YY, Lin ZZ, Chen TJ, Hsu C, Shen YC, Hsu CH, Cheng AL. High circulating endothelial progenitor levels associated with poor survival of advanced hepatocellular carcinoma patients receiving sorafenib combined with metronomic chemotherapy. Oncology. 2011;81:98-103. [PubMed] [DOI] |
| 25. | Jiang JW, Chen XM, Chen XH, Zheng SS. Ginsenoside Rg3 inhibit hepatocellular carcinoma growth via intrinsic apoptotic pathway. World J Gastroenterol. 2011;17:3605-3613. [PubMed] [DOI] |
| 27. | 李 玲玲. 人参皂苷Rg3、索拉非尼、奥沙利铂不同联合方式对肝癌细胞周期调控影响的实验研究. 南京: 南京中医药大学 2014; . |
| 28. | 单 魁中. 人参皂苷Rg3、索拉非尼、奥沙利铂不同联合方案对抑制人类肝癌细胞株生长的研究. 南京: 南京中医药大学 2012; . |
| 29. | 倪 晶. 人参皂苷Rg3、索拉非尼、奥沙利铂、氟尿嘧啶不同联合方式对肝癌TGF-β/Smad通路影响的实验研究. 南京: 南京中医药大学 2015; . |
| 30. | Liu F, Dong X, Lv H, Xiu P, Li T, Wang F, Xu Z, Li J. Targeting hypoxia-inducible factor-2α enhances sorafenib antitumor activity via β-catenin/C-Myc-dependent pathways in hepatocellular carcinoma. Oncol Lett. 2015;10:778-784. [PubMed] |