修回日期: 2016-09-14
接受日期: 2016-10-20
在线出版日期: 2016-12-08
探讨应用改良的组织块酶消化法体外培养人大肠癌原代细胞的方法.
应用结合组织块法和Ⅳ胶原酶消化法的改良的组织块酶消化法体外原代培养人大肠癌细胞, 通过对培养条件、促进贴壁、控制污染、细胞纯化等方面的探索得到了大肠癌细胞, 并最终用形态学方法(瑞姬氏染色)、和免疫学方法(免疫细胞化学)鉴定所得细胞.
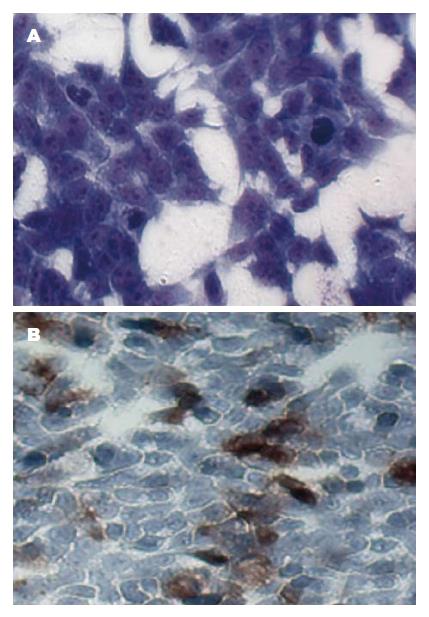
经改良的组织块酶消化法体外培养的人大肠癌原代细胞, 瑞姬氏染色进行细胞形态学鉴定, 结果显示胞核呈紫红色, 核质比明显增大, 符合肿瘤细胞特征; 细胞胃肠癌相关糖链抗原19-9(carbohydrate antigen 19-9, CA19-9)进行细胞免疫学鉴定, 结果显示胞浆呈棕色, 细胞CA19-9阳性.
改良的组织块酶消化法在培养方法改良、促进贴壁、控制污染和去除杂细胞四方面进行了改进, 既可快速获得游离细胞, 又充分利用了未彻底消化的组织块. 采用该改良的组织块酶消化法原代培养细胞成功率高, 所培养的细胞进行初步鉴定证明为大肠癌细胞.
核心提要: 本研究利用改良的组织块酶消化法体外培养人大肠癌原代细胞, 并通过细胞形态学及细胞免疫学方法鉴定所得细胞.
引文著录: 梁剑华, 张雯, 郭强, 唐慧. 应用改良的组织块酶消化法体外培养人大肠癌原代细胞. 世界华人消化杂志 2016; 24(34): 4562-4567
Revised: September 14, 2016
Accepted: October 20, 2016
Published online: December 8, 2016
To investigate methods of primary culture of human colorectal cancer cells in vitro by application of improved tissue piece enzyme digestion method.
Human colorectal cancer cells were cultured by improved tissue piece enzyme digestion method, which combines the tissue explant method with Ⅳ collagenase digestion method. Colorectal cancer cells were obtained by optimizing culture conditions, promoting adherence, controlling pollution, and purifying the cells. Wright Giemsa staining and immunocytochemistry were used to identify the cells.
Wright Giemsa staining of the cells showed karyomegaly and purple red-stained colorectal cancer cells. Immunocytochemistry staining showed that the cells were carbohydrate antigen 19-9 (CA19-9) positive and the cytoplasm was brown.
We have improved the tissue piece enzyme digestion method, which allows to obtain free cells quickly and make full use of the tissue pieces which have not been digested completely. The improved tissue piece enzyme digestion method has a high success rate, and cultured cells have been identified as colorectal cancer cells.
- Citation: Liang JH, Zhang W, Guo Q, Tang H. Application of improved tissue piece enzyme digestion method in primary culture of human colorectal cancer cells in vitro. Shijie Huaren Xiaohua Zazhi 2016; 24(34): 4562-4567
- URL: https://www.wjgnet.com/1009-3079/full/v24/i34/4562.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i34.4562
大肠癌包括直肠癌和结肠癌, 是目前常见的恶性肿瘤, 严重危害人类健康[1-4]. 大肠癌细胞多以商品化的细胞株为材料, 然而, 相比之下, 原代培养的肿瘤细胞离体时间短, 变异少, 生物特性更接近体内状态, 对大肠癌防治的研究更有参考意义. 截至目前, 国内外已有较多关于大肠癌原代培养的报道, 但成功率极低且成本高[5-7]. 在前人工作的基础上, 本研究对部分方法做了改良, 以期找到更优化的培养条件, 提高大肠癌原代培养的成功率, 为大肠癌原代细胞培养提供一种成功率高且成本较低的方法.
1.1.1 实验样本: 收集于云南省第一人民医院普外科手术切除的新鲜大肠癌组织样本, 患者术前均未接受放化疗. 收集的所有组织样本均经病理检查证实. 本研究获得了云南省第一人民医院伦理委员会的批准, 同时样本采集得到了患者的知情同意.
1.1.2 主要试剂: Ⅳ胶原酶、透明质酸酶、DNA酶、胰岛素均购自Sigma公司; Trypsinase、RPMI 1640培养基、胎牛血清和红细胞裂解液均购自GIBCO公司; 成纤维细胞抑制剂购自齐氏生物科技有限公司; 糖链抗原19-9(carbohydrate antigen 19-9, CA19-9)抗体购自Abcam公司; 抗生素/抗霉菌药物溶液(青霉素/链霉素/两性霉素B)、青链霉素购自HyClone公司; 瑞姬氏染色液、免疫细胞化学相关试剂等购自福州迈新生物技术有限公司. 实验过程中各个步骤所用的主要试剂配方如表1.
| 实验步骤 | 试剂名称 | 试剂配方 |
| 肿瘤组织的处理 | 取组织用液 | Hank's液+10倍抗生素/抗霉菌药物溶液 |
| 肿瘤组织的清洗 | 洗组织用液 | PBS+5倍青链霉素 |
| 肿瘤组织的消化 | 组织消化液 | Ⅳ胶原酶+透明质酸酶+DNA酶 |
| 肿瘤组织碎块和游离细胞的培养 | 完全培养基 | RPMI 1640培养基+10%胎牛血清+1%双抗+0.5 μg/mL胰岛素+成纤维细胞抑制剂 |
1.2.1 肿瘤组织标本的收集和处理: 患者手术切除的新鲜大肠癌组织, 找到肿瘤细胞最丰富的部位, 取1-3 cm3大小的组织样本, 放入装有取组织用液的无菌离心管, 于冰上迅速带至实验室, 使组织浸泡于取标本用液中10-20 min, 尽快开始后续操作.
1.2.2 原代培养: 以下步骤均在超净工作台内操作, 必须严格遵循无菌操作要求, 同时, 所用到的手术器材(手术剪、手术镊、玻璃皿等)均经过高压灭菌处理: (1)将取回的组织置于玻璃皿内, 用洗组织用液清洗组织7-10次; (2)用剪刀剪去组织周围脂肪组织、坏死组织以及肠膜部分; (3)洗组织用液适量, 处理组织5 min; 75%酒精适量, 处理组织1 min; 弃去酒精, 加洗组织用液适量, 处理组织5 min; (4)将组织块置于玻璃器皿内, 剪碎至1-3 mm3大小. 将组织碎块收集至无菌离心管, 加适量洗组织用液, 1000 r/min, 5 min, 重复几次, 直到上清透亮即可, 弃去上清; (5)加入适量红细胞裂解液重悬, 置于4 ℃, 8 min; 1000 r/min, 5 min, 弃去上清; 洗组织用液清洗一次, 弃去上清; (6)根据组织碎块的量添加消化酶: 每1 mL组织碎块, 加入1 mL胶原酶、100 μL透明质酸酶及20 μL DNA酶. 轻轻震荡混匀, 于37 ℃震荡消化2-4 h; (7)消化结束后, 可看到离心管内消化液已变浑浊. 加入适量洗组织用液, 1000 r/min, 5 min, 清洗数次, 至上清透亮即可, 弃去上清; (8)向离心管内加入少量完全培养基, 用吸管吹打数次. 用吸管将消化后所得部分(组织碎块和游离细胞)放入培养皿, 再向培养皿内加入1-2 mL完全培养基(不宜太多, 尽量使组织碎块黏附附于底部); (9)在保证未污染的前提下, 静置细胞3 d(此时不宜反复观察, 以免影响细胞及组织块贴壁).
1.2.3 细胞处理: (1)换液: 静置3 d后, 适当补加完全培养基(动作务必轻缓, 避免剧烈晃动). 培养初期, 细胞生长较慢, 可4-5 d左右换液1次. 培养至第10天左右, 贴壁的组织块周围有细胞游出, 且密度明显高于其他部位; (2)传代: 大肠癌细胞较难消化, 但为了保证后续培养过程中的细胞活力, 应掌握好消化时间, 切勿消化过度.
1.2.4 大肠癌原代细胞鉴定: (1)形态学观察: 做细胞爬片, 用瑞姬氏染色液染色, 观察细胞形态; (2)免疫学鉴定: 做细胞爬片, 用免疫细胞化学方法. 由于CA19-9与胃肠癌密切相关[8-10], 故检测细胞CA19-9.
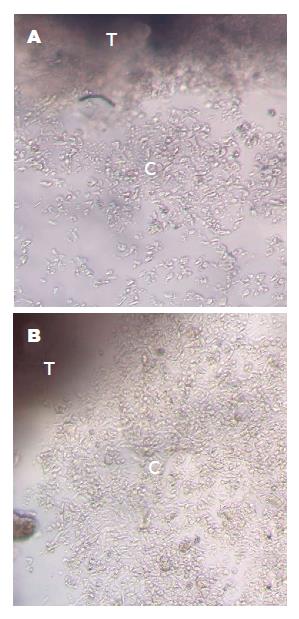
培养至第10天左右, 显微镜下观察, 贴壁的肿瘤组织块周围可见有细胞游出(图1).
大肠癌细胞的原代培养是极具技术性和挑战性的工作, 影响实验成败的因素众多. 所以, 找到更优化的培养条件对提高实验成功率至关重要. 本研究在培养方法、促进细胞的贴壁、污染的控制和去除如成纤维细胞等杂细胞这四方面均做了一些改良: (1)培养方法: 目前, 文献报道的大肠癌细胞原代培养方法主要为酶消化法和组织块培养法[11-13], 但两种方法各有优缺点. 酶消化法, 一般用胶原酶消化、过滤后可直接得到单细胞悬液, 但往往浪费了残留的组织碎块, 其中仍含有大量肿瘤细胞. 另有研究表明, 细胞间的相互接触可以减少细胞凋亡, 利于保持细胞的固有特性[14,15]. 组织块培养法, 操作简便, 但需要较长时间才可看到有细胞爬出. 组织块酶消化法可以结合两者的优点, 效果更好. 本研究中, 将三种方法做了对比, 培养至10 d左右时, 发现酶消化法贴壁细胞少、组织块法游出细胞少, 均不能进一步增殖, 但组织块酶消化法可以较快速的得到大肠癌细胞. 目前, 组织块酶消化法已被很多学者用于人牙周膜细胞、血管瘤内皮细胞等的原代培养[16-19], 但大肠癌细胞原代培养方面报道尚少见. 大剂量的胰岛素往往对细胞不利, 而低剂量时则可促进细胞的生长, 本研究采用的胰岛素浓度为文献报道的0.5 μg/mL, 发现细胞在该胰岛素浓度下生长状态良好[20-22]; (2)促进贴壁: 组织块的贴壁对细胞迁出十分重要, 所以培养初期在保证未污染的前提下, 保持绝对静置3-4 d. 待组织块中细胞贴壁稳定后, 方可补加培养基, 以免冲散刚贴壁的组织块, 导致重新漂浮, 而影响成活. 补液后继续静置, 进一步促进细胞贴壁生长. 大量学者证明, 用鼠尾胶原包被过的培养瓶培养, 可显著提高细胞的贴壁效率[23-25]. 我们在培养初期, 只加入1-2 mL培养基, 该"干涸法"也可达到促进贴壁的目的; (3)污染的控制: 由于肠道本身的开放性, 且内部微生物种类丰富、数量庞大[26-28], 所以污染是大肠癌原代培养最常见的问题之一. 取标本时尽量剪取靠近癌灶内部的部分. 我们在取组织用液和洗组织用液中都加入了高浓度的抗生素, 结果表明, 用高浓度抗生素多次冲洗之后, 基本可避免污染. 实验过程所用到的手术器材必须经过高压灭菌, 严格遵守无菌操作; (4)去除杂细胞: 成纤维细胞生命力强、生长速度快, 是大肠癌原代培养中最常见的杂细胞来源. 不少文献中报道, 利用成纤维细胞与上皮细胞贴壁速度差异和对胰酶敏感性的差异, 可用反复贴壁法或者胰酶消化法对细胞进行纯化; 也有学者将细胞稀释后用96孔板进行单细胞克隆培养, 从而筛选出目的细胞, 但往往操作繁琐且效果有限[29-32]. 本研究中, 我们分别尝试进行了反复贴壁法和胰酶消化法以期去除成纤维细胞, 但经细胞爬片染色、观察, 仍有大量成纤维细胞存在, 未达到理想效果. 最终通过向培养基中加入成纤维细胞抑制剂, 即可有效控制成纤维细胞的生长, 得到纯度较高的肿瘤细胞.
利用组织块酶消化法培养的细胞瑞姬氏染液染色观察细胞核大呈紫红色, 胞浆呈浅蓝色, 核质比明显增大, 具有肿瘤细胞的典型特征. 免疫细胞化学检测细胞中胃肠癌相关抗原CA19-9, 表明CA19-9阳性, 证明该细胞簇来源于肠道的肿瘤细胞. 以上实验初步鉴定所培养的细胞为大肠癌细胞.
大肠癌对人类健康危害巨大, 原代细胞由于更接近体内状态, 更具研究意义. 所以, 探索出一套简便有效的大肠癌原代培养方法有着重要的理论意义及实用价值.
关于大肠癌细胞的原代培养, 较多学者已做过探索, 但操作繁琐、成功率低, 仍是亟待解决的问题.
关于大肠癌细胞的原代培养, 目前应用较多的方法是组织块培养法和酶消化培养法. 而对于培养过程中细胞的纯化, 较多学者应用胰酶消化法、反复贴壁法、机械刮除法等方法去除成纤维细胞.
组织块酶消化法多见于牙周膜细胞的原代培养, 本研究将该方法改良后应用于人大肠癌细胞的原代培养, 并取得较好的效果.
本文利用酶消化组织块法进行了大肠癌的原代培养, 结果可供科研工作者借鉴参考.
组织块酶消化法: 即组织块法和酶消化法相结合的方法, 将剪碎的组织块利用酶消化一段时间后, 放入培养瓶一起培养的方法.
肖恩华, 教授, 中南大学湘雅二医院放射教研室; 胡兵, 副研究员, 上海中医药大学附属龙华医院肿瘤科; 张鹏, 副研究员, 主治医师, 同济大学附属第十人民医院普外科; 王道荣, 主任医师, 江苏省苏北人民医院胃肠外科; 孙莉, 副主任护师, 大连医科大学附属第一医院心脏重症监护室
原代培养的肿瘤细胞, 其生物特性更接近在体肿瘤. 如何稳定、高效获得大肠癌原代肿瘤细胞仍亟待研究. 该论文探讨应用结合组织块法和Ⅳ胶原酶消化法的改良的组织块酶消化法体外原代培养人大肠癌细胞, 通过优化细胞培养方法、促进贴壁措施、控制污染和减少杂细胞等手段, 可较短时间获得游离的肿瘤特征性细胞, 值得进一步探索比较研究.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 云南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | Cunningham D, Atkin W, Lenz HJ, Lynch HT, Minsky B, Nordlinger B, Starling N. Colorectal cancer. Lancet. 2010;375:1030-1047. [PubMed] [DOI] |
| 2. | Nautiyal J, Banerjee S, Kanwar SS, Yu Y, Patel BB, Sarkar FH, Majumdar AP. Curcumin enhances dasatinib-induced inhibition of growth and transformation of colon cancer cells. Int J Cancer. 2011;128:951-961. [PubMed] [DOI] |
| 3. | Liu S, Zheng R, Zhang M, Zhang S, Sun X, Chen W. Incidence and mortality of colorectal cancer in China, 2011. Chin J Cancer Res. 2015;27:22-28. [PubMed] [DOI] |
| 4. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 5. | Dangles-Marie V, Pocard M, Richon S, Weiswald LB, Assayag F, Saulnier P, Judde JG, Janneau JL, Auger N, Validire P. Establishment of human colon cancer cell lines from fresh tumors versus xenografts: comparison of success rate and cell line features. Cancer Res. 2007;67:398-407. [PubMed] [DOI] |
| 6. | Rowehl RA, Burke S, Bialkowska AB, Pettet DW, Rowehl L, Li E, Antoniou E, Zhang Y, Bergamaschi R, Shroyer KR. Establishment of highly tumorigenic human colorectal cancer cell line (CR4) with properties of putative cancer stem cells. PLoS One. 2014;9:e99091. [PubMed] [DOI] |
| 7. | Maletzki C, Stier S, Gruenert U, Gock M, Ostwald C, Prall F, Linnebacher M. Establishment, characterization and chemosensitivity of three mismatch repair deficient cell lines from sporadic and inherited colorectal carcinomas. PLoS One. 2012;7:e52485. [PubMed] [DOI] |
| 8. | Filipovic B, Milinić N, Gacic J, Markovic O, Djokovic A, Filipovic B. Benign Hydronephrosis and Elevated of Serum Levels of Carbohydrate Antigen CA 19-9: A Case Report. Am J Case Rep. 2016;17:395-397. [PubMed] [DOI] |
| 9. | Al-Shuneigat JM, Mahgoub SS, Huq F. Colorectal carcinoma: nucleosomes, carcinoembryonic antigen and ca 19-9 as apoptotic markers; a comparative study. J Biomed Sci. 2011;18:50. [PubMed] [DOI] |
| 10. | Burz C, Aziz BY, Bălăcescu L, Leluţiu L, Buiga R, Samasca G, Irimie A, Lisencu C. Tumor markers used in monitoring the tumor recurrence in patients with colorectal cancer. Clujul Med. 2016;89:378-383. [PubMed] [DOI] |
| 12. | Arul M, Roslani AC, Ng CL, Cheah SH. Culture of low passage colorectal cancer cells and demonstration of variation in selected tumour marker expression. Cytotechnology. 2014;66:481-491. [PubMed] [DOI] |
| 13. | Pastor DM, Poritz LS, Olson TL, Kline CL, Harris LR, Koltun WA, Chinchilli VM, Irby RB. Primary cell lines: false representation or model system? a comparison of four human colorectal tumors and their coordinately established cell lines. Int J Clin Exp Med. 2010;3:69-83. [PubMed] |
| 14. | Kondo J, Endo H, Okuyama H, Ishikawa O, Iishi H, Tsujii M, Ohue M, Inoue M. Retaining cell-cell contact enables preparation and culture of spheroids composed of pure primary cancer cells from colorectal cancer. Proc Natl Acad Sci USA. 2011;108:6235-6240. [PubMed] [DOI] |
| 15. | Hofmann C, Obermeier F, Artinger M, Hausmann M, Falk W, Schoelmerich J, Rogler G, Grossmann J. Cell-cell contacts prevent anoikis in primary human colonic epithelial cells. Gastroenterology. 2007;132:587-600. [PubMed] [DOI] |
| 17. | 鄂 玲玲, 刘 洪臣, 王 东胜. 酶消化贴壁组织块反复消化法培养人牙周膜细胞. 中华老年口腔医学杂志. 2014;12:70-73. |
| 18. | 郑 桂婷, 徐 燕, 赵 璇, 沈 继龙. 发育期牙根端复合体细胞条件培养液对脂肪干细胞增殖、分化的影响. 牙体牙髓牙周病学杂志. 2014;331-337. |
| 19. | 唐 诗鹏, 俞 松, 闫 陶然, 陆 建国, 卓 金伟, 柳 望舒, 于 怀景. MEK/ERK信号通路在体外培养血管瘤内皮细胞中的表达及意义. 中华小儿外科杂志. 2014;35:890-894. |
| 20. | 杨 磊磊, 戴 岳初, 董 米连, 朱 敏, 林 雪飞, 廖 伟, 梅 统. 大肠癌细胞的原代培养方法. 中国中西医结合外科杂志. 2012;18:341-345. |
| 21. | Radulescu RT. Intracellular insulin in human tumors: examples and implications. Diabetol Metab Syndr. 2011;3:5. [PubMed] [DOI] |
| 22. | Liang D, Zhang Y, Chen J, Wang H, Huang T, Xue X. Effects of Exogenous Growth Hormone on Growth Hormone-Insulin-Like Growth Factor Axis of Human Gastric Cancer Cell. Chin Med J. 2014;5:259-269. [DOI] |
| 23. | Failli A, Consolini R, Legitimo A, Spisni R, Castagna M, Romanini A, Crimaldi G, Miccoli P. The challenge of culturing human colorectal tumor cells: establishment of a cell culture model by the comparison of different methodological approaches. Tumori. 2009;95:343-347. [PubMed] |
| 24. | Xue X, Shah YM. In vitro organoid culture of primary mouse colon tumors. J Vis Exp. 2013;2001:e50210. [PubMed] [DOI] |
| 26. | Moore AM, Munck C, Sommer MO, Dantas G. Functional metagenomic investigations of the human intestinal microbiota. Front Microbiol. 2011;2:188. [PubMed] [DOI] |
| 27. | Chen W, Liu F, Ling Z, Tong X, Xiang C. Human intestinal lumen and mucosa-associated microbiota in patients with colorectal cancer. PLoS One. 2012;7:e39743. [PubMed] [DOI] |
| 28. | Sobhani I, Tap J, Roudot-Thoraval F, Roperch JP, Letulle S, Langella P, Corthier G, Tran Van Nhieu J, Furet JP. Microbial dysbiosis in colorectal cancer (CRC) patients. PLoS One. 2011;6:e16393. [PubMed] [DOI] |
| 29. | 姜 文静, 张 忠献, 王 尧河, 石 海亮, 赵 瑞华, 宗 红, 曹 风雨. 腹水来源胃癌原代细胞的建立及鉴定. 郑州大学学报(医学版). 2016;28:498-502. |
| 31. | Wang XY, Lai ZS, Yeung CM, Wang JD, Deng W, Li HY, Han YJ, Kung HF, Jiang B, Lin MC. Establishment and characterization of a new cell line derived from human colorectal laterally spreading tumor. World J Gastroenterol. 2008;14:1204-1211. [PubMed] [DOI] |
| 32. | Ku JL, Shin YK, Kim DW, Kim KH, Choi JS, Hong SH, Jeon YK, Kim SH, Kim HS, Park JH. Establishment and characterization of 13 human colorectal carcinoma cell lines: mutations of genes and expressions of drug-sensitivity genes and cancer stem cell markers. Carcinogenesis. 2010;31:1003-1009. [PubMed] [DOI] |