修回日期: 2016-09-22
接受日期: 2016-09-25
在线出版日期: 2016-11-18
探讨药物性肝损伤(drug-induced liver injury, DILI)患者血清中抗核抗体(anti-nuclear antibody, ANA)的临床特点, 总结临床经验, 以期望为临床工作提供一定的帮助.
收集并回顾性分析郑州大学第一附院2012-09/2015-09经肝穿刺确诊的DILI患者44例; 根据ANA阳性与否及其滴度的高低水平分组, 比较各组的年龄、临床表现、实验室指标[谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)、碱性磷酸酶(alkaline phosphatase, ALP)、球蛋白(globulin, GLB)]、病理学表现及保肝治疗效果. 呈正态分布的定量资料采用单因素方差分析, 非正态分布的定量资料采用Wilcoxon秩和检验, 计数资料组间比较采用χ2检验.
44例DILI患者中, ANA阴性者17例, ANA低滴度(1:100)16例, ANA中滴度(1:320)11例, 其中一般情况(临床表现、年龄)、肝脏生化学指标(ALT、AST、GGT、ALP)差异方面均无统计学意义(P>0.05), 而GLB、IgG、肝脏组织病理学、2 wk临床保肝治疗肝脏生化指标恢复情况方面表现为统计学差异(P<0.05).
随着血清中ANA滴度的增高, DILI患者肝脏中自身免疫现象更加突出, 肝穿刺病理学检验在诊断与评估病情中至关重要.
核心提要: 本文对44例药物性肝损伤(drug-induced liver injury, DILI)患者进行生化指标、抗核抗体(anti-nuclear antibody, ANA)滴度、肝脏组织活检对比分析, 发现界面炎、淋巴细胞、CD38半定量评分存在显著的统计学差异, DILI伴高滴度ANA的患者肝脏生化指标转归差, 必要时给予激素及免疫抑制剂治疗.
引文著录: 华静, 徐芸, 保洁, 刘香漫, 高素纪, 侯宇格. 加强对药物性肝损伤中自身抗体滴度的认识. 世界华人消化杂志 2016; 24(32): 4404-4408
Revised: September 22, 2016
Accepted: September 25, 2016
Published online: November 18, 2016
To analyze the clinical characteristics of serum anti-nuclear antibody (ANA) in patients with drug-induced liver injury (DILI).
This analysis was performed on the clinical data of 44 patients who were admitted to the First Affiliated Hospital of Zhengzhou University from 2012 to 2015 and diagnosed with DILI by liver puncture. The participants were divided into a low-titer ANA group, a high-titer ANA group, and an ANA-negative group. Comparisons were made for laboratory parameters such as alanine transaminase (ALT), aspartate transaminase (AST), alkaline phosphatase (ALP), gamma-glutamyl transpeptidase (GGT), globulin (GLB), and immunoglobulin G (IgG), age, clinical features and pathological characteristics, and therapeutic effects. Comparisons of normally distributed continuous data between groups were performed by one-way analysis of variance, comparisons of non-normally distributed continuous data between groups were made by rank-sum test, and comparisons of categorical data between groups were performed by chi-square test.
Among the 44 patients, 16 had low-titer ANA, 11 had high-titer ANA, and 17 were negative for ANA. There were no significant differences in ALT, AST, ALP, GGT, age or clinical features between the three groups (P > 0.05). GLB, IgG, pathological characteristics, and therapeutic effects differed significantly between the three groups (P < 0.05).
As serum ANA titer increases, liver autoimmune phenomenon becomes prominent in patients with DILI. Liver biopsy pathology is of great significance for the diagnosis and disease evaluation.
- Citation: Hua J, Xu Y, Bao J, Liu XM, Gao SJ, Hou YG. Clinical significance of serum anti-nuclear antibody level in patients with drug-induced liver injury. Shijie Huaren Xiaohua Zazhi 2016; 24(32): 4404-4408
- URL: https://www.wjgnet.com/1009-3079/full/v24/i32/4404.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i32.4404
免疫机制在药物性肝损伤(drug-induced liver injury, DILI)的发病机制中占有十分重要的地位[1], DILI合并自身免疫现象甚至最终发展为自身免疫性肝炎(autoimmune hepatitis, AIH)在临床上较常见, 单纯DILI与DILI伴自身免疫现象之间的临床表现、肝脏生化指标十分相似, 然而二者治疗、预后相差较大, 为临床工作带来一定的困扰, 但是目前国内外相关研究报道较少. 本研究通过回顾性分析单纯性DILI与伴有自身免疫现象的DILI的临床特点, 为临床工作提供可值得借鉴的经验.
纳入2012-09/2015-09郑州大学第一附属医院住院诊治并行肝穿刺确诊的DILI 44例, 并对其进行AIH简易化评分, 均<7分; 其中男18例, 平均年龄45.35岁; 女26例, 平均年龄49.62岁; DILI诊断标准参考美国胃肠病学院制定的DILI诊疗指南[2]. 排除不符合国际标准的患者, 除外病毒性肝炎、酒精性及非酒精性脂肪性肝炎、遗传性肝病等, 本研究经过医院医学伦理委员会审批, 所有研究对象均签署知情同意书.
1.2.1 肝组织活检: 使用法国Supersonic Imagine公司生产AixPlore全数字化彩色多普勒超声波诊断仪, 嘱患者左侧卧位, 于感兴趣部位进行定位及穿刺, 肝活检3条标本, 每条长度1.5-2.0 cm, 每条至少包括10个以上汇管区. 肝活检标本用40 g/L中性甲醛固定后, 其中2条进行石蜡包埋, 进行HE、网状纤维、Masson纤维及CD38、CD138、CK7染色, 另1条备用.
1.2.2 血清抗体滴度的测定: 晨起抽取患者2 mL静脉血放入肝素锂管中应用标准试剂进行检测; 取1:100为阳性结果, 其中1:100为低滴度, 1:320为中滴度.
1.2.3 观察指标: 发病年龄、性别、临床表现及血清学指标[抗核抗体(anti-nuclear antibody, ANA)滴度、谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)、碱性磷酸酶(alkaline phosphatase, ALP)、球蛋白(globulin, GLB)、免疫球蛋白G(immunoglobulin G, IgG)]病理表现: 根据ISHAK评分对界面炎、中性粒细胞、嗜酸性粒细胞、浆细胞/淋巴细胞浸润程度进行半定量评分; 血清中ANA滴度的高低与2 wk临床保肝治疗效果.
统计学处理 采用SPSS21.0软件进行统计学分析. 首先对资料进行正态性检验, 呈正态性分布的计数资料采用mean±SD, 组间比较采用单因素方差分析, 非正态分布的计数资料采用中位数与四分位间距M(P25-P75), 组间比较采用Wilcoxon秩和检验; 计数资料采用百分位数, 组间比较采用χ2检验; P<0.05为差异具有统计学意义.
收集经肝穿刺确诊的DILI 44例, 其中男18例, 女26例, 年龄9-81岁, 平均年龄47.56岁±16.6岁; 主要临床表现为乏力(35/44), 其次为消化系症状(如食欲减退、腹胀等)(28/44), 临床表现方面差异无统计学意义(P>0.05).
按照ANA滴度的高低分为ANA阴性组(17例)、ANA低滴度组(16例)、ANA中滴度组(11例); 3组分类方式的年龄、肝脏生化学指标(ALT、AST、GGT、ALP)之间对比结果提示差异方面均不具有统计学意义(P>0.05); 而免疫学相关指标GLB、IgG均有统计学意义; 2 wk临床保肝治疗肝脏生化学指标恢复情况: ANA阴性组(3/17)显著优于ANA低滴度组(6/16)及ANA中滴度(8/11), 且具有统计学差异(表1).
| 项目 | ANA低滴度(n = 16) | ANA中滴度(n = 11) | ANA阴性(n = 17) | F值 | P值 |
| 年龄(岁) | 41.19±18.94 | 54.64±18.38 | 48.94±10.91 | 2.370 | 0.106 |
| ALT(U/L) | 325.69±155.23 | 365.91±135.09 | 445.65±142.62 | 2.887 | 0.067 |
| AST(U/L) | 386.44±126.16 | 385.09±88.24 | 493.00±166.58 | 2.793 | 0.073 |
| ALP(U/L) | 169.69±79.66 | 169.09±34.04 | 169.09±34.04 | 0.182 | 0.084 |
| GGT(U/L) | 164.06±58.46 | 184.91±61.64 | 237.34±145.12 | 2.242 | 0.119 |
| GLB(g/L) | 23.89±4.91 | 28.33±3.85 | 20.38±4.93 | 7.930 | 0.001 |
| IgG | 10.40±1.60 | 14.06±1.51 | 9.80±1.52 | 27.68 | 0.000 |
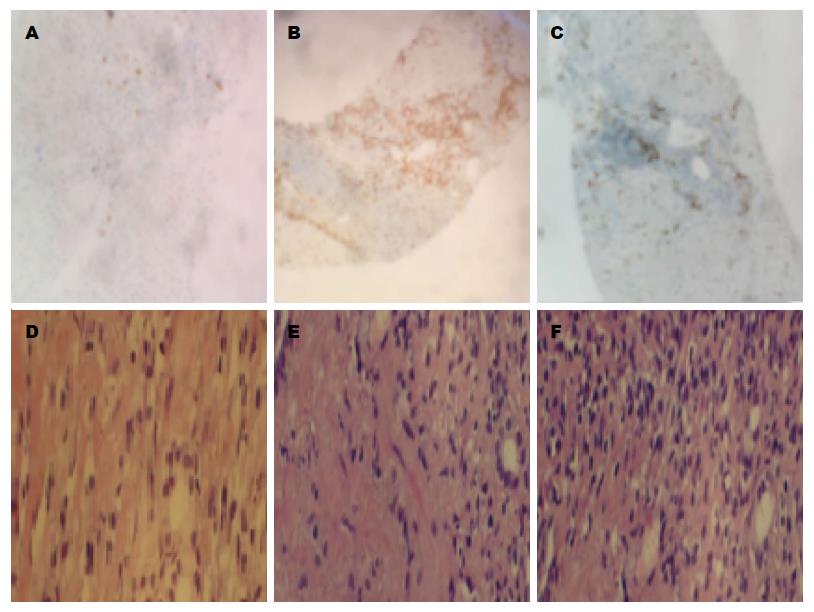
ANA中滴度组界面炎、浆细胞/淋巴细胞浸润显著高于ANA阴性组及ANA低滴度组, 且3组之间差异具有统计学意义; 3组共44例患者肝脏组织病理中均未见玫瑰花结及穿入现象等经典AIH病理学表现(表2, 图1).
| 分组 | ANA低滴度 | ANA中滴度 | ANA阴性 | F值 | P值 |
| 嗜酸性粒细胞 | 1.00±0.730 | 1.09±0.701 | 1.06±0.748 | 0.055 | 0.946 |
| 中性粒细胞 | 0.94±0.772 | 0.91±0.701 | 0.88±0.781 | 0.022 | 0.978 |
| 淋巴细胞 | 0.88±0.719 | 1.36±0.674 | 0.53±0.624 | 5.145 | 0.010 |
| CD38阳性 | 1.06±0.680 | 1.36±0.674 | 0.35±0.606 | 9.228 | 0.000 |
| 界面炎 | 0.75±0.577 | 1.55±0.522 | 0.65±0.606 | 9.078 | 0.001 |
DILI是指由各类处方或非处方的化学药物、生物制剂、传统中药、天然药、保健品、膳食补充剂及其代谢产物乃至辅料等所致的肝损伤[3-5]. DILI目前发病机制不明, 大多数学者认为包括药物的直接肝损伤及特异体质所致的肝损伤, 临床工作中DILI患者自身抗体(以ANA为主)阳性十分常见, 但是ANA滴度的高低与疾病的临床特点、预后及转归之间的关系目前国内外较少报道, 本研究通过收集经过肝脏穿刺病理检验确诊的DILI患者的临床指标, 观察DILI患者的血清ANA滴度及其临床特点、实验室指标以及疾病转归, 以期为临床工作提供一定的帮助.
本研究收集2012-2015年间郑州大学第一附属医院经肝穿刺病理确诊的44例DILI患者, 其中ANA阳性率61.4%, 与大多数文献报道[6,7]相近; 本实验中所有患者AIH简易化评分均<7分, 但多集中于5-6分之间, 虽未达到AIH诊断标准, 但这一结果进一步说明自身免疫现象、DILI、AIH之间关系错综复杂, 有学者将这一现象称为"免疫介导的DILI、药物介导的AIH或者合并DILI的AIH"[8-10], 但目前尚无统一定论.
纳入本研究的44例患者, 在临床表现方面, 3种不同分组之间差异均未表现出统计学差异; 在肝脏生化学指标方面, ALT、AST、ALP、GGT无统计学差异, 表明初步的肝脏生化检验不能鉴别单纯的DILI与伴有自身免疫现象的DILI. 在自身免疫性指标方面, 3组之间GLB、IgG表现出显著的统计学差异, 这一现象可能与自身免疫性疾病发病机制相关, 免疫介导的DILI的发病机制中包括通过MHC-Ⅱ途径激活B淋巴细胞, 进而促进分泌免疫球蛋白等[11], 说明随着ANA滴度的增高, 自身免疫现象也更加突出. 肝脏组织病理学方面, 中性粒细胞、嗜酸性粒细胞半定量评分未表现出统计学差异, 界面炎、淋巴细胞、CD38半定量评分存在显著的统计学差异, 表明随着ANA滴度增高, 肝脏的自身免疫现象更加突出. 2 wk保肝治疗效果方面, 3组不同分组间差异具有统计学意义, ANA滴度较高的患者肝脏生化指标恢复差, 表明在解除了药物对肝脏的直接损伤后, ANA滴度增高的患者仍存在自身免疫介导的肝脏损伤. 但是, DILI又分为肝细胞型、胆管细胞型及混合型, 本研究仅仅收集了肝细胞型为主的DILI, 存在一定局限性.
另外, 本研究在收集资料过程中发现两例ANA 1:1000患者, 这2例患者肝脏穿刺病理学示中度界面炎、小叶内浆细胞/淋巴细胞浸润, 但无玫瑰花结、穿入现象等, AIH简易化评分均为6分, 给予常规保肝药物(天晴甘美)应用, 1年后再次肝穿刺确诊为AIH.
ANA[12,13]是一组将自身真核细胞的各种成分: 脱氧核糖蛋白、DNA、可提取核抗原、RNA等作为靶抗原的总称, 是自身免疫性疾病的重要诊断指标之一. ANA阳性可见于多种自身免疫性疾病, 在部分DILI及几乎所有AIH患者中均可出现[14,15], 其血清中滴度的高低虽然不能完全作为DILI和AIH的诊断及鉴别诊断的标准, 但仍可给临床工作提供一定的指向性, 伴有高滴度ANA的DILI患者, 我们往往不能确诊其单单是DILI伴自身免疫现象或者是AIH前驱阶段, 二者临床诊疗及预后大不相同, 此时, 需密切随访其病情演变过程, 在常规保肝治疗效果欠佳或是病情反复时肝穿刺病理学检验是诊断并评估病情的重要手段.
药物性肝损伤(drug-induced liver injury, DILI)伴抗核抗体(anti-nuclear antibody, ANA)滴度增高是临床上非常常见的一种现象, 也是国内外肝病领域研究的热点. DILI伴自身免疫现象与自身免疫性肝炎(autoimmune hepatitis, AIH)的关系十分复杂, 其发病机制及诊疗目前尚无统一意见.
现阶段对DILI的研究多集中在ANA阳性与否的临床特点、治愈情况的方面, 对ANA滴度的高低与其临床转归、肝脏组织活检方面尚缺乏进一步研究.
廖惠钰教授指出, 免疫介导的DILI、药物介导的AIH或者合并DILI的AIH既存在相同又有不同之处, 鉴别十分困难, 建议应用AIH简易化评分及肝脏组织活检.
本课题对44例经过肝组织活检确诊的DILI患者的临床生化、肝组织病理及治疗效果等方面进行研究, 内容及观点新颖.
DILI伴ANA滴度阳性的患者临床十分常见, 但是目前尚缺乏统一的诊疗标准及相关文献报道. 本文分析郑州大学第一附属医院收治的44例DILI患者临床治疗, 提供了大量有价值的信息, 以期提高大家对此类疾病的重视并为临床工作提供一定的帮助.
张进祥, 副教授, 华中科技大学同济医学院附属协和医院
本文为临床医生规范化诊疗、避免误诊、漏诊提供了依据, 有较好的临床意义, 结论客观, 显示了治疗的困境.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 河南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:胡珊
| 1. | Ju C, Reilly T. Role of immune reactions in drug-induced liver injury (DILI). Drug Metab Rev. 2012;44:107-115. [PubMed] [DOI] |
| 2. | Suzuki A, Brunt EM, Kleiner DE, Miquel R, Smyrk TC, Andrade RJ, Lucena MI, Castiella A, Lindor K, Björnsson E. The use of liver biopsy evaluation in discrimination of idiopathic autoimmune hepatitis versus drug-induced liver injury. Hepatology. 2011;54:931-939. [PubMed] [DOI] |
| 4. | Björnsson E, Davidsdottir L. The long-term follow-up after idiosyncratic drug-induced liver injury with jaundice. J Hepatol. 2009;50:511-517. [PubMed] [DOI] |
| 5. | 李 健, 程 香普, 崔 静, 段 芳龄. 36例药物性肝病的临床分析. 胃肠病学和肝病学杂志. 2009;9:216-217, 220. |
| 6. | Ohira H, Takahashi A. Current trends in the diagnosis and treatment of autoimmune hepatitis in Japan. Hepatol Res. 2012;42:131-138. [PubMed] [DOI] |
| 7. | Liu YM, Yan HP, Han Y, Zhang LJ, Liu Y, Liao HY, Chen YS, Huang YL, Zhao GQ, Ding HG. [Clinical significance of liver function and autoantibodies in patients with acute or chronic drug-induced liver injury]. Zhonghua Ganzangbing Zazhi. 2010;18:37-40. [PubMed] |
| 8. | Yang JX, Yan HP, Tan YF, Liu Y, Ma DM, Zhao Y, Zhang HP. Analysis on autoantibodies of pa-tients with drug-induced liver disease. Clin Focus. 2008;23:992-995. |
| 9. | Castiella A, Lucena MI, Zapata EM, Otazua P, Andrade RJ. Drug-induced autoimmune-like hepatitis: a diagnostic challenge. Dig Dis Sci. 2011;56:2501-2502; author reply 2502-2503. [PubMed] [DOI] |
| 10. | Devarbhavi H, Dierkhising R, Kremers WK, Sandeep MS, Karanth D, Adarsh CK. Single-center experience with drug-induced liver injury from India: causes, outcome, prognosis, and predictors of mortality. Am J Gastroenterol. 2010;105:2396-2404. [PubMed] [DOI] |
| 11. | Weiler-Normann C, Schramm C. Drug induced liver injury and its relationship to autoimmune hepatitis. J Hepatol. 2011;55:747-749. [PubMed] [DOI] |