修回日期: 2015-11-27
接受日期: 2015-12-14
在线出版日期: 2016-01-28
目的: 研究Ⅳ期不可切除性直肠癌患者经联合化疗后继续行卡培他滨维持化疗, 观察其有效性及安全性.
方法: 回顾性分析2011-06/2014-06吉安市中心人民医院收治的53例Ⅳ期不可切除性晚期直肠癌给予常规联合化疗(FOLFOX或FOLFIRI q2W方案×12周期), 使肿瘤缩小, 然后采用随机数字表法分组: A组(n = 28) 卡培他滨维持组(卡培他滨片1000 mg/m2, 口服bid, d1-14, q3w), B组(n = 25)对照组(未接受维持治疗). 比较两组无进展生存期(progression free survival, PFS)以及A组维持化疗前后临床不良反应发生率.
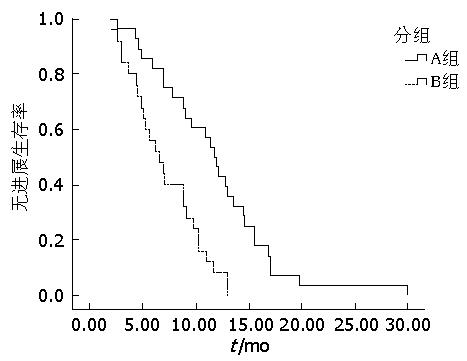
结果: 28例卡培他滨维持治疗组患者中位PFS为11.6 mo±0.79 mo, 95%CI: 10.04-13.16, 治疗有效率(response rate, RR)为39.2%. 25例对照组患者中位无疾病进展时间为6.5 mo±1.08 mo, 95%CI: 4.38-8.62, RR = 32%. A、B组RR间无统计学差异(P>0.05), 但中位PFS疗效有统计学差异(P<0.05). 联合化疗时的所有不良反应在进入维持治疗组或观察组后都有明显减少或减轻(P<0.05), 而维持治疗组和对照组间除手足综合征及色素沉着外, 余不良反应无统计学差异(P>0.05).
结论: Ⅳ期不可切除性晚期直肠癌患者在联合方案化疗后卡培他滨单药维持治疗可获得较长的PFS, 并且耐受性好, 不良反应轻, 值得临床推广.
核心提示: 晚期直肠癌患者, 在控制肿瘤生长的同时, 还应考虑不良反应及并发症的发生. 因此卡培他滨单药维持化疗正好解决了这一棘手的问题, 其治疗的有效性既能提高无进展生存期, 又能减轻患者的不良反应, 值得临床推广.
引文著录: 刘景, 徐晶. Ⅳ期不可切除性直肠癌联合化疗后卡培他滨维持治疗的临床价值. 世界华人消化杂志 2016; 24(3): 467-473
Revised: November 27, 2015
Accepted: December 14, 2015
Published online: January 28, 2016
AIM: To investigate the efficacy and safety of capecitabine maintenance therapy after first-line combination chemotherapy in patients with unresectable stage Ⅳ rectal cancer.
METHODS: Fifty-three patients with unresectable stage Ⅳ advanced rectal cancer who achieved clinical response after first-line chemotherapy (FOLFOX or FOLFIRI, q2w, 12 cycles) from June 2011 to June 2014 at the People's Hospital of Ji'an City were randomly divided into two groups: A and B. Group A (28 patients) received maintenance therapy with capecitabine (1000 mg/m2, po, bid, d1-14, q21d). Group B (25 patients) did not receive any further chemotherapy. Progression-free survival (PFS) and adverse reactions were compared between the two groups.
RESULTS: The 28 patients treated with capecitabine maintenance therapy achieved a median progression free survival (PFS) of around 11.6 mo, significantly longer than the value (6.5 mo) in the 25 patients who did not receive maintenance treatment (P < 0.05). The response rate (RR) after first-line chemotherapy was 39.2% in the maintenance group and 32% in the non-maintenance group (P > 0.05). The adverse effects were reduced significantly in the maintenance therapy group and control group compared with those in first-line combination chemotherapy (P < 0.05). There was no statistical difference in adverse effects between the maintenance treatment and observation groups except for hand-foot syndrome and pigmentation (P > 0.05).
CONCLUSION: Patients with unresectable stage Ⅳ rectal cancer could benefit from capeciabine maintenance therapy in terms of longer PFS, better tolerance and milder adverse reactions.
- Citation: Liu J, Xu J. Clinical value of capecitabine maintenance therapy after first-line combination chemotherapy in patients with unresectable stage Ⅳ rectal cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(3): 467-473
- URL: https://www.wjgnet.com/1009-3079/full/v24/i3/467.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i3.467
直肠癌是国内外常见的恶性肿瘤之一, 在全球范围内直肠癌发病率仅次于肺癌和乳腺癌位居第3位[1-3]. 由于早期直肠癌症状不明显, 无特异性, 加之其浸润和转移的特点, 多数患者在初诊时就已处于晚期并失去了手术机会, 因此联合化疗成了当前晚期直肠癌的应用最广泛的治疗措施. 但是, 随着联合化疗使用时间的延长, 不良反应也相应增加, 且患者的生活质量明显降低[4]. 基于此现状, 有学者提出, 对晚期直肠癌联合化疗得到控制后, 采用低毒、有效的药物维持治疗成了近年来的研究新方向[5]. 因此本研究将观察53例临床Ⅳ期不可切除性直肠癌(即诊断时已发生远处转移, 并失去手术机会的晚期直肠癌患者), 通过联合化疗后应用卡培他滨单药维持治疗或观察等待, 评价分析两组间的临床疗效及安全性.
收集吉安市中心人民医院2011-06/2014-06中的晚期直肠癌患者53例(经伦理委员会批准, 签订知情同意书), 所有患者均已发生远处转移, 分期为Ⅳ期, 并经肿瘤多学科综合诊断和治疗(Multidisciplinary Approach for Cancer Diagnosis and Treatment, MDT)组讨论确定为已失去手术机会, 均完成FOLFOX或FOLFIRI q2w方案×12周期的辅助化疗, ECOG评分均为0-1分, 其中男27例, 女性26例, 18岁≤年龄≤74岁, 平均年龄为59岁, 全部病例均经病理活检证实为直肠腺癌. 其中28例患者接受维持治疗为A组(维持组), 25例患者不愿接受维持治疗及其他任何治疗方案的为B组(对照组). A、B两组患者在治疗前入组时平均年龄相仿(A组为50.9岁±10.3岁, B组为49.3岁±10.岁, 两组间无统计学差异, P>0.05); 此外, A、B两组患者在性别、转移部位及分化程度等基本特征方面也无统计学差异(P>0.05)(表1).
| 基本特征 | 卡培他滨维持组(n = 28) | 对照组(n = 25) | χ2值 | P值 |
| 性别 | 0.164 | 0.685 | ||
| 男 | 15(53.6) | 12(48) | ||
| 女 | 13(46.4) | 13(52) | ||
| 转移部位 | 0.043 | 0.998 | ||
| 肝脏 | 9(32.1) | 8(32) | ||
| 肺 | 5(17.9) | 5(20) | ||
| 腹膜后淋巴结 | 7(25.0) | 6(24) | ||
| 其他(多发部位转移) | 7(25.0) | 6(24) | ||
| 病理类型 | 0.002 | 0.963 | ||
| 高分化 | 8(28.6) | 7(28) | ||
| 中低分化 | 20(71.4) | 18(72) |
1.2.1 治疗: 所有53例患者均完成基因多态性检测(XRCC1、ERCC1、TS、UGT1A1*6、UGT1A1*28), 依据基因检测结果确定为使用FOLFOX或FOLFIRI q2w方案×12周期的辅助化疗, 联合化疗后再经MDT组讨论, 53例患者中没有出现可以手术根治的病例. A组维持治疗(维持组), 卡培他滨片1000 mg/m2, 口服bid, d1-14, q3w, 共8周期; B组不愿接受维持治疗及其他任何治疗方案.
1.2.2 评估: 所有患者每周期化疗前均进行完整的体格检查, 包括肝肾功能、血常规及肿瘤指标检测、心电图、ECOG评分以及3周期化疗结束后行上下腹部+胸部计算机断层扫描(computed tomography, CT)检查等, 随后在化疗结束后3年内, 常规每3 mo进行1次CT检查进行肿瘤评估, 每隔6 mo复查1次肠镜检查, 但是如果患者临床表现考虑有疾病进展可能, 则立即进行相关检查. 肿瘤病灶经过实体瘤的疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)进行疗效评价[6]: 完全缓解 (complete response, CR), 即所有目标病灶消失, 任何病理性淋巴结的短轴值必须<10 mm; 部分缓解(partial response, PR), 即以临界半径的总和为参照, 所有目标病灶半径的总和至少减小30%; 进展(progressive disease, PD), 即以研究目标病灶半径的总和最小值为参照, 所有目标病灶半径的总和至少增加20%; 稳定(stable disease, SD), 即以研究目标病灶半径的总和最小值为参照, 既达不到缓解标准, 也达不到恶化标准; 总有效率(response rate, RR) = (完全缓解+部分缓解)/总例数×100%; 中位无进展生存期(progression free survival, PFS), 即从第1天的治疗到发现临床/放射学进展或死亡之间的时间间隔. 不良反应评定参照美国国立癌症研究所通用毒性分级标准(NCI CTCAE 3.0)[7].
统计学处理 采用SPSS17.0统计分析软件分析, 生存分析采用Kaplan-Meier分析法. 统计中位数值和95%可信区间(CI). 组间差采用χ2检验, P<0.05为差异有统计学意义.
预定化疗周期数为8个, 其中2例患者因不良反应事件出现而中断治疗, 28例患者共完成216个周期化疗, 最少化疗周期数为3个.
A组与B组的CR、PR、SD等结果对比如表2, 其中A、B两组治疗的RR分别为39.2%和32%, 两组间比较无统计学差异(P>0.05); A组中位无疾病进展时间为11.6 mo±0.79 mo, 95%CI: 10.04-13.16, B组中位无疾病进展时间为6.5 mo±1.08 mo, 95%CI: 4.38-8.62, 两组间有统计学差异(P<0.05). 根据生存曲线分析: A组与B组中位生存有统计学差异(P<0.05, 图1).
| 分组 | n | CR | PR | SD | RR(%) |
| 卡培他滨组(A组) | 28 | 2(7.1) | 9(32.1) | 17(60.8) | 39.2 |
| 对照组(B组) | 25 | 2(8.0) | 6(24.0) | 17(68.0) | 32.0 |
53例患者在联合化疗过程中, 大部分不良事件严重程度为Ⅰ或Ⅱ级. 4例Ⅲ-Ⅳ级白细胞下降, 2例Ⅲ-Ⅳ级血小板下降, 1例Ⅲ级腹泻, 3例Ⅲ-Ⅳ级神经病变, 1例Ⅲ级手足综合征, 2例Ⅲ级恶心呕吐. 联合化疗后进入卡培他滨维持组或是停药观察组, 大部分不良反应的发生率下降, 且程度有减轻. 各组间差采用χ2检验, 发现卡培他滨维持组与本组联合化疗期间不良反应比较, 除口腔黏膜反应及神经性病变外, 其余大部分不良反应均有统计学差异(P<0.05); 卡培他滨维持组与对照组不良反应比较, 除手足综合征及色素沉着等反应有统计学差异(P<0.05), 其余大部分不良反应无统计学差异(表3).
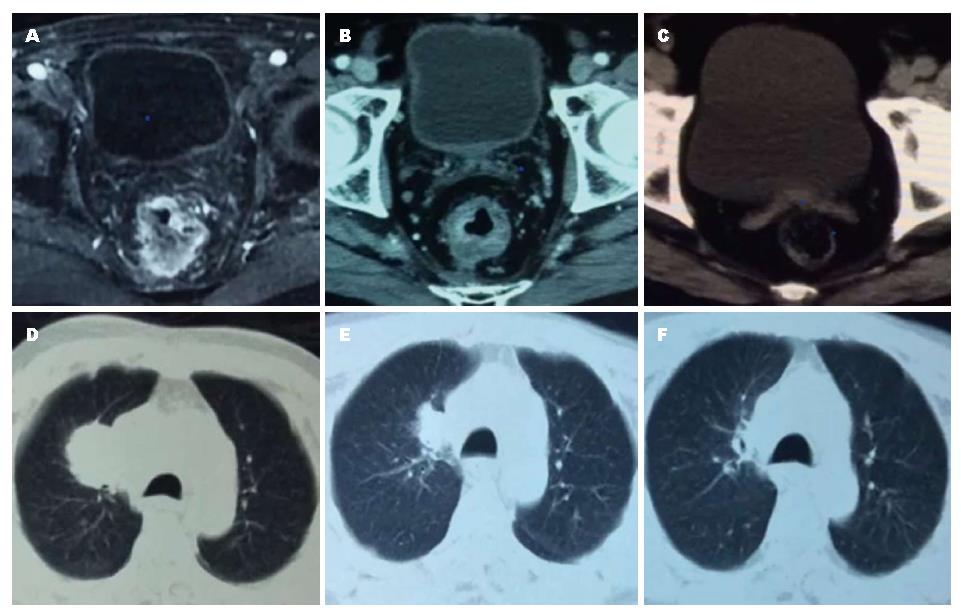
男性, 72岁, 便血6 mo余. 电子肠镜+病理活检示: 直肠中分化腺癌, 盆腔MRI示: 直肠占位, 侵及盆壁组织并黏连固定(图2A); 胸部CT示: 右肺门占位伴上腔静脉压迫, 侵犯周边大血管(图2D); 穿刺活检病理示: 右肺转移性腺癌; MDT讨论无手术机会; 经UGT1A1检测后行FOLFIRI方案化疗12周期后复查CT见直肠肿瘤及右肺转移瘤均有明显缩小, 纵隔血管仍受侵(图2B, E), 再次评估并确定患者仍无手术机会; 患者随机入组卡培他滨维持治疗A组, 治疗结束后再行CT复查见直肠原发肿瘤及右肺转移瘤完全退缩(图2C, F).
在2015年胃肠肿瘤论坛会议上, 刘云鹏教授提出: 患者之所以要进行治疗, 是因为病灶持续存在, 一线治疗又很有效, 那么有效的药物在有病灶的患者身上就不能停, 一旦停药肿瘤就会再次进展, 因此就需要维持治疗. 而且维持治疗的提出及实施已从早年的白血病的治疗中就获得了非常多的有益经验[8]. 但是对于晚期直肠癌的治疗, 如果用一线治疗有效的联合化疗方案维持化疗, 患者很难耐受, 当患者一般情况下降后, 他不能从中获益, 相反还会影响他的生活质量[4,9]. Tournigand等[10]研究发现, 由FOLFOX方案化疗后, 予单药5-氟尿嘧啶(5-fluorouridine, 5-Fu)维持治疗, 与持续原联合方案FOLFOX强烈化疗相比, 单药5-Fu维持治疗组的不良反应明显降低, 且延长PFS, 总生存与持续强烈化疗相当. 但3、4度严重不良反应有所减少, 特别是在单药维持治疗阶段, 3度神经毒性明显减少, 有效地改善了患者的生活质量.
因此说我们在临床肿瘤治疗中要求选择一个低毒、有效的治疗药物进行维持, 这样既能发挥药物的治疗作用, 又能保证患者的生活质量. 卡培他滨是氟尿嘧啶类治疗药物, 其治疗作用也是通过独特的肿瘤内选择性激活这一途径, 卡培他滨能迅速通过肠道以原形吸收, 在肝内经羧酸酯酶(分布在肝脏)转变成脱氧氟胞苷, 再通过胞苷脱氨酶(分布在肝脏和肿瘤)成为脱氧氟尿苷, 然后特异性在肿瘤内由胸苷磷酸化酶激活, 在肿瘤内产生高浓度的5-Fu起作用[11]. 且低毒的原因是对肿瘤细胞的细胞毒性作用具有高选择性, 对正常组织具有低的相关毒性. 正因为此, 卡培他滨在临床的应用越来越广泛, 特别是维持治疗领域, 其有效性已经开始渗透到所有胃肠肿瘤. 且已有相当多的学者进行过这方面的临床试验并证实了卡培他滨维持治疗对晚期直肠癌是安全有效的[12-14]. 同样, 最近的一项研究[15]表明, 进展期胃癌经一线联合化疗(XELOX方案)后, 进行卡培他滨维持治疗也能显著延长患者的PFS和OS, 而且患者毒性轻微, 具有有较好的耐受性. 此外, 卡培他滨是一种口服类药物, 其应用于消化系肿瘤的治疗, 较常规静脉5-Fu化疗相比使用更方便, Twelves等[16]报道了一项在大肠癌患者的辅助治疗中比较使用卡培他滨和 Mayo Clinic方案的研究结果(X-ACT试验), 共有1987例患者进入研究, 结果表明卡培他滨在DFS及OS方面优于5-Fu, 除了手足综合征之外, 其他不良反应卡培他滨组都显著低于5-Fu组(P<0.001).
总之, 结合本研究结果, 我们不难发现, 临床Ⅳ期不可切除性直肠癌经一线联合方案化疗后卡培他滨维持治疗可延长患者PFS. 本研究中28例卡培他滨维持治疗组患者中位PFS为11.6 mo±0.79 mo, 95%CI: 10.04-13.16, 25例对照观察组患者中位PFS为6.5 mo±1.08 mo, 95%CI: 4.38-8.62, 两组间中位PFS疗效有统计学差异(P<0.05). 且在不良反应方面, 联合化疗后进入卡培他滨维持治疗组, 大部分不良反应的发生率下降, 而且程度均有减轻. 本研究中卡培他滨维持治疗组与本组联合化疗期间不良反应比较, 除口腔黏膜反应及神经性病变外, 其余大部分不良反应均有统计学差异(P<0.05); 卡培他滨维持组与对照组不良反应比较, 除手足综合征及色素沉着等反应有统计学差异(P<0.05), 其余大部分不良反应无统计学差异.
由此可见, 本研究采用卡培他滨单药维持应用于晚期直肠癌联合化疗后不仅使患者生存上获益, 而且具有良好的耐受性. 这一可喜的结果, 为晚期直肠癌的治疗提供了新的、初步的临床依据, 同时也为进一步寻找晚期直肠癌的后续治疗拓宽了思路. 但是本研究因病例数较少, 为非随机的回顾性分析, 不足之处难免. 因此希望在以后的工作中, 需要大样本及多中心前瞻性的随机对照研究来进一步证实维持治疗在临床晚期直肠癌治疗中的有效性, 这将有助于探索出更优更佳的治疗方案.
直肠癌早期症状不明显, 加之其浸润和转移性强等特点, 导致发现时大多数患者已处于晚期并失去了手术机会. 联合化疗是目前晚期直肠癌的主要治疗措施, 但长时间多药联合化疗不良反应大. 因此, 对晚期直肠癌联合化疗得到控制后, 采用低毒、有效的药物维持治疗成了当前研究的新方向.
王成锋, 主任医师, 中国医学科学院肿瘤医院腹部肿瘤外科; 贾云鹤, 教授, 主任医师, 哈尔滨医科大学附属肿瘤医院结直肠外科
晚期直肠癌国内外常见, 联合化疗是目前晚期不可切除性直肠癌的主要治疗措施, 但长时间联合化疗患者不良反应增加、生活质量明显降低. 因此, 寻求有效、低毒的单药维持治疗方案成了人们近年的研究热点.
众多学者都进行过这方面的临床试验并证实了卡培他滨维持治疗对晚期直肠癌是安全有效的.
本研究总立题新颖, 且治疗过程中患者不良反应小、耐受性好, 其结果为晚期直肠癌的治疗提供了新的、初步的临床依据, 同时也为进一步寻找晚期直肠癌的后续治疗拓宽了思路.
本研究采用卡培他滨单药维持应用于联合化疗后取得的结果, 可能成为晚期直肠癌治疗的一个新选择, 同时也有望在其他类型肿瘤治疗中取得新的突破.
不可切除性直肠癌: 即诊断时已发生远处转移, 并失去手术机会的晚期直肠癌患者, 如侵犯重要脏器或血管, 包括肝门部、纵隔血管、腹主动脉等部位受侵, 以及患者因年龄或本身患有重要的内科疾病不能耐受手术.
文章立意比较新颖, 对目前直肠癌晚期治疗提供了一个新的思路.
编辑: 郭鹏 电编: 都珍珍
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin. 2013;63:11-30. [PubMed] [DOI] |
| 2. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 3. | Siegel R, Ward E, Brawley O, Jemal A. Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths. CA Cancer J Clin. 2011;61:212-236. [PubMed] [DOI] |
| 4. | Grothey A, Sargent D. Overall survival of patients with advanced colorectal cancer correlates with availability of fluorouracil, irinotecan, and oxaliplatin regardless of whether doublet or single-agent therapy is used first line. J Clin Oncol. 2005;23:9441-9442. [PubMed] [DOI] |
| 5. | Chibaudel B, Maindrault-Goebel F, Lledo G, Mineur L, André T, Bennamoun M, Mabro M, Artru P, Carola E, Flesch M. Can chemotherapy be discontinued in unresectable metastatic colorectal cancer? The GERCOR OPTIMOX2 Study. J Clin Oncol. 2009;27:5727-5733. [PubMed] [DOI] |
| 6. | Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45:228-247. [PubMed] [DOI] |
| 7. | Liu YJ, Zhu GP, Guan XY. Comparison of the NCI-CTCAE version 4.0 and version 3.0 in assessing chemoradiation-induced oral mucositis for locally advanced nasopharyngeal carcinoma. Oral Oncol. 2012;48:554-559. [PubMed] [DOI] |
| 8. | Toyoda Y, Manabe A, Tsuchida M, Hanada R, Ikuta K, Okimoto Y, Ohara A, Ohkawa Y, Mori T, Ishimoto K. Six months of maintenance chemotherapy after intensified treatment for acute lymphoblastic leukemia of childhood. J Clin Oncol. 2000;18:1508-1516. [PubMed] |
| 9. | Di Francia R, Siesto RS, Valente D, Del Buono A, Pugliese S, Cecere S, Cavaliere C, Nasti G, Facchini G, Berretta M. Current strategies to minimize toxicity of oxaliplatin: selection of pharmacogenomic panel tests. Anticancer Drugs. 2013;24:1069-1078. [PubMed] [DOI] |
| 10. | Tournigand C, Cervantes A, Figer A, Lledo G, Flesch M, Buyse M, Mineur L, Carola E, Etienne PL, Rivera F. OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer--a GERCOR study. J Clin Oncol. 2006;24:394-400. [PubMed] [DOI] |
| 11. | Miwa M, Ura M, Nishida M, Sawada N, Ishikawa T, Mori K, Shimma N, Umeda I, Ishitsuka H. Design of a novel oral fluoropyrimidine carbamate, capecitabine, which generates 5-fluorouracil selectively in tumours by enzymes concentrated in human liver and cancer tissue. Eur J Cancer. 1998;34:1274-1281. [PubMed] [DOI] |
| 12. | Waddell T, Gollins S, Soe W, Valle J, Allen J, Bentley D, Morris J, Lloyd A, Swindell R, Taylor MB. Phase II study of short-course capecitabine plus oxaliplatin (XELOX) followed by maintenance capecitabine in advanced colorectal cancer: XelQuali study. Cancer Chemother Pharmacol. 2011;67:1111-1117. [PubMed] [DOI] |
| 13. | Li YH, Luo HY, Wang FH, Wang ZQ, Qiu MZ, Shi YX, Xiang XJ, Chen XQ, He YJ, Xu RH. Phase II study of capecitabine plus oxaliplatin (XELOX) as first-line treatment and followed by maintenance of capecitabine in patients with metastatic colorectal cancer. J Cancer Res Clin Oncol. 2010;136:503-510. [PubMed] [DOI] |
| 14. | Novello S, Bruzzi P, Barone C, Buosi R, Masotti A, Michetti G, Fioretti M, Barbera S, Spatafora M, Garetto L. Phase III study in stage IV non-small-cell lung cancer patients treated with two courses of cisplatin/gemcitabine followed by a randomization to three additional courses of the same combination or gemcitabine alone. Ann Oncol. 2007;18:903-908. [PubMed] [DOI] |
| 15. | Qiu MZ, Wei XL, Zhang DS, Jin Y, Zhou YX, Wang DS, Ren C, Bai L, Luo HY, Wang ZQ. Efficacy and safety of capecitabine as maintenance treatment after first-line chemotherapy using oxaliplatin and capecitabine in advanced gastric adenocarcinoma patients: a prospective observation. Tumour Biol. 2014;35:4369-4375. [PubMed] [DOI] |
| 16. | Twelves C, Wong A, Nowacki MP, Abt M, Burris H, Carrato A, Cassidy J, Cervantes A, Fagerberg J, Georgoulias V. Capecitabine as adjuvant treatment for stage III colon cancer. N Engl J Med. 2005;352:2696-2704. [PubMed] [DOI] |