修回日期: 2015-12-15
接受日期: 2015-12-21
在线出版日期: 2016-01-28
目的: 观察幽门螺杆菌(Helicobacter pylori, H. pylori)在胃黏膜的感染密度及在胃黏膜层不同深度的分布定植对胃黏膜炎症的影响, 探讨H. pylori生物膜在其致病性及对抗生素产生耐药机制中的作用.
方法: 组织病理学观察158例H. pylori阳性慢性胃炎或消化性溃疡患者的胃黏膜病变活检标本, 应用苏木精-伊红染色对胃黏膜炎症程度及活动程度分级并观察H. pylori感染密度, 比较两者的相关性. 应用免疫组织化学染色观察H. pylori在黏膜表面、胃小凹及浅层腺体的分布, 比较胃黏膜层不同深度H. pylori定植情况及其感染密度与炎症的关系.
结果: 免疫组织化学染色显示H. pylori定植在胃黏膜层表面、小凹及浅层腺体. 158例胃黏膜组织, 黏膜表面H. pylori(+)41例、(++)38例、(+++)79例; 小凹(+)29例、(++)42例、(+++)74例; 浅层腺体(+)51例、(++)51例、(+++)39例. 胃黏膜表面及小凹H. pylori密度与黏膜炎症程度有相关性(P<0.05); 浅层腺体H. pylori密度与黏膜炎症程度无明显相关性(P>0.05). 158例胃黏膜组织, 黏膜表面H. pylori(+)40例、(++)39例、(+++)79例; 小凹(+)29例、(++)41例、(+++)74例; 浅层腺体(+)48例、(++)53例、(+++)29例. 胃黏膜层表面、小凹及浅层腺体H. pylori密度与胃黏膜炎症活动性均有相关性(P<0.05), H. pylori在胃黏膜层不同深度密度越高胃黏膜炎症活动程度越重.
结论: H. pylori可以定植在胃黏膜层表面、小凹和浅层腺体, H. pylori感染密度与胃黏膜炎症程度有相关性. 具有细菌数量(感染密度)依赖性的H. pylori生物膜可能参与了其致病性及对抗生素的耐药.
核心提示: 该研究观察了幽门螺杆菌(Helicobacter pylori, H. pylori)感染密度及其在胃黏膜层不同深度定植对胃黏膜炎症程度和活动性的影响, 从细菌生物膜形成及细菌深层休眠状态等方面解释了H. pylori的致病强度及对抗生素耐药性的形成机制, 提出对初治失败的患者, 在拟定补救方案时, 除了检测H. pylori耐药基因及抗生素药敏, 还需考虑从病理组织学角度观察H. pylori感染密度及定植深度等因素.
引文著录: 王莉, 谢会忠, 刘友斌, 王炳淑, 张丽媛, 叶长华, 陈桂妃, 符仲标, 刘昌江, 温必盛. 幽门螺杆菌感染的密度和在胃黏膜层不同深度的定植对其致病性和抗生素耐药的影响. 世界华人消化杂志 2016; 24(3): 347-354
Revised: December 15, 2015
Accepted: December 21, 2015
Published online: January 28, 2016
AIM: To observe the influence of Helicobacter pylori (H. pylori) infection density and colonization depth in the gastric mucosa on the severity of gastric mucosal inflammation, in order to approach the pathogenicity and the mechanism of antibiotic resistance caused by the H. pylori biofilm.
METHODS: Gastric mucosal biopsy specimens were histopathologically studied in 158 patients with H. pylori positive chronic gastritis and peptic ulcer. The severity of gastric mucosa inflammation and the H. pylori infection density were evaluated using haematoxylin-eosin staining to explore the relationship between H. pylori infection density and the severity of gastric mucosa inflammation. The colonization of H. pylori in different layers of the gastric mucosa (gastric mucosa surface, gastric pits, and superficial glands) was observed by immunohistochemistry. The relationship between the H. pylori colonization depth and the severity of gastric mucosa inflammation was analyzed statistically.
RESULTS: H. pylori can colonize at the surface, pits and superficial glands of the gastric mucosa as revealed by immunohistochemistry. Of 158 gastric mucosa specimens, 41 had low H. pylori density (+) at the surface of the gastric mucosa, 38 had moderate H. pylori density (++), and 79 had high density (+++); the corresponding figures were 29, 42 and 74 at the pits, and 51, 51 and 39 at the superficial glands. There was a significant association between H. pylori density and the inflammatory severity at the surface and pits (P < 0.05), but not at the superficial glands (P > 0.05). Of 158 gastric mucosa specimens, 40 had low H. pylori density (+) at the surface of the gastric mucosa, 39 had moderate H. pylori density (++), and 79 had high density (+++); the corresponding figures were 29, 41 and 74 at the pits, and 48, 53 and 29 at the superficial glands. There were significant associations between H. pylori density and inflammatory activity at the surface, pits, and superficial glands (P < 0.05). Higher H. pylori density was associated with more severe mucosal inflammation.
CONCLUSION: H. pylori can colonize at the surface, pits and superficial glands of the gastric mucosa layer. There is a significant association between H. pylori infection density and the severity of gastric mucosa inflammation. H. pylori biofilm, which is formed depending on bacterial number (infection density), may participate in the pathogenicity and antibiotics resistance of H. pylori.
- Citation: Wang L, Xie HZ, Liu YB, Wang BS, Zhang LY, Ye CH, Chen GF, Fu ZB, Liu CJ, Wen BS. Helicobacter pylori infection density and colonization depth in gastric mucosa: Influence on pathogenicity and drug resistance. Shijie Huaren Xiaohua Zazhi 2016; 24(3): 347-354
- URL: https://www.wjgnet.com/1009-3079/full/v24/i3/347.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i3.347
近30年的研究证实人类致病菌-幽门螺杆菌(Helicobacter pylori, H. pylori)是胃炎、消化性溃疡、胃黏膜相关淋巴样组织(mucosal-associated lymphoid tissue, MALT)淋巴瘤和胃癌的主要致病因素[1], H. pylori感染根除治疗是目前的研究热点之一[2,3]. 随着抗生素的广泛使用, H. pylori对抗生素耐药问题亦日益严重[4], H. pylori对抗生素耐药是导致其根除治疗失败的主要原因[5,6]. 本研究在既往研究的基础上[7], 通过胃黏膜病理组织学观察胃黏膜H. pylori感染密度(细菌数量)对胃黏膜损伤程度及其在胃黏膜层不同深度的定植状态, 从依赖细菌数量(感染密度)形成的生物膜效应理论及H. pylori定植深度两个方面讨论解释H. pylori致病强度差异及产生抗生素耐药的机制, 为临床医生拟定抗H. pylori感染的个体化方案提供依据.
收集2012-01-01/2012-12-31在海南省农垦总医院消化内科接受胃镜检查的门诊及住院患者共计408例, 男性305例、74.75%(305/408), 女性103例、25.25%(103/408), 男女比例2.96:1; 年龄在21-82岁之间、平均年龄50.61岁±15.61岁(均数±标准差). 患者在胃镜检查前均签署知情同意书, 408例患者胃镜诊断消化性溃疡190例、慢性胃炎218例. 患者空腹行胃镜检查, 所有患者均在距幽门2.5 cm处取胃黏膜组织2块, 进行病理组织学诊断分析.
1.2.1 组织病理学染色: 病理组织学对408例胃窦黏膜活组织送检标本进行苏木精-伊红(hematoxylin-eosin staining, HE)染色切片, 病理组织学诊断胃黏膜炎症程度和炎症活动程度及H. pylori感染. 对HE染色显示阳性的H. pylori组织标本进行免疫组织化学染色, 半定量分析H. pylori感染密度及H. pylori在黏膜不同深度的定植状态. HE常规病理染色, 诊断胃黏膜病变及H. pylori感染密度分级. 免疫组织化学染色, 观察H. pylori在胃黏膜层不同深度(黏膜表面、小凹及浅层腺体)的定植分布情况.
1.2.2 组织病理学诊断: (1)胃黏膜病变观察: HE染色胃窦黏膜活组织, 由一位资深病理医师观察胃窦黏膜炎症程度及活动程度. 低倍镜(10×10)下观察胃窦黏膜炎症的不同程度. 轻度炎症: 炎症细胞较少并局限于黏膜浅层, 不超过黏膜层1/3; 中度炎症: 炎症细胞较密集, 超过黏膜层1/3, 但不超过2/3; 重度炎症: 炎症细胞密集, 累及黏膜全层. 高倍镜(40×10)下观察胃窦黏膜炎症的活动程度, 根据胃窦黏膜固有层、上皮内嗜中性粒细胞浸润量分级. 炎症静止期: 无中性粒细胞浸润; 炎症轻度活动期: 黏膜固有层见少数中性粒细胞浸润; 炎症中度活动期: 中性粒细胞较多且存在于黏膜层并出现在表面上皮间, 小凹上皮间, 腺管上皮间; 炎症重度活动期: 中性粒细胞较密集或除了中度所见外亦有小凹脓肿存在[8]; (2)胃黏膜H. pylori定植及密度观察: 免疫组织化学染色胃窦黏膜活组织, 由一位资深病理医师进行胃窦黏膜H. pylori半定量分析并观察H. pylori在胃窦黏膜定植状态. 高倍镜(40×10)下观察胃窦黏膜表面、胃小凹及浅层腺腔内H. pylori定植状态, 镜下见染色呈棕黄色逗点状或短棒状小体为H. pylori阳性. H. pylori感染密度定为+-+++级, "+"偶见或小于标本全长1/3有少量H. pylori; "++" H. pylori分布超过全长1/3, 未在标本全长2/3或似连续性或稀疏地存在于上皮表面; "+++" H. pylori成堆存在, 基本分布于标本全长[9].
统计学处理 采用SPSS统计软件17.0统计学分析, 配对设计双向有序资料的卡方检验, P<0.05为差异有统计学意义.
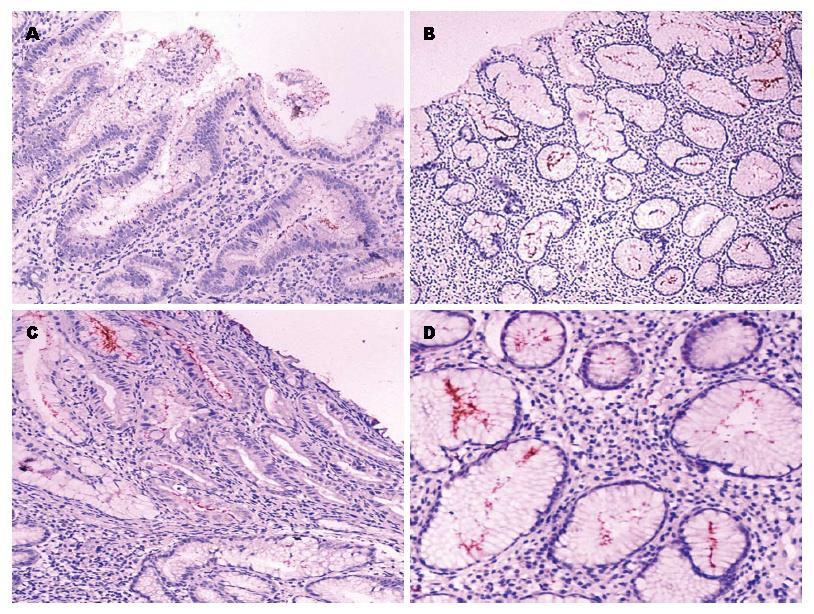
胃镜诊断190例消化性溃疡(胃溃疡和/或十二指肠溃疡)及218例慢性胃炎, 病理HE染色胃窦黏膜组织H. pylori阳性158例. 免疫组织化学染色显示H. pylori呈棕色短棒状小体, 主要定植分布在胃黏膜表面及胃黏膜小凹, 少许分布在胃黏膜浅层腺体(图1).
158例H. pylori阳性组织样本, 胃黏膜层表面H. pylori密度(+)41例、(++)38例、(+++)79例; 胃黏膜层小凹H. pylori密度(+)29例、(++)42例、(+++)74例; 胃黏膜层浅层腺体H. pylori密度(+)51例、(++)51例、(+++)39例. 统计学分析, 胃黏膜表面及胃小凹H. pylori定植密度与胃黏膜炎症程度有相关性, 差异有统计学意义(P<0.05); 胃黏膜浅层腺体H. pylori定植密度与胃黏膜炎症程度无明显相关性(P>0.05)(表1).
158例H. pylori阳性组织样本, 胃黏膜层表面H. pylori密度(-)0例、(+)40例、(++)39例、(+++)79例; 胃黏膜层小凹H. pylori密度(-)14例、(+)29例、(++)41例、(+++)74例; 胃黏膜浅层腺体H. pylori密度(-)28例、(+)48例、(++)53例、(+++)29例. 统计学分析, 胃黏膜层表面、小凹及浅层腺体H. pylori定植密度与胃黏膜炎症活动性有相关性(P<0.05), H. pylori在胃黏膜层不同深度定植密度越高胃黏膜炎症活动程度也越重(表2).
细菌生物膜由多糖、细胞外DNA、脂质和蛋白质构成[10,11], 其可以使微生物长期存活并抵抗抗菌素和机体免疫反应的作用. 在生物膜内的病原微生物, 具有更强地在不利环境中的生存能力[12]. 细菌生物膜的形成是一个动态演化过程, 生物膜内的细菌在形成生长过程中分泌一种或多种诱导分子到外环境中, 随着细菌数量(密度)的增加, 分泌信号分子的浓度也随之增加. 当浓度达到一定阈值时可激发一系列特定基因表达, 以调节细菌的群体行为, 这种现象称为密度感应(quorum sensing, QS). QS系统是细菌之间信号传递的重要机制, 细菌通过感应这些诱导分子来判断菌群密度和周围环境变化, 避免细菌因过度生长而造成空间和营养物质缺乏, 更重要的是通过QS系统共同对周围环境刺激做出反应, 极大提高了整个细菌群体的生存能力[13].
1999年Stark等[14]报道H. pylori在体外具有形成生物膜的能力, Cole等[15]、Cellini等[16]报道H. pylori在体内外环境均具有形成生物膜的能力. 从胃及十二指肠溃疡患者中分离出的H. pylori菌株TK1402在体内外均显示极强的生物膜形成能力[16-20].
H. pylori作为嗜胃黏膜的定植细菌, 本身具有形成生物膜的能力[21,22]. 生物膜可以使H. pylori免受外界环境变换的干扰[18,23], 生物膜可以使H. pylori在不利于繁殖的环境中得以存活, H. pylori生物膜的重要性在于其是致病性的基础[12]. 细菌生物膜的特性决定了其强大的环境适应能力, 具有生物膜形成能力的细菌引起的机体持续性炎症反应和组织损伤被认为是慢性感染形成或恶化的原因[24]. 在细菌生物膜内, 表层菌容易获得营养而易于生长具有生命力(致病性较强), 接近基质的深层菌处于缓慢生长或不生长的休眠静止状态[25]. 本研究免疫组织化学显示, H. pylori可以定植在胃黏膜层表面、胃小凹及较深部位的浅层腺体. 本研究认为, H. pylori形成的生物膜有助于其在胃黏膜上皮存活, 黏膜表面的H. pylori处于生长活跃状态而对外界攻击因素抗生素或铋剂等容易起应答反应, 被杀灭清除; 寄居在黏膜深层的H. pylori处于休眠静止状态而对外界攻击因素不应答, 加之细菌本身生物膜的保护作用, 使H. pylori能够持续存活. 本研究认为可以用细菌深度定植及生物膜理论解释H. pylori相关性胃黏膜病变不易治愈或停药后复发的原因.
本研究结果显示H. pylori在胃黏膜层表面及小凹的感染密度与黏膜炎症程度有相关性(P<0.05), 随着H. pylori感染密度增加, 黏膜炎症程度越重(表1). H. pylori在胃黏膜层表面、小凹及浅层腺体的感染密度与黏膜炎症活动性有相关性(P<0.05), 随着H. pylori感染密度增加, 黏膜炎症活动性越趋明显(表2). 本研究结果表明H. pylori感染密度(数量)不同对胃黏膜损伤的程度亦不同. H. pylori的QS系统具有细菌密度依赖性[25]. H. pylori的QS系统调整细菌生存环境, 益于细菌生长, 结果是细菌本身的致病性增强, 这一过程的开始有赖于细菌的感染数量(密度), H. pylori生物膜对胃黏膜具有致病性[20]. 本研究认为, 依赖H. pylori感染数量形成的QS, 可以产生促进细菌生长, 进一步形成细菌数量递级性增加的效应, 使其致病性更加增强. 藉此可以解释同为H. pylori感染的患者, 但黏膜病变严重程度有异的原因. 另外, H. pylori分泌的细胞外聚合物(extracellular polymeric substance, EPS)可以促进细菌生存和生长, 使细菌逃避机体防御因素和抗菌素的清除作用, 维持了H. pylori的持续感染[12].
H. pylori生物膜的大量黏性基质形成物理屏障, 限制了吞噬细胞呼吸爆发产生的活性氧产物渗透进入生物膜, 导致吞噬细胞无法破坏生物膜内细菌[26]. 包裹细菌的黏性基质以及细菌释放出的抗原性物质刺激机体产生大量的特异性抗体. 这些抗体与可溶性抗原结合形成免疫复合物, 沉积在感染病灶周围, 与黏附菌体诱导胃上皮细胞产生的白介素8(interleukin 8, IL-8), 共同趋化大量中性粒细胞浸润并释放蛋白水解酶[27], 这种免疫复合物效应能引起宿主严重的免疫损害[26,28], 却无法对生物膜内的细菌起作用[24].
根除H. pylori感染对治疗其相关性疾病具有重要价值[29,30], 这一治疗原则已成为全球推荐的治疗指南[31]. 随着抗生素的广泛使用, H. pylori对抗生素耐药问题已呈逐年上升趋势[5], H. pylori对抗生素耐药是导致其根除失败的主要原因[4]. Glupczynski等[32]、史彤等[33]认为耐药菌株出现基因突变是导致H. pylori产生对抗生素耐药的主要原因, 患者在使用抗生素时, 其存在的靶位结构极易出现变化, 使抗菌药物的抗菌作用失效或降低抗菌药物的活性, 因此极易产生耐药情况.
本研究免疫组织化学显示, H. pylori可以定植分布在胃黏膜层的表面、胃小凹及较深部位的浅层腺体. H. pylori生物膜结构的复杂性和其代谢活动造成深层菌不易获得足够的营养和氧气, 结果导致深层菌生长缓慢或处于休眠状态. 大部分抗生素主要针对表层代谢活跃的细菌, 因此深层菌在很大程度上增强了H. pylori生物膜的耐药性[34]. 另外, 由于局部代谢产物的堆积使得深层菌处于偏酸的微环境中, 需要中性理化环境的克拉霉素抗菌活性在偏酸性生物膜深层大大降低. 抗菌药物能够很快地根除表层菌, 停药后, 残存在深层的细菌可迅速繁殖形成新的生物膜, 造成了临床上感染的反复发作, 难以治愈, 也可能导致生物膜对抗菌药物耐受的遗传性[25]. 即使抗生素浸润至黏膜深层, 或许也难以奏效. H. pylori生物膜自身分泌的EPS带有大量阴离子, 通过氢键、共价键、范德华力吸附部分带有阳离子的抗菌药物; 另外, EPS含有多种抗菌药物降解酶, 导致抗菌药物水解和钝化灭活[24]. H. pylori生物膜可以引起耐药株增加[25].
H. pylori在生物膜内的生长繁殖对于其清除治疗是一个危险的内环境. 生物膜内的H. pylori在宿主体内或环境中长期存活、抵抗力增强而且获得毒性增强的基因特性, 这些特性导致H. pylori存活、基因变异、对抗生素耐药性增加和持续感染[12]. 本研究认为, H. pylori生物膜的形成有赖于细菌感染密度(数量), 不同的细菌感染密度可以引起胃黏膜损伤程度的不同, 在胃黏膜层深层定植的H. pylori可以形成新的生物膜并逃避抗生素打击. 对临床初治失败的患者, 除了检测H. pylori耐药基因外, 胃黏膜组织病理学观察H. pylori感染密度及H. pylori在胃黏膜定植深度是有必要的, 籍此分析初治失败的原因, 为拟定抗H. pylori补救方案提供个体化支持依据, 除了使用个体化剂量的质子泵抑制剂、抗生素及铋剂等制剂, 佐以抗生物膜制剂或许是较好的选择.
幽门螺杆菌(Helicobacter pylori, H. pylori)感染密度(数量)与胃黏膜病变严重性有相关性. 细菌生物膜形成有赖于细菌本身的数量, 前者益于细菌生存或导致病变迁延不愈或复发. H. pylori在胃黏膜层不同深度定植, 或许可以逃避抗生素打击. H. pylori生物膜形成与深层定植或许可以解释细菌致病强度的差异及产生对抗生素耐药性的部分机制.
王江滨, 教授, 主任医师, 吉林大学中日联谊医院消化内科, 吉林大学白求恩医学部内科学系; 张炜, 副教授, 主任医师, 江苏大学附属医院消化科
2014年Percival等研究发现H. pylori自身形成的生物膜可以使其在不利于繁殖的环境中得以存活, 生物膜是H. pylori致病性基础并且可以使细菌逃避机体防御因素和抗菌素清除作用, 维持H. pylori持续感染. 生物膜的形成具有细菌感染数量(密度)依赖性. 通过观察H. pylori感染密度与在胃黏膜层不同深度定植对胃黏膜病变的影响, 从生物膜角度探讨H. pylori的致病性和抗生素耐药的形成理论, 则罕有报道.
H. pylori对抗生素耐药是目前临床医生关注的热点, H. pylori株出现基因突变是产生耐药的主要原因. 该研究通过观察H. pylori的感染密度及在胃黏膜层不同深度的定植, 从病理学方面解释了具有细菌数量依赖性的生物膜形成及深层菌休眠状态对胃黏膜损伤的不同强度、抗生素耐药增加及胃黏膜病变反复发作难以治愈的原因.
该研究表明, 对H. pylori感染相关性胃黏膜病变临床初治失败的患者, 除了检测H. pylori耐药基因及抗生素药敏, 还需要从胃黏膜组织病理学方面观察患者H. pylori的感染密度及在胃黏膜层的定植深度, 从而分析初治失败的原因, 为拟定补救方案提供个体化的支持依据.
该研究表明H. pylori感染数量(密度)及在胃黏膜层不同深度的定植与胃黏膜炎症程度和活动性有相关性. 从胃黏膜病理组织学方面解释了H. pylori感染数量对细菌生物膜形成及在胃黏膜层深度定植对抗生素耐药形成的原因, 对于临床H. pylori感染相关性胃黏膜病变初治失败的患者, 需要从H. pylori抗生素耐药基因突变、细菌感染数量及细菌定植深度等方面考虑补救方案的拟定.
编辑: 郭鹏 电编: 都珍珍
| 1. | Kusters JG, van Vliet AH, Kuipers EJ. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 2006;19:449-490. [PubMed] [DOI] |
| 3. | Malfertheiner P, Megraud F, O'Morain C, Bazzoli F, El-Omar E, Graham D, Hunt R, Rokkas T, Vakil N, Kuipers EJ. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report. Gut. 2007;56:772-781. [PubMed] [DOI] |
| 5. | Broutet N, Tchamgoué S, Pereira E, Lamouliatte H, Salamon R, Mégraud F. Risk factors for failure of Helicobacter pylori therapy--results of an individual data analysis of 2751 patients. Aliment Pharmacol Ther. 2003;17:99-109. [PubMed] [DOI] |
| 6. | Kim JM, Kim JS, Jung HC, Kim N, Kim YJ, Song IS. Distribution of antibiotic MICs for Helicobacter pylori strains over a 16-year period in patients from Seoul, South Korea. Antimicrob Agents Chemother. 2004;48:4843-4847. [PubMed] [DOI] |
| 7. | 王 莉, 谢 会忠, 刘 友斌, 符 仲标, 杨 维忠, 王 炳淑, 叶 长华, 陈 桂妃, 刘 昌江. 幽门螺杆菌定植部位和密度对胃黏膜炎症及耐药性的影响. 世界华人消化杂志. 2014;22:2997-3002. [DOI] |
| 8. | Rugge M, Correa P, Dixon MF, Fiocca R, Hattori T, Lechago J, Leandro G, Price AB, Sipponen P, Solcia E. Gastric mucosal atrophy: interobserver consistency using new criteria for classification and grading. Aliment Pharmacol Ther. 2002;16:1249-1259. [PubMed] [DOI] |
| 9. | Karttunen T, Niemelä S, Lehtola J. Helicobacter pylori in dyspeptic patients: quantitative association with severity of gastritis, intragastric pH, and serum gastrin concentration. Scand J Gastroenterol Suppl. 1991;186:124-134. [PubMed] |
| 10. | Whitchurch CB, Tolker-Nielsen T, Ragas PC, Mattick JS. Extracellular DNA required for bacterial biofilm formation. Science. 2002;295:1487. [PubMed] |
| 11. | Costerton JW, Lewandowski Z, DeBeer D, Caldwell D, Korber D, James G. Biofilms, the customized microniche. J Bacteriol. 1994;176:2137-2142. [PubMed] |
| 12. | Percival SL, Suleman L. Biofilms and Helicobacter pylori: Dissemination and persistence within the environment and host. World J Gastrointest Pathophysiol. 2014;5:122-132. [PubMed] [DOI] |
| 13. | Jayaraman A, Wood TK. Bacterial quorum sensing: signals, circuits, and implications for biofilms and disease. Annu Rev Biomed Eng. 2008;10:145-167. [PubMed] [DOI] |
| 14. | Stark RM, Gerwig GJ, Pitman RS, Potts LF, Williams NA, Greenman J, Weinzweig IP, Hirst TR, Millar MR. Biofilm formation by Helicobacter pylori. Lett Appl Microbiol. 1999;28:121-126. [PubMed] |
| 15. | Cole SP, Harwood J, Lee R, She R, Guiney DG. Characterization of monospecies biofilm formation by Helicobacter pylori. J Bacteriol. 2004;186:3124-3132. [PubMed] [DOI] |
| 16. | Cellini L, Grande R, Di Campli E, Di Bartolomeo S, Di Giulio M, Traini T, Trubiani O. Characterization of an Helicobacter pylori environmental strain. J Appl Microbiol. 2008;105:761-769. [PubMed] [DOI] |
| 17. | Yonezawa H, Osaki T, Kurata S, Fukuda M, Kawakami H, Ochiai K, Hanawa T, Kamiya S. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation. BMC Microbiol. 2009;9:197. [PubMed] [DOI] |
| 18. | Yonezawa H, Osaki T, Kurata S, Zaman C, Hanawa T, Kamiya S. Assessment of in vitro biofilm formation by Helicobacter pylori. J Gastroenterol Hepatol. 2010;25 Suppl 1:S90-S94. [PubMed] [DOI] |
| 19. | Yonezawa H, Osaki T, Woo T, Kurata S, Zaman C, Hojo F, Hanawa T, Kato S, Kamiya S. Analysis of outer membrane vesicle protein involved in biofilm formation of Helicobacter pylori. Anaerobe. 2011;17:388-390. [PubMed] [DOI] |
| 20. | Cellini L, Grande R, Di Campli E, Traini T, Giulio MD, Lannutti SN, Lattanzio R. Dynamic colonization of Helicobacter pylori in human gastric mucosa. Scand J Gastroenterol. 2008;43:178-185. [PubMed] [DOI] |
| 21. | Andersen LP. Colonization and infection by Helicobacter pylori in humans. Helicobacter. 2007;12 Suppl 2:12-15. [PubMed] |
| 22. | Percival SL, Thomas JG. Transmission of Helicobacter pylori and the role of water and biofilms. J Water Health. 2009;7:469-477. [PubMed] [DOI] |
| 23. | Azevedo NF, Pinto AR, Reis NM, Vieira MJ, Keevil CW. Shear stress, temperature, and inoculation concentration influence the adhesion of water-stressed Helicobacter pylori to stainless steel 304 and polypropylene. Appl Environ Microbiol. 2006;72:2936-2941. [PubMed] [DOI] |
| 24. | Hall-Stoodley L, Stoodley P. Evolving concepts in biofilm infections. Cell Microbiol. 2009;11:1034-1043. [PubMed] |
| 26. | Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections. Science. 1999;284:1318-1322. [PubMed] |
| 27. | Cole SP, Cirillo D, Kagnoff MF, Guiney DG, Eckmann L. Coccoid and spiral Helicobacter pylori differ in their abilities to adhere to gastric epithelial cells and induce interleukin-8 secretion. Infect Immun. 1997;65:843-846. [PubMed] |
| 29. | Zhou L, Sung JJ, Lin S, Jin Z, Ding S, Huang X, Xia Z, Guo H, Liu J, Chao W. A five-year follow-up study on the pathological changes of gastric mucosa after H. pylori eradication. Chin Med J (Engl). 2003;116:11-14. [PubMed] |
| 30. | Wong BC, Lam SK, Wong WM, Chen JS, Zheng TT, Feng RE, Lai KC, Hu WH, Yuen ST, Leung SY. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial. JAMA. 2004;291:187-194. [PubMed] |
| 32. | Glupczynski Y, Mégraud F, Lopez-Brea M, Andersen LP. European multicentre survey of in vitro antimicrobial resistance in Helicobacter pylori. Eur J Clin Microbiol Infect Dis. 2001;20:820-823. [PubMed] |
| 34. | Lewis K. Multidrug tolerance of biofilms and persister cells. Curr Top Microbiol Immunol. 2008;322:107-131. [PubMed] |