修回日期: 2016-07-12
接受日期: 2016-07-29
在线出版日期: 2016-08-08
目的: 探讨促吞噬肽及其拮抗剂诱导炎性介质肿瘤坏死因子(tumor necrosis factor, TNF)、白介素-1(interleukin-1, IL-1)释放在急性胰腺炎(acute pancreatitis, AP)病情发展中的作用.
方法: SD大鼠5组每组24只, 分别为对照组、促吞噬肽组、AP组、AP+促吞噬肽组、AP+促吞噬肽拮抗剂组. 4%牛磺胆酸钠经胆胰管内注射建立AP模型, 促吞噬肽及其拮抗剂组(75 μg/kg)于模型建立后20 min后从股静脉注入. 按随机原则在制模后3、6、12 h处死, 甲醛固定胰腺组织行HE染色观察胰腺病理变化; 分离血清ELISA法测定IL-1和TNF浓度.
结果: AP各组TNF、IL-1浓度均比对照组明显升高; AP+促吞噬肽组各时间段TNF、IL-1浓度均较单纯AP组升高; AP+促吞噬肽拮抗剂组在制模后6、12 h TNF、IL-1浓度明显降低, 在制模后3 h无明显影响; AP模型病理学评分与TNF浓度、IL-1浓度存在正相关关系.
结论: 在大鼠AP模型中促吞噬肽使TNF、IL-1浓度升高, 胰腺炎症反应加重; 应用促吞噬肽拮抗剂可减少TNF、IL-1释放, 使胰腺炎症反应减轻.
核心提示: 促吞噬肽及其抑制剂可诱导炎性介质释放, 目前没有研究表明两者在急性胰腺炎(acute pancreatitis, AP)的发展过程中是如何起作用的. 本文通过对大鼠AP模型进行相关干预, 证明促吞噬肽及其抑制剂通过影响肿瘤坏死因子、白介素-1浓度来影响AP程度.
引文著录: 魏强, 成雨, 朱文涛, 吕潇童, 欧琨, 陈强谱. 促吞噬肽及其拮抗剂诱导炎性介质释放在急性胰腺炎中的作用与机制. 世界华人消化杂志 2016; 24(22): 3404-3409
Revised: July 12, 2016
Accepted: July 29, 2016
Published online: August 8, 2016
AIM: To investigate the role of tuftsin and its inhibitor in acute pancreatitis (AP).
METHODS: Twenty-four SD rats were randomly divided into five groups: a blank control group, a tuftsin group, an AP group, an AP + tuftsin group, and an AP + tuftsin inhibitor group. AP was induced in rats by injecting sodium taurocholate in the pancreatic duct. Tuftsin or its inhibitor (75 μg/kg) was injected via the femoral vein at 20 min after model induction. At 3, 6, and 12 h after model induction, pancreatic samples were taken for HE staining to detect pancreatic pathology, and serum samples were taken for tumor necrosis factor (TNF) and interleukin-1 (IL-1) measurement by ELISA.
RESULTS: Serum levels of TNF and IL-1 were significantly higher in the AP group than in the control group, and in the AP + tuftsin group than in the AP group. Serum levels of TNF and IL-1 were significantly decreased in the AP + tuftsin inhibitor group at 6 h and 12 h, but showed no significant change at 3 h. Correlation analysis showed that serum levels of TNF/IL-1 were positively correlated with pancreatic pathology.
CONCLUSION: Tuftsin accelerates the deve-lopment of AP by inducing TNF and IL-1. The inhibitor of tuftsin can alleviate AP by downregulating TNF and IL-1.
- Citation: Wei Q, Cheng Y, Zhu WT, Lv XT, Ou K, Chen QP. Role of tuftsin and its inhibitor in progression of acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2016; 24(22): 3404-3409
- URL: https://www.wjgnet.com/1009-3079/full/v24/i22/3404.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i22.3404
急性胰腺炎(acute pancreatitis, AP)是常见急腹症, 并发症多, 死亡率高, 其具体机制尚不十分清楚[1], 炎性介质诱导的炎症反应导致的胰腺水肿和腺泡坏死是AP加重的重要原因[2,3]. 促吞噬肽为脾脏合成的四肽, 具有促进吞噬和调节免疫的作用[4,5]. 其拮抗剂与促吞噬肽竞争同一受体而起到抑制作用. 已有研究[6]表明, AP时促吞噬肽促使胰腺微血栓数量增加, 加重了AP病情发展, 但促吞噬肽及其拮抗剂是如何影响炎性介质的释放, 以及在AP的病情发展中起何作用, 目前尚无报道. 本课题通过建立大鼠AP模型, 对促吞噬肽及其拮抗剂对炎性介质的释放在AP中的影响进行研究.
SD大鼠120只体质量210 g±27 g, 随机分为5组, 每组24只. A: 对照组; B: 促吞噬肽组; C: AP组; D: AP+促吞噬肽组; E: AP+促吞噬肽拮抗剂组. B、C、D组分别在制模20 min后股静脉注入促吞噬肽和拮抗剂75 μg/kg, 其他组注入生理盐水. 97%牛磺胆酸钠(092k5323)和促吞噬肽(110k13301)购自美国Sigma公司, 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1(interleukin-1, IL-1)试剂盒购自Santa Cruz公司.
1.2.1 AP模型的建立: 1%戊巴比妥钠(0.3 mL/100 g)腹腔麻醉后, 采用肠壁穿刺逆行胰胆管注射建立AP模型[7]: 用钝性细针头通过十二指肠壁经乳头插入胆胰管, 夹闭肝门处的胆总管及针头插入部位的胆胰管. 向胆胰管内注射4%牛磺胆酸钠溶液(0.1 mL/100 g), 抽出针头的同时夹闭胆胰管, 5 min后松开.
1.2.2 标本留取及检测: 每组在模型建立3、6、12 h后随机分3批处死、每批8只, 胰腺组织甲醛固定HE染色观察胰腺病理改变、心脏取血分离血清储存于-20 ℃供TNF和IL-1测定. 动物胰腺病变程度评分标准参考1997年Rongione建立的标准[5], ELISA法检测血清TNF和IL-1浓度.
统计学处理 采用Graph Pad Prism软件对数据进行统计学分析. t-test用于比较2个组之间的可数变量结果. Spearman correlation analysis用于判断2个变量之间的相关性. P<0.05为差异具有统计学意义.
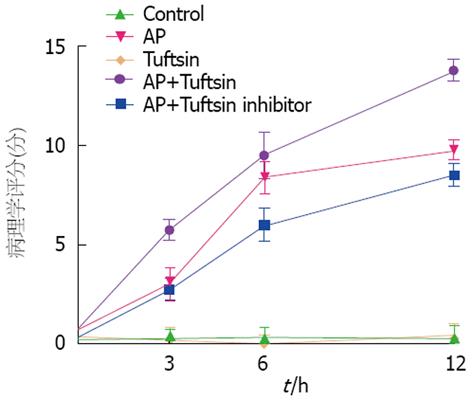
制模3 h后可见胰腺组织水肿、淡黄色腹水, 镜下见胰腺腺泡轻度肿胀、少量炎性细胞浸润; 制模6 h后胰腺及胰周组织点状出血、淡血性腹水, 镜下见腺泡细胞肿胀、坏死, 大量炎性细胞浸润, 渗出明显、间质出血; 12 h后胰腺组织片状坏死、胰周组织皂化斑、血性腹水, 镜下腺泡灶性坏死、小叶轮廓不清、大量炎性细胞浸润、间质弥漫性出血(图1). AP模型胰腺病理改变明显加重; AP+促吞噬肽组各时间段较AP组病理学评分明显升高; AP+促吞噬肽拮抗剂组在6、12 h明显减轻胰腺病理改变程度(图2).
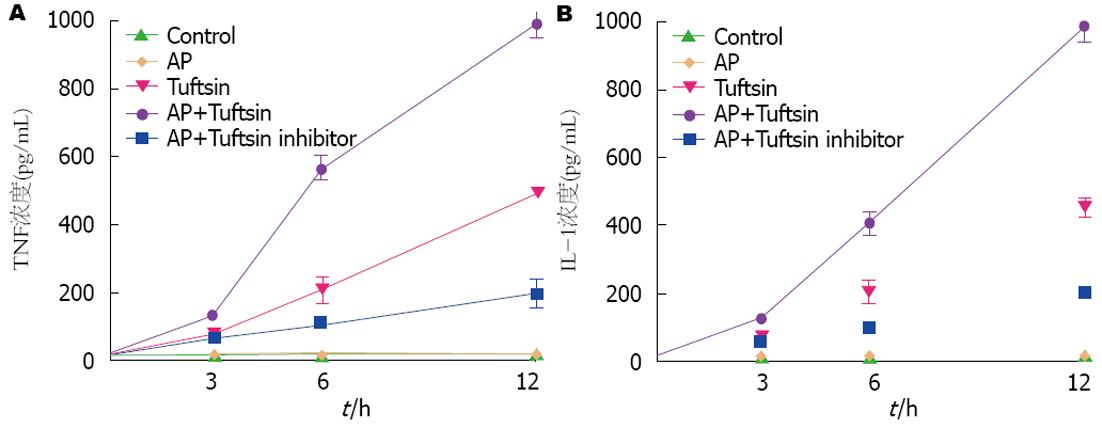
制模后各组在不同时间段TNF、IL-1浓度均比对照组明显升高; AP+促吞噬肽组各时间段TNF、IL-1浓度均较单纯AP组升高; AP+促吞噬肽拮抗剂组在制模后6、12 h TNF、IL-1浓度明显降低, 在制模后3 h对TNF、IL-1浓度无明显影响(图3).
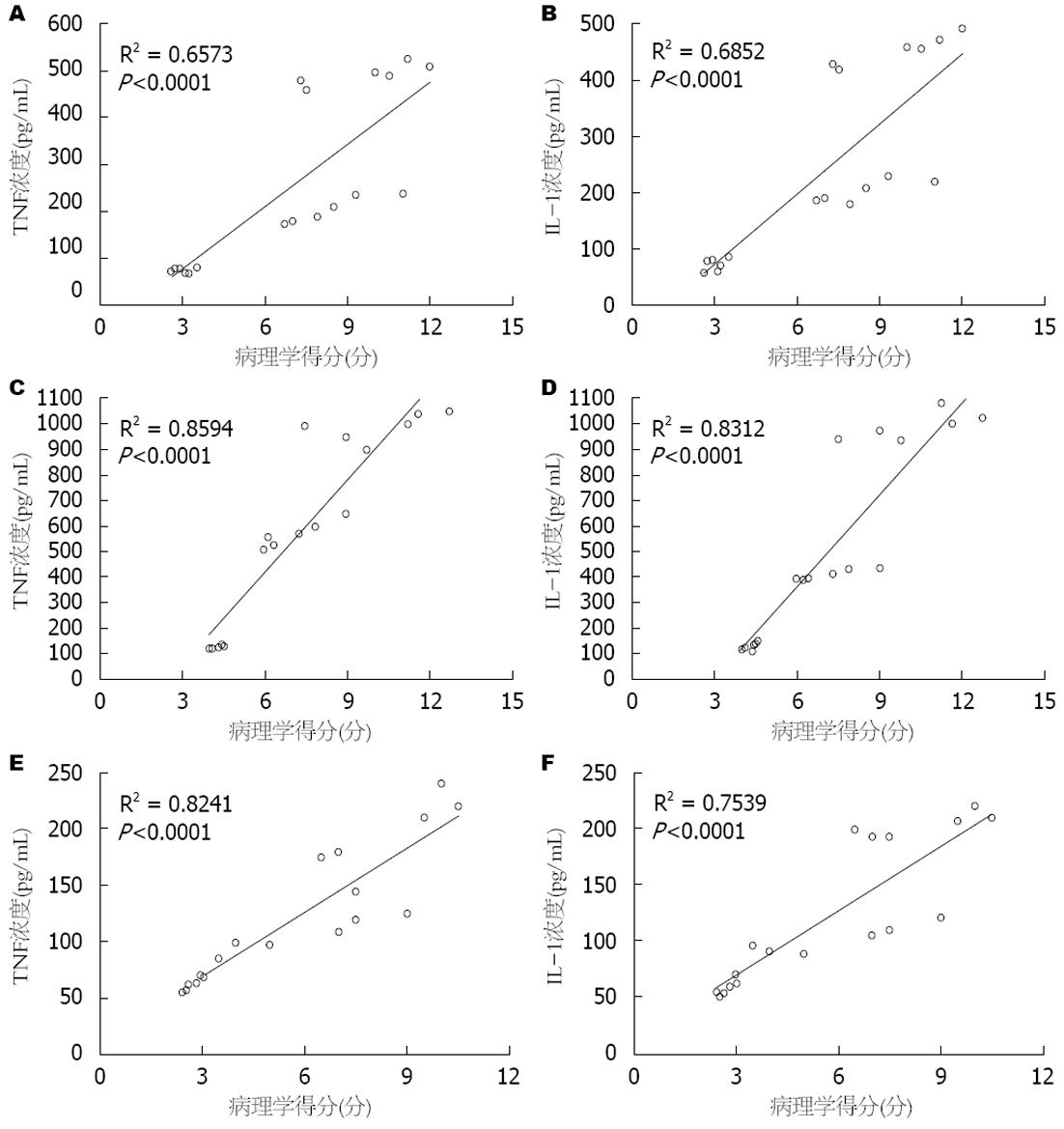
AP组、AP+促吞噬肽组和AP+促吞噬肽拮抗剂组中, 在3、6和12 h各个时间段病理学评分与TNF浓度、IL-1浓度存在正相关关系(图4).
AP并发症多, 死亡率高, 具体发病机制尚未完全阐明[8]. Rongione等[9]认为AP的进展与一些细胞介质参与有关. 炎性介质因子TNF、IL-1等引起的全身性炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)加重了AP病情发展.
促吞噬肽作为脾脏分泌生理活性物质, 具有促进吞噬和调节免疫作用. 吞噬细胞、多形核细胞等多种细胞的细胞膜上有促吞噬肽的特异性受体, 促吞噬肽是通过其靶细胞膜受体(Nrp1受体)的介导而发挥生物学活性的, 当这些细胞上的特异性受体与促吞噬肽结合后发挥促吞噬、杀菌作用[10]. 促吞噬肽拮抗剂则与促吞噬肽竞争细胞膜上的特异性受体, 而起到抑制作用. 雷新等[11]应用苏氨酸、赖氨酸、脯氨酸、精氨酸等氨基酸固相法合成促吞噬肽拮抗剂, 其纯度很高. 国内研究[12]发现在创伤应激下动物注射促吞噬肽后细胞因子和炎性介质显著升高, 相关分析结果表明促吞噬肽与TNF、IL-1呈中度正相关. 本实验结果发现在应用外源性促吞噬肽后胰腺炎症病理学改变明显加重, TNF及IL-1浓度明显升高; 应用促吞噬肽拮抗剂减少机体促吞噬肽量时TNF及IL-1浓度明显降低, 并应用相关分析发现在制模后6、12 h 胰腺炎症严重阶段病变严重程度与TNF及IL-1浓度呈正相关, 表明这些炎性介质加重胰腺炎病情发展. 这也与国内外报道一致. TNF在AP中作用机制为: (1)TNF-α促进白细胞的聚集和活化和渗出, 释放PAF、NO、氧自由基, 引起毛细血管渗漏及组织损伤[13]; (2)改变血栓调理素表达, 促进微循环内血栓形成. 本实验显示在应用外源性促吞噬肽后血清TNF、IL-1浓度明显升高, 胰腺炎病变程度明显加重, 即使在制模后3 h胰腺炎症轻微阶段这种变化也非常明显; 在制模后3 h胰腺炎症轻微阶段, 应用促吞噬肽拮抗剂减少tuiftsin的量对TNF、IL-1浓度无明显影响, 在6、12 h胰腺出血坏死阶段, 血清TNF、IL-1浓度明显降低, 从而使AP病情明显减轻. IL-1在AP中的机制作用为: (1)IL-1可上调细胞黏附分子而促进中性粒细胞黏附和聚集, 诱发其他炎症细胞因子(TNF-α、IL-6)的产生, 参与急性胰腺MODS的发展[14,15]; (2)IL-1可直接刺激胰酶产生和激活, 加剧胰腺腺泡细胞坏死[16]. 本组应用相关分析证实加入外源性促吞噬肽后TNF及IL-1释放明显增加, 胰腺炎病变程度明显加重, 两者存在正相关关系. 表明在AP发病过程中, 外源性促吞噬肽促进了炎细胞因子TNF、IL-1等所产生的一系列连锁反应和放大反应, 使胰腺组织对炎性介质的反应更为敏感, 加重了SIRS和MOSF, 使AP病情恶化.
本实验证实了在AP病情发展过程中, 促吞噬肽使TNF、IL-1浓度升高, 胰腺炎症反应加重; 应用促吞噬肽拮抗剂可减少TNF、IL-1释放, 使胰腺炎症反应减轻, 从而减轻或阻止AP病情发展, 对AP发病机制有了进一步认识.
急性胰腺炎(acute pancreatitis, AP)发生、发展过程中伴有不同程度的局部或全身炎症反应, 多种炎症介质在此过程中起重要作用. 目前对促吞噬肽及其抑制剂的研究发现两者可诱导炎性介质释放, 促吞噬肽是否通过炎性介质影响AP发展, 还有待进一步研究.
郑盛, 副教授, 副主任医师, 云南省第三人民医院消化内科
肿瘤坏死因子(tumor necrosis factor, TNF)、白介素-1(interleukin
-1, IL-1)是重要的炎症因子, 在AP的发展过程中也起重要作用. 本研究发现促吞噬肽增加了TNF、IL-1浓度, 从而使AP病理学评分升高, 而其抑制剂减少了TNF、IL-1浓度, 减少了胰腺炎病理学评分. 首次证实促吞噬肽-炎性介质-AP之间关系.
既往成雨研究了促吞噬肽通过影响微循环改变形成微血栓加重AP病情发展, 本研究通过促吞噬肽及其抑制剂控制炎症介质释放, 进一步证实了TNF、IL-1等炎症因子浓度增加可加重AP病情发展, 进一步的从另一方面阐述了促吞噬肽影响AP病情发展的机制.
促吞噬肽及其拮抗剂是如何影响炎性介质的释放, 以及在AP的病情发展中起何作用, 目前尚无报道. 本课题通过建立大鼠AP模型, 对促吞噬肽及其拮抗剂对炎性介质的释放在AP中的影响进行研究.
AP发展过程中的炎症介质释放是加重胰腺炎程度、导致AP并发症多、死亡率高的原因之一, 研究相关控制炎症介质释放的因素可为AP的治疗、降低并发症发生率、降低死亡率提供依据.
动物胰腺病变程度评分: 参考Rongione标准, 从水肿、炎症、血栓、坏死四个方面评价胰腺改变程度.
本文探讨了促吞噬肽在AP发生发展中的作用, 具有较好的创新性. 且本文内容完整, 可读性强, 具有一定学术价值, 在研究AP的发展过程中起重要作用, 为AP的治疗提供了思路.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:闫晋利
| 1. | Bumbasirevic V, Radenkovic D, Jankovic Z, Karamarkovic A, Jovanovic B, Milic N, Palibrk I, Ivancevic N. Severe acute pancreatitis: overall and early versus late mortality in intensive care units. Pancreas. 2009;38:122-125. [PubMed] [DOI] |
| 2. | Perides G, Weiss ER, Michael ES, Laukkarinen JM, Duffield JS, Steer ML. TNF-alpha-dependent regulation of acute pancreatitis severity by Ly-6C(hi) monocytes in mice. J Biol Chem. 2011;286:13327-13335. [PubMed] [DOI] |
| 4. | Jain S, Amiji M. Tuftsin-modified alginate nanoparticles as a noncondensing macrophage-targeted DNA delivery system. Biomacromolecules. 2012;13:1074-1085. [PubMed] [DOI] |
| 7. | 张 明钧, 姚 玮艳, 乔 敏敏, 诸 琦, 袁 耀宗. 肠壁穿刺逆行胰胆管注射牛黄胆酸钠重症急性胰腺炎造模. 上海交通大学学报(医学版). 2006;26:488-490. |
| 8. | Raraty MG, Connor S, Criddle DN, Sutton R, Neoptolemos JP. Acute pancreatitis and organ failure: pathophysiology, natural history, and management strategies. Curr Gastroenterol Rep. 2004;6:99-103. [PubMed] [DOI] |
| 9. | Rongione AJ, Kusske AM, Kwan K, Ashley SW, Reber HA, McFadden DW. Interleukin 10 reduces the severity of acute pancreatitis in rats. Gastroenterology. 1997;112:960-967. [PubMed] |
| 10. | Nissen JC, Selwood DL, Tsirka SE. Tuftsin signals through its receptor neuropilin-1 via the transforming growth factor beta pathway. J Neurochem. 2013;127:394-402. [PubMed] [DOI] |
| 13. | Kingsnorth A. Role of cytokines and their inhibitors in acute pancreatitis. Gut. 1997;40:1-4. [PubMed] |
| 14. | Lahiri T, Laporte JD, Moore PE, Panettieri RA, Shore SA. Interleukin-6 family cytokines: signaling and effects in human airway smooth muscle cells. Am J Physiol Lung Cell Mol Physiol. 2001;280:L1225-L1232. [PubMed] |
| 15. | Abliz A, Deng W, Sun R, Guo W, Zhao L, Wang W. Wortmannin, PI3K/Akt signaling pathway inhibitor, attenuates thyroid injury associated with severe acute pancreatitis in rats. Int J Clin Exp Pathol. 2015;8:13821-13833. [PubMed] |
| 16. | Li D, Li J, Wang L, Zhang Q. Association between IL-1β, IL-8, and IL-10 polymorphisms and risk of acute pancreatitis. Genet Mol Res. 2015;14:6635-6641. [PubMed] [DOI] |