修回日期: 2016-07-04
接受日期: 2016-07-11
在线出版日期: 2016-07-28
目的: 探讨LKB1在胃癌发生中的作用及相关分子机制研究, 为胃癌化疗药物的研发提供一定的理论基础.
方法: 利用LKB1过表达质粒以及LKB1 siRNA转染人胃癌细胞株SGC7901, 实时荧光定量PCR及Western blot检测质粒以及siRNA转染效果, 流式细胞术检测LKB1过表达以及干扰后的SGC7901细胞(血清饥饿处理2 h)凋亡数量. 活性氧检测试剂盒检测LKB1对SGC7901细胞内ROS产生的影响. MTT法检测NAC抑制细胞内ROS产生后LKB1过表达以及干扰后SGC7901细胞数量的改变. Western blot检测LKB1过表达以及干扰后SGC7901细胞中凋亡相关蛋白的表达水平.
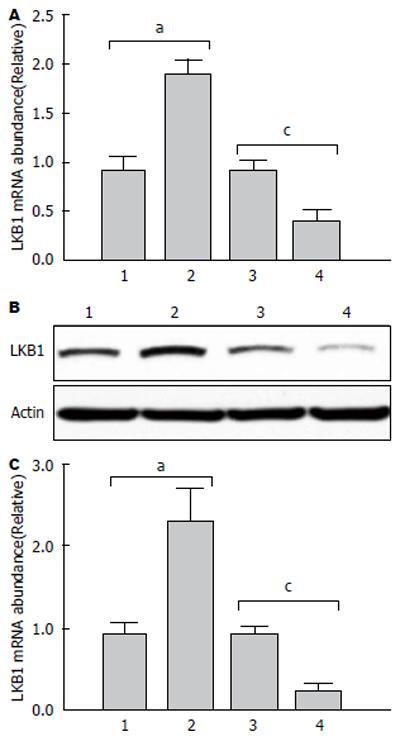
结果: LKB1过表达质粒转染后的人胃癌细胞株SGC7901细胞凋亡增加, 胞内ROS产生增加, LKB1过表达后的SGC7901细胞凋亡则明显增多(3.54% vs 1.29%), 转染LKB1 siRNA的人胃癌细胞株SGC7901早期凋亡和晚期凋亡的细胞数量占总数较转染scramble siRNA组明显减少(0.54% vs 1.39%). 同时Western blot检测发现LKB1过表达后的SGC7901细胞中剪切型Caspase3表达明显升高上升3.12倍, 较对照组差异有统计学意义, 而siRNA干扰后剪切型Caspase3表达则表现为相反的趋势.
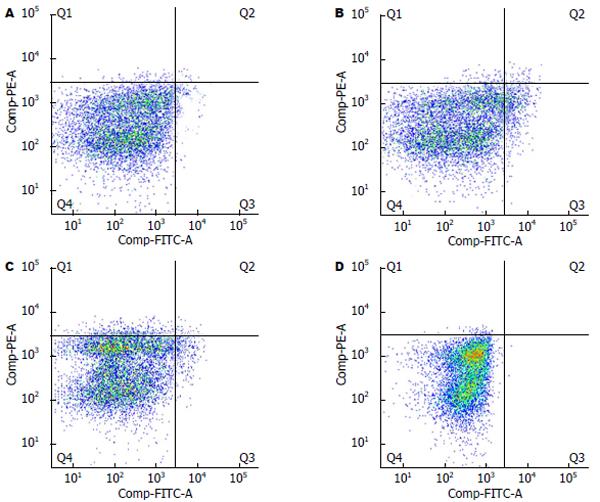
结论: LKB1通过促进ROS的产生, 上调剪切型Caspase3介导的凋亡通路促进胃癌细胞凋亡, 因此LKB1在胃癌发生发展过程中具有重要抑制作用, 其可能作为胃癌化疗药物研发的重要目标分子.
核心提示: LKB1不仅可以抑制胃癌细胞的增殖, 而且可抑制胃癌组织的血管化, 抑制癌细胞的生长和转移, 在抑制肿瘤发生和发展方面具有重要作用.
引文著录: 陶海云, 屈中玉, 魏光敏, 盛晶, 王文廉, 万里新. LKB1对胃癌细胞增殖、凋亡的影响及相关分子实验. 世界华人消化杂志 2016; 24(21): 3262-3269
Revised: July 4, 2016
Accepted: July 11, 2016
Published online: July 28, 2016
AIM: To explore the role of LKB1 in gastric cancer cells and the related mechanism.
METHODS: Real-time PCR and Western blot were used to detect the expression of LKB1 in SGC7901 cells carrying LKB1 expression vector or siRNA against LKB1. Flow cytometry was used to detect the apoptosis of SGC7901 cells after LKB1 overexpression or knockdown. Reactive oxygen detection kits were applied to detect the impact of LKB1 on ROS production. MTT method was used to determine intracellular ROS production after NAC inhibition. Western blot was used to detect the expression of apoptosis related proteins in SGC7901 cells after LKB1 overexpression or knockdown.
RESULTS: LKB1 expression was efficiently enhanced or silenced by LKB1 expression vector or siRNA against LKB1, respectively. The number of SGC7901 cells decreased as its proliferation rate decreased and apoptosis rate increased (3.54% vs 1.29%). Intracellular ROS production was increased but blunted by the use of NAC. The apoptosis of SGC7901 cells was significantly reduced following the inhibition of intracellular ROS, but the siRNA transfected group exhibited an opposite trend. Western blot analysis showed that LKB1 overexpression up-regulated the expression of cleaved Caspase3 in SGC7901 cells significantly (about 3.12 times), compared with control cells, but the expression of cleaved Caspase3 in the siRNA transfected group was decreased.
CONCLUSION: LKB1 raises the production of ROS and up-regulates the expression of cleaved Caspase3 to promote gastric cancer cell apoptosis. Hence, LKB1 plays an important role in the development of gastric cancer and it may be a valuable target for chemotherapy of gastric cancer.
- Citation: Tao HY, Qu ZY, Wei GM, Sheng J, Wang WL, Wan LX. Role of LKB1 in proliferation and apoptosis of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2016; 24(21): 3262-3269
- URL: https://www.wjgnet.com/1009-3079/full/v24/i21/3262.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i21.3262
胃癌是人类最常见的恶性肿瘤之一, 流行病学调查显示胃癌的发病和年龄[1]、感染幽门螺杆菌[2]、霉菌毒素和亚硝酸盐的摄入量、吸烟等因素有关, 但由于胃癌的病因复杂, 因此胃癌的治疗亦较为棘手, 需要多方面治疗[3], 包括手术、放疗和化疗[4-6]. 目前胃癌的发病机制尚不明确, 胃癌的发生涉及多种的突变, 因此, 癌基因和抑癌基因在胃癌发生中的作用也成为许多探究胃癌的发病机制以及转移复发机制相关研究的热点问题[7], 许多癌基因和抑癌基因如P53、PTEN、LKB1等成为胃癌化疗药物研发的重要目标[8-10].
LKB1基因可编码具有丝/苏氨酸蛋白激酶活性的蛋白, 在细胞内广泛存在, 调节多种细胞生理病理过程, 研究发现LKB1蛋白激酶不仅可以调节细胞能量代谢[11]、维持细胞骨架以及细胞极性、细胞周期, 而且在细胞生长增殖、自噬[12]、凋亡[13]中具有一定的抑制作用, 其作为一个较为普遍的抑癌基因, 在许多肿瘤疾病中存在LKB1的基因突变, 如肝癌, 结肠癌、乳腺癌以及上皮细胞性癌症中[14]基因. 对于LKB1在肿瘤发生中的作用, 目前有研究显示在果蝇模型总观察到LKB1依赖Caspase3途径介导细胞凋亡, 同时伴随着线粒体释放细胞色素γ诱导氧化应激[14]. LKB1作为主要的抑癌基因之一[15], 但其在胃癌中的抑癌机制和Caspase途径以及ROS的产生之间的机制关联目前尚不完全清楚, 本研究旨在探究LKB1在胃癌中的表达及其和Caspase途径以及ROS的产生之间的机制关联, 探究LKB1蛋白在胃癌治疗中的临床应用价值.
DMEM培养基、Lipo-fectamin 2000、Hanks平衡盐缓冲溶液(HBSS)和TRIzol购自Thermo公司; 胎牛血清、剪切型Caspase3抗体以及actin抗体购自上海银海圣生物科技有限公司. NAC购自sigma公司, M-MLV逆转录试剂盒购自Invitrogen公司; 实时荧光定量PCR荧光染料SYBR Green Supermix购自美国BIORAD公司; LKB1、actin实时荧光定量PCR引物均由上海生工公司合成, 引物序列如表1. LKB1过表达质粒经上海生工公司测序鉴定, LKB1 siRNA设计合成于上海吉玛有限公司, 人胃癌细胞株SGC7901购自上海生命科学院细胞研究所, Annexin V-FITC/PI细胞凋亡检测试剂盒和MTT试剂盒购自南京建成生物有限公司. ROS试剂盒购自上海碧云天有限公司.
| 基因名称 | 引物序列 |
| LKB1 | Forward: ACTTGACTGATCGCTAAGGTTGCT |
| LKB1 | Reverse: ACCCTACCATGTGGCATCGTCTGACCT |
| actin | Forward: ACTCACATGTGGTCCTGCTCCTGC |
| actin | Reverse: TGAATTGCCCCTGTGGACTATGAC |
1.2.1 人胃癌细胞株SGC7901培养: 人胃癌细胞株SGC7901用DMEM培养基静置培养于37 ℃、含50 mL/L二氧化碳的细胞培养箱中, DMEM培养基中添加有10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素. 当细胞汇聚密度约80%时用Trypsin-EDTA消化2 min左右以1:3比例传代.
1.2.2 构建LKB1过表达质粒: 在PubMed上查找LKB1基因序列, 使用Primer Premier 5.0设计引物, 扩增该表达序列. 设计引物序列如下: sense 5'-TACTGGATCTTCGCTATCGT-3'; anti-sense 5'-TTGGCCTCCACGCATGCT-3'. 将扩增片段用XhoⅠ和EcoRⅠ酶切, 同时用上述酶切载体pcDNA3.1, 最后将酶切后的扩增片段和载体用T4DNA连接酶连接. 基因测序验证克隆质粒.
1.2.3 质粒以及siRNA转染: 将人胃癌细胞株SGC7901中制作成细胞悬液, 接种于24孔细胞板中, 分为4组, 分别为LKB1过表达组, 对照质粒组, LKB1干扰组, scramble siRNA组. 转染方法参照Lipo-fectamin 2000说明书操作, 转染6 h后换液, 转染36h后实时荧光定量PCR及Western blot检测质粒过表达效果以及siRNA的干扰效果.
1.2.4 流式细胞术检测发现LKB1过表达后的SGC7901细胞凋亡数量: 转染步骤同上. 将转染36 h后的SGC7901细胞去除培养基, 换为Hanks平衡盐缓冲溶液(HBSS), 对细胞饥饿处理2 h, 最后将细胞消化为单细胞悬液, 离心, 1500 r/min×5 min, 弃上清液. 加入PI(工作浓度50 μg/mL)于500 μL 1×PBS中, 室温避光孵育30 min. 然后加入Annexin V-FITC, 染色5 min, 在流式机器中上机检测细胞的凋亡数量.
1.2.5 活性氧检测试剂盒: LKB1质粒以及LKB1 siRNA转染SGC7901细胞36 h后, 按照1∶1000用无血清培养液稀释DCFH-DA, 使终浓度为10 μmol/L, 37 ℃细胞培养箱内孵育20 min. 每隔3-5 min颠倒混匀一下, 使探针和细胞充分接触. 用无血清细胞培养液洗涤细胞3次, 以充分去除未进入细胞内的DCFH-DA. 搜集细胞, 然后使用570 nm激发波长检测两组细胞的荧光的强弱, 检测LKB1对细胞中ROS的含量的影响.
1.2.6 MTT法检测NAC抑制后SGC7901细胞数量: LKB1质粒以及LKB1 siRNA转染SGC7901细胞36 h后, 在12孔细胞板中每孔加入20 μL 5 mg/mL MTT溶液, 避光继续孵育4 h后每孔加入100 μL DMSO充分融解结晶物, 在酶联免疫检测仪570 nm处测量各孔的吸光值, 计算细胞的相对数量的变化.
1.2.7 Western blot检测LKB1过表达后SGC7901细胞内相关分子的表达: 提取细胞总蛋白, 测量蛋白浓度, 然后进行蛋白样品电泳、转膜、封闭、一抗孵育、二抗孵育、胶片的压片检测、凝胶图象分析剪切型Caspase3的表达变化.
统计学处理 数据采用SPSS16.0软件进行分析, 计量结果以"mean±SD"表示, 两组间比较采用方差齐性t检验, P<0.05表示差异有统计学意义.
为了检测LKB1质粒的表达效果, 提取质粒以及siRNA转染36 h后的人胃癌细胞株SGC7901总RNA和蛋白, 分别进行实时荧光定量PCR及Western blot检测LKB1质粒的表达情况如图1. 转染LKB1质粒的人胃癌细胞株SGC7901无论在mRNA水平还是蛋白水平均较对照组显著升高, 而转染LKB1 siRNA组LKB1的表达在mRNA水平和蛋白水平均较转染scramble siRNA组低, 这表明LKB1过表达质粒过表达效果以及LKB1 siRNA的干扰效果显著.
为了检测LKB1质粒的表达效果, 收集转染36 h后且饥饿处理的的人胃癌细胞株SGC7901进行流式细胞术检测LKB1的表达对细胞数量凋亡的影响图2所示. 转染LKB1质粒的人胃癌细胞株SGC7901早期凋亡和晚期凋亡的细胞数量占总数的3.54%, 较质粒对照组(1.29%)差异具有显著的统计学意义(图2A, B). 转染LKB1 siRNA的人胃癌细胞株SGC7901早期凋亡和晚期凋亡的细胞数量占总数的0.54%, 较转染scramble siRNA组(1.39%), 差异具有显著的统计学意义(图2C, D).
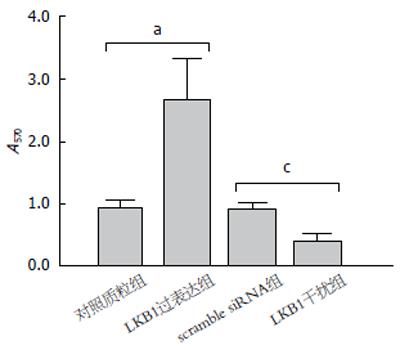
检测LKB1对胃癌细胞株SGC7901中ROS产生的影响如图3所示, LKB1过表达可显著促进细胞内ROS的产生, 而siRNA干扰LKB1表达后ROS产生减少, 差异具有显著的统计学意义.
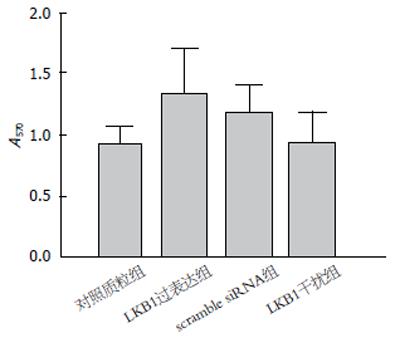
当NAC抑制SGC7901细胞内ROS的产生, MTT法检测SGC7901细胞数量发现细胞数量变化, 发现LKB1过表达组较对照质粒组, LKB1干扰组较scramble siRNA组差异均无统计学意义(图4).
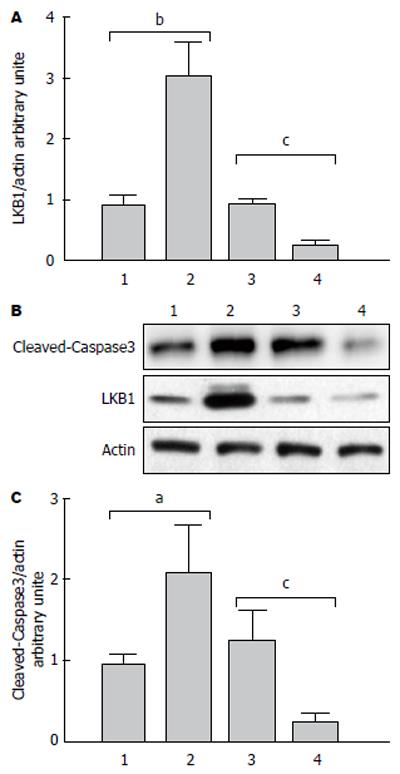
LKB1过表达后SGC7901细胞内剪切型Caspase3的表达明显上调, 上调约3.12倍, 差异有显著的统计学意义(P<0.05), 当siRNA干扰LKB1表达后SGC7901细胞内剪切型Caspase3的表达明显下调, 差异有统计学意义(图5).
LKB1在人类所有组织中均有表达, 尤其在肝脏、胃、小肠、胰腺中表达较多, LKB1具有多个氨基酸残基可被磷酸化, 同时LKB1的激酶区域又可磷酸化其他底物, 通过磷酸化调控相关信号通路[16]. 在细胞能量供应下降时, LKB1可磷酸化激活AMP激活的蛋白激酶(AMP-activated protein kinase, AMPK)[17], 通过调控代谢过程的多个关键酶, 降低耗能的合成代谢, 促进分解代谢, 抑制合成代谢, 重建细胞能量稳态[18,19]. 此外LKB1还可抑制mTORC1信号通路[20], 下调AREBP1活性, 抑制脂类生成. LKB1抑制糖脂合成的作用亦是LKB1抑癌机制的一部分[21], LKB1可作用于肿瘤细胞, 抑制癌细胞的生长和转移[22]. 此外LKB1通过抑制mTORC1信号通路调控细胞生长和细胞周期[23,24].
本研究发现LKB1过表达质粒转染后的人胃癌细胞株SGC7901细胞增殖减少, 凋亡增加, 由流式细胞术结果和ROS检测结果可知, LKB1过表达可促进细胞内ROS的产生以及细胞凋亡, 那么LKB1对细胞凋亡的调控是否是通过促进ROS的产生呢? 为此, 我们利用NAC抑制SGC7901细胞内ROS的产生, 发现细胞凋亡数量较对照组无显著差异, 这表明LKB1即通过促进细胞内ROS的产生促进胃癌细胞的凋亡. LKB1促进细胞的凋亡, 那么具体哪些分子介导LKB1对凋亡的调控呢? 首先我们在蛋白水平检测了凋亡标志性蛋白剪切型Caspase3的表达变化. 发现LKB1过表达后SGC7901细胞内剪切型Caspase3的表达明显上调, 这表明LKB1通过促进ROS的产生, 上调剪切型Caspase3介导的凋亡通路促进胃癌细胞凋亡, 因此LKB1在胃癌发生发展过程中具有重要抑制作用, 其可能作为胃癌化疗药物研发的重要目标分子.
此外有研究表明LKB1可参与调控微管稳定性[25], 进而影响细胞极性[26]. LKB1通过多种途径调控细胞极性的改变, 如LKB1可磷酸化Emk维持细胞极性[27], 可磷酸化细胞极性调节激酶MARK[28], 甚至有研究发现LKB1直接磷酸化肌球蛋白轻链和细胞骨架连接蛋白Ezrin[29,30], 直接改变细胞极性. 因此下一步我们经进一步探究LKB1在胃癌细胞极性调控中的作用以及意义.
总之, LKB1不仅可以抑制胃癌细胞的增殖, 而且可抑制胃癌组织的血管化, 抑制癌细胞的生长和转移, 在抑制肿瘤发生和发展方面具有重要作用, 因此需要进一步探究其在胃癌血管生成及转移中的作用, 不仅为治疗胃癌的生长转移提供理论依据, 而且进一步发展可调控LKB1活性、及早干预肿瘤生长与转移的药物, 改善胃癌患者的愈后.
LKB1基因可编码具有丝/苏氨酸蛋白激酶活性的蛋白, 在细胞内广泛存在, 调节多种细胞生理病理过程, 其作为一个较为普遍的抑癌基因, 在许多肿瘤疾病中存在LKB1的基因突变.
杨金娥, 副教授, 中山大学生命科学大学院
目前LKB1对胃癌细胞凋亡的影响及机制尚不清楚, 因此本文研究有一定的创新性.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 河南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 于明茜 电编:都珍珍
| 1. | Ahmad A, Khan H, Cholankeril G, Katz SC, Somasundar P. The impact of age on nodal metastases and survival in gastric cancer. J Surg Res. 2016;202:428-435. [PubMed] [DOI] |
| 2. | Laird-Fick HS, Saini S, Hillard JR. Gastric adenocarcinoma: the role of Helicobacter pylori in pathogenesis and prevention efforts. Postgrad Med J. 2016; May 24. [Epub ahead of print]. [PubMed] [DOI] |
| 3. | Kilic L, Ordu C, Yildiz I, Sen F, Keskin S, Ciftci R, Pilanci KN. Current adjuvant treatment modalities for gastric cancer: From history to the future. World J Gastrointest Oncol. 2016;8:439-449. [PubMed] [DOI] |
| 4. | Boniface MM, Wani SB, Schefter TE, Koo PJ, Meguid C, Leong S, Kaplan JB, Wingrove LJ, McCarter MD. Multidisciplinary management for esophageal and gastric cancer. Cancer Manag Res. 2016;8:39-44. [PubMed] [DOI] |
| 5. | Tarazona N, Gambardella V, Huerta M, Roselló S, Cervantes A. Personalised Treatment in Gastric Cancer: Myth or Reality? Curr Oncol Rep. 2016;18:41. [PubMed] [DOI] |
| 6. | Kang BW, Kwon OK, Chung HY, Yu W, Kim JG. Taxanes in the Treatment of Advanced Gastric Cancer. Molecules. 2016;21:pii: E651. [PubMed] [DOI] |
| 7. | Gasser M, Waaga-Gasser AM. Therapeutic Antibodies in Cancer Therapy. Adv Exp Med Biol. 2016;917:95-120. [PubMed] [DOI] |
| 8. | Martelli AM, Chiarini F, Evangelisti C, Ognibene A, Bressanin D, Billi AM, Manzoli L, Cappellini A, McCubrey JA. Targeting the liver kinase B1/AMP-activated protein kinase pathway as a therapeutic strategy for hematological malignancies. Expert Opin Ther Targets. 2012;16:729-742. [PubMed] [DOI] |
| 9. | van Veelen W, Korsse SE, van de Laar L, Peppelenbosch MP. The long and winding road to rational treatment of cancer associated with LKB1/AMPK/TSC/mTORC1 signaling. Oncogene. 2011;30:2289-2303. [PubMed] [DOI] |
| 10. | Jakhetiya A, Garg PK, Prakash G, Sharma J, Pandey R, Pandey D. Targeted therapy of gastrointestinal stromal tumours. World J Gastrointest Surg. 2016;8:345-352. [PubMed] [DOI] |
| 11. | Gan RY, Li HB. Recent progress on liver kinase B1 (LKB1): expression, regulation, downstream signaling and cancer suppressive function. Int J Mol Sci. 2014;15:16698-16718. [PubMed] [DOI] |
| 12. | Aki T, Funakoshi T, Unuma K, Uemura K. Impairment of autophagy: from hereditary disorder to drug intoxication. Toxicology. 2013;311:205-215. [PubMed] [DOI] |
| 13. | Nikoletopoulou V, Markaki M, Palikaras K, Tavernarakis N. Crosstalk between apoptosis, necrosis and autophagy. Biochim Biophys Acta. 2013;1833:3448-3459. [PubMed] [DOI] |
| 14. | Herrmann JL, Byekova Y, Elmets CA, Athar M. Liver kinase B1 (LKB1) in the pathogenesis of epithelial cancers. Cancer Lett. 2011;306:1-9. [PubMed] [DOI] |
| 15. | Gao Y, Ge G, Ji H. LKB1 in lung cancerigenesis: a serine/threonine kinase as tumor suppressor. Protein Cell. 2011;2:99-107. [PubMed] [DOI] |
| 16. | Shan T, Zhang P, Xiong Y, Wang Y, Kuang S. Lkb1 deletion upregulates Pax7 expression through activating Notch signaling pathway in myoblasts. Int J Biochem Cell Biol. 2016;76:31-38. [PubMed] [DOI] |
| 17. | Liu P, Cheng GC, Ye QH, Deng YZ, Wu L. LKB1/AMPK pathway mediates resistin-induced cardiomyocyte hypertrophy in H9c2 embryonic rat cardiomyocytes. Biomed Rep. 2016;4:387-391. [PubMed] [DOI] |
| 18. | Swisa A, Granot Z, Tamarina N, Sayers S, Bardeesy N, Philipson L, Hodson DJ, Wikstrom JD, Rutter GA, Leibowitz G. Loss of Liver Kinase B1 (LKB1) in Beta Cells Enhances Glucose-stimulated Insulin Secretion Despite Profound Mitochondrial Defects. J Biol Chem. 2015;290:20934-20946. [PubMed] [DOI] |
| 19. | Azim HA, Kassem L, Treilleux I, Wang Q, El Enein MA, Anis SE, Bachelot T. Analysis of PI3K/mTOR Pathway Biomarkers and Their Prognostic Value in Women with Hormone Receptor-Positive, HER2-Negative Early Breast Cancer. Transl Oncol. 2016;9:114-123. [PubMed] [DOI] |
| 20. | Han SH, Malaga-Dieguez L, Chinga F, Kang HM, Tao J, Reidy K, Susztak K. Deletion of Lkb1 in Renal Tubular Epithelial Cells Leads to CKD by Altering Metabolism. J Am Soc Nephrol. 2016;27:439-453. [PubMed] [DOI] |
| 21. | Sun G, da Silva Xavier G, Gorman T, Priest C, Solomou A, Hodson DJ, Foretz M, Viollet B, Herrera PL, Parker H. LKB1 and AMPKα1 are required in pancreatic alpha cells for the normal regulation of glucagon secretion and responses to hypoglycemia. Mol Metab. 2015;4:277-286. [PubMed] [DOI] |
| 22. | Lu J, Cao Y, Cheng K, Xu B, Wang T, Yang Q, Yang Q, Feng X, Xia Q. Berberine regulates neurite outgrowth through AMPK-dependent pathways by lowering energy status. Exp Cell Res. 2015;334:194-206. [PubMed] [DOI] |
| 23. | Li Z, Wang C, Zhu J, Bai Y, Wang W, Zhou Y, Zhang S, Liu X, Zhou S, Huang W. The possible role of liver kinase B1 in hydroquinone-induced toxicity of murine fetal liver and bone marrow hematopoietic stem cells. Environ Toxicol. 2016;31:830-841. [PubMed] [DOI] |
| 24. | Lu C, Xie C. Radiation-induced autophagy promotes esophageal squamous cell carcinoma cell survival via the LKB1 pathway. Oncol Rep. 2016;35:3559-3565. [PubMed] [DOI] |
| 25. | Reglero-Real N, Alvarez-Varela A, Cernuda-Morollón E, Feito J, Marcos-Ramiro B, Fernández-Martín L, Gómez-Lechón MJ, Muntané J, Sandoval P, Majano PL. Apicobasal polarity controls lymphocyte adhesion to hepatic epithelial cells. Cell Rep. 2014;8:1879-1893. [PubMed] [DOI] |
| 26. | Konen J, Wilkinson S, Lee B, Fu H, Zhou W, Jiang Y, Marcus AI. LKB1 kinase-dependent and -independent defects disrupt polarity and adhesion signaling to drive collagen remodeling during invasion. Mol Biol Cell. 2016;27:1069-1084. [PubMed] [DOI] |
| 27. | Lin J, Hou KK, Piwnica-Worms H, Shaw AS. The polarity protein Par1b/EMK/MARK2 regulates T cell receptor-induced microtubule-organizing center polarization. J Immunol. 2009;183:1215-1221. [PubMed] [DOI] |
| 28. | Zhang W, Gao Y, Li F, Tong X, Ren Y, Han X, Yao S, Long F, Yang Z, Fan H. YAP promotes malignant progression of Lkb1-deficient lung adenocarcinoma through downstream regulation of survivin. Cancer Res. 2015;75:4450-4457. [PubMed] [DOI] |
| 29. | ten Klooster JP, Jansen M, Yuan J, Oorschot V, Begthel H, Di Giacomo V, Colland F, de Koning J, Maurice MM, Hornbeck P. Mst4 and Ezrin induce brush borders downstream of the Lkb1/Strad/Mo25 polarization complex. Dev Cell. 2009;16:551-562. [PubMed] [DOI] |
| 30. | Gungor-Ordueri NE, Tang EI, Celik-Ozenci C, Cheng CY. Ezrin is an actin binding protein that regulates sertoli cell and spermatid adhesion during spermatogenesis. Endocrinology. 2014;155:3981-3995. [PubMed] [DOI] |