修回日期: 2016-06-29
接受日期: 2016-07-05
在线出版日期: 2016-07-18
目的: 探讨慢性丙型肝炎患者外周血CD4+CD25+CD127low/- Treg细胞比例对其临床诊治的指导意义.
方法: 以禹城市人民医院收治并采用派罗欣联合利巴韦林治疗的69例慢性丙型肝炎患者为观察组, 同期入院体检的65例健康志愿者为对照组. 分别于基线和治疗24 wk后检CD4+CD25+CD127low/- Treg比例. 分析基线不同病毒载量及肝损伤程度CD4+CD25+CD127low/- Treg比例的变化. 同时根据停药后24 wk是否获得病毒学应答分为获得持续病毒学应答(sustained virologic response, SVR)组和未获得SVR组, 并分析两组CD4+CD25+CD127low/- Treg比例在治疗24 wk前后的差异.
结果: 观察组治疗前外周血CD4+CD25+CD127low/- Treg细胞比例高于对照组和治疗(P<0.05). 不同HCV RNA载量的患者外周血CD4+CD25+CD127low/- Treg细胞比例不同, 随着HCV RNA载量的升高, CD4+CD25+CD127low/- Treg细胞比例也持续升高, 组与组之间差异有统计学意义(P<0.05). 治疗48 wk随访24 wk后, 观察组SVR率78.3%. 无论是基线还是治疗24 wk, 获得SVR患者的CD4+CD25+CD127low/- Treg细胞比例均明显低于未获得SVR者(P<0.05). 此外, 经相关性分析发现, 基线CD4+CD25+CD127low/- Treg细胞比例均与肝功能指标AST/ALT呈正相关性(P<0.05).
结论: CD4+CD25+CD127low/- Treg细胞可能参与了慢性丙型肝炎的发病过程, 其临床检测对患者病情诊断和预后评估有指导意义.
核心提示: 调节性T细胞是T淋巴细胞中的一个特殊群体, 主导免疫抑制效应. 本文研究显示CD4+CD25+CD127low/- Treg细胞可能参与了慢性病型肝炎的发病过程, 其临床检测对患者病情诊断和抗病毒治疗预后评估有一定指导意义.
引文著录: 武晓丽. 慢性丙型肝炎CD4+CD25+CD127low/- Treg细胞的检测价值. 世界华人消化杂志 2016; 24(20): 3182-3187
Revised: June 29, 2016
Accepted: July 5, 2016
Published online: July 18, 2016
AIM: To investigate the diagnostic and therapeutic significance of CD4+CD25+CD127low/- regulatory T (Treg) cell ratio in peripheral blood of patients with chronic hepatitis C.
METHODS: Ninety-six chronic hepatitis C patients undergoing polyethylene glycol interferon (PEG-IFN) and ribavirin (RBV) therapy at Yucheng People's Hospital were assigned to an observation group, and 65 healthy volunteers were included in a control group. CD4+CD25+CD127low/-Treg ratio was detected at baseline and 24 wk after treatment. The changes of CD4+CD25+CD127low/- Treg ratio with different viral levels and liver injury were analyzed. According to whether the patients achieved a virologic response in 24 wk after withdrawal, they were divided into a sustained virologic response (SVR) group or a non-SVR group. The differences between the two groups in CD4+CD25+CD127low/-Treg ratios were analyzed at baseline and 24 wk after treatment.
RESULTS: The proportion of CD4+CD25+CD127low/- Treg cells at baseline in the observation group was significantly higher than that at baseline in the control group and that at the end of treatment in the observation group (P < 0.05). CD4+CD25+CD127low/- Treg cell ratios of patients with different load of HCV RNA were different. With the increase in HCV RNA load, CD4+CD25+CD127low/- Treg cell proportion continued to rise significantly (P < 0.05). At 24 wk after withdrawal, the rate of SVR in the observation group was 78.3%. The proportion of CD4+CD25+CD127low/- Treg cells in SVR patients was significantly lower than that of patients without SVR (P < 0.05) no matter whether at baseline or at 24 wk after treatment. Correlation analysis showed that the baseline CD4+CD25+CD127low/- Treg cell proportion was positively correlated with the liver function index AST/ALT (P < 0.05).
CONCLUSION: CD4+CD25+CD127low/- Treg cells may be involved in the pathogenesis of chronic hepatitis, and clinical detection of CD4+CD25+CD127low/- Treg cell ratio may be helpful for disease diagnosis and prognosis evaluation.
- Citation: Wu XL. Significance of CD4+CD25+CD127low/- regulatory T cells in hepatitis C. Shijie Huaren Xiaohua Zazhi 2016; 24(20): 3182-3187
- URL: https://www.wjgnet.com/1009-3079/full/v24/i20/3182.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i20.3182
丙型肝炎病毒(hepatitis C virus, HCV)常使机体发生免疫功能紊乱和免疫耐受, 这是丙型肝炎临床症状隐匿、易于发展为慢性病变的主要原因[1]. 调节性T细胞是T淋巴细胞中的一个特殊群体, 表面高表达CD25, 主导免疫抑制效应, 其功能紊乱被认为是发生免疫逃逸和免疫耐受的重要原因之一[2,3]. 近年, 在HCV的病理性研究中发现了调节性T细胞的异常高表达, 越来越多的学者指出调节性T细胞可能参与了HCV患者的机体免疫抑制过程, 其反应强弱与HCV的自然转归相关, 可以作为HCV感染的诊断指标和抗病毒治疗疗效的预测指标[4,5]. 本研究对比69例慢性丙型肝炎患者治疗前后的调节性T细胞比例, 并分析其水平的变化与病毒载量、肝损伤程度及抗病毒疗效的关系, 旨在探讨调节性T细胞对慢性丙型肝炎临床诊治的指导意义.
选取禹城市人民医院2011-07/2013-05收治、并以派罗欣联合利巴韦林治疗的慢性丙型肝炎患者69例为观察组开展的一项前瞻性研究. 纳入标准: (1)符合2008版《丙型肝炎防治指南》中丙型肝炎的诊断标准; (2)病毒载量>103拷贝/mL; (3)无干扰素治疗禁忌证; (4)无其他类型肝炎合并症. 排除标准: (1)失代偿性肝硬化; (2)肿瘤或癌症; (3)情志或意识障碍; (4)全身炎症性疾病; (5)酒精或药物成瘾. 另以65例同期入院体检的健康志愿者为对照组. 69例观察组中, 男性37例, 女性32例. 年龄41.3岁±8.2岁(18-63岁). 病程3.1年±0.7年(1-11年). 基因1型41例; 非1型28例. HCV RNA载量为5.8 log10 copies/mL±1.3 log10 copies/mL. 65例对照组中, 男性33例, 女性32例. 年龄42.1岁±7.6岁(21-70岁). 两组患者在年龄、性别及基础内科合并症方面差异无统计学意义(P>0.05). 该研究方案符合人体试验伦理学标准, 并得到伦理委员会的批准, 受试者在受试前已知情, 且获得书面同意. 利巴韦林片, 山东齐都药业有限公司, 国药准字: H20073892. 规格: 0.1g/片; 聚乙二醇干扰素α-2a, 派罗欣, 上海罗氏制药有限公司, 国药准字: J20070055; HCV RNA检测试剂盒由上海江莱生物科技有限公司提供; 全自动生化分析仪, AU5800, Beckman, 试剂盒由波音特生物科技有限公司提供.
1.2.1 治疗: 采用干扰素与利巴韦林联合治疗方案: 利巴韦林片, 口服, 900-1200 mg/d, 根据体质量适当增减. 聚乙二醇干扰素α-2a, 皮下注射, 180 μg/wk. 48 wk为1疗程, 治疗1疗程后停药观察24 wk, 复发患者再行治疗.
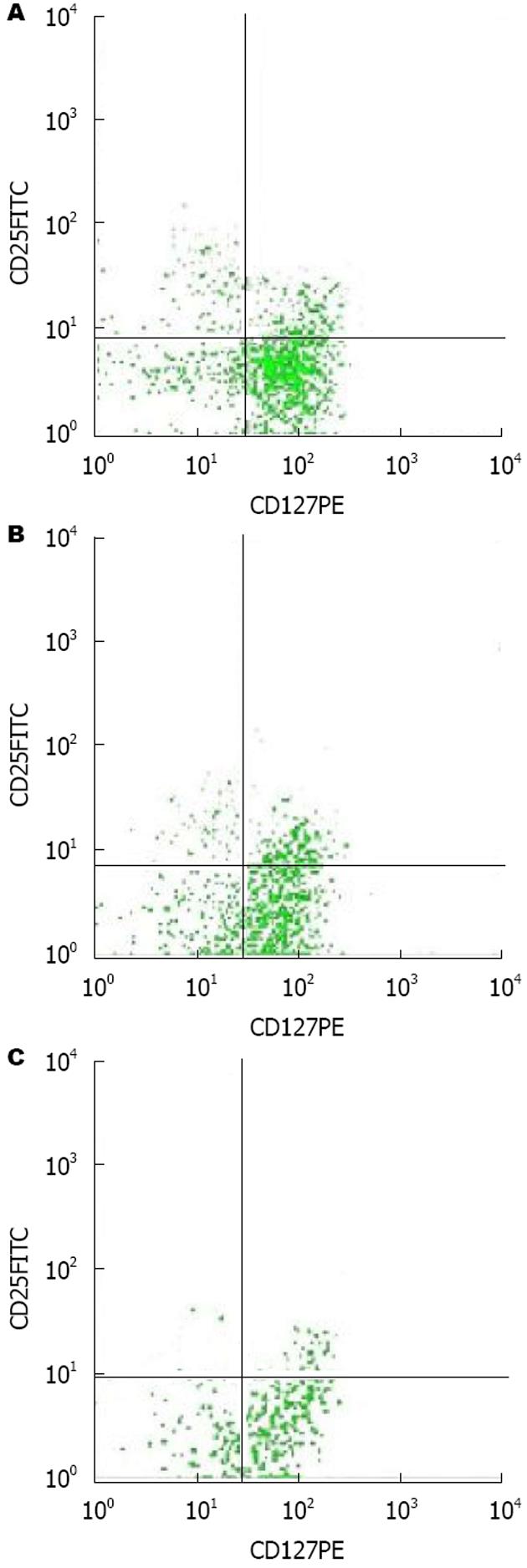
1.2.2 观察指标: (1)CD4+CD25+CD127low/- Treg细胞比例: 对照组患者入院体检时抽取清晨空腹肘静脉血, 观察组分别于治疗前1 d和治疗24 wk后抽取清晨空腹肘静脉血, 采用流式细胞法检测外周血CD4+CD25+CD127low/- Treg细胞比例. 主要步骤: 取两个EP管(A+B), 各加入100 μL外周血, EDTA抗凝, 管A为样品管, 加入PercP标记的CD4抗体、FITC标记的D25抗体各10 μL, PE标记的CD127抗体10 μL; 管B为阴性对照管, 加入CD4、CD25同型阴性对照剂; 所用抗体和试剂均由美国ebioscience公司提供.置入震荡培养箱, 35 ℃恒温避光孵育20 min. 滴加红细胞裂解液, 继续孵育10 min, 1500 r/min离心5 min, 离心半径为8 cm, 弃上清. PBS液洗涤并重悬后即可行流式细胞仪检测, 先圈定CD4+ T亚群, 再通过CD25和CD127荧光标志定位CD4+CD25+CD127low/- Treg细胞, 采用Cellquest软件分析CD4+CD25+CD127low/- Treg细胞所占CD4+ T亚群比例; (2)病毒载量: 于基线、4、12、24、48 wk及停药24 wk时检测HCV RNA, 采用实时荧光定量法检测患者外周血HCV RNA, 最低检测限103 copies/mL. SVR定义为停药后24 wk, HCV RNA低于103 copies/mL; (3)肝功能: 分别于治疗前和治疗48 wk后抽取观察组患者空腹肘静脉血, 分离血清, 采用全自动生化分析仪检测谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)和总胆红素(total bilirubin, TBIL)水平.
统计学处理 所得数据均采用统计学软件GraphPad Prism 5.0进行分析; 计量资料以mean±SD表示, 观察组治疗前后的比较行配对设计的t检验, 观察组和对照组之间的比较采用t检验; 不同层次HCV RNA载量之间的比较采用方差分析; 计数资料以构成比或率表示, 行χ2检验; 检验水准: P<0.05表示差异有统计学意义.
治疗前, 观察组、对照组外周血CD4+CD25+CD127low/- Treg细胞比例分别为8.33%±0.94%、3.81%±0.27%, 两者相比, 差异有统计学意义(t = 37.336, P<0.05); 治疗24 wk后, 观察组CD4+CD25+CD127low/- Treg细胞比例为4.21%±0.56%, 与治疗前差异有统计学意义(P<0.05); 其典型病例的流式细胞图如图1所示.
治疗48 wk随访24 wk后, 观察组69例患者, 获得SVR 54例, 未获得SVR 15例, SVR率为78.3%. 获得SVR患者(SVR+)治疗前和治疗24 wk后CD4+CD25+CD127low/- Treg细胞比例均明显低于未获得SVR(SVR-)的患者, 差异有统计学意义(P<0.05)(表1).
| 分组 | n | 治疗前 | 治疗24 wk | t值 | P值 |
| SVR+ | 54 | 7.22±0.82 | 4.05±0.37 | 25.894 | <0.001 |
| SVR- | 15 | 9.45±1.03 | 8.46±0.52 | 3.460 | <0.001 |
| t值 | 8.802 | 31.780 | |||
| P值 | <0.001 | <0.001 |
进一步分析基线时69例不同HCV RNA载量患者的外周血CD4+CD25+CD127low/- Treg细胞比例, 差异存在统计学意义(F = 8.267, P<0.001), 随着HCV RNA载量的升高, CD4+CD25+CD127low/- Treg细胞比例也持续升高, 且组与组之间的差异均有统计学意义(P<0.05)(表2).
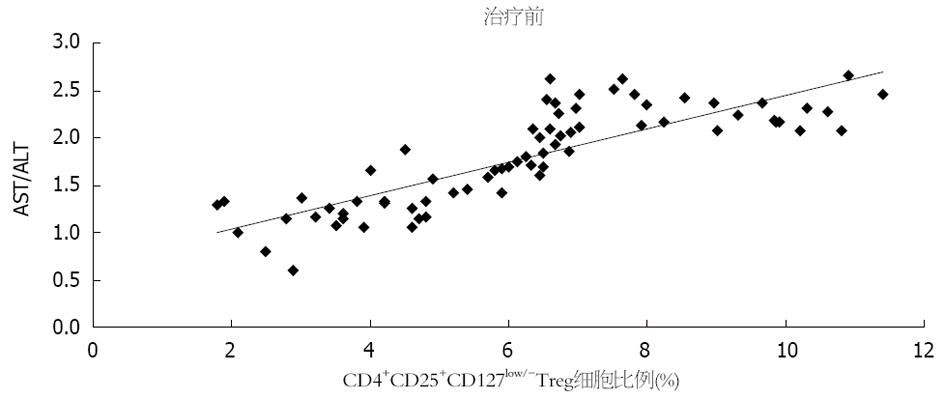
相关性分析进一步显示: 观察组患者治疗前CD4+CD25+CD127low/- Treg细胞比例均与肝功能指标AST/ALT呈正相关性(P<0.05)(图2).
丙型肝炎早期临床表现与乙型肝炎相比, 症状隐匿, 更容易发展成为肝纤维化、肝硬化乃至肝癌. 研究[6]表明, HCV抑制宿主固有免疫系统和特异性免疫系统功能, 产生免疫耐受是导致其症状隐匿和病毒持续复制的主要原因, 具体作用机制可总结为两点[7]: (1)破坏Toll样受体介导的信号通路, 阻断天然免疫应答, 包括巨噬细胞、树突状细胞及自然杀伤细胞等; (2)增强调节性T细胞的免疫抑制功能, 削弱T、B淋巴细胞的应答能力. 天然的调节性T细胞表面高表达CD25, 同时也表达CD4, 然而CD4+与CD25+均不具备专属性, 故而CD4+CD25+ Treg不足以表达调节性T细胞. 关于调节性T细胞的特异性标志, 学术界比较公认的是Foxp3+和CD127low. 实质上, 诸多研究已证实Foxp3表达与CD127低表达具有密切相关性[8-10], 考虑到Foxp3为胞内蛋白, 需细胞固化、穿孔后才可鉴定, 本研究以CD4+CD25+CD127low/-Treg 细胞作为调节性T细胞的衡量标准.
结果显示, 慢性丙型肝炎患者外周血CD4+CD25+CD127low/-Treg细胞比例明显高于健康人群, 采用派罗欣和利巴韦林联合干预后, CD4+CD25+CD127low/- Treg细胞比例有所降低, 初步证实了CD4+CD25+CD127low/- Treg细胞可能参与了慢性丙型肝炎的发病过程.进一步研究发现患者的CD4+CD25+CD127low/- Treg细胞比例与病毒载量密切相关, 随着HCV RNA的升高CD4+CD25+CD127low/- Treg细胞比例也持续升高, 说明两者存在相辅相成的关系. 此外, 本研究还发现获得SVR的患者治疗24 wk前后CD4+CD25+CD127low/- Treg细胞比例较未获得SVR的患者偏低并且下降更明显, 说明高CD4+CD25+CD127low/- Treg细胞水平可导致HCV清除障碍. 据悉[11-13], 细胞免疫在清除HCV时发挥重要作用, 慢性丙型肝炎患者CD3+T细胞减少, CD4+/CD8+升高, 呈现出典型的细胞免疫抑制状态. 以往也有研究指出CD4+CD25+ Treg细胞是通过抑制HCV特异性T细胞的免疫应答, 能够导致HCV病毒在体内持续性复制[14,15], 与本研究结果基本一致, 均说明高水平的CD4+CD25+CD127low/- Treg细胞水平不利于HCV清除.
此外, 本研究还发现观察组患者治疗前CD4+CD25+CD127low/- Treg细胞比例均与肝功能指标AST/ALT呈正相关性. ALT主要存在于肝细胞质, 其含量增加能反应肝功能障碍, 却不能反应肝实质损伤. AST分布于线粒体, 主要反应肝细胞的凋亡程度, 故而AST>ALT时, 往往已经发生较严重的肝实质损伤. 国内学者戚应杰等[16]指出AST、ALT的检查结果有助于了解HCV在患者体内的复制水平和肝脏炎性损伤程度. 本研究证实CD4+CD25+CD127low/- Treg细胞比例与基线AST/ALT有密切相关性, 说明CD4+CD25+CD127low/- Treg细胞比例也能从一定程度上预测肝细胞损伤程度, 与患者预后息息相关.
总之, CD4+CD25+CD127low/- Treg细胞可能参与了慢性病型肝炎的发病过程, 其临床检测对患者病情诊断和抗病毒治疗预后评估有一定指导意义. 当然, 本研究也存在一定的局限性; 只检测了基线和治疗后24 wk的CD4+CD25+CD127low/- Treg细胞水平, 对于其他多个时间点的动态变化有待进一步研究.
调节性T细胞可能参与了丙型肝炎患者的机体免疫抑制过程, 其反应强弱与丙型肝炎病毒(hepatitis C virus, HCV)的自然转归相关, 可以作为HCV感染的诊断指标和抗病毒治疗疗效的预测指标.
丁向春, 副教授, 主任医师, 宁夏医科大学总医院感染性疾病科; 阴赪宏, 研究员, 首都医科大学附属北京友谊医院感染与急救医学
免疫耐受是导致丙型肝炎症状隐匿和病毒持续复制的主要原因, 调节性T细胞可能参与了这一过程. 然而, 其具体的作用及对诊断和抗病毒治疗预后评估的价值有待进一步研究.
近年, 在HCV的病理性研究中发现了调节性T细胞的异常高表达, 越来越多的学者指出调节性T细胞可能参与了HCV患者的机体免疫抑制过程, 其反应强弱与HCV的自然转归相关, 可以作为HCV感染的诊断指标和抗病毒治疗疗效的预测指标.
分别于基线和治疗24 wk后检测CD4+CD25+CD127low/- Treg比例. 分析基线不同病毒载量及肝损伤程度CD4+CD25+CD127low/- Treg比例的变化. 同时根据停药后24 wk是否获得病毒学应答分析两组CD4+CD25+CD127low/- Treg比例在治疗24 wk前后的差异.
CD4+CD25+CD127low/- Treg细胞可能参与了慢性病型肝炎的发病过程, 其临床检测对患者病情诊断和抗病毒治疗预后评估有一定指导意义.
流式细胞术工作原理是在细胞分子水平上通过单克隆抗体对单个细胞或其他生物粒子进行多参数、快速的定量分析. 他可以高速分析上万个细胞, 并能同时从一个细胞中测得多个参数, 具有速度快、精度高、准确性好的优点, 是当代最先进的细胞定量分析技术之一.
本研究通过检测抗病毒治疗后丙型肝炎患者的调节性T细胞变化, 拟探讨其在丙型肝炎发生发展中的作用. 试验设计严谨合理、数据处理详实可信, 对于丙型肝炎的治疗有一定的临床指导意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Roque-Cuéllar MC, Sánchez B, García-Lozano JR, Praena-Fernández JM, Márquez-Galán JL, Núñez-Roldán A, Aguilar-Reina J. Hepatitis C virus-specific cellular immune responses in sustained virological responders with viral persistence in peripheral blood mononuclear cells. Liver Int. 2014;34:e80-e88. [PubMed] [DOI] |
| 2. | Fernandez-Ponce C, Dominguez-Villar M, Aguado E, Garcia-Cozar F. CD4+ primary T cells expressing HCV-core protein upregulate Foxp3 and IL-10, suppressing CD4 and CD8 T cells. PLoS One. 2014;9:e85191. [PubMed] [DOI] |
| 4. | Ji XJ, Ma CJ, Wang JM, Wu XY, Niki T, Hirashima M, Moorman JP, Yao ZQ. HCV-infected hepatocytes drive CD4+ CD25+ Foxp3+ regulatory T-cell development through the Tim-3/Gal-9 pathway. Eur J Immunol. 2013;43:458-467. [PubMed] [DOI] |
| 5. | Claassen MA, de Knegt RJ, Janssen HL, Boonstra A. Retention of CD4+ CD25+ FoxP3+ regulatory T cells in the liver after therapy-induced hepatitis C virus eradication in humans. J Virol. 2011;85:5323-5330. [PubMed] [DOI] |
| 6. | Losikoff PT, Mishra S, Terry F, Gutierrez A, Ardito MT, Fast L, Nevola M, Martin WD, Bailey-Kellogg C, De Groot AS. HCV epitope, homologous to multiple human protein sequences, induces a regulatory T cell response in infected patients. J Hepatol. 2015;62:48-55. [PubMed] [DOI] |
| 7. | Kong F, Zhang W, Feng B, Zhang H, Rao H, Wang J, Cong X, Wei L. Abnormal CD4 + T helper (Th) 1 cells and activated memory B cells are associated with type III asymptomatic mixed cryoglobulinemia in HCV infection. Virol J. 2015;12:100. [PubMed] [DOI] |
| 8. | Soldevila B, Alonso N, Martínez-Arconada MJ, Morillas RM, Planas R, Sanmartí AM, Martínez-Cáceres EM. A prospective study of T- and B-lymphocyte subpopulations, CD81 expression levels on B cells and regulatory CD4(+) CD25(+) CD127(low/-) FoxP3(+) T cells in patients with chronic HCV infection during pegylated interferon-alpha2a plus ribavirin treatment. J Viral Hepat. 2011;18:384-392. [PubMed] [DOI] |
| 9. | Shen T, Zheng J, Liang H, Xu C, Chen X, Zhang T, Xu Q, Lu F. Characteristics and PD-1 expression of peripheral CD4+CD127loCD25hiFoxP3+ Treg cells in chronic HCV infected-patients. Virol J. 2011;8:279. [PubMed] [DOI] |
| 10. | 邓 敏, 李 明慧, 刘 顺爱, 刘 凤, 桑 燕, 宋 淑静, 张 书凤, 关 小平, 谢 尧, 邬 小萍. 慢性HBV感染者调节性T细胞水平及Foxp3与CD127表达关系的研究. 中华实验和临床病毒学杂志. 2010;24:21-23. |
| 11. | Soldevila B, Alonso N, Martínez-Arconada MJ, Granada ML, Baía D, Vallejos V, Fraile M, Morillas RM, Planas R, Pujol-Borrell R. A prospective study of lymphocyte subpopulations and regulatory T cells in patients with chronic hepatitis C virus infection developing interferon-induced thyroiditis. Clin Endocrinol (Oxf). 2011;75:535-543. [PubMed] [DOI] |
| 12. | Feuth T, van Baarle D, van Erpecum KJ, Siersema PD, Hoepelman AI, Arends JE. CD4/CD8 ratio is a promising candidate for non-invasive measurement of liver fibrosis in chronic HCV-monoinfected patients. Eur J Clin Microbiol Infect Dis. 2014;33:1113-1117. [PubMed] [DOI] |
| 13. | Shi JJ, Zhang JY, Zhang XX, Wang FS. [HCV infection and specific T lymphocyte immunity]. Zhonghua Ganzangbing Zazhi. 2016;24:170-174. [PubMed] [DOI] |
| 14. | Perrella A, Arenga G, Pisaniello D, Rampone B, Di Costanzo GG, Atripaldi L, Esposito C, Di Florio E, Perrella O, Cuomo O. Elevated CD4+/CD25+ T-cell frequency and function during hepatitis C virus recurrence after liver transplantation. Transplant Proc. 2009;41:1761-1766. [PubMed] [DOI] |
| 15. | Perrella A, D'Antonio A, Sbreglia C, Sorrentino P, Conca P, Atripaldi L, Conti P, Perrella O. CD4+/CD25+ T cells suppress autologous CD4+/CD25- lymphocytes and secrete granzyme B during acute and chronic hepatitis C. Pathog Dis. 2014;72:124-130. [PubMed] [DOI] |