修回日期: 2015-12-08
接受日期: 2015-12-14
在线出版日期: 2016-01-18
目的: 增强对自身免疫性肝病中三联重叠综合征(autoimmune hepatitis-primary biliary cirrhosis-primary sclerosing cholangitis overlap syndromes, AIH-PBC-PSC OS)的认识, 提高对自身免疫性肝病中AIH-PBC-PSC OS的诊断及治疗水平.
方法: 经肝活检确诊的7例AIH-PBC-PSC OS患者, 收集其临床特征、生化指标、自身抗体、影像学及肝组织学指标, 7例患者给予口服熊去氧胆酸(ursodeoxycholic acid, UDCA)胶囊[13-15 mg/(kg•d)]、泼尼松(30 mg/d, 每周递减5 mg, 至10 mg/d维持)和硫唑嘌呤(azathioprine, AZA)(50 mg/d), 观察疗效.
结果: 谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、γ-谷氨酰转肽酶(gamma glutamyl transpeptidase, GGT)、碱性磷酸酶(alkaline phosphatase, ALP)治疗后比基线水平降低, 总胆红素(total bilirubin, TBIL)治疗后较基线水平升高. ALP比较差异有统计学意义(P<0.05), ALT、AST、GGT、球蛋白(globulin, GLOB)、TBIL、IgG、IgM比较差异均无统计学意义(P>0.05), 7例患者均肝穿活检, 病理结果均显示AIH、PBC及PSC的特征性表现. 随访中1例行肝移植, 术后肝功能正常, 4例去世(3例死于肝衰竭, 1例死于消化道出血).
结论: 自身免疫性肝病血清特异性抗体及特征性组织学、影像学是诊断自身免疫性肝病的金标准. AIH-PBC-PSC OS患者药物治疗效果差, 出现症状后短期死亡率高. 肝移植仍是治疗终末期OS患者的唯一有效方法.
核心提示: 本研究对7例自身免疫性肝病中三联重叠综合征患者进行生化指标、自身抗体检测及肝脏组织活检, 结果发现碱性磷酸酶(alkaline phosphatase)比较差异有统计学意义, 自身免疫性肝病中三联重叠综合征(autoimmune hepatitis-primary biliary cirrhosis-primary sclerosing cholangitis overlap syndromes)患者药物治疗效果差, 肝移植仍是治疗终末期叠综合征患者的唯一有效方法.
引文著录: 高素纪, 徐芸, 保洁, 刘象, 刘香漫, 华静. 加强对自身免疫性肝病三联重叠综合征的认识. 世界华人消化杂志 2016; 24(2): 293-299
Revised: December 8, 2015
Accepted: December 14, 2015
Published online: January 18, 2016
AIM: To investigate the diagnosis and treatment of trigeminy overlap syndrome [autoimmune hepatitis-primary biliary cirrhosis-primary sclerosing cholangitis overlap syndrome (AIH-PBC-PSC OS)] of autoimmune liver disease (AILD).
METHODS: All data for seven patients diagnosed with AIH-PBC-PSC OS by liver biopsy, including clinical characteristics and biochemistry indexes, autoantibodies, imaging findings and liver histology, were analyzed. Ursodeoxycholic acid (UDCA) [13-15 mg/(kg•d)], prednisone (30 mg/d, diminished by 5 mg/qw, until 10 mg/d) and azathioprine (AZA) (50 mg/d) were given to these patients.
RESULTS: Over 12 mo of observation, the levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), γ-glutamyl transpeptidase (GGT), and alkaline phosphatase (ALP) in all the 7 patients decreased, and the levels of TBIL increased. Compared with baseline value, there was a significant decrease in ALP (P < 0.05). However, there were no significant differences in other parameters (P > 0.05). Pathological results showed the characteristics of AIH, PBC and PSC. Liver transplantation was performed in one patient, and the hepatic function of the patient was normal after operation. Four patients died (one died of hepatic failure and one died of gastrointestinal bleeding) during follow-up.
CONCLUSION: The diagnosis of AILD is based mainly on serologic tests and characteristic histological features. The short-term mortality of AIH-PBC-PSC OS is high. The effect of medical treatment for patients with AIH-PBC-PSC OS is poor. Liver transplantation is the only option with known therapeutic benefit for end-stage patients.
- Citation: Gao SJ, Xu Y, Bao J, Liu X, Liu XM, Hua J. Diagnosis and treatment of trigeminy overlap syndrome of autoimmune liver disease. Shijie Huaren Xiaohua Zazhi 2016; 24(2): 293-299
- URL: https://www.wjgnet.com/1009-3079/full/v24/i2/293.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i2.293
自身免疫性肝病(autoimmune liver disease, AILD)是一组病因不明、免疫介导的肝脏损伤, 主要包括自身免疫性肝炎(autoimmune hepatitis, AIH)、原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)、原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)及以上两种或三种肝病的重叠综合征. 关于自身免疫性肝病重叠综合征的诊断, 目前尚无国际或国内统一的标准[1]. 2011年国际AIH工作组(International Autoimmune Hepatitis Group, IAIHG)发表了关于重叠综合征(overlap syndromes, OS)的立场文件[2], 该文件认为OS不是独立的疾病, 是自身免疫性肝病中, 患者同时具有PBC或PSC和AIH两种疾病特征, 即OS, 以AIH-PBC重叠综合征(AIH-PBC OS)最为常见[3]. 近期我们临床发现一些三联重叠综合征(AIH-PBC-PSC OS)患者, 由于AIH-PBC-PSC OS发生率相对较低, 目前国内尚无其相关文献报道及统一的诊断标准与治疗. 本研究拟通过分析郑州大学第一附属医院消化内科于2012-01/2015-10收治的7例自身免疫性肝病中AIH-PBC-PSC OS患者资料, 以期提高对此类疾病的认识.
收集2012-01/2015-10郑州大学第一附属医院消化内科收治的7例AIH-PBC-PSC OS患者临床资料. 研究中男1例, 女6例, 平均年龄46岁±7岁. 确诊后平均随访时间15.5 mo±5.2 mo. 病程1-20年. AIH-PBC-PSC OS的诊断标准: AIH诊断参照2008年IAIHG修订并提出了简化的评分系统[4]. PBC的诊断主要参照2009年欧洲肝病学会制定的指南[5], PSC的诊断主要是在发现提示胆汁淤积的生化学指标[碱性磷酸酶(alkaline phosphatase, ALP)和γ-谷氨酰转肽酶(gamma glutamyl transpeptidase, GGT)水平升高]的基础上, 存在相关的胆管影像学表现[6][经内镜逆行性胰胆管造影术(endoscopic retrograde cholangio-pancreatography, ERCP)和磁共振胰胆管造影(magnetic resonance cholangiopancreatography, MRCP)下呈现出特征性的胆管串珠样改变, 包括多发狭窄和节段性扩张或具有典型的PSC生化与组织学改变, 但胆管造影正常, 则诊断为小胆管PSC]. 同时满足以上诊断特征的诊断为AIH-PBC-PSC OS.
1.2.1 ELISA法抗体检测及肝脏活检: 收集研究对象的一般特征(年龄、性别、随访时间)、临床生化指标[谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、GGT、ALP、总胆红素(total bilirubin, TBIL)、球蛋白(globulin, GLOB)等]、自身抗体[抗核抗体(antinuclear antibody, ANA)、抗平滑肌抗体(anti-smooth muscle antibody, SMA)、抗线粒体抗体(anti-mitochondrial antibody, AMA)、IgG、IgM、抗sp100抗体、抗gp210抗体、核周抗中性粒细胞胞浆抗体p-ANCA和去唾液酸糖蛋白受体抗体anti-ASGPR)]及肝组织学结果. 滴度≥1:100为阳性.
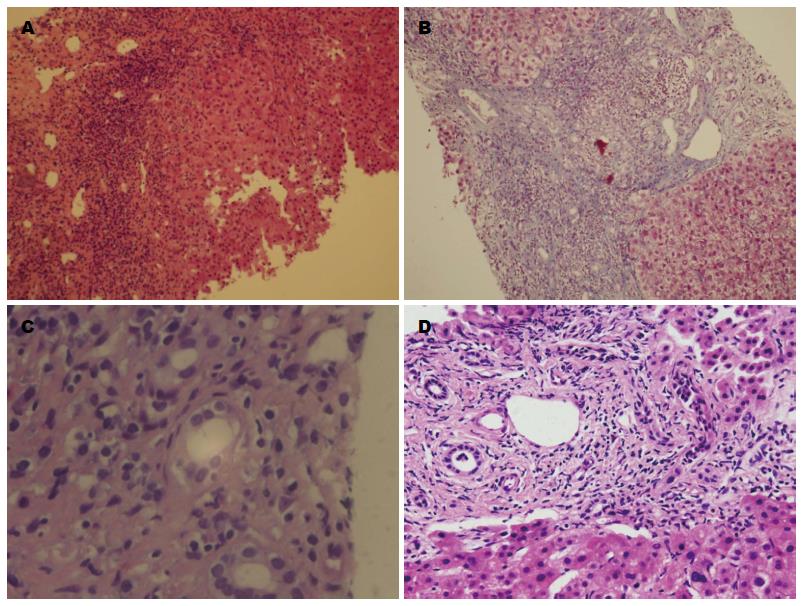
1.2.2 肝脏活检病理学评估: 参考2001年版《病毒性肝炎防治方案》[7] 中慢性肝炎病理分级分期, 将肝脏炎征活动分为G0-G4级, 纤维化程度分为S0-S4期. AIH特征性表现: 界面性肝炎伴淋巴-浆细胞浸润、肝细胞玫瑰花环样改变、淋巴细胞穿入现象. PBC常伴有非化脓性胆管炎、上皮样肉芽肿, 小汇管区中常显现胆管消失. 小胆管周围"洋葱皮"样的管周纤维化为大胆管PSC特征性表现, 具有典型的PSC生化与组织学改变, 但胆管造影正常, 为小胆管PSC特点.
1.2.3 治疗: 7例均给予熊去氧胆酸(ursodeoxycholic acid, UDCA)胶囊[13-15 mg/(kg•d)]、泼尼松(30 mg/d, 每周递减5 mg, 至10 mg/d维持)和硫唑嘌呤(azathioprine, AZA)(50 mg/d). 其中4号患者起始应用甲强龙40 mg/d静滴2 wk后调整为甲泼尼龙24 mg/d和AZA 50 mg/d口服.
统计学处理 采用SPSS17.0统计学软件对数据进行处理. 计量资料以中位数、mean±SD表示, 采用t检验; 计数资料以例数或百分率描述, 采用秩和检验; 生存曲线采用Kaplan-Meier法. 检验水准α = 0.05. P<0.05为差异有统计学意义.
AIH-PBC-PSC OS主要表现为纳差、乏力、黄疸等症状, 可并发其他疾病, 5例患者并发骨质疏松(表1). ALT、AST、GGT、GLOB、TBIL、IgG、IgM较正常水平升高(表2). AILD具有特异性血清抗体,7例患者中5例(71%)ANA阳性, SMA、gp210/sp100阳性者均为1例(14%), 3例(43%)AMA、anti-ASGPR阳性, 其中1例两者均为阳性. 2例(29%)p-ANCA阳性. 7例患者治疗前肝脏炎症G0-G2为57%(4/7), 肝脏纤维化S3-S4为86%(6/7). 7例患者MRCP结果分别为: 1号: 肝内胆管、肝总管、胆总管上段粗细不均; 2号因经济问题未做MRCP; 3号: 肝内胆管串珠样改变; 4号: 肝内胆管扩张, 胆总管断续显示; 5号: 肝脏边缘、门静脉周围异常信号; 6号: 肝总管及胆总管上段显影较细; 7号: 左右肝管、肝总管及肝内分支肝管多发狭窄.
| 患者编号 | 性别 | 临床表现 |
| 1 | 女 | 纳差、乏力、黄疸、骨质疏松 |
| 2 | 女 | 乏力、黄疸、腹泻、骨质疏松 |
| 3 | 女 | 乏力、黄疸、骨质疏松 |
| 4 | 女 | 乏力、黄疸、牙龈出血、骨质疏松 |
| 5 | 女 | 纳差、乏力、黄疸、瘙痒 |
| 6 | 男 | 乏力、黄疸、瘙痒、骨质疏松 |
| 7 | 女 | 乏力、黄疸、瘙痒 |
| 项目 | 治疗前 | 最后一次就诊 |
| 性别(男/女) | 1/6 | 1/2 |
| 年龄(岁) | 48(32-54) | - |
| 随访时间(mo) | - | 15.5(12-26) |
| ALT(ULN) | 1.9(0.2-3.2) | 1.4(0.3-3.1) |
| AST(ULN) | 2.9(1.2-5.9) | 2.7(0.5-6.3) |
| GGT(ULN) | 4.2(2.3-9.1) | 4.1(0.2-7.5) |
| ALP(ULN) | 4.6(0.5-7.3) | 3.1(0.5-9.9) |
| GLOB(ULN) | 1.3(0.9-1.4) | 0.9(0.7-1.2) |
| TBIL(ULN) | 4.5(1.0-8.4) | 8.3(0.3-27.4) |
| IgG(ULN) | 1.6(1.0-2.7) | 1.2(0.8-1.6) |
| IgM(ULN) | 0.8(0.6-2.6) | 1.4(0.6-2.1) |
| ANA[n(%)] | 5(71) | - |
| SMA/Anti-LKM [n(%)] | 1(14) | - |
| anti-ASGPR[n(%)] | 3(43) | - |
| AMA[n(%)] | 3(43) | - |
| gp210/sp100[n(%)] | 1(25) | - |
| p-ANCA[n(%)] | 2(29) | - |
| 炎症分级0-2/3-4(%) | 57/43 | - |
| 纤维化分期0-2/3-4(%) | 14/86 | - |
7例镜下见界面炎性炎、淋巴-浆细胞浸润、肝细胞玫瑰花环样改变, 4例见上皮肉芽肿, 3例见中度-重度胆管消失, 3例见小胆管周围"洋葱皮"样的管周纤维化, 1例见小胆管PSC. 7例患者肝活检组织学结果如图1.
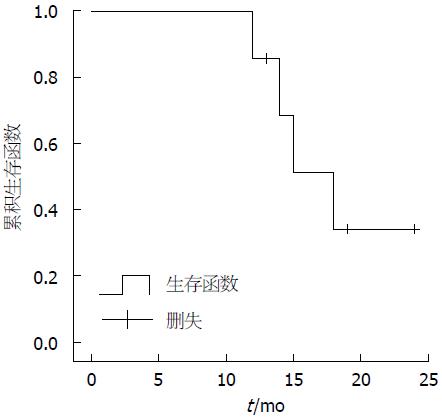
ALT、AST、GGT、ALP治疗后比基线水平降低, TBIL治疗后较基线水平升高. 7例患者生化指标基线水平与治疗(1年)后ALT、AST、GGT、GLOB、TBIL、IgG、IgM比较差异均无统计学意义(P>0.05); ALP比较差异有统计学意义(P<0.05). 随访中1例因药物治疗无效行肝移植, 4例去世(3例死于肝衰竭, 1例死于消化道出血, 出现严重并发征后均停用激素及免疫抑制剂). AIH-PBC-PSC OS确诊后12 mo内生存率为85.7%, 15 mo内生存率下降较快, 说明AIH-PBC-PSC OS患者出现症状就诊后短期内死亡率较高(图2, 表3).
| 指标 | 治疗前 | 治疗后(1年) | P值 |
| ALT(U/L) | 78.4±41.3 | 63.0±41.8 | 0.50 |
| AST(U/L) | 138.0±55.5 | 115.4±79.0 | 0.50 |
| GGT(U/L) | 287.0±157.9 | 218.7±158.4 | 0.44 |
| ALP(U/L) | 585.0±301.5 | 292.7±156.4 | 0.04 |
| GLOB(g/L) | 40.2±7.7 | 32.7±6.2 | 0.07 |
| TBIL(μmmol/L) | 117.5±74.4 | 277.2±256.0 | 0.16 |
| IgG(g/L) | 24.1±10.0 | 18.8±4.1 | 0.23 |
| IgM(g/L) | 3.1±1.9 | 3.0±1.5 | 0.90 |
自身免疫性肝病的早期诊断及治疗是控制疾病进展的关键, 根据流行病学最新调查显示: AIH在欧洲人群的患病率为(17.3-19.4)/10万[8], PBC的发病率为(0.7-49.0)/100万, 患病率为(6.7-402.0)/100万. PSC发病率为每年(0-1.3/)100万人, 患病率为(0-16.2)/10万人[9]. 至于常见的重叠综合征, 如AIH-PBC OS, 由于诊断方法尚不确切, AIH-PBC OS患病率存争议. Zhao等[10]研究显示其患病率约为10.33%. PBC-PSC重叠综合征(PBC-PSC OS)目前仅有个别病例报告[11]. 同样, AIH-PSC OS临床罕见, 诊断困难, 迄今仅见少数病例报告发表, 多见于儿童或青少年[12], 有观点认为简化的积分系统对AIH-PSC OS有更好的特异性[13]. 本研究中由于AIH-PBC-PSC OS相关报道欠缺, 统计患病率缺乏流行病学资料, 对其的研究有待进一步完善.
AIH-PBC-PSC OS首先表现为消化系症状, 如纳差等; 部分患者以消化系外症状为首发, 如骨质疏松等. 本研究中7例患者均存在黄疸、乏力, 1例伴有牙龈出血. 均为非特异性表现, 这对其早期诊断和治疗比较困难, 因此建议长期肝功能异常患者行自身免疫性肝病血清学筛查及肝脏病理检查具有重要意义.
多种抗体对诊断AILD表现出了较高的特异性及敏感性. ANA阳性往往是诊断AIH的重要线索, 但特异性较低, 因为在PBC和PSC中亦有一定比例的阳性, 但滴度较低. 肝脏特异性ASGPR是一种AIH患者的自身抗原. Anti-ASGPR抗体与疾病活动相关[14]. AMA对诊断PBC的特异性较高, 在95%的PBC患者中AMA为阳性; 对于AMA阴性患者而言, 肝脏病理活检则是诊断PBC的必需[15]. 有学者发现抗gp210抗体对诊断PBC的敏感度为35.4%[16]. 与PSC最相关的自身抗体是p-ANCA. 本研究AMA和ANA阳性率分别为43%和71%, 而gp210/sp100阳性率为25%, 与报道有差异, 推测可能与研究对象样本量少、环境因素以及种族差异有关.
AILD具有典型病理改变, 本研究5例患者有均有界面炎、淋巴细胞及浆细胞浸润及玫瑰花环样改变, 2例患者发现"洋葱样"纤维化. PBC病理特征的患者分期以晚期居多, 提示PBC患者较易发生肝纤维化, 肝脏损伤较重. 由于大多数患者拒绝再次肝穿, 尚缺乏病理对照.
美国肝病研究学会(American Association for the Study of Liver Diseases, AASLD)推荐一般使用联合方案(泼尼松龙30 mg/d和AZA 50 mg/d)作为AIH的初始治疗, 病情缓解需长期维持. 研究[17]表明, UDCA(13-15 mg/kg)可显著改善PBC患者的肝脏生化参数, 是PBC治疗的首选药物, 也是唯一被美国食品药品监督管理局(Food and Drug Administration, FDA)批准的药物. AASLD对PSC患者主张采用个性化治疗方案, UDCA是治疗早期或中期PSC的常用药物. 近日一项荟萃分析[18]有表明在PSC患者的生存率和肝组织学进展方面, 甲硝唑加UDCA是最有效的治疗. 本研究中AIH-PBC-PSC OS给予UDCA、泼尼松和AZA, 提示UDCA、泼尼松、AZA在缩短临床治愈时间方面欠佳. 至3年末本研究结束, 所观察病例7例仅2例存活, 据文献报道PBC患者5年生存率为65.4%-80.1%, 提示与PBC患者相比, AIH-PBC-PSC OS患者预后较差.
本研究通过小样本队列研究探讨了AIH-PBC-PSC OS的临床特点和治疗方案, 对临床自身免疫性肝病中二联重叠综合征患者的诊断可有借鉴意义. AIH-PBC-PSC OS血清特异性抗体及特征性组织学改变是诊断的金标准; 肝移植仍是治疗终末期OS患者的唯一有效方法.
自身免疫性肝病(autoimmune liver disease, AILD)是国内肝病领域研究的新热点. AILD中重叠综合征是一种特殊类型的自身免疫性疾病, 其病因机制及诊疗尚无统一意见.
辛永宁, 副教授, 青岛市市立医院肝病科; 朱建平, 主任医师, 清华大学第一附属医院肝胆外科
现阶段对AILD的研究多集中在自身免疫紊乱、感染、遗传易感性等方面. 自身免疫性肝炎-原发性胆汁性肝硬化(autoimmune hepatitis-primary biliary cirrhosis, AIH-PBC)临床特点研究较多, 但是对AIH-PBC-原发性硬化性胆管炎重叠综合征(AIH-PBC-primary sclerosing cholangitis overlap syndromes, AIH-PBC-PSC OS)尚缺乏对其临床资料及相关性的进一步研究.
马雄教授指出, AIH的简化积分系统易漏诊不典型病例, AIH的综合诊断积分系统因比较复杂, 多用于临床科研, 但有补救诊断作用, 建议临床上联合使用.
本课题对7例AIH-PBC-PSC OS的临床生化、特异性血清抗体、影像学检查、肝脏组织活检病理及治疗等方面进行研究, 内容及观点新颖.
由于AIH-PBC-PSC OS发生率相对较低, 目前国内尚无其相关文献报道及统一的诊断标准与治疗. 本研究分析郑州大学第一附属医院收治的7例AIH-PBC-PSC OS患者资料, 提供了大量有价值的信息, 以期提高对此类疾病的认识.
本文选材好, 通过临床研究所得出的结果为临床医生规范化诊疗、避免误诊提供了的依据. 本文有较好的临床意义, 结论客观, 显示了治疗的困境.
编辑: 郭鹏 电编:闫晋利
| 1. | Lee H, Stapp RT, Ormsby AH, Shah VV. The usefulness of IgG and IgM immunostaining of periportal inflammatory cells (plasma cells and lymphocytes) for the distinction of autoimmune hepatitis and primary biliary cirrhosis and their staining pattern in autoimmune hepatitis-primary biliary cirrhosis overlap syndrome. Am J Clin Pathol. 2010;133:430-437. [PubMed] [DOI] |
| 2. | Boberg KM, Chapman RW, Hirschfield GM, Lohse AW, Manns MP, Schrumpf E. Overlap syndromes: the International Autoimmune Hepatitis Group (IAIHG) position statement on a controversial issue. J Hepatol. 2011;54:374-385. [PubMed] [DOI] |
| 3. | Durazzo M, Premoli A, Paschetta E, Belci P, Spandre M, Bo S. Overlap syndromes of autoimmune hepatitis: an open question. Dig Dis Sci. 2013;58:344-348. [PubMed] [DOI] |
| 4. | Hennes EM, Zeniya M, Czaja AJ, Parés A, Dalekos GN, Krawitt EL, Bittencourt PL, Porta G, Boberg KM, Hofer H. Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology. 2008;48:169-176. [PubMed] [DOI] |
| 5. | European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of cholestatic liver diseases. J Hepatol. 2009;51:237-267. [PubMed] [DOI] |
| 6. | Williamson KD, Chapman RW. Primary sclerosing cholangitis. Dig Dis. 2014;32:438-445. [PubMed] [DOI] |
| 8. | van Gerven NM, Verwer BJ, Witte BI, van Erpecum KJ, van Buuren HR, Maijers I, Visscher AP, Verschuren EC, van Hoek B, Coenraad MJ. Epidemiology and clinical characteristics of autoimmune hepatitis in the Netherlands. Scand J Gastroenterol. 2014;49:1245-1254. [PubMed] [DOI] |
| 9. | Boonstra K, Beuers U, Ponsioen CY. Epidemiology of primary sclerosing cholangitis and primary biliary cirrhosis: a systematic review. J Hepatol. 2012;56:1181-1188. [PubMed] [DOI] |
| 10. | Zhao P, Han Y. Low incidence of positive smooth muscle antibody and high incidence of isolated IgM elevation in Chinese patients with autoimmune hepatitis and primary biliary cirrhosis overlap syndrome: a retrospective study. BMC Gastroenterol. 2012;12:1. [PubMed] [DOI] |
| 12. | Lamia S, Sana K, Rachid J, Hajer A, Leila M, Nabil T, Mongia H. Autoimmune hepatitis-primary sclerosing cholangitis overlap syndrome complicated by inflammatory bowel disease. Tunis Med. 2012;90:899-900. [PubMed] |
| 13. | Chandok N, Silveira MG, Lindor KD. Comparing the simplified and international autoimmune hepatitis group criteria in primary sclerosing cholangitis. Gastroenterol Hepatol (N Y). 2010;6:108-112. [PubMed] |
| 14. | Hausdorf G, Roggenbuck D, Feist E, Büttner T, Jungblut PR, Conrad K, Berg C, Klein R. Autoantibodies to asialoglycoprotein receptor (ASGPR) measured by a novel ELISA--revival of a disease-activity marker in autoimmune hepatitis. Clin Chim Acta. 2009;408:19-24. [PubMed] [DOI] |
| 15. | Leuschner U. Primary biliary cirrhosis--presentation and diagnosis. Clin Liver Dis. 2003;7:741-758. [PubMed] [DOI] |
| 16. | Izzard AS, Rizzoni D, Agabiti-Rosei E, Heagerty AM. Small artery structure and hypertension: adaptive changes and target organ damage. J Hypertens. 2005;23:247-250. [PubMed] [DOI] |
| 17. | Chapman R, Fevery J, Kalloo A, Nagorney DM, Boberg KM, Shneider B, Gores GJ. Diagnosis and management of primary sclerosing cholangitis. Hepatology. 2010;51:660-678. [PubMed] [DOI] |
| 18. | Zhu GQ, Shi KQ, Huang GQ, Wang LR, Lin YQ, Braddock M, Chen YP, Zhou MT, Zheng MH. A network meta-analysis of the efficacy and side effects of udca-based therapies for primary sclerosing cholangitis. Oncotarget. 2015;6:26757-26769. [PubMed] [DOI] |